FGF (Fibroblast Growth Factor )
Фактор Роста Фибробластов
Известно 9 членов семейства FGF (FGF-1 (acidic FGF), FGF-2 (basic FGF),spliced isoform alt-bFGF, int-2, K-FGF, FGF5, FGF6, KGF. Путь предачи сигналов Fibroblast growth factor (FGF) участвует в формированиии паттерна мезодермальных и нейральных клонов во время раннего развития позвоночных.
FGF2(Fibroblast Growth Factor 2)
Фактор Роста Фибробластов 2
FGF2 участвует в широком круге биологических процессов, таких как индукция мезодермы, митогенез, миграция и дифференцировка, а также формирование и поддержание ЦНС.FGF2 осуществляет свои эффекты через взаимодействие с трансмембранными тирозин-киназными рецепторами (FGFR). FGF2 участвует в контроле различных аспектов развития сетчатки, включая пролиферацию и судьбу клеток. Эндогенный FGF2 участвует в дифференцировке фоторецепторов ретинальных ганглиолярных клеток (RGC) in vivo у кур.
Постепенное снижение пролиферации в сетчатке, индуцируемой FGF2, обусловлено изменением полу-максимальной реакции клеток на фактор роста с возрастом.
Усиление экспрессии FGF5 в зачатках задних конечностей эмбрионов кур обусловливало уменьшение презумптивной мышечной массы. Эктопическая экспрессия FGF5 существенно стимулировала пролиферацию и экспансию экспрессирующих тенасцин клонов фибробластов по всей развивающейся конечности. Фибробласты соответствовали стек(stacked)-клеткам перихндриума. Увеличение размеров перихондриума было обусловлено усилением пролиферации клеток. FGF5, по-видимому, действует как митоген, стимулируя пролиферацию мезенхимных фибробластов и тем самым образование соединительной ткани (перихондриума) и ингибируя развитиe дифференцированных скелетных мышц. Очевидно, он является посредником в формировании паттерна соединительной ткани и скелетных мышц в задних конечностях
Показано, что FGF7 индуцирует эктопический апикальный эктодермальный гребень (АЭГ) во фланкирующей эктодерме эмбрионов кур иным способом нежели FGF1, -2 и -4 и активирует экспрессию гена Fgf8, маркерного гена АЭГ, в культивируемой фланкирующей эктодерме без мезодермы. Интересно, что FGF7 и FGF10, приложенные к спине, индуцируют эктопический АЭГ в дорсальной срединной эктодерме. Очевидно FGF7 и FGF10 непосредственно индуцируют АЭГ в эктодерме.
FGF7(Fibroblast Growth Factor 5)
Фактор Роста Фибробластов 5
Усиление экспрессии FGF5 в зачатках задних конечностей эмбрионов кур обусловливало уменьшение презумптивной мышечной массы. Эктопическая экспрессия FGF5 существенно стимулировала пролиферацию и экспансию экспрессирующих тенасцин клонов фибробластов по всей развивающейся конечности. Фибробласты соответствовали стек(stacked)-клеткам перихндриума. Увеличение размеров перихондриума было обусловлено усилением пролиферации клеток. FGF5, по-видимому, действует как митоген, стимулируя пролиферацию мезенхимных фибробластов и тем самым образование соединительной ткани (перихондриума) и ингибируя развитиe дифференцированных скелетных мышц. Очевидно, он является посредником в формировании паттерна соединительной ткани и скелетных мышц в задних конечностях
FGF7(Fibroblast Growth Factor 7)
Фактор Роста Фибробластов 7
Показано, что FGF7 индуцирует эктопический апикальный эктодермальный гребень (АЭГ) во фланкирующей эктодерме эмбрионов кур иным способом нежели FGF1, -2 и -4 и активирует экспрессию гена Fgf8, маркерного гена АЭГ, в культивируемой фланкирующей эктодерме без мезодермы. Интересно, что FGF7 и FGF10, приложенные к спине, индуцируют эктопический АЭГ в дорсальной срединной эктодерме. Очевидно FGF7 и FGF10 непосредственно индуцируют АЭГ в эктодерме.
FGF8(Fibroblast Growth Factor 8)
Фактор Роста Фибробластов 8
Об участии гена Fgf-8 в формировании апикального эктодермального гребня конечностей позвоночных смотри ЗДЕСЬ
FGF12(Fibroblast Growth Factor 12)
Фактор Роста Фибробластов 12
Подобно высоко законсервированным человечьим гомологам FGF-12 и FGF-13 факторы мыши являются членами отдельного подсемейства FGF-подобных белков , характеризующихся высокой степенью перекрестной гомологии аминокислотных последовательностей и законсервированным N-terminal доменом, который не исключает секреции сигнальных молекул. Помимо их экспрессии в нескольких взрослых тканях оба FGF гена регионально экспрессируются у эмбрионов мыши в середине беременности (midgestation). Fgf12 and fgf13 РНК обнаруживается в развивающейся нервной системе в клеткаx вне пролиферирующего эпендимного слоя, а fgf13 РНК обнаруживается также в периферической нервной системе . Fgf12 экспрессируется в развивающейся мягкой соединительной ткани скелета конечностей и в презумптивной сединительной ткани , связывающей позвонки и ребра. Оба гена экспрессируются также в миокарде сердца , с fgf12 РНК ,обнаруживаемой только в предсердной камере и fgf13 РНК обнаруживаемой в предсердии и желудочке (Hartung et al., 1997) .
The FGFR family
Семейство FGFR состоит из 4-х очeнь сходных членов чьи аминокислоные последовательности высоко законсервированы. Они регулируют множественные клеточные процессы, включая рост, дифференцировку, миграцию, выживаемость клеток, они участвуют и патологических процессах, включая ангиогенез, заживление ран и рак. FGFRs взаимодействуют с fibroblast growth factors (FGFs), из которых сейчас охарактеризовано 13 членов. Лиганды FGF взаимодействуют с внеклеточной частью молекул FGFR molecules, которая состоит из 3-х иммуноглобулин (Ig)-подобных доменов с короткими связующими сегментами (Рис.1). В сегменте между IgI и IgII имеется run кислых остатков глютаминовой и аспартиковой кислоты, которые обозначаются как кислотный бокс `acid box', а такжк как трех-аминокислоный мотив histidine-alanine-valine (HAV). Последовательности HAV обнаруживаются также в молекулях адгезии N-CAM, L-CAM и N-cadherin, и, по-видимому, обеспечивают связь между молекулами. Имеется одиночная трансмембранная часть и внутри клетки имеется домен, расщепляющий тирозин-кинаду. В результате альтернативного сплайсинга у этих рецепторов может отсуствовать первый Ig (IgI)домен, отсуствовать IgI и область acid-box или,что важнее, содержат альтернативные последовательности C-терминальной половины третьего Ig-подобного домена, кодируемого отдельным экзоном (Рис.1)
Взаимодействие между фактором роста, рецептором и гепаран сульфат протеогликаном необходимо для активизации сигналов. После связывания лиганда молекуля рецептора димеризуется и это сопровождается автофосфорилированием некоторых остатков тирозина во внутриклеточном домене. |
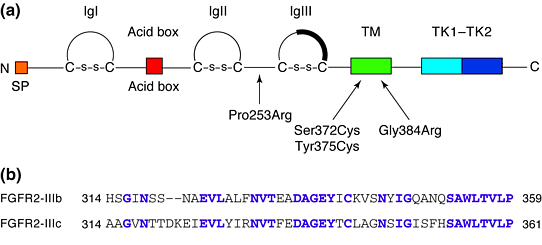 |
Рис. 1. (a) Рецептор фактора роста фибробластов состоит из: N-терминального сигнального пептида (SP); области кислотного бокса (a run of acidic residues); трех иммуноглобулиновых доменов (IgI, IgII and IgIII); трансмембранной области (TM); и домена, расщепляющего тирозин-киназу (TK1–TK2). Два цистеина, формирующие дисульфидные мостики, показаны в каждом Ig-подобном домене. Темная область в IgIII объяснена в тексте. (b) Расположение последовательностей в альтернативных форм C-терминальной половины IgIII домена (IgIIIb and IgIIIc) у FGFR2. Показанные последовательности представляют полный экзон. Идентичные остатки показаны пурпурным цветом. Figure 1. (a) The fibroblast growth factor receptor, consisting of: the N-terminal signal peptide (SP); the acid-box region (a run of acidic residues); the three immunoglobulin-like domains (IgI, IgII and IgIII); the transmembrane region (TM); and the split tyrosine-kinase domain (TK1–TK2). The two cysteines forming the disulphide bridge are shown in each Ig-like domain. The dark region in IgIII is explained in the text. (b) Sequence alignment of the alternative forms of the C-terminal half of the IgIII domain (IgIIIb and IgIIIc) of FGFR2. The sequences shown represent the complete exon. Identical residues are shown in purple. |
FGFR-1 (Fibroblast Growth Factor Receptor-1 (cek-1; flg))
FGF Рецептор-1
Известны 5 типов рецепторов для этих лигандов (FGFR-1, -2, -3, -4 и FREK).
Иммуногистохимически было установлено, что у эмбрионов кур небольшие точечные отложения FGFR-1 выявляются в прекардиальной энтодерме уже на стадии 6, в прекардиальной спланхнической мезодерме и ассоциированной с ней энтодерме и передней кишке - на стадии 8. После их слияния на стадии 9/10 сердечная трубка обнаруживала FGFR-1 в миокарде. Позднее на стадииях 13-18 FGFR-1 остается связанным с миокардом. На стадии 30 (7-й день) FGFR-1 уменьшается в желудочке, но не в предсердии. Кардиальные эндотелиальные клетки не экспрессировали FGFR-1 ни на одной из исследованных стадий (Sugi et al., 1995). Подтверждается предположение, что система FGFR-лиганд регулирует развитие сердца паракринно и автокринно. На паракринной ступени энтодермальные клетки в сердце-формирующей области на стадии 6 секретируют FGF, обусловливая терминальную дифференцировку прекардиальных мезодермальных клеток. В ответ на паракринные сигналы начинается синтез аутокринного FGF-2, необходимого для дифференцировки и пролиферации кардиальных миоцитов в развивающемся сердце. У эмбрионов мышей и крыс FGFR-1 мРНК также выявляется в сердечной мышце. У 17-18 недельных плодов человека FGFR-1 мРНК также обнаруживается в развивающемся сердце.
Мыши, гомозиготные по мутантному аллелю Fgfr1 (fgfr1(delta tmk)) погибают в раннем развитии, обнаруживая аномальный рост и аномальное формирование паттерна мезодермы. У химерных эмбрионов мыши на стадии E9.5 fgfr1(delta tmk)/fgfr1(delta tmk) клетки обнаруживают существенную недостаточность в отношении своей способности вносить вклад в формирование внеэмбриональной, цефалической, сердечной, аксиальной и параксиальной мезодермы и энтодермы. Анализ ранних стадий развития показал, что fgfr1(delta tmk)/fgfr1(delta tmk) клетки накапливаются в примитивной полоске химерных эмбрионов и ,следовательно, неспособны заселять переднюю мезодерму и энтодермальные клоны при их закладке (inception. Предполагается, что первичный дефект, связанный с fgfr1(delta tmk) мутацией, - отсутствие способности клеток эпибласта проходить( traverse)через первичную полоску (primitive streak). Клетки fgfr1(delta tmk)/fgfr1(delta tmk), которые накапливаются в примитивной полоске химерных эмбрионов стремятся сформировать вторичную нервную трубку. Эта вторичная нервная трубка целиком состоит из производных fgfr1(delta tmk)/fgfr1(delta tmk) клеток . Приобретение судьбы вторичной нервной трубки указывает на то, что нормальное морфогенетическое перемещение через первичную полоску является существенным не только для собственно формирования паттерна мезодермы, но и для правильной детерминации судьбы мезодермально/нейродерамальных клеток(Ciruna et al., 1997).
FGFR1 и 2 обнаруживают высоко регулируемый в пространстве и времени паттерн экспрессии в развивающейся сетчатке кур. Следовательно, разные популяции клеток сетчатки отличаются чувствительностью к FGF во время их пролиферации и дифференцировки. Передача сигналов FGFR играет ключевую роль в инициации нейрональной connectivity в зрительной системе.
FGFR1 растворимые рецепторы типа 1 (SR1)
Идентифицирован и секвенирован растворимый укороченный (отсутствует трансмембранный и часть кинадного деменов) FGFR1(SR1) из сетчатки взрослых крыс. Он в основном располагается во внутренних частях зрелой сетчатки. In vivo SR1 ингибирует нейротофную активность FGF2
У крыс Fisher на 18 эмбриональный день (Е18) развития мРНК и белок SR1 обнаруживаются в сетчатке. Белок SR1 строго ассоциирует с дифференцирующимися ганглиолярными клетками и его распределение обнаруживает параллелизм с радиальным паттерном развития сетчатки. Вплоть до 5 дня постнатального развития уровень мРНК и белка SR1 остается постоянным. Затем этот уровень быстро снижается, т.е. он необходим для регуляции дифференцировки сетчатки. SR1 обнаруживается во внутреннем ядерном слое, но никогда в фоторецепторных ядрах. В сечатке RCS дистрофичных крыс уровни мРНК и белка SR1 в 2-3 раза выше, чем в норме как до, так и после дегенерации фоторецепторов. Следовательно, изменения в содержании SR1 могут влиять на активность FGF в сетчатке.
SR1 ингибирует активность FGF благодаря конкурентному взаимодействию с FGFRs. Ингибирование FGF сигнализации сдивигает судьбу фоторецепторов и амакринных клеток в направлении развития в Retinal Muller Glial (RMG) клетки. FGF2 контролирует дифференцировку и выживаемость фоторецепторов во врем развития. SR1 может регулировать активность FGF2 в амккринных клетках и в зависимости от распределения и количества SR1 в различных клеточных слоях сетчатки SR1 может контролировать активность FGF2, отвечающую за дифференцировку и выживаемость клеток сетчатки.
Другая возможная роль SR1 в дифференцировке RGC - регуляция роста и ведение аксонов. SR1 и FGFR1 содержат участок в 20 аминокислот, называемый cell adhesion molecule homology domain (CHD). FGFR поддерживает САМ-стимулируемый рост аксонов RGС. Возможно, что концентрация и доступность САМ может контролироваться SR1 и действовать как антогонист FGFR/САМ взаимодействия.
Fgfr2 у ранних эмбрионов экспрессируется в трофэктодерме и некоторых внеэмбриональных местах, во время средней и поздней беременности Fgfr2 экспрессируется во многих развивающихся органах. Анализ химерных особей мышей показал, что Fgfr2 необходим как для формирования конечностей, так и для процесса ветвления в легких. Ранняя летальность обусловлена дефектами трофэктодермы. Эмбриональные клеточные клоны Fgfr2 активно проявляются в зачатках конечностей и развивающихся легких. Сходные изменения фенотипа ног и легких выявлены и у мутантов Fgf10, т.е. с аномальным лигандом для рецепторов Fgfr2. Следовательно, если во время раннего развития Fgfr2 взаимодействует с Fgf4, то в конечностях и легких необходимо взаимодействие между Fgf10 и Fgfr2. Возможно в этих взаимодействиях участвуют разные сплайс-варианты Fgfr2
FGFR-2 (Fibroblast Growth Factor Receptor-2)
FGF Рецептор-2
Fgfr2 у ранних эмбрионов экспрессируется в трофэктодерме и некоторых внеэмбриональных местах, во время средней и поздней беременности Fgfr2 экспрессируется во многих развивающихся органах. Анализ химерных особей мышей показал, что Fgfr2 необходим как для формирования конечностей, так и для процесса ветвления в легких. Ранняя летальность обусловлена дефектами трофэктодермы. Эмбриональные клеточные клоны Fgfr2 активно проявляются в зачатках конечностей и развивающихся легких. Сходные изменения фенотипа ног и легких выявлены и у мутантов Fgf10, т.е. с аномальным лигандом для рецепторов Fgfr2. Следовательно, если во время раннего развития Fgfr2 взаимодействует с Fgf4, то в конечностях и легких необходимо взаимодействие между Fgf10 и Fgfr2. Возможно в этих взаимодействиях участвуют разные сплайс-варианты Fgfr2
FGFR-3 (Fibroblast Growth Factor Receptor-3)
FGF Рецептор-3
Mutations associated with birth defects
Ряд врожденных дефектов ассоциирован с мутациями FGFRs, которые часто обусловливают неправильное слияние черепных швов или скелетные аномалии Box A описывает характеристики синдромов, представленные в таблице 1
Table 1. Birth defects associated with mutation in fibroblast growth factor receptorsa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Два класса мутаций выявлены. Наиболее сильно законсервированный мотив в Ig супер-семействе это присутствие двух остатков цистеина, стабилизирующих внеклеточные домены (Рис.2). Оба цистеина в третьем домене Ig FGFR2 часто мутируют, в результате цистеины оказываются несвязанными, что ведет к лиганд-независимой димеризации рецепторных молекул (благодаря образованию межмолекулярных дисульфидных мостиков) и конституитивной активации. Это подтверждено на других мутациях вне Ig-подобных доменов в FGFR2 и FGFR3, в которых тирозин или серин мутировали в цистеин.
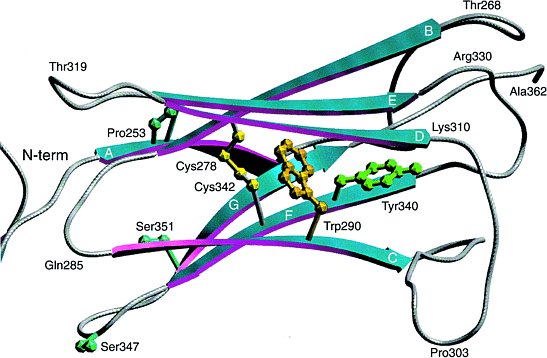 |
Рис.2.
Диаграмма сравнительной модели третьего иммуноглобулинового (IgIII) внеклеточного с `c' splice формой FGFR2. Этот домен и эквивалентные домены FGFR1, недавно смоделированы по аналогии с IgV , IgC , IgC-like и IgV-like доменами. Однако домен обладает высоко законсервированными признаками,которые недавно определены в I-set Ig семействе . Они включают законсервированные цистеиновые зачатки Cys278 и Cys342, инвариантный остаток триптофана Trp290 и законсервированный остаток тирозина Tyr340. Домен состоит из двух 4-нитчатых бета-слоев (ABED and A'GFC). Показаны законсервированные остатки, которые часто мутируют и вызывают скелетные аномалии. Figure 2. A ribbon diagram of a comparative model of the third immunoglobulin (IgIII) extracellular domain with the `c' splice form of FGFR2. This domain, and the equivalent domains within FGFR1, have previously been modelled by analogy to IgV domains16, IgC domains33, IgC-like domains34 and IgV-like domains35. However, the domain has been shown to possess well-conserved features of the recently defined I-set Ig family17. These include the conserved cysteine residues Cys278 and Cys342, the invariant tryptophan residue Trp290, and the conserved tyrosine residue Tyr340. We have constructed the model using the COMPOSER36 suite of programs (Sybyl; Tripos Inc., USA) by analogy with the crystal structure37 of telokin, the C-terminal domain of myosin light-chain kinase from turkey gizzard. Telokin is one of only three members of the I-set Ig family of proteins whose structure has been characterized. Telokin was chosen because it gave the best amino acid sequence alignment with FGFR2, with the fewest insertions or deletions. This is in agreement with Bateman and Chothia17, who analysed the sequence similarities of each of the three extracellular Ig domains of FGFR2 and concluded that each of the domains contained all the major secondary structure elements found in telokin. The domain consists of two four-stranded beta-sheets (ABED and A'GFC). The conserved residues, which are often mutated and cause skeletal disorders, are shown. The picture was produced using the program SETOR38. |
Область между 2 и 3-м Ig-подобными доменами строго законсервирована у членов семейства FGFR у разных видов. Известны 2 мутации в этой области (Ser252Trp and Pro253Arg) объясняющие все кроме одлного случая синдрома Apert. В другом случае Ser252 мутирует в фенилаланин, аминокислоту наиболее структурно сходную с триптофаном . Эквивалентная мутация Pro252Arg в FGFR1, которая обнаруживается при некоторых случаях синдрома Pfeiffer и Pro250Arg в FGFR3 найдена у большого круга пациентов с краниосиностозами. Сюда вошли некоторые с диагнозом Crouzon, Pfeiffer, изолированным краниосиностозом, несиндромальным краниосиностозом или Saethre–Chotzen синдромом.
Две специфические мутации найдены в трансмембранной области FGFR3,обе связаны с изменением заряда в положении 380; нейтральная аминокислота глицин заменена на более щелочной аргинин почти во всех случаях ахондроплазии и мутация аланина в глютаминовую кислоту, лишь отстоящая на 11 аминокислот, ведет к форме синдрома Crouzon вместе с acanthosis nigricans (a thickened and velvety appearance of the skin). Выявлен ряд мутаций во втором и третьем Ig-подобных доменах внеклеточной области FGFR2. Это не только мутации, затрагивающие неспаренные цистеины, но и мутации дестабилизирующие дисульфидные мостики, также ведущие к возникновению неспатерных цистеиновых остатков. Например, инвариантный остаток Trp290 в С-нити IgIII обнаруживаемый в центральной области между двумя is found at the centre of the region between the two β-слоями и стабилизирует Cys–Cys мостик. Мутация Trp290Arg, по-видимому, ведет к разрушению упаковки стержневого (core) домена и снижению его стабильности. Другая распространенная мутация связана с инвариантным остатком тирозина (Tyr340His), которая расположена рядом с законсервированным Cys342 в гидрофобной сердцевине (core). Разрушение четвертичной структуры этими мутациями ведет к трудностям образования внутридоменовых дисульфидных мостиков, и ,по-видимому, обусловливает альтернативные межмолекулярные связи.
Мутации, связанные с образовнаием свободных цистеинов, обнаружены в других областях FGFR2 и FGFR3, включая линкерную область между IgII и IgIII и в трансмембранной области. На Рис.2 мутации в IgIII (i.e. Ser347Cys и Ser351Cys), показаные голубым, располагаются у петле между нитями F и G. Из-за своей экспозиции они скорее всего будут приводить к поперечному связыванию Cys–Cys скорее, чем к разрушению дисульфидных мостиков между двумя слоями Ig доменов. Мутации линкерной области (Arg248Cys, Ser249Cys of FGFR3), которые обусловливают thanatophoric dysplasia, по-видимому, связаны с лиганд-независимой димеризацией рецепторов и находятся в резком контрасте с мутаций Pro250Arg, обнаруживаемой при краниосиностозах, которая, по-видимому, нарушает связываание FGF.
Functional studies
Мутации, связанные с образовнаием свободных цистеинов, обнаружены в других областях FGFR2 и FGFR3, включая линкерную область между IgII и IgIII и в трансмембранной области. На Рис.2 мутации в IgIII (i.e. Ser347Cys и Ser351Cys), показаные голубым, располагаются у петле между нитями F и G. Из-за своей экспозиции они скорее всего будут приводить к поперечному связыванию Cys–Cys скорее, чем к разрушению дисульфидных мостиков между двумя слоями Ig доменов. Мутации линкерной области (Arg248Cys, Ser249Cys of FGFR3), которые обусловливают thanatophoric dysplasia, по-видимому, связаны с лиганд-независимой димеризацией рецепторов и находятся в резком контрасте с мутаций Pro250Arg, обнаруживаемой при краниосиностозах, которая, по-видимому, нарушает связываание FGF.
Functional studies
Степнь активации сигнализации , измеряемая по степени фосфорилирования, коррелирует с тяжестью клинических проявлений мутаций. У Xenopus мутации FGFR1 и FGFR2 генов связаны с образованием неспаривающихся цистеинов(analogous to Cys278Phe или Cys342Tyr у FGFR2) ведут к ковалентной димеризации рецепторных молекул путем образования межмолекулярных дисульфидных мостиков и лиганд-независимую активацию тирозин-киназы. Двойные мутации (аналоги Cys278Phe и Cys342Tyr у FGFR2) ведут к мономерным типам (resulted in a monomeric species). Трансмембранные мутации (аналогичные Gly380Arg у FGFR3)и мутации тирозин-киназного домена (аналогичные Lys650Glu у FGFR3) все обнаруживают повышенное тирозин-киназное фосфорилирование .
Однако мутация в линкерной области Pro160Arg (аналогичная Pro252Arg найденной во всех трех FGFRs) не усиливает фосфорилирования тирозинов, но обнаруживает усиление связывания FGF1 и FGF2 . Это же наблюдается и при сходных мутациях человека IgII–IgIII линкеров .
Однако мутация в линкерной области Pro160Arg (аналогичная Pro252Arg найденной во всех трех FGFRs) не усиливает фосфорилирования тирозинов, но обнаруживает усиление связывания FGF1 и FGF2 . Это же наблюдается и при сходных мутациях человека IgII–IgIII линкеров .
Не выявлено мутаций, связанных с отсуствием или укорочением белка FGFR1, 2 или 3. Мутаций TGC в TGA (Cys to stop) не найдено. Дети с Wolf–Hirschhorn синдромом, при котором теряется кончик короткого плеча 4-й хромосомы, не имели нарушений роста, даже в случае полного удаления копии FGFR3.
FGFR3-дефицитные мыши имели более длиные кости , это указывает на то, что FGFR3 является негативным регулятором роста. Мутации, вызывающие achondroplasia и thanatophoric dysplasia увеличивают лиганд-независмую активность FGFR3,что согласуется с действием этих мутаций как преодолением негативного контроля, обычно обеспечиваемого FGFR3. ( Burke et al,1998)
FGFR3-дефицитные мыши имели более длиные кости , это указывает на то, что FGFR3 является негативным регулятором роста. Мутации, вызывающие achondroplasia и thanatophoric dysplasia увеличивают лиганд-независмую активность FGFR3,что согласуется с действием этих мутаций как преодолением негативного контроля, обычно обеспечиваемого FGFR3. ( Burke et al,1998)
Экспрессия FGFR-2 мРНК в эндокардиальных подушках указывает на участие этой изоформы в формировании клапанов сердце. В развивающемся сердцe обнаружены транскрипты и FGFR-3 (cek-2). Транскрипты FGFR-4 не обнаруживаются в сердце, но в большом количестве встречаются в развивающихся скелетных мышцах.