Ползователи: 
гены HOXA1-4
Роль в развитии и при болезнях
Role of HOXA1-4 in the development of genetic and malignant diseases Lumin Wang, Haifeng Sun, Li Cao & Jinhai Wang
 Biomarker Research Volume 12, article number 18, (2024)
|
The HOXA genes, belonging to the HOX family, encompass 11 members (HOXA1-11) and exert critical functions in early embryonic development, as well as various adult processes. Furthermore, dysregulation of HOXA genes is implicated in genetic diseases, heart disease, and various cancers. In this comprehensive overview, we primarily focused on the HOXA1-4 genes and their associated functions and diseases. Emphasis was placed on elucidating the impact of abnormal expression of these genes and highlighting their significance in maintaining optimal health and their involvement in the development of genetic and malignant diseases. Furthermore, we delved into their regulatory mechanisms, functional roles, and underlying biology and explored the therapeutic potential of targeting HOXA1-4 genes for the treatment of malignancies. Additionally, we explored the utility of HOXA1-4 genes as biomarkers for monitoring cancer recurrence and metastasis.
|
Гены Homeobox (HOX) представляют собой группу эволюционно консервативных транскрипционных факторов, которые можно разделить на четыре семейных кластера: HOXA, HOXB, HOXC и HOXD (рис. 1). Эти гены играют важнейшую роль в клеточном развитии и формировании формы тела в процессе эмбриогенеза. Например, мутации в HOXA13 были связаны с отсутствием формирования большого пальца [1]. Аналогично, гетерозиготные изменения в HOXD13 связаны с синполидактилией 1, наследственной деформацией конечностей [2]. Кроме того, гены HOX были замешаны в развитии неврологических заболеваний. В частности, подмножество HOXD критически вовлечено в развитие моносинаптических сенсорно-моторных связей. У мышей потеря Hoxd9, Hoxd10 и Hoxd11 приводит к дефектам локомоции [3]. Более того, регуляция HOXB3 с помощью LncRNA147410.3 влияет на важнейшие физиологические процессы, такие как пролиферация, дифференцировка и апоптоз, в микроглии мыши [4]. Дисрегуляция уровней метилирования HOXB4, HOXC4 и HOXD1 была связана с дефектами нервной трубки (NTDs) [5]. Кроме того, аномальная экспрессия генов HOX наблюдается при различных заболеваниях, включая гипертоническое расстройство, осложняющее беременность (HDCP) [6] и аллергическую астму [7]. Например, miR-1233 напрямую нацелена на HOXB3, подавляя инвазию клеток трофобласта и способствуя развитию HDCP. Кроме того, HOX5 регулирует функцию Th2-клеток при хроническом аллергическом воспалении путем модуляции Gata3.
 Fig. 1
The human HOX gene clusters. 39 HOX are organized into four chromosomal clusters: HOXA, HOXB, HOXC, and HOXD
Предыдущие исследования выявили регуляторную роль генов HOX в развитии рака человека, влияющих на такие процессы, как клеточная пролиферация, дифференцировка, апоптоз, метастазирование, ангиогенез и эпителиально-мезенхимальный переход (EMT). Хотя некоторые гены HOX, как сообщается, функционируют как опухолевые супрессоры, последние исследования показывают, что гены HOX в основном действуют как онкогены в прогрессии рака. Например, HOXD1 снижен в почечной clear cell карциноме (KIRC), а его высокая экспрессия связана с ингибированием пролиферации раковых клеток, прогрессии клеточного цикла и передаче сигналов TGF-β [8]. Аналогичным образом, эксперименты с потерей и приобретением функции показали, что HOXD13 подавляет пролиферацию и миграцию клеток при раке простаты (PCa) путем блокирования сигнализации BMP4/SMAD1 [9]. Напротив, HOXB3/6/7/8/9 высоко экспрессируются в аденокарциноме легкого (LUAD) и коррелируют с плохой общей выживаемостью (OS) [10]. Кроме того, HOXC6/8/9/10/11/13 избыточно экспрессируются при раке желудка (GC) и ассоциируются с неблагоприятным прогнозом [11]. Наши предыдущие исследования показали, что HOXD3 выступает в качестве онкогена, способствующего пролиферации, метастазированию, инвазии и ангиогенезу рака печени через пути ITGA и EGFR [12, 13].
Гены HOXA, представляющие собой особое подмножество семейства HOX, привлекают значительное внимание в области развития органов, патогенеза заболеваний и различных видов рака. Эти гены были идентифицированы как ключевые игроки в прогрессии рака, действующие как в качестве онкогенов, так и в качестве ингибиторов. Например, HOXA5 участвует в регуляции фенотипа сосудистых гладкомышечных клеток, оказывая тем самым защитное действие против атеросклероза сонных артерий [14].При GC наблюдается коэкспрессия HOXA6 с PBX2, что приводит к усилению клеточной пролиферации, метастазированию и инвазии [15]. Однако противоречивые данные свидетельствуют о том, что HOXA6 на самом деле действует как ингибитор, подавляя клеточную пролиферацию через сигнальный путь PI3K/AKT в clear cell почечно-клеточной карциноме [16].
Всестороннее понимание участия генов HOXA в развитии заболеваний, связанных с HOXA, имеет решающее значение для определения новых мишеней для лечения и инновационных терапевтических стратегий. Поэтому цель данного исследования - представить обзор, охватывающий разнообразные функции генов HOXA1-4 в патогенезе как наследственных, так и приобретенных заболеваний. Это будет достигнуто путем оценки их регуляторных механизмов, биологических функций и связанных с ними путей. Кроме того, мы стремимся обобщить предварительные данные, подтверждающие возможность использования этих генов в качестве мишеней для генотерапии, что открывает новые перспективы для лечения заболеваний, связанных с HOXA.
Structural domains of HOXA1-4
Млекопитающие обладают в общей сложности 39 генами HOX, которые объединены в четыре хромосомных кластера: HOXA (7p15-p14), HOXB (17q21-q22), HOXC (12q12-q13) и HOXD (2q31-q32). Эти гены кодируют транскрипционные факторы, содержащие гомеодомены и играющие важную роль в развитии архитектуры позвонков по передне-задней оси. Примечательно, что экспрессия генов HOX происходит по определенной схеме, причем первыми экспрессируются гены, расположенные на 3' конце. Следовательно, они могут активировать экспрессию задних HOX-генов, расположенных на 5' конце. Такая последовательная экспрессия приводит к временной и пространственной коллинеарности между HOX-генами внутри каждого кластера. Таким образом, регуляторные взаимодействия между генами HOX во время эмбрионального развития в конечном итоге определяют морфологию сегментов тела.
Гены HOXA расположены последовательно в соответствии с группами их паралогов, которые охватывают от 1 до 13. Кластер генов HOXA включает в себя HOXA1, HOXA2, HOXA3, HOXA4, HOXA5, HOXA6, HOXA7, HOXA9, HOXA10, HOXA11 и HOXA13. Примечательно, что гены HOXA1-4 существенно влияют на развитие головы у млекопитающих (рис. 1).
Different roles of HOXAs in common diseases
HOXA1
О важнейшей роли генов HOXA в физиологии клетки свидетельствуют многочисленные заболевания, возникающие в результате мутаций или изменения экспрессии генов (рис. 2). Например, мутации в HOXA1 были связаны с группой генетических заболеваний, получивших название "HOXA1-связанные синдромы" [17]. Фенотипические проявления этих синдромов могут варьировать в разных популяциях. Одним из примеров является синдром Bosley-Salih-Alorainy [18], который встречается преимущественно у ближневосточных пациентов. Характерными симптомами этого синдрома являются weakness лица, нарушение слуха, нейросенсорная тугоухость, пороки сердца и задержка развития. Другой иллюстрацией является синдром Athabascan Brain Dysgenesis Syndrome (ABDS), наблюдаемый преимущественно среди коренного населения Америки. У людей, страдающих ABDS, наблюдаются такие признаки, как умственная отсталость, центральная гиповентиляция, weakness лица и конотрункальные пороки сердца [19, 20]. Кроме того, усеченная мутация HOXA1 была выявлена у свиней с врожденным пороком развития наружных ушей, обнаруженная в результате анализа РНК-секвенирования эмбрионов свиней. Учитывая, что уровень заболеваемости свиней схож с человеческим, это открытие может послужить отправной точкой для понимания молекулярных механизмов, лежащих в основе генетических заболеваний у человека [21].
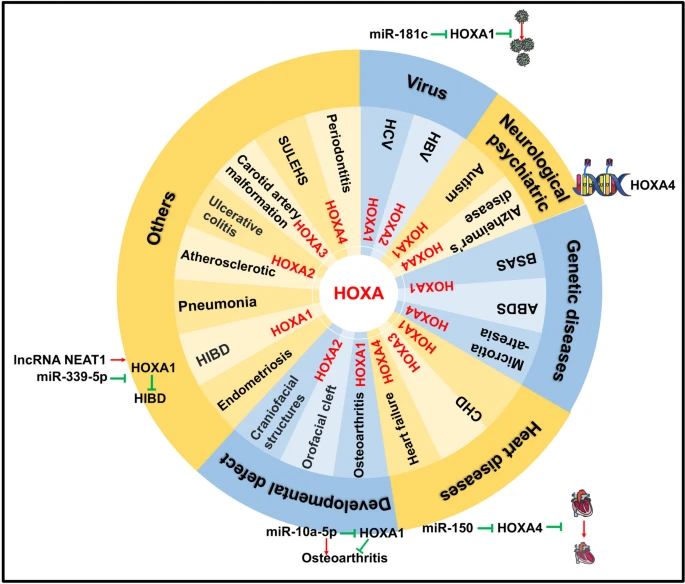 Fig.2
HOXA1-4 genes have participated in the regulation of gene expression related to the heart, blood vessels, viruses, genetic diseases, neurology, psychiatry, and developmental defects
В последние годы в ряде исследований были получены доказательства участия экспрессии HOXA1 в развитии заболеваний сердца, в частности врожденных пороков сердца (ВПС) [22]. Например, исследования показали, что вариации в мотиве полигистидинового повтора HOXA1 могут вызывать развитие двустворчатого аортального клапана (BAV) у мышей и рыбок данио [23]. BAV представляет собой наиболее распространенную форму ВПС и клинически характеризуется различными аномалиями аортального клапана, включая аортальный стеноз и регургитацию, эндокардит и аневризму/рассечение восходящей аорты, поражая примерно одну треть пациентов. Кроме того, HOXA1 экспрессируется в предшественниках клеток нервного гребня сердца (NCC) и вносит вклад в развитие сердца через регуляцию NCC [24].
HOXA1 играет важную роль не только в регуляции сердечных заболеваний, но и участвует в развитии заболеваний, связанных с суставами, в частности посредством влияния на апоптоз. Повышенный уровень miR-10a-5p способствует апоптозу хондроцитов, подавляя экспрессию HOXA1 при остеоартрите [25]. Этот вывод был дополнительно подтвержден miR-18a-3p, которая нацелена на 3' UTR HOXA1, тем самым подавляя его экспрессию и вызывая апоптоз хондроцитов [26].
В исследованиях, посвященных аутизму, ученые обнаружили корреляцию между полиморфизмом HOXA1 A218G и изменениями окружности головы у пациентов с аутизмом [27]. Кроме того, Ingram et al.установили, что наличие полиморфизма (His)73(Arg) (A:G) в гене HOXA1 вносит значительный вклад в предрасположенность к аутизму [28]. Однако эти выводы были поставлены под сомнение группой доктора Девлина, которая провела анализ частот генотипов и передачи аллелей, используя данные из сети Collaborative Programs of Excellence in Autism. Их результаты свидетельствуют о том, что полиморфизм (His)73(Arg) в гене HOXA1 не имеет значимой ассоциации с аутизмом [29].
HOXA продемонстрировал функциональное участие в различных заболеваниях, таких как эндометриоз [30], гипоксически-ишемическое повреждение мозга (HIBD) [31], повреждения вируса гепатита С (HCV) и пневмония, вызванная сепсисом [32]. При эндометриозе все паралоги HOXA и HOXB, за исключением HOXA1, демонстрировали значительное снижение регуляции в эктопических тканях по сравнению с контрольными тканями. В случае HIBD длинная не-кодирующая РНК NEAT1 конкурирует с miR-339-5p, эффективно повышая экспрессию HOXA1, способствуя жизнеспособности клеток нейронов и подавляя апоптоз во время гипоксии-ишемии. Аналогично, при исследовании HCV экспрессия антисмысловой РНК миелоид-специфической 1 (HOTAIRM1) транскрипта HOXA повышается, это указывает на ее потенциал в качестве иммуномодулирующей мишени, регулирующей экспрессию HOXA1 и miR-124 и способствующей экспансии миелоидных супрессорных клеток [33]. Соответственно, miR-181c нацелена на HOXA1 и через регуляцию STAT3 и STAT5 препятствует репликации вируса гепатита С [34]. Наконец, при пневмонии, вызванной сепсисом, снижение экспрессии urothelial carcinoma-associated 1 (UCA1) фактора приводит к снижению регуляции EZH2 и, как следствие, к повышению экспрессии HOXA1. Это повышение экспрессии HOXA1 способствует смягчению прогрессирования пневмонии, вызванной сепсисом.
HOXA2
Все больше данных подтверждают участие эпигенетической регуляции в различных заболеваниях, связанных с HOXA2. Например, анализ метилирования ДНК показал, что HOXA2 подвергается гипометилированию в атеросклеротических бляшках сонных артерий, в отличие от интактных тканей внутренних грудных артерий и подкожных вен [35]. Влияние HOXA2 на прогрессирование фиброза при хронической инфекции гепатита В было подтверждено с помощью Illumina Infinium Bead Arrays. Результаты этих исследований указывают на значительную ассоциацию между гиперметилированием HOXA2 и тяжелым фиброзом [36]. При исследовании орофациальной расщелины для различных подтипов орофациальной расщелины были отмечены различные паттерны метилирования в гене HOXA2 [37]. Кроме того, было обнаружено, что длинная не-кодирующая РНК HOTAIRM1 подавляет обогащение DNMT1 на промоторе HOXA2, что приводит к гипометилированию и последующей индукции экспрессии HOXA2, это в конечном итоге приводит к остеогенезу стволовых клеток периодонтальной связки человека [38].
Кроме того, экспрессия HOXA2 была связана с язвенным колитом (UC). Было обнаружено, что уровень HOXA2 значительно снижен у пациентов с UC по сравнению с пациентами с ремиссией и здоровыми людьми [39]. Кроме того, HOXA2 также ассоциируется с врожденными пороками развития наружного уха. Используя Phenolyzer, генный анализатор, основанный на фенотипе, вычислительный анализатор подтвердил эту связь [40]. Подтверждая этот вывод, Si et al. обнаружили, что экспрессия HOXA2 связана с эволюционно консервативной областью энхансера гена фактора транскрипции гомеобокса 1 (HMX1), который играет роль в развитии черепно-лицевых структур [41]. Кроме того, HOXA2 участвует в прогрессировании хондрогенеза и из-за его дисрегуляции был связан с идиопатическим пропорциональным коротким ростом человека [42].
HOXA3
Исследования показали, что при заживлении ран HOXA3 способствует неоваскуляризации, что ускоряет заживление ран. Этот эффект достигается за счет мобилизации, рекрутирования и усиления дифференцировки мультипотентных клеток, полученных из костного мозга, при одновременном подавлении экспрессии провоспалительных белков, связанных с путем ядерного фактора κ В [43]. Подобно HOXA1, HOXA3 также играет важную роль в развитии ВПС [22]. HOXA3 демонстрирует различные паттерны экспрессии в субдоменах клеток второго поля сердца, которые способствуют эмбриональному развитию сердца во время петлеобразования [44]. У гомозиготных мутантов HOXA3 наблюдается отсутствие третьей артериальной дуги, что приводит к пороку развития системы сонных артерий [45, 46]. Кроме того, HOXA3 связан с эпигенетическими модификациями. Дифференциальное гиперметилирование в HOXA3 было связано с нейродегенерацией при поздней стадии болезни Альцгеймера (AD) [47]. Интересно, что метилирование HOXA3 также коррелирует с физической активностью: в одном из исследований было показано, что снижение физической активности у молодых взрослых людей связано с повышением уровня метилирования HOXA3 [48].
HOXA4
Экспрессия HOXA4 была связана с сердечной недостаточностью (HF). У пациентов с HF длинная не-кодирующая РНК Myocardial Infarction-Associated Transcript (MIAT) обнаруживается усиление активности, тем самым усиливается экспрессия HOXA4 за счет супрессии miR-150. Это вносит вклад в прогрессирование HF [49]. Кроме того, HOXA4 играет критическую роль в поддержании пространственных качественных особенностей в аорте взрослых и его избыточная активность может снижать чувствительность к аневризме абдоминальной аорты у людей [50]. Аналогичным образом, исследования Kimura et al. с использованием модельных HOXA4-дефицитных мышей показали, что HOXA4 взаимодействует с доменом активатора транскрипционного энхансера (TEADs), что приводит к ослаблению транскрипции, опосредованной Yes-Associated Protein (YAP)/TEAD, конкурируя за связывание TEAD. Это взаимодействие влияет на фенотипическое переключение сосудистых гладкомышечных клеток [51]. Кроме того, HOXA4 способен индуцировать дифференцировку мезенхимных стволовых клеток пуповины человека в эпидермальноподобные клетки, способствуя тем самым восстановлению кожи [52].
При исследовании генетических заболеваний была обнаружена аномальная экспрессия HOXA4, а мутации в HOXA4, связанные с microtia-atresia, редким врожденным заболеванием [53]. Кроме того, HOXA4 участвует в эпигенетических модификациях. Экспрессия HOXA4 ингибируется TASP1, гетеродимерной эндопептидазой, которая активирует гистоновые метилтрансферазы семейства KMT2. Утрата функции TASP1 может привести к синдрому Suleiman-El-Hattab (SULEHS) - расстройству, влияющему на модификацию гистонов [54]. Кроме того, изменения в метилировании ДНК на цитозин-фосфат-гуаниновых (CpG) сайтах в HOXA4 были связаны как с AD [55], так и с пародонтитом [56]. Повышенный уровень мРНК HOXA4 также коррелирует с гипоспадией [57].
Представленная информация подчеркивает ключевое участие метилирования CpG и генных мутаций в возникновении и прогрессировании заболеваний, на которые влияют гены HOXA. Кроме того, функции, приписываемые HOXA1-4, в основном связаны с регуляцией экспрессии генов, связанных с сердцем, кровеносными сосудами, вирусами, воспалением, неврологией, психиатрией и аномалиями развития. Следовательно, всестороннее исследование HOXA1-4 может дать ценные сведения о молекулярной биологии этих заболеваний, тем самым обеспечивая потенциальные направления исследований и мишени для их развития.
Role of HOA1-4 genes in the progression of cancer
Ключевое участие HOXA1-4 в развитии и прогрессировании различных типов рака было твердо установлено, как показано на рис. 3. Многочисленные исследования постоянно показывают, что активация генов HOXA1-4 может способствовать прогрессированию рака. Однако важно признать, что в некоторых типах опухолей влияние HOXA1-4 может иметь противоположный эффект, когда их экспрессия выступает в качестве опухолевого супрессора.
 Fig. 3
HOXA1-4 genes dysregulation in human cancers. The color code highlights alterations found for more than one HOXA gene in different tumor sites Hepatocellular carcinoma (HCC)
Ранее было показано, что HOXA1 может служить биомаркером метилирования для повышения чувствительности при выявлении HCC на ранних стадиях [58-61]. Между тем, многочисленные исследования указывают на регуляцию белков HOXA1 и HOXA3 некодирующими РНК при HCC (табл. 1). Например, miR-218 и miR-99a непосредственно связываются с предполагаемыми сайтами связывания 3'-UTR HOXA1, ингибируя уровень его экспрессии и, следовательно, подавляя пролиферацию, инвазию и метастазирование HCC [62, 63]. Кроме того, деметилаза H3K9, KDM3A, является мишенью для miRNA-202-3p и усиливает экспрессию HOXA1 путем стирания H3K9me2 для увеличения роста клеток HCC человека [64]. Более того, lncRNA HOXA-AS2 стимулирует злокачественное поведение гепатобластомы путем повышения экспрессии HOXA3 [65]. Циркулярные РНК, как не-кодирующие РНК, также играют роль в прогрессии рака печени. Было показано, что нокдаун circWHSC1 подавляет пролиферацию и метастазирование клеточных линий рака печени за счет регуляции HOXA1. Молекулярные исследования показали, что circWHSC1 функционирует как губка для miR-142-3p, которая нацелена на HOXA1 [66].
Table 1 HOXA1-4 genes were regulated by ncRNA in cancers
Lung cancer
Совместный анализ нескольких баз данных выявил повышение экспрессии HOXA1 при немелкоклеточном раке легкого (NSCLC). Эти базы данных, а именно Oncomine, Gene Expression Profiling Interactive Analysis, Multi Experiment Matrix и The Cancer Genome Atlas (TCGA), предоставили подтверждающие доказательства [91]. Напротив, база данных TCGA показала, что экспрессия HOXA3 снижена в тканях NSCLC, и этот вывод был подтвержден с помощью RT-PCR анализа в клинических образцах [92]. Кроме того, исследования Tang и Gao et al. показали, что HOXA4, подобно HOXA3, функционирует как опухолевый супрессор при прогрессировании рака легкого [93, 94].
Выявление гиперметилирования ДНК в промоторных CpG-островках стало одним из важнейших факторов прогрессии рака легкого. В частности, HOXA1 показал значительное гиперметилирование при раке легкого, что открывает перспективы в качестве потенциального маркера для раннего выявления LUAD [95]. Гиперметилирование HOXA1 может регулироваться H3K27me3 через HOTAIR, тем самым способствуя развитию химиорезистентности при мелкоклеточном раке легкого (SCLC) [77]. Аберрантное метилирование HOXA1 также наблюдалось в преинвазивных поражениях, которые связаны с ранними стадиями развития аденокарциномы легкого (ADC) [96]. Аналогично, гиперметилирование CpG-сайтов в области HOXA3/HOXA4 было обнаружено при раке легкого [97].
Растущее количество данных указывает на то, что дисрегуляция не-кодирующих РНК (ncRNA) в сочетании с HOXA играет регуляторную роль в прогрессии рака легкого. Например, miR-577 непосредственно нацелена на HOXA1, и функциональное действие miR-577 на клетки рака легкого зависит от HOXA1 [74]. Нокдаун онкогенной lncRNA LINC00958 приводит к подавлению онкогенного фенотипа, который может быть восстановлен за счет и збыточной экспрессии HOXA1 в LUAD [83]. Кроме того, HOXA3 регулируется LncRNA HOXA-AS3, онкогеном, который усиливает резистентность к цисплатину и способствует EMT [80]. Роль HOXA выходит за рамки опухолевой пролиферации, миграции и инвазии, поскольку он также способствует иммунной защите при раке легкого. Исследования продемонстрировали заметные ассоциации между HOXA1 и инфильтрацией иммунных клеток, а также иммунными контрольными точками. Нокдаун HOXA1 в клетках LUAD усиливает ответ CD8+ T-клеток [98].
Breast cancer (BC)
В исследовании с использованием RT-PCR анализа для анализа экспрессии генов HOX в инвазивных тканях протоков BC человека и нормальных тканях были отмечены значительные различия в экспрессии 11 генов HOX (HOXA1, A2, A3, A5, A9, C11, D3, D4, D8, D9 и D10) между раковыми и нормальными тканями. В частности, экспрессия HOXA1, A2 и A3 была ниже в раковых тканях по сравнению с нормальными тканями [99]. Функциональная значимость HOXA1 при BC была также подтверждена Magali Belpaire et al. [100]. Кроме того, у пациентов с BC наблюдалась пониженная регуляция HOXA4 по сравнению с не раковыми тканями, что может быть связано с повышенным уровнем метилирования ДНК HOXA4 [101].
В противоположность этим данным, некоторые исследования указывают на то, что HOXA1 действует как онкоген. Liu et al. продемонстрировали, что при BC повышены уровни мРНК и белка HOXA1. Высокая экспрессия HOXA1 ассоциировалась с плохим прогнозом и развитыми клинико-патологическими признаками у пациентов с BC. Ингибирование HOXA1 значительно подавляло клеточную прогрессию, усиливая апоптоз клеток и вызывая арест клеточного цикла в клетках BC [102].
Кроме того, регуляция HOXA1 и HOXA3 некодирующими РНК играет определенную роль в модуляции прогрессии BC. Избыточная экспрессия circRASSF2 увеличивает экспрессию белка HOXA1, что приводит к усилению способности к пролиферации, образованию клонов, инвазии и метастазированию в клетках BC [90]. LncRNA SNHG действует как губка для miR-193a-5p, активируя экспрессию HOXA1 [84]. В случае HOXA3 сверхэкспрессия miR-338-3p снижает экспрессию HOXA3, в то время как нокдаун miR-338-3p повышает экспрессию HOXA3 [88].
Prostate cancer (PCa)
PCa является серьезным заболеванием, поражающим преимущественно мужчин. Исследования показали, что избыточная экспрессия HOXA1 способствует росту, инвазии и метастазированию PCa. И наоборот, подавление HOXA1 приводит к высокой экспрессии E-кадхерина и низкой экспрессии Snail и MMP-3 в клетках PCa, что указывает на потенциальную роль в ингибировании прогрессии рака [103]. Кроме того, не-кодирующие РНК (нкРНК) играют важнейшую роль в опухолевом генезе PCa. Онкогенная роль HOXA1 была отмечена при PCa, поскольку его экспрессия может быть усилена circ_0074032, который функционирует как приманка для miR-198 [87]. Более того, HOXA2 [104] и HOXA4 [105] также были вовлечены в прогрессирование PCa. В частности, было обнаружено, что экспрессия HOXA2 заметно повышена в метастатических опухолях PCa по сравнению с нормальной тканью, и она ассоциируется с более коротким сроком жизни пациентов.
Gastric cancer (GC)
Рак желудка занимает третье место по распространенности в мире. Исследования показали, что HOXA1 демонстрирует высокую экспрессию в клетках GC, а его ингибирование приводит к снижению экспрессии связанного с клеточным циклом белка циклина D1 [106]. Кроме того, HOXA1 входит в число 27 маркеров метилирования ДНК, которые демонстрируют более высокую частоту или уровень метилирования в тканях GC по сравнению с неопластическими тканями слизистой [107]. Однако исследование HOXA2 выявило более низкую экспрессию гена HOXA2 в опухолевых образцах GC по сравнению с нормальными образцами [108]. Кроме того, HOXA3 был идентифицирован как ген-мишень для miR-338-3p, а повышение регуляции LINC00689 подавляет miR-338-3p, что приводит к повышению экспрессии HOXA3 в клетках GC [82].
Ovarian cancer (OC)
Анализ данных из базы TCGA выявил корреляцию между избыточной экспрессией HOXA1 и A4 и продвинутой стадией Federation of Gynecology and Obstetrics (FIGO) при epithelial ovarian cancer (EOC)) [109]. Кроме того, было обнаружено, что miR-10a-5p подавляет агрессивный фенотип клеток OC путем подавления экспрессии HOXA1 [67]. Примечательно, что сверхэкспрессия HOXA4 значительно ассоциируется с более короткой не прогрессивной выживаемостью у больных серозной карциномой яичников высокой степени тяжести [110]. Кроме того, экспрессия HOXA4 повышена в инвазивных OC по сравнению с неинвазивными [111, 112].
Head and neck squamous cell carcinoma (HNSCC)
На основе биоинформационного анализа с использованием анализа сети ко-экспрессии генов были получены данные, свидетельствующие об отрицательной корреляции между уровнем экспрессии HOXA1 и прогнозом выживаемости опухоли, что подразумевает значительную роль в развитии HNSCC [113]. Более того, анализ вариаций набора генов (GSVA) и анализ обогащения набора генов (GSEA) успешно связали экспрессию HOXA1 с опухоль-ассоциированными сигнальными путями и путями клеточной адгезии [114]. Эти выводы получили дальнейшее подтверждение в исследовании He et al [115].
Oral cancer
Пять генов, а именно ASCL4, CELSR3, HIST1H3J, HOXA1 и ZFP42, были определены как повышенные при плоскоклеточной карциноме полости рта (OSCC). Эти гены участвуют в различных биологических процессах, включая репликацию ДНК, репарацию несоответствий и сигнальный путь, связанный с NOTCH [116]. Было установлено, что избыточная экспрессия HOXA1 в OSCC ассоциируется с плохим прогнозом [117]. Кроме того, HOXA1 в сочетании с Ki67 маркером пролиферации связан с развитием OSCC [118]. Кроме того, в исследовании сообщается об увеличении экспрессии HOXA2 при дисплазии ротовой полости, но и о последующем ее подавлении при прогрессировании рака ротовой полости [119].
Pancreatic ductal adenocarcinoma (PDAC)
В одном из исследований для эффективного выявления PDAC была использована панель из 13 метилированных ДНК-маркеров (MDMs), а именно AK055957, CD1D, CLEC11A, FER1L4, GH05J042948, GRIN2D, HOXA1, LRRC4, NTRK3, PRKCB, RYR2, SHISA9 и ZNF781, в сочетании с углеводным антигеном 19-9 (CA19-9) [120]. Кроме того, повышение уровня HOXA4 было отмечено у пациентов с PDAC с более благоприятным прогнозом [121].
Cervical cancer (CC)
HOXA1 признан активатором опухолей благодаря его хорошо известной роли в стимулировании пролиферации, миграции, инвазии и аэробного гликолиза. В частности, его обогащение в CC было подробно описано [122-124]. Кроме того, miR-10b был идентифицирован как регулятор HOXA1, нацеленный на его 3'-UTR область и эффективно подавляющий рост и инвазию клеток CC [68]. Кроме того, circEIF4G2 [89] и LINC00152 [81] действуют как губки для miR-218 и miR-216b-5p, соответственно, тем самым внося свой вклад в функциональную регуляцию CC. HOXA1 является мишенью miR-218 и miR-216b-5p и напрямую модулирует экспрессию ENO1 и PGK1, тем самым способствуя гликолизу и прогрессированию рака [125]. Соответственно, экспрессия HOXA1 повышена при ранних стадиях рака по сравнению с прилегающими не раковыми тканями и связана с неблагоприятным прогнозом [126].
Esophageal squamous cell carcinoma (ESCC)
Было установлено, что экспрессия HOXA1 повышена в клетках ESCC по сравнению с нормальными клетками. Интересно, что влияние HOXA1 на карциному пищевода можно ослабить с помощью антисмысловых олигодезоксинуклеотидов, которые эффективно подавляют инвазию и метастазирование клеток карциномы пищевода за счет ингибирования активации сигнального пути PI3K/AKT [127]. Кроме того, circ_0058063 оказывает влияние на экспрессию HOXA1 путем нацеливания на miR-377-3p, что в конечном итоге усиливает пролиферацию рака пищевода [86].
Glioblastoma (GBM)
HOXA1 играет ключевую роль в качестве опухолевого активатора, способствующего пролиферации, метастазированию и инвазии GBM [128]. Этот механизм активации опосредован lncRNA-HOTAIRM1 через эпигенетические модификации [78]. Эти выводы были подтверждены Xia et al. в их исследовании, проведенном на стволовых клетках GBM [129]. При исследовании HOXA3 было отмечено, что HOXA3 повышается у пациентов с GBM и ассоциируется с неблагоприятным прогнозом. Примечательно, что HOXA3 транскрипционно активирует аэробный гликолиз, тем самым значительно ускоряя опухолевую прогрессию [130, 131]. Кроме того, было установлено, что HOXA4 повышается в клетках GBM и глиомы, а уровень его экспрессии сильно коррелирует с плохим прогнозом [132].
Nasopharyngeal carcinoma (NPC)
MiR-100 функционирует путем снижения экспрессии HOXA1, тем самым подавляя рост клеток NPC [71]. Используя данные GEO и профилирования метилирования генов, в исследовании определены уровни экспрессии HOXA4 при NPC. Результаты показали, что HOXA4 характеризуется гиперметилированием, что приводит к снижению его экспрессии, и он играет решающую роль в прогрессии NPC [133].
Other cancers
Feng et al. обнаружили участие оси DLX6-AS1/miR-193b-3p/HOXA1 в thyroid carcinoma (TC). Деплеция DLX6-AS1 подавляет рост клеток TC и индуцирует аутофагию за счет повышения экспрессии miR-193b-3p и снижения экспрессии HOXA1 [76]. Примечательно, что уровень метилирования HOXA1 значительно выше при билиарной интраэпителиальной неоплазии - предраковом поражении вне-печеночной холангиокарциномы (EHC) [134]. Кроме того, избыточная экспрессия miR-218 эффективно подавляет развитие миелодиспластических новообразований (MDS), регулируя клеточную пролиферацию, колониеобразование и апоптоз как in vitro, так и in vivo. Механистически miR-218, по-видимому, нацелена на HOXA1, который играет ключевую роль в патогенезе MDS [72]. Кроме того, было показано, что избыточная экспрессия HOXA1 способствует развитию опухолевых эффектов, включая клеточную пролиферацию, метастазирование и инвазию, при раке эндометрия (EC) [79]. Кроме того, аберрантное метилирование HOXA2 определило его как потенциальный биомаркер колоректального рака (CRC) [135, 136]. В ряде исследований сообщалось, что miR-338-3p ингибирует развитие Т-клеточной лимфобластной лимфомы путем прямого воздействия на онкогенный фактор HOXA3 через связывание с 3'-UTR-областью [73]. Кроме того, было обнаружено, что miR-10b нацелен на HOXA3, что приводит к ингибированию пролиферации и инвазии в клетках ccRCC [69].
В заключение следует отметить, что HOXA1 играет важную роль в регуляции развития и прогрессирования основных видов рака, оказывающих существенное влияние на выживаемость человека, включая рак легкого, BC,CRC, GC и рак печени. Примечательно, что экспрессия HOXA1 постоянно повышена при раке легких, раке желудка и печени. Однако его точная роль в BC остается неясной, поскольку некоторые исследования указывают на его функцию в качестве онкогена, в то время как другие свидетельствуют об обратном. HOXA2 привлекает сравнительно меньше внимания исследователей: его экспрессия снижена в BC и GC, а гиперметилирование наблюдается в CRC. Кроме того, экспрессия HOXA3 повышена при раке печени и GC, а при раке легкого она снижена. Как и в случае с HOXA1, роль HOXA3 в BC остается неясной. Напротив, HOXA4 служит геном-супрессором опухоли при раке легкого и BC.
По сравнению с HOXA-4, HOXA1 привлекает значительное внимание при исследовании различных других опухолей. Он служит онкогеном в CC, EC, GBM, HNSCC, NPC, OC, PCa и TC, опосредуя опухолевую пролиферацию, миграцию, инвазию и лекарственную устойчивость. Напротив, HOXA2 демонстрирует высокую экспрессию в PCa. HOXA3 избыточно экспрессируется при раке шейки матки (ccRCC), GBM и T-LBL. Более того, HOXA4 выступает в качестве онкогена в регуляции GBM, одновременно подавляя биологические функции NPC.
Role of HOXA-AS2/3 in disease regulation
Длинная не-кодирующая РНК HOXA cluster antisense RNA 2 и 3 (HOXA-AS2/3) расположена в кластере генов HOXA. Многочисленные исследования неизменно показывают участие HOXA-AS2/3 в развитии различных заболеваний.
HOXA-AS2 in diseases
При изучении диабетической нефропатии было установлено, что ось HOXA-AS2/miRNA-302b-3p/TIMP3 защищает от воспалительного ответа и ингибирует пролиферацию в подоцитах, тем самым смягчая прогрессирование диабетической нефропатии [137]. Кроме того, HOXA-AS2 повышает экспрессию tipe2 путем прямого нацеливания на miR-17-5p, тем самым защищая легочную ткань от повреждения хронической прерывистой гипоксией [138]. HOXA-AS2 нацелен на miRNA-877-3p, которая повышается после повреждения гладкомышечных клеток сосудов аорты человека (HA-VSMCs), что приводит к увеличению пролиферации и метастазированию, подавляя при этом апоптоз VSMC [139]. С помощью высокопроизводительного секвенирования мРНК Zhu et al. установили, что HOXA-AS2 может подавлять воспаление эндотелия путем подавления сигнального пути NF-κB [140]. Ингибирование HOXA-AS2 может облегчить прогрессирование эпилепсии за счет регулирования оси miR-372-3p/STAT3 [141]. Кроме того, высоко экспрессируемый HOXA-AS2 модулирует поляризацию микроглии, взаимодействуя с комплексом PRC2 и эпигенетически подавляя PGC-1, тем самым усиливая нейровоспаление [142]. Кроме того, снижение экспрессии HOXA-AS2 негативно регулирует системную красную волчанку через инактивацию сигнального пути ERK [143] (табл. 2).
Table 2 Role of HOXA- AS2/3 in diseases HOXA-AS3 in diseases
При исследовании атеросклероза экспрессия HOXA-AS3 положительно связана с воспалительным атеросклерозом и взаимодействует с NF-κB, вызывая воспаление эндотелия [145]. Chi et al. обнаружили, что повышение уровня HOXA-AS3 значительно способствует прогрессированию атеросклероза, модулируя ось miR-455-5p/p27 Kip1 [144]. Кроме того, HOXA-AS3 усиливает развитие легочной артериальной гипертензии за счет модуляции оси miR-675-3p/PDE5 [146] (табл. 2).
Кроме того, многочисленные исследования продемонстрировали опухолеродную роль HOXA-AS2/3 в различных видах рака, включая CRC, карциному желчного пузыря (GBC), GC, HCC, рак поджелудочной железы (PC), злокачественную глиому и другие.
HOXA-AS2 in cancers
В HCC снижение экспрессии HOXA-AS2 подавляет клеточную пролиферацию и инвазию, способствуя при этом апоптозу. Напротив, высокая экспрессия HOXA-AS2 ассоциируется с большим размером опухоли, продвинутой стадией TNM и более коротким сроком жизни [147]. Аналогичным образом, при GC HOXA-AS2 значительно повышает свой уровень экспрессии в раковых тканях по сравнению с нераковыми тканями [148]. Благодаря взаимодействию с EZH2, HOXA-AS2 связывается с промоторной областью PLK3, P21 и DDIT3, это приводит к их подавлению через триметилирование H3K27 и способствует прогрессированию GC [149]. Аналогичные наблюдения были сделаны и при CRC [150]. Li et al. показали, что HOXA-AS2 высоко экспрессируется в тканях CRC по сравнению с нормальными тканями, и его экспрессия может служить предсказанием плохого прогноза у пациентов CRC [151]. Связь между HOXA-AS2 и EZH2 также была подтверждена в PC [152], OSCC [153], остром миелоидном лейкозе (AML) [154] и глиоме [155]. Кроме того, снижение уровня HOXA-AS2 индуцирует апоптоз клеток, останавливает клеточный цикл в фазе G1, а также препятствует метастазированию и инвазии в GBC [156]. В глиоме HOXA-AS2 влияет на экспрессию E2F8, E2F1, ATF3 и STAT1, способствуя пролиферации стволовых клеток глиомы (GSCs) и повышая их агрессивность [157]. В CC HOXA-AS2 усиливает пролиферацию и метастазирование, активируя сигнальный путь Notch [158]. Более того, HOXA-AS2 усиливает метастазирование и инвазию клеток NSCLC через активацию IGF2 [159].
Накопленные данные свидетельствуют о том, что HOXA-AS2 действует как губка для миРНК, способствуя опухолевой прогрессии путем регуляции экспрессии генов. Например, в глиоме HOXA-AS2 взаимодействует с miR-373 и miR-302a, модулируя экспрессию EGFR, KDM2A/JAG1, что приводит к усилению формирования васкулогенной мимикрии (VM), жизнеспособности клеток и метастазированию [160], а также иммунной толерантности [161]. Аналогичным образом, при GBM HOXA-AS2 нацелен на miR-2116-3p, miR-885-5p и miR-302a-3p, тем самым регулируя экспрессию SERPINA3, RBBP4 и IGF1, которые влияют на прогрессию GBM [162-164]. При PCa HOXA-AS2 играет роль в регуляции клеточной пролиферации, миграции и EMT через оси miR-885-5p/KDM5B и miR-509-3p/PBX3 [165, 166]. Кроме того, при OSCC HOXA-AS2 способствует прогрессии опухоли, модулируя CDK8 и SNX5 и подавляя miR-567 и miR-520c-3p, соответственно [167, 168]. Более того, HOXA-AS2 действует как губка для miR-520c-3p и miR-106a, регулируя TGFBR2/RELA и SCN3A, соответственно, тем самым усиливая опухолевую прогрессию в BC [169, 170]. Кроме того, HOXA-AS2 участвует в развитии и прогрессии различных других видов рака, включая CC [171], папиллярный рак щитовидной железы [172], карциному эндометрия I типа [173], NPC [174], остеосаркому [175], NSCLC [176], рак мочевого пузыря (BCa) [177] и аневризму грудной аорты [178]. В этих случаях HOXA-AS2 модулирует различные пути, связанные с миРНК, такие как miR-509-3p/BTN3A1, miR-15a-5p/HOXA3, miRNA-302c-3p/ZFX, miR-519/HIF-1? /PD-L1, miR-124-3p/E2F3, miR-216a-5p, miR-125b/Smad2 и miR-520d-3p/KIAA1522/IGF2BP3, способствуя прогрессии опухоли (табл. 3 и рис. 4).
Table 3 Role of HOXA- AS2 in tumor regulation
 figure 4
Role of HOXA- AS2 in tumor regulation HOXA-AS3 in cancers
Kyung Jin Eoh et al. в своем исследовании EOC продемонстрировали, что высокая экспрессия HOXA-AS3 ассоциируется с более короткой продолжительностью жизни, а избыточная экспрессия HOXA-AS3 усиливает пролиферацию и метастазирование клеток EOC [179]. При PC HOXA-AS3 направляет miR-29c на экспрессию CDK6, тем самым стимулируя рост клеток PC [180]. Между тем, оси HOXA-AS3/miR-455-5p/PD-L1 [181] и miR-29c/ BMP1 [182] участвуют в прогрессии HCC, так как высокая экспрессия HOXA-AS3 приводит к увеличению пролиферации, метастазированию и инвазии в HCC. При HCC HOXA-AS3 способствует прогрессированию заболевания, модулируя активность miR-29a-3p [183]. Кроме того, HOXA-AS3 взаимодействует с HOXA3, способствуя развитию резистентности к цисплатину при NSCLC [80]. Одновременно HOXA-AS3 повышает экспрессию TEAD1 за счет конкурирующей активности эндогенной РНК miR-1286, вызывая пролиферацию и миграцию HUVECs и EMT в остеосаркоме [184]. Кроме того, HOXA-AS3 осуществляет регуляторный контроль над связанными с миРНК путями, включая miR-455-5p/Notch1, miR-4319/SPNS2, miR-455-5p/USP3, miR-29a-3p/LT?R/NF-κB, miR-218-5p/COL1A1/LPCAT1, что способствует прогрессии BCa [185], CRC [186], GBM [187], GC [188] и OSCC [189] (Таблица 4 и Рис. 5).
Table 4 Role of HOXA- AS3 in tumor regulation
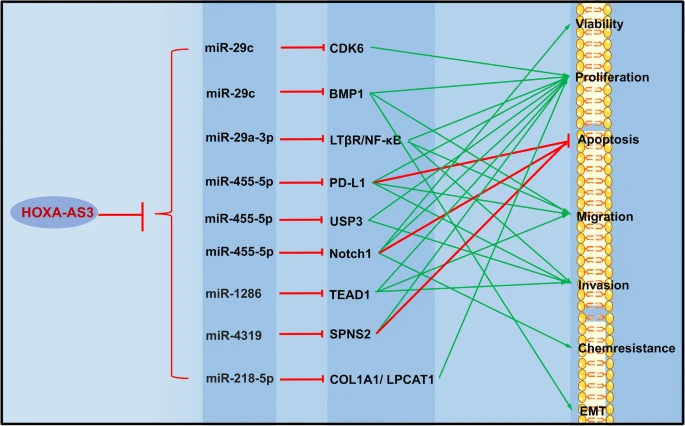 figure 5
Role of HOXA- AS3 in tumor regulation
Эти исследования дают ценное представление об участии HOXA-AS2/3 в возникновении и прогрессировании различных заболеваний, тем самым освещая потенциальные терапевтические мишени и прогностические показатели.
HOXA1-4 genes downstream: target genes and pathway modulation in cancers <
Target genes
Являясь транскрипционным фактором, HOXA играет ключевую роль в развитии заболеваний, воздействуя как на промоторные, так и на энхансерные области генов. Он оказывает регуляторное воздействие, связываясь со специфическими последовательностями ДНК в этих регионах, тем самым влияя на экспрессию нижележащих генов и способствуя развитию и прогрессированию широкого спектра заболеваний.
Было установлено, что экспрессия HOXA1 коррелирует с трансформацией VSMCs в макрофагоподобные клетки. Механистические исследования показали, что ингибирование HOXA1 приводит к подавлению транскрипционной активации NF-κB p65 и KLF4, тем самым участвуя в патологических проявлениях VSMCs [190]. Одновременно HOXA2 связывается с дальним энхансером Hmx1, регулируя тем самым его экспрессию. Hmx1 служит важнейшим транскрипционным фактором в развитии глаза и уха [191].
В контексте онкологических исследований повышение экспрессии HOXA1 было отмечено при BC. Было показано, что повышенная экспрессия HOXA1 способствует пролиферации клеток и усиливает метастазирование, напрямую связываясь с промоторной областью SMAD3 и регулируя его транскрипцию [192]. Кроме того, HOXA1 может способствовать обогащению H3K4me1 и H3K27ac в области энхансера MEIS3, что приводит к усилению экспрессии MEIS3. MEIS3, в свою очередь, регулирует 3-фосфоинозитид-зависимую протеинкиназу 1, связанную с сигнальным путем PI3K/AKT, тем самым способствуя миграции и инвазии при HCC [64]. Недавние исследования также выявили связь между транскрипционными регуляторами гликолитического метаболизма и прогрессией HCC. В частности, HOXA3 активирует лизин-специфическую деметилазу KDM6A, которая затем связывается с сайтами связывания на гликолитических генах и удаляет модификацию гистонов H3K27me3. Этот процесс запускает аэробный гликолиз, способствуя прогрессии GBM [130]. Кроме того, HOXA4 связывается с промоторной областью ARHGAP25, осуществляя регуляторный контроль над его транскрипционной активностью и влияя на рост, инвазию и миграцию клеток рака легкого [193]. HOXA4 также связывается с промотором miR-138, который ингибирует пролиферацию и резистентность к гефитинибу при NSCLC [93].
HOXAs как сигнальный модулятор
HOXAs играют роль в регуляции различных сигнальных путей, включая пути Wnt/β-катенин, JAK-STAT, MEK/ERK и другие, которые вовлечены в канцерогенез и имеют решающее значение при многих типах рака (рис. 6).
 Fig.6
HOXA1-4 is involved in signaling pathways. These include the Wnt/β-catenin, JAK-STAT, MEK/ERK, and PI3K-AKT pathways
С помощью таких инструментов биоинформатики, как GSEA и Китайский атлас геномов глиомы (CGGA), был проведен анализ влияния HOXA2 на прогрессирование глиомы. Результаты показали, что HOXA2 высоко экспрессируется в опухолевых тканях по сравнению с нормальными тканями. Избыточная экспрессия HOXA2 способствует активации сигнального пути JAK-STAT, пути молекул клеточной адгезии (CAMS), фокальной адгезии, пути цитозольного ДНК-сенсинга и цитотоксичности, опосредованной натуральными клетками-киллерами [194]. Кроме того, роль пути Wnt/β-катенин, который, как известно, играет важную роль в онкогенезе и развитии опухолей, была изучена в связи с HOXA1. Han et al. сообщили, что miR-100 нацелен на HOXA1, что приводит к увеличению способности к инвазии и миграции клеток NSCLC через Wnt/β-катениновый путь [70]. Аналогично, длинная не-кодирующая РНК ZFPM2-AS1 действует как конкурирующая эндогенная РНК для miR-515, положительно взаимодействуя с HOXA1 для активации сигнального пути Wnt/β-катенин, способствуя развитию ретинобластомы [85]. Кроме того, имеются данные о том, что HOXA1, функционирующий как ген-супрессор опухоли, участвует в регуляции химиорезистентности при мелкоклеточном раке легкого через сигнальный путь NF-κB [195]. В ОК miR-99a нацелен на HOXA1 для подавления пролиферации ОК путем воздействия на путь AKT/mTOR [75]. Еще один заметный путь, в котором задействован HOXA3, - это путь EGFR. HOXA-AS2 усиливает экспрессию HOXA3, тем самым активируя сигнальный путь EGFR/Ras/Raf/MEK/ERK. Это приводит к повышению устойчивости к глюкокортикоидам, способствуя пролиферации и подавляя апоптоз в клеточных линиях острого лимфобластного лейкоза [196].
Перекрестное взаимодействие между HOXs
В заимодействие и совместная экспрессия членов семейства HOXA при различных заболеваниях были продемонстрированы с помощью биоинформационных данных, а также результатов in vitro и in vivo. Такая сетевая регуляция генов может вносить существенный вклад в развитие заболеваний. Например, при эндометриозе все члены семейства генов HOXA (за исключением HOXA1) были значительно снижены в эктопических тканях по сравнению с нормальным эндометрием [30]. В опухолях анализ данных TCGA показал, что HOXA2, HOXA9 и HOXA10 являются значимыми генами, ассоциированными с PCa, и дисрегуляторными PCa, влияющими на OS пациентов с PCa. Примечательно, что экспрессия HOXA2, HOXA9 и HOXA10 связана с иммунными инфильтратами иммунных клеток [197]. Исследования, проведенные в KIRC, показали значительное увеличение экспрессии HOXA4 и HOXA13, в то время как экспрессия HOXA7 и HOXA11 была снижена. Более того, высокая экспрессия HOXA2, HOXA3 и HOXA13, наряду с низкой экспрессией HOXA7, ассоциируется с плохой OS у пациентов с KIRC [198]. Однако при плоскоклеточном раке гортани экспрессия HOXA2 и HOXA4 была значительно снижена, а HOXA7 и HOXA9-13 - повышена [199]. Благодаря использованию различных открытых баз данных и биоинформатическому анализу было обнаружено, что 11 HOXA (HOXA1, HOXA2, HOXA3, HOXA4, HOXA5, HOXA6, HOXA7, HOXA9, HOXA10, HOXA11 и HOXA13) демонстрируют высокую экспрессию в тканях глиомы низкого класса и GBM [200]. Кроме того, в ранней стадии CRC высокочастотное гиперметилирование HOXA2, HOXA5 и HOXA6 было определено как основная причина их низкой экспрессии при CRC [136].
Помимо ко-экспрессии среди членов семейства HOXA, существуют также ко-экспрессии с другими членами семейства HOX. Например, HOXA3 демонстрирует повышенную экспрессию в эпендимоме в сочетании с ARX, HOXA5, HOXA9 и HOXC6 [201]. Кроме того, механистические исследования показали, что 2F1, HNF3, KLF6 и SP3 способны связываться с промоторными областями, общими для всех генов HOX, тем самым регулируя их экспрессию в совокупности [202].
HOXA1-4 genes potentiate disease treatment
Sclerostin (Sost), секретируемый гликопротеин, кодируемый геном мыши, играет важную роль в ремоделировании костей. Терапия антителами, направленная на склеростин, была одобрена для лечения остеопороза. Было установлено, что у пожилых мышей, питающихся по западной диете, нокаут гена Sost предотвращает стеноз аортального клапана. Интересно, что в интерстициальных клетках клапана мышей с нокаутом гена Sost была выявлена повышенная экспрессия HOXA1 [203]. В исследованиях на мышиных эмбрионах, обработанных фенитоином натрия, известным фактором риска развития расщелины нёба, была отмечена высокая экспрессия HOXA2 в тканях черепно-лицевой области [204]. Кроме того, дигидроартемизинин, экстракт, полученный из Artemisia apiacea, продемонстрировал способность ингибировать дифференцировку мезенхимных стволовых клеток через модуляцию регуляции Runx2 и Col10a1 с помощью Pax6/HOXA2 [205].
При исследовании функции HOXA в лечении опухолей было обнаружено, что метилирование HOXA1 может быть индуцировано HOTAIR, что приводит к химиорезистентности в SCLC через активацию пути NF-κB [195]. Этот механизм также наблюдался при резистентности к цисплатину при LUAD. Кроме того, совместный анализ различных баз данных выявил HOXA1, наряду с пятью другими генами (BATF3, FOXA2, IRF5, SIX1 и ZBTB38), в качестве модели резистентности к цисплатину [206]. Сочетание метилированных HOXA1, CA19-9 и SST было использовано для диагностики PC I стадии [207]. Кроме того, длинная не-кодирующая РНК CCAT1 функционирует как губка для miR-218, усиливая резистентность к gefitinib при NSCLC за счет модуляции HOXA1 [208]. KDM3A подвергается тирозиновому фосфорилированию, которое, в свою очередь, регулирует экспрессию HOXA1, способствуя росту резистентного к тамоксифену BC [209]. Радиотерапия является широко используемым методом лечения онкологических больных, и в этом контексте HOXA1 был идентифицирован как независимый предиктор прогрессии опухоли, демонстрируя положительную корреляцию с экспрессией генов, повышающих лучевую устойчивость, включая EGFR, CDK6 и CAV1 [115]. Кроме того, при сравнении пациентов с хроническим миелоидным лейкозом, резистентным к imatinib mesylate, гиперметилирование промотора гена HOXA4 было значительно выше у тех, кто плохо отвечал на лечение [210]. Эпигенетическое замалчивание HOXA4 также связано со снижением чувствительности клеток хронического лимфоцитарного лейкоза к лечению fludarabine, ibrutinib и idelalisib [211].
Широкая экспрессия и заметное прогностическое значение генов HOXA1-4 наблюдаются при различных видах рака человека. Следовательно, воздействие на гены HOXA представляет собой привлекательную стратегию для поиска лекарств, и в настоящее время предпринимаются активные усилия по разработке терапии, избирательно воздействующей на эти гены.
Conclusion and prospective
В целом, гены HOXA1-4 играют важнейшую роль в регуляции различных заболеваний и прогрессии опухолей. При общих заболеваниях мутации, эпигенетические модификации и дисрегуляция генов являются значимыми патогенетическими факторами, способствующими таким состояниям, как дефекты развития головы и лица, сердечно-сосудистые заболевания, вирусные инфекции, неврологическое развитие, а также воспалительные реакции. При раке гены HOXA1-4 могут функционировать как онкогены или супрессоры опухолей и взаимодействовать с другими членами семейства HOX для регулирования опухолевой пролиферации, инвазии и метастазирования через такие сигнальные пути, как JAK-STAT, MEK/ERK и Wnt/β-катенин. Кроме того, HOXA-AS2/3 участвует в прогрессировании различных заболеваний, включая сосудистые нарушения и воспаление. В онкологии HOXA-AS2/3 часто избыточно экспрессируется в нескольких типах рака, таких как CC, GBM, GC, NSCLC и OSCC. Повышенная экспрессия HOXA-AS2/3 связана с плохим прогнозом, лекарственной устойчивостью, метастазированием рака и низкой выживаемостью. В первую очередь он действует как губка для миРНК, участвуя в регуляции развития и прогрессии опухоли. Кроме того, экспрессия HOXA1-4 связана с химиорезистентностью и ответом на радиотерапию. Таким образом, изучение механизмов, лежащих в основе участия HOXA1-4 в развитии заболеваний и опухолей, может заложить прочный теоретический фундамент для генной терапии. Однако применение HOXA1-4 в таргетной терапии в настоящее время находится на стадии доклинических или клинических испытаний, что обуславливает необходимость дальнейших исследований в этой области.
|
 Fig. 1
The human HOX gene clusters. 39 HOX are organized into four chromosomal clusters: HOXA, HOXB, HOXC, and HOXD
Fig. 1
The human HOX gene clusters. 39 HOX are organized into four chromosomal clusters: HOXA, HOXB, HOXC, and HOXD
 Fig.2
HOXA1-4 genes have participated in the regulation of gene expression related to the heart, blood vessels, viruses, genetic diseases, neurology, psychiatry, and developmental defects
Fig.2
HOXA1-4 genes have participated in the regulation of gene expression related to the heart, blood vessels, viruses, genetic diseases, neurology, psychiatry, and developmental defects
 Fig. 3
HOXA1-4 genes dysregulation in human cancers. The color code highlights alterations found for more than one HOXA gene in different tumor sites
Fig. 3
HOXA1-4 genes dysregulation in human cancers. The color code highlights alterations found for more than one HOXA gene in different tumor sites  figure 4
Role of HOXA- AS2 in tumor regulation
figure 4
Role of HOXA- AS2 in tumor regulation  figure 5
Role of HOXA- AS3 in tumor regulation
figure 5
Role of HOXA- AS3 in tumor regulation
 Fig.6
HOXA1-4 is involved in signaling pathways. These include the Wnt/β-catenin, JAK-STAT, MEK/ERK, and PI3K-AKT pathways
Fig.6
HOXA1-4 is involved in signaling pathways. These include the Wnt/β-catenin, JAK-STAT, MEK/ERK, and PI3K-AKT pathways