Удивительный размер геномов прокариот диктует, чтобы ядерная ДНК собиралась в компактную - и всё же динамическую - структуру, которая может эффективно хранить и использовать правильно генетическую информацию. ДНК ассоциирована с гистонами в нуклеопротеиновые структуры, известные как хроматин (Kornberg and Lorch, 1999). Однако хроматиновые структуры негомогенны; они организованы в иерархически последовательные уровни компакции, от базовых единиц хроматина, нуклеосомы, до наиболее компактной формы, метафазных хромосом. Хроматиновые структуры детерминируют не только физическое распределение генома, но играют ключевую роль в контроле доступа к генетической информации, а значит и к генной экспрессии (Kornberg and Lorch, 1999; Wu and Grunstein, 2000). Т.о., первый уровень организации хроматина, нить в 11 nm, соответствует набору нуклеосом или бусинкам на нитке, в которых ДНК компактизована в 7 раз. Эта нить доступна для транскрипционного аппарата и ассоциирует с транскрипционно активными регионами, которые известны как активный хроматин или эухроматин (Trojer and Reinberg, 2007; Vaquero et al., 2003). Гетерохроматин означает регионы генома, которые ассоциируют в неактивными областями, красятся дифференциально определенными красками и соответствуют наиболее компактной структуре хроматина. Наилучшим кандидатом на роль гетерохроматиновой структуры является нить в 30nm, которая соответствует существенно более компактной (в 42-раза) структуре ДНК, которая не подвержена транскрипции. Однако нить в 30nm всё ещё нечетко определяется in vivo (Tremethick, 2007; Trojer and Reinberg, 2007).
Переход между этими двумя уровнями организации хроматина жизненно необходим для контроля транскрипции, репликации и многих др. клеточных функций, связанных с ДНК.
Одной из крупнейших находок в последнюю декаду стал тот факт, что гистоны участвуют практически во всех аспектах регуляции хроматина. Основной механизм, с помощью которого гистоны осуществляют эту регуляцию, является модификация их N-терминальных доменов, или гистоновых хвостов, которые являются доступными, не структуированными доменами, которые выступают из нуклеосом. Некоторые остатки гистоновых хвостов подвергаются специфическим пост-трасляционным модификациям, таким как ацетилирование, метилирование, фосфорилирование, ADP-рибозилирование, убиквитилирование, сумоилирование и биотинирование (Vaquero et al., 2003). Среди этих модификаций ацетилирование и метилирование лизиновых остатков в гистонах H3 и H4, является критическим для регуляции структуры хроматина и генной экспрессии (Shahbazian and Grunstein, 2007). Ацетилирование lysine 16 в гистоне H4 (H4K16Ac) выделяется своим участием в эпигенетических феноменах, обнаруживаемых в ходе всей эволюции хроматина, а также благодаря своей уникальной роли в структуре хроматина, генной экспрессии, репарации и рекомбинации ДНК (Vaquero et al., 2007b). Эти пост-трансляционные модификации являются частично эпигенетическими, означающим, что организмы могут передавать их своим потомкам. Альтерации эпигенетических процессов имеют удивительные последствия для многочисленных патологий у человека, включая рак (Esteller, 2007; Ting et al., 2006).
Гистоновые метки предоставляют важную информацию о определенных свойствах эухроматина и гетерохроматина, а также о факторах, участвующих в переходе между этими двумя формами хроматина (Vaquero et al., 2003). В целом эухроматиновые активные регионы коррелируют с ацетилированием лизинов и определенными комбинациями метилирования как лизина, так и аргинина. Эти модификации предоставляют доступ регуляторным факторам к промоторным регионам и делают возможной эффективную транскрипцию с помощью RNA polymerase II (Eissenberg and Shilatifard, 2006). Этими метками являются H4K16Ac, H3K4me3, H3K36me3, H3K79me2 и 3 и H4R3me2. Напротив, компактные гетерохроматиновые регионы обычно гипоацетилированы и метилированы по иным комбинациям из лизиновых метилированных меток, таких как H3K9me2 и 3, H4K20me1 и 3 и H3K27me3 (Trojer and Reinberg, 2007). В частности, метилирование лизина 9 в H3 (H3K9me2 и 3) является характеристикой глобальной организации хроматина и его распознавание с помощью специфических структурных белков, таких как HP1 необходимо для сборки и распределения гетерохроматина (Lachner and Jenuwein, 2002).
Histone deacetylases (HDACs) являются частью группы белков, которые регулируют метки ацетилирования. Эти энзимы ответственны за удаление acetyl группы с ε-lysine остатков и следовательно, участвуют в репрессии генов и формировании гетерохроматина. Эта роль также делает HDACs ключевыми игроками в эпигенетической регуляции и в осуществлении специфических пространственно-временных программ экспрессии, таких как развитие и клеточная дифференцировка (Ahringer, 2000; Margueron et al., 2005; Vaquero et al., 2003; Verdin et al., 2003). Более того, HDACs выполняют важную роль в репарации, репликации ДНК , в контроле клеточного цикла, апоптозе и др. функциях (de Ruijter et al., 2003; Kurdistani and Grunstein, 2003). Интересно, что HDACs не ограничены деацетилированием гистонов, а скорее имеют широкий спектр и не гистоновых мишеней. Acetylation/ deacetylation негистоновых белков считается более общим механизмом модуляции функции клеточных белков, чем это считалось ранее. Сегодня предполагается три основных уровня регуляции: связывание ДНК, стабильность белков и ферментативная активность (Glozak et al., 2005).
HDACs подразделены на 4 филогенетические группы (Class I to IV) (Yang and Seto, 2008). Classes I, II и IV являются близко родственными структурно и механистически, тогда как Class III представлен членами семейства Sir2, группой белков с уникальными свойствами, критическими для клеточной жизнеспособности, адаптации к средоввым стимулам и геномной целостности.
The Sir2 family
Семейство Sir2 определено по его гомологии с в фактором молчания Sir2p (Silencing Information Regulator 2) почкующихся дрожжей, NAD+-зависимой histone deacetylase (Imai et al., 2000; Landry et al., 2000), участвующей в процессах, которые включают эпигенетическое молчание, репарацию, репликацию, рекомбинацию ДНК и контроль клеточного цикла (Saunders and Verdin, 2007; Vaquero et al., 2007b). Степень консервации среди членов семейства Sir2 ограничена каталитическим доменом, областью почти в 250 остатков (Frye, 1999), которая содержит два хорошо известных структурных мотива: NAD+ связывающий, reverse Rossman fold домен и небольшая zinc полоска, которая обеспечивает структурную стабильность (Finnin et al., 2001; Min et al., 2001).
Члены семейства Sir2 характеризуются своей зависимостью от NAD+ для осуществления ферментативных реакций (Imai et al., 2000). Динуклеотид NAD+ является метаболическим кофактором. необходимым для переноса электронов в промежуточном метаболизме вместе с редуцированной формой, NADH. В каталитическом механизме, обеспечиваемом с помощью этих энзимов, NAD+ катаболизируется в nicotinamide и ADP-ribose в присутствии ацетилированной мишени (Sauve and Schramm, 2003). В противоположность др. классам HDACs, белки Class III не высвобождают acetyl группы в раствор в качестве ацетата. Вместо этого, acetyl группы переносятся на ADP-ribose, высвобождая O-acetylADP-ribose в качестве финального продукта (Sauve et al., 2001).
Тот факт, что sirtuins нуждаются в NAD+ является фундаментальным для понимания большинства их функций, т.к. предполагается, что они могут действовать в качестве сенсоров метаболического состояния клеток (Fulco et al., 2003; Haigis and Guarente, 2006). Следовательно, sirtuins способны обеспечивать изменения в метаболизма хроматина посредством деацетилирования гистонов и др. белков. Как мы увидим в ходе эволюции существовали две первичные функции, связанные с sirtuins: метаболизм и регуляция хроматина. Третья роль реакция на стрессы, широко обнаруживается у эукариот, но не распространяется на первые два, указывая тем самым, что она приобретена позднее в эволюции.
Каталитический механизм семейства Sir2 осуществляет не только деацетилирование, но и может также обладать mono ADP-ribosyltransferase активностью (Tanny et al., 1999), которая присутствует у почти всех протестированных sirtuins-хотя у многих она лишь остаточная (Saunders and Verdin, 2007; Yamamoto et al., 2007). Хотя Sirtuins первоначально были ribosyltransferases, тот факт, что они стали осуществлять деацетилирование белков у archaea , а также у бактерий, указывает на то, что они вероятно приобрели эту функцию довольно рано в эволюции (Starai et al., 2002; Tsang and Escalante-Semerena, 1998). Открытие HDAC активности у белков семейства Sir2 привело к их классификации в качестве HDAC Class III. Однако не все sirtuins обнаруживают заметную deacetylase активность (North et al., 2005). В некоторых случаях они обладают лишь mono-ADP ribosyltransferase активностью. Следовательно, возможен пересмотр Class III HDACs. Тем не менее sirtuins, лишенные известной deacetylase активности могут быть действительно настоящими deacetylases с не идентифицированными субстратами.
Как упоминалось прежде, семейство Sir2 намного старше, чем гистоны и хроматин. Фактически его члены обнаруживаются во всех трех доменах жизни (eubacteria, archaea и eukaryotes) (Frye, 2000) и находки подтверждают, что оригинальная роль sirtuins заключается в регуляции метаболизма посредством ключевых энзимов, таких как acetyl-CoA synthetase (Starai et al., 2002). Однако функциональная связь между sirtuins и регуляцией хроматина особенно поразительна по нескольким причинам. Во-первых, sirtuins участвуют в регуляции хроматина в ходе всей эволюции от первых примеров хроматин-подобной организации ДНК у archaea (Bell et al., 2002) до более сложных и развитых геномов млекопитающих (Kuzmichev et al.,
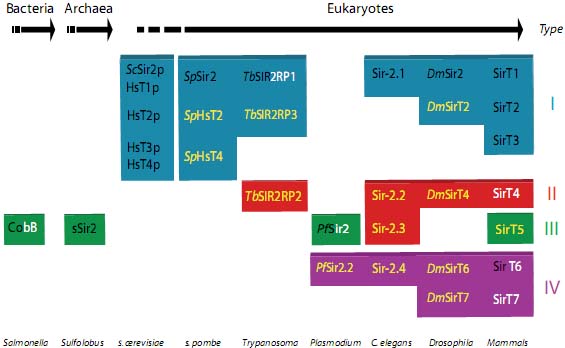 Fig. 1. Classification of sirtuins. List of sirtuins from selected organisms from bacteria to humans classified phylogenetically (Type) according to Frye (2000). The denomination "Type" here and elsewhere in the text has been used instead of "Class", to avoid confusion with HDAC classification (HDAC Class I to III). The font color used for the sirtuins indicates current knowledge on their enzymatic activity: black for those with known deacetylase activity; white for those whose main activity is ADP-ribosylation; and black and white for both. The sirtuins shown in yellow have not yet been characterized; hence, no information on them is available.
Fig. 1. Classification of sirtuins. List of sirtuins from selected organisms from bacteria to humans classified phylogenetically (Type) according to Frye (2000). The denomination "Type" here and elsewhere in the text has been used instead of "Class", to avoid confusion with HDAC classification (HDAC Class I to III). The font color used for the sirtuins indicates current knowledge on their enzymatic activity: black for those with known deacetylase activity; white for those whose main activity is ADP-ribosylation; and black and white for both. The sirtuins shown in yellow have not yet been characterized; hence, no information on them is available.
2004; Vaquero et al., 2007a, Vaquero et al., 2004; Vaquero et al., 2006). Во-вторых, активность эукариотических sirtuin тесно связана с регуляцией определенной метки , H4K16Ac и в меньшей степени H3K9Ac (Vaquero et al., 2007b). Интересно, что это единственные два остатка с хорошо известной ролью в регуляции структуры хроматина (Shahbazian and Grunstein, 2007), это указывает на то, что специфичность sirtuin тесно связана с контролем организации хроматина. В-третьих, активность sirtuin нацелена не только на гистоны, но и на различные др. связанные с хроматином факторы, такие как хроматин модифицирующие энзимы. структурные белки и транскрипционные факторы (Saunders and Verdin, 2007; Shahbazian and Grunstein, 2007). Наконец, хотя sirtuins высших организмов участвуют в разнообразных функциях, имея мириады мишеней, многие из этих ролей осуществляются посредством генной экспрессии и, следовательно, посредством регуляции хроматина.
Интересно, что каталитическая активность sirtuin-в противоположность таковой др. HDACs-тонко регулируется с помощью разных механизмов Один механизм действует от дрожжей до человека, это не конкурирующий эффект избытка свободного nicotinamide, который высвобождается после NAD+ катаболизма (Bitterman et al., 2002). Это ингибирование может представлять собой путь ограничения активности sirtuin и тем самым избегать истощения NAD+ , которое может приводить к летальности в определенных условиях, как это было показано дляr Poly-ribosyltransferase 1 (PARP1) (Pieper et al., 2000). Второй механизм использует метаболическое промежуточное образование nicotinamide riboside, предшественник NAD+ в дрожжевом пути утилизации отходов метаболизма, который усиливает активность Sir2 in vivo (Belenky et al., 2007). Третий механизм, посредством которого sirtuins регулируют использование Oacetyl-ADP ribose, основного продукта активности Sir2. В случае Sir3p, связывание O-acetyl-ADP ribose , ка было установлено, вызывает конформационное изменение, которое увеличивает его связывание с ScSir2p и способствует загрузке на хроматин (Liou et al., 2005). Однако путь, в котором O-acetyl-ADP ribose регулирует др. sirtuins млекопитающих неясен. Единственное доступное указание заключается в том, что эта молекула может соединяться с гистоном macroH2A (mH2A), вариантом H2A, участвующим в определенных формах гетерохроматина (Kustatscher et al., 2005). Хотя это может указывать на нижестоящую передачу сигналов на действие sirtuin, эффект O-acetyl-ADP ribose на mH2A неизвестен.
Метаболиты являются не только типом молекул, которые могут модулировать активность sirtuin. Недавние исследования идентифицировали несколько белков, которые могут усиливать или ослаблять активность определенных sirtuins, таких как SirT1 млекопитающих (Kim et al., 2007; Kim et al., 2008; Zhao et al., 2008). Однако условия, при которых эти модуляторы действуют, остаются неизвестными.
Интересным следствием вовлечения sirtuin в передачу метаболических сигналов является возможная связь контролем продолжительности жизни. Это было продемонстрировано на организмах, включая дрожжи, C. elegans и Drosophila (Longo and Kennedy, 2006; Rogina and Helfand, 2004; Tissenbaum and Guarente, 2001). Принимая во внимание калорическое ограничение, которое ассоциирует с увеличением продолжительности жизни, как полагают, sirtuins являются медиаторами эффектов ограничения калорий на продолжительность жизни, вообще-то за счет усиления клеточной жизнеспособности. Это было продемонстрировано только на дрожжах и Drosophila (Longo and Kennedy, 2006; Rogina et al., 2002), хотя имеющиеся данные указывают на то. что это может иметь место и у млекопитающих (Boily et al., 2008).
Количество sirtuins варьирует среди разных организмов и в целом коррелирует со величиной сложности. Напр., прокариоты имеют 1-2 sirtuins, дрожжи от 3-х до 5, Drosophila имеет 5, а млекопитающие имеют 7 (Fig. 1). Однако растения составляют исключение из этого правила: Arabidopsis thaliana и рис имеют только 2 (Frye, 2000).
Sirtuins филогенетически подразделены на 5 типов: I - IV и U (Frye, 2000) (Fig. 1). Члены типа I четко связаны с регуляцией хроматина-хотя и не только-и обнаруживают настоящую histone deacetylase активность. Type I sirtuins включают все дрожжевые sirtuins, SirT1-3 человека и др. Тип II представлен sirtuins прокариот, которые, по-видимому, участвуют в контроле метаболизма. Эти sirtuins, по-видимому, обладают прежде всего ADP-ribosyltransferase активностью и в основном локализованы в митохондриях. Типа III - это др. группа sirtuins, связанная с прокариотами; фактически, она включает большинство eubacterial и archeal Sirtuins. Эукариотические члены подобно Type II sirtuins, расположены в митохондриях. Type IV содержит эукариотические sirtuins, которые также, по-видимому, функционально связаны с хроматином, такие как SirT6 и SirT7. Хотя предыдущие находки намекали, что Type IV sirtuins являются ADP-ribosyltransferases, , однако сравнительно недавние открытия выявили H3K9Ac-специфическую deacetylase активность для SirT6 на теломерах, это изменило взгляд на функцию Class IV и позволило предположить, что обе активности сосуществуют в этом семействе (Michishita et al., 2008). Наконец, Type U представляет др. не охарактеризованные sirtuins прокариот. Наиболее распространенной комбинацией sirtuins, присутствующей в ходе эволюции, является сочетание Types II и IV.
Prokaryotes
Хотя sirtuins широко распространены, они присутствуют не у всех прокариот. Знания о членах Sir2-семейства и их функциях довольно ограничены. Sirtuins из грамм-негативных бактерий филогенетически родственны членам archaea и. как было установлено, обладают как ADP-ribosyltransferase, так и deacetylase активностью (Starai et al., 2002; Tsang and EscalanteSemerena, 1998). Напротив Gram-положительны sirtuins полностью не охарактеризованы. Salmonella enterica sirtuin кодируемый геном CobB, участвует в регуляции acetyl-CoA synthetase (Acs), энзима, который генерирует acetyl-CoenzymeA (Ac-CoA) из acetate, ATP и CoenzymeA (CoA) (Starai et al., 2002). Деацетилирование Acs лизина 609 с помощью CobB ведет к двукратному увеличению активности Acs и делает возможной генерацию Ac-CoA в условиях роста, при которых источниками углерода и энергии являются корото-цепочечные жирные кислоты (напр, propionate и acetate). Кроме того, CobB может компенсировать потерю CobT, phosphoribosyltransferase, участвующей в синтезе cobalamin (vitamin B12) (Tsang and Escalante-Semerena, 1998). Эти находки указывают на то, что обе активности сосуществуют с самого раннего развития семейства sirtuin.
Archaea предоставляют сложную и уникальную точку зрения на ранние стадии эволюции хроматина. Во-первых, archaeal хромосомы содержат две широко распространенные группы белков хроматина: гистоны и Alba (Sandman and Reeve, 2005). Некоторые члены Euryarchaeota и Nanoarchaeota phyla содержат гистоны, которые упакованы в нуклеосомы, представленные в 80 bp ДНК, обернутой вокруг гистонового октамера (Sandman and Reeve, 2005). Эти гистоны содержат характерную гистоновую складку и м. формировать хроматиновые волокна in vitro, сходные с эукариотическими гистонами, но они не выставляют N-терминальные хвосты и они не подвергаются пост-трансляционным модификациям (Luijsterburg et al., 2008). Alba, с др. стороны, более повсеместны, чем гистоны: они обнаруживаются у всех археа за исключением некоторых Euryarchaeota (Sandman and Reeve, 2005). Некоторые archaea содержат оба типа хроматиновых белков, тогда как др. содержат только один тип, отражая разные стратегии эволюции эффективной организации ДНК. Интересно, что эукариоты содержат как гистоновые, так и Alba белки. Однако гистоны эукариот используются для приобретения гистоновых N-окончаний, которые подвергаются широкому набору пост-трансляционных модификаций, тогда как эукариотические родственники Alba необходимы для более специализированной связанной с РНК роли (Bernander, 2003).
Поскольку Alba были изучены почти исключительно у Sulfolobus, который является членом Crenarchaea phylum, и поэтому лишен гистонов, степень взаимодействия между Alba и гистонами и возможные значения этого взаимодействия на организацию ДНК у др. archaea, изучены слабо. Alba является белковым димером, формируемым за счет 10 kDa субъединиц (Zhao et al., 2003). Он неспецифически соединяется с двунитчатой ДНК и униформно распределен по геному. В соответствии с ролью генерального структурного компонента хроматина, Alba соединяется с ДНК со стоихометрией 5-10 bp на белковый димер, создавая хроматин-подобную структуру (Zhao et al., 2003). Подобно эукариотическим гистонам, Alba имеет N-треминальный домен, который ацетилируется по lysine 16, это сказывается негативно на сродстве связывания Alba's с ДНК (Wardleworth et al., 2002). Интересно, что Sulfolobus Sir2 увеличивает связывание Alba с ДНК за счет деацетилирования K16, это ведет к образованию компактной, хроматин-подобной структуры, которая устойчива к транскрипции (Bell et al., 2002; Wardleworth et al., 2002). Это удивительная находка. т.к. это связано с одной из самых ранних стадий эволюции хроматина. Функциональное участие Sir2 подтверждает не только то, что sirtuins участвуют с регуляции структуры хроматина с самого начала, но и также то, что Sir2 может быть среди факторов, которые обеспечили эволюцию хроматина.
Lower eukaryotes
Переход от прокариот к эукариотам происходил революционно во многих аспектах, включая создание ядерной мембраны, развитие новых органелл и организацию ДНК в настоящий хроматин. Это происходило впервые у низших эукариот, которые специализировали хроматиновый аппарат, способный к эффективной упаковке. Это позволило увеличить размер генома и сложность, необходимую для эволюции многоклеточных организмов, дифференцировки типов клеток и развития.
Существует значительное количество данных о роли sirtuins у низших эукариот. Они в основном получены в результате генетических исследований на почкующихся дрожжах Saccharomyces cerevisiae, у которые впервые был идентифицирован sirtuin (ScSir2p) (Rine and Herskowitz, 1987; Rine et al., 1979). Исследования на низших эукариотах показали участие sirtuins в регуляции структуры хроматина. Фактически, ядерные sirtuins имеют два законсервированный места в клетках: теломеры и ядрышки (Guarente, 2000). В обоих случаях sirtuins участвуют в формировании гетерохроматина. В первых они играют важную роль в структуре генома и замалчивании генов, тогда как во вторых они обеспечивают молчание экспрессии рДНК, контролируют клеточный цикл, рекомбинацию и др. процессы (Gartenberg, 2000).
Yeast
Исследования на почкующихся дрожжах, Saccharomyces cerevisiae, являются ключевыми для понимания регуляции хроматина у высших организмов. Это частично обусловлено тем фактом, что S. cerevisiae являются атипичными эукариотами в терминах структуры хроматина. Хроматин у S. cerevisiae не компактизируется тем же способом, что у др. эукариот; вместо этого он находится в целом в эухроматиновом, или слегка упакованном, конформационном состоянии, которое наиболее пригодно для транскрипции. Фактически, только три места в геноме S. cerevisiae подвергаются хроматиновой компакции: теломеры, локусы типов спаривания и гены ядрышковой рДНК (Gartenberg, 2000). Но даже эти гетерохроматиновые структуры существенно отличны от таковых у высших организмов, поскольку они лишены важных характеристик компакции хроматина, таких как метилирование H3K9 и специфичные для гетерохроматина структурные белки (Buck et al., 2004). Фактически образование гетерохроматина у S. cerevisiae is базируется в основном на гипоацетилировании гистонов, который, хотя и способен продуцировать определенную степень компакции волокон хроматина, но не способен это делать в такой же степени, что и гетерхроматин у высших эукариот (Kurdistani et al., 2004; Robyr et al., 2002). Поэтому S. cerevisiae's специфический тип хроматина делает histone deacetylases основными игроками организации хроматина у дрожжей. Эта довольно неожиданная находка показывает, что после деацетилирования гистона метилирование H3K9 является наиболее законсервированным признаком молчащего хроматина у эукариот (Klose et al., 2007; Krauss, 2008; Schotta et al., 2002). Принимая по внимание, что эта модификация уже присутствует у ряда членов царства Amoebozoa, метилирование H3K9 , по-видимому, развивается на ранних стадиях эволюции эукариот. Сравнения с Neurospora и Schizosaccharomyces, которые являются ближайшими родственниками Saccharomyces, которые обнаруживают метилирование H3K9, указывает на то, что в то время как их общий родоначальник возможно обладает этой активностью, Saccharomycesтеряют её, т.к. это связано с более компактным геномом (Krauss, 2008).
Становление гетерохроматиновых локусов у Saccharomyces зависит от активности впервые описанного sirtuin, ScSir2p. 4 SIR гена, SIR1 -4, были идентифицированы благодаря мутациям, которые делали возможной аномальную экспрессию обычно молчащих генов типов спаривания (Rine et al., 1979). Их генные продукты участвуют в эпигенетическом молчании локусов типа спаривания за счет связывания регионов silencer в HMR и HML локусах, расположенных на др. плечах хромосомы 3. Sir1p ответственен за установление генного молчания посредством своего взаимодействия с ORC1, компонентом origin of replication complex (ORC), и транскрипционными факторами, такими как Rap1p и Abf-1 в регионе HMR/HML сайленсера (Fig. 2A). Процесс замалчивания локусов типов спаривания использует прибытие Sir1p, сопровождаемое рекрутированием Sir3p и комплекса Sir4p-ScSir2p (Moazed et al., 1997). Как Sir3p, так и Sir4p связывают хроматин благодаря непосредственному взаимодействию с гистонами H3 и H4. Рекрутирование ScSir2p (в виде Sir4pScSir2p комплекса), приводит к деацетилированию хвостов H3 и H4 и особенно
H4K16Ac. После загрузки структура гетерохроматина распластывается благодаря связыванию Sir3p и Sir4p-ScSir2p с соседним гипоацетилированным H3 и H4, это в свою очередь приводит к дальнейшему деацетилированию (Fig. 2A) (Gartenberg, 2000). Более того, гипоацетилирование H4K16 распознается как сигнатура ScSir2p молчащих регионов (Robyr et al., 2002). Напротив, известно, что распространение Sir комплекса ингибируется с помощью ацетилирования H4K16 и что пограничные регионы в молчащем гетерохроматине гиперацетилированы по H4K16 (Ekwall, 2005; Kimura et al., 2002; Suka et al., 2002). Действительно было показано, что H4K16Ac HAT (histone acetyltransferase) Sas2p создает градиент H4K16Ac, который контролирует расширение ScSir2p-молчания (Kimura et al., 2002; Suka et al., 2002).
Хотя ScSir2p участвует в молчании теломер, локусов типа спаривания и генов ядрышковой рДНК, белки Sir, которые действуют на этих регионах гетерохроматина не всегда одни и те же (Fig. 2 A-C). Напр., в то время как молчание теломер обеспечивается с помощью Sir3p и Sir4p, но не Sir1p, молчание рДНК не нуждается ни в одном из них (Grunstein, 1997) (Fig. 2C). ScSir2p-индуцированное молчание теломер (Fig. 2B) может расширяться по хромосоме на расстояние от 2 kb до 19 kb и участвовать в position effect variegation (PEV) (Aparicio et al., 1991; Lieb et al., 2001). Sir4p ответственен за установление степени индуцированного с помощью ScSir2p молчания теломер путем соединения с Rap1p и белком репарации ДНК Ku70p. После загрузки Sir4p-ScSir2p комплекса, Sir3p также рекрутируется, инициируя
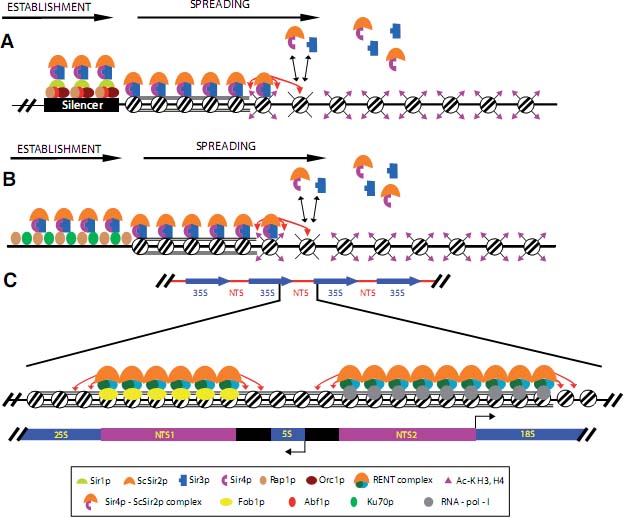 Fig. 2. Model of Sir2-dependent Heterochromatin formation in S. cerevisiae. (A) Mating-type loci: Sir1 participates in the establishment of the heterochomatin structure during S-phase through binding to silencer-bound proteins such as ORC1p, Rap1 and Abf1p and recruitment of the rest of the SIR machinery. Different models have been proposed to describe this process but it is commonly accepted that Sir4p (present in vivo as Sir4-ScSir2p complex) is probably responsible for binding to Sir1p, which in turn is believed to bring Sir3p to chromatin, resulting in hypoacetylation of H3 and H4 as well as silencing. Once the structure is established, it can spread without Sir1p. (B) Telomeres: The SIR complex is formed in the telomeric regions, through binding to Rap1. Sir3p and Sir4p bind to Rap1p independently and recruit ScSir2p. The complex spreads similarly as in the mating-type loci. (C) Nucleolar silencing of rDNA. Each of the 100-200 repeats distributed in tandem is around 9.1kb and composed of two regions: 35S (blue arrows), formed by 18S and 25S, and NTS (Non transcribed spacer). The latter consists of a 5S gene and two flanking regions named NTS1 and NTS2. Transcription of each repeat renders a RNA pol-I dependent 35S precursor rRNA and a RNA-pol III -dependent 5S rRNA precursor. The RENT complex binds to two regions, NTS1 and NTS2. In both cases, RENT recruitment to chromatin requires binding to specific factors, fob1p in the case of NTS1, and RNA-polymerase Ip (RNA-pol-I) in the case of NTS2. Binding of RENT to NTS2 spreads into the coding region of 18S (Huang and Moazed, 2003). Based on Huang and Moazed, 2003.
Fig. 2. Model of Sir2-dependent Heterochromatin formation in S. cerevisiae. (A) Mating-type loci: Sir1 participates in the establishment of the heterochomatin structure during S-phase through binding to silencer-bound proteins such as ORC1p, Rap1 and Abf1p and recruitment of the rest of the SIR machinery. Different models have been proposed to describe this process but it is commonly accepted that Sir4p (present in vivo as Sir4-ScSir2p complex) is probably responsible for binding to Sir1p, which in turn is believed to bring Sir3p to chromatin, resulting in hypoacetylation of H3 and H4 as well as silencing. Once the structure is established, it can spread without Sir1p. (B) Telomeres: The SIR complex is formed in the telomeric regions, through binding to Rap1. Sir3p and Sir4p bind to Rap1p independently and recruit ScSir2p. The complex spreads similarly as in the mating-type loci. (C) Nucleolar silencing of rDNA. Each of the 100-200 repeats distributed in tandem is around 9.1kb and composed of two regions: 35S (blue arrows), formed by 18S and 25S, and NTS (Non transcribed spacer). The latter consists of a 5S gene and two flanking regions named NTS1 and NTS2. Transcription of each repeat renders a RNA pol-I dependent 35S precursor rRNA and a RNA-pol III -dependent 5S rRNA precursor. The RENT complex binds to two regions, NTS1 and NTS2. In both cases, RENT recruitment to chromatin requires binding to specific factors, fob1p in the case of NTS1, and RNA-polymerase Ip (RNA-pol-I) in the case of NTS2. Binding of RENT to NTS2 spreads into the coding region of 18S (Huang and Moazed, 2003). Based on Huang and Moazed, 2003.
распространение гетерохроматина посредством механизма очень сходного с таковым в локусах типов спаривания (Fig. 2B). Интересно, что ScSir2p и Sir3p, как было установлено, ре-локализуются с теломер на сайты репарации non-homologous end-joining (NHEJ) ДНК после double-strand break (DSB), указывая тем самым, что они играют роль в этих процессах (Mills et al., 1999). Однако неизвестно участвуют ли эти sirtuins непосредственно в репарации ДНК.
Третий пример гетерохроматина у S. cerevisiae, локусы рДНК, расположенные на хромосоме 12 и представленные 100 - 200 тандемными копиями генов рДНК. В этом локусе, ScSir2p индуцирует эпигенетическое молчание в контексте комплекса, наз. RENT (regulator of nucleolar silencing and telophase exit), где он ассоциирует с Net1p и phosphatase Cdc14p. Net1p взаимодействует непосредственно с ScSir2p и ответственен за удержание ScSir2p в ядрышках (Fig. 2C) (Straight et al., 1999). Он соединяется с DNA polymerase I (Pol I) и, по-видимому, непосредственно участвует в регуляции структуры ядрышка (Shou et al., 2001). Напротив, Cdc14p участвует в контроле митозов, особенно во время выхода из анафазы (Hogan and Koshland, 1992). На немитогенных стадиях, Cdc14p секвестрируется в ядрышке с помощью комплекса RENT и высвобождается в ранней анафазе за счет фосфорилирования (Shou et al., 1999). Интересно, что ScSir2p также сцеплен с мейозом двумя способами: во-первых, благодаря Cdc14p, который также участвует в выходе из мейоза-I и контролирует последующую мейотическую программу (Marston et al., 2003); и, во-вторых, посредством meiosis checkpoint белка Pch2p, с которым он участвует в регуляции мейоза-особенно в фазе пахитены мейоза I (San-Segundo and Roeder, 1999). Pch2p прикреплен к ядрышку посредством ScSir2p-зависимого механизма, но обусловлен ли этот эффект прямым взаимодействием между двумя факторами. неизвестно.
Результатом ядрышкового молчания ScSir2p является его ингибирующий эффект на рекомбинацию, которая происходит внутри генов рДНК. Это связывает ScSir2p с увеличением продолжительности репликативной жизни, наблюдаемой у дрожжей, поскольку рекомбинация рДНК продуцирует внехромосомные extrachromosomal rDNA circles (ERC), накопление которых является токсичным и, по-видимому, ассоциирует со старением организма (Gottlieb and Esposito, 1989; Sinclair et al., 1998).
Помимо SIR2, S. cerevisiae содержит 4 др.sirtuins, наз. HST (homologs of Sir-two) 1 - 4. Интересно, что все этого Class I sirtuins, подобно ScSir2p, указывают на то, что их функции могут быть связаны с хроматином и могут индуцировать histone deacetylase активность (Fig. 1). Hst1p является ближайшим гомологом ScSir2p и является продуктом относительно недавнего удвоения гена, т.к. ближайшие родственники S. cerevisiae , такие как Kluyveromyces lactis или S. pombe содержат только один ген (Hickman and Rusche, 2007). Hst1p расположен в ядре подобно ScSir2p и участвует в замалчивании средних генов споруляции. Hst1p рекрутируется на свои гены мишени с помощью транскрипционного фактора Sum1p и индуцирует репрессию с помощью деацетилирования H3 и H4 хвостов (Xie et al., 1999). Hst1p участвует также в регуляции некоторых генов пути kynureine, который участвует в de novo формировании NAD+ (Bedalov et al., 2003; Robert et al., 2004). Интересно, что Sum1p действительно ответственен за рекрутирование Hst1p фактически на все его гены мишени; в самом деле, делеция SUM1 нарушает локализацию Hst1p в ChIP-on-chip экспериментах. Кроме того, Hst1p обнаружен в SET3C, в комплексе. который участвует в репрессии мейоза и споруляции вместе с др. факторами, среди которых HDAC Hos2p (Pijnappel et al., 2001). Однако учитывая ChIP-on-chip результаты, описанные выше, и факт, что Hst1p не ответственен за активность комплекса, значение этой находки неясно.
Исследования показали, что функция Hst1p может восстанавливать некоторые из дефектов молчания у SIR2Δ линий, тогда как ScSir2p всё ещё сохраняет способность взаимодействовать с Sum1p и восстанавливает большинство HST1Δ дефекты споруляции (Hickman and Rusche, 2007). Эти находки указывают на то, что способность связывать Sum1p заключается в оригинальном SIR2/HST1 кодируемом белке, тогда как , SIR-обусловленный гетерохроматин развивается после события удвоения. Это заключение подтверждается отсутствием покоящихся SIR белков вне S. cerevisiae.
Hst2p локализован в цитоплазме, хотя он, по-видимому, присутствует в ядре на невысоком уровне. Это обусловлено механизмом активного ядерного экспорта, который недавно был описан (Wilson et al., 2006). Избыточная экспрессия Hst2p, как известно, способна затрагивать ScSir2p молчание:он увеличивает репрессию рДНК, благодаря дерепрессии ScSir2p-зависимого теломерного молчания (Perrod et al., 2001). Эти наблюдения могут быть объяснены недавним доказательством, показавшим, что Hst2p участвует в ядерном эпигенетическом молчании в некоторых случаях. Hst2p и Hst1p участвует в замалчивании субтеломерного flocculation гена FLO10, который кодирует гликопротеин клеточной стенки, важный для слипчивости клеток с поверхностью и клеток с клетками (Halme et al., 2004). Более того, ChIP-on-chip исследования на S. pombe показали, что SpHst2, гомолог Hst2p, участвует в замалчивании рДНК и центромер, а также в репрессии генов специфического субнабора (Durand-Dubief et al., 2007). Однако точная роль Hst2p в обоих случаях пока неизвестна.
Подобно своему гомологу у млекопитающих SirT2, Hst2p обладает гистон деацетилазной активностью, специфичной для H4K16Ac и,в меньшей степени, для H3K9Ac (Vaquero et al., 2006). В противовес ScSir2p или Hst1p, потеря Hst2p у дрожжей вызывает глобальное гиперацетилирование H4K16Ac. Эти наблюдения могут указывать на роль Hst2p в контроле уровней глобальной зависимой от клеточного цикла H4K16Ac. Эта гипотеза подкрепляется тем фактом, что SirT2 , как было установлено, локализуется в хроматине во время G/M перехода и деацетилирования H4K16Ac перед вступлением в митотический клеточный цикл (Vaquero et al., 2006). Однако неизвестно, ответственен ли Hst2p у дрожжей за снижение H4K16Ac перед митозами аналогично SirT2 у млекопитающих. Др. аспекты функции Hst2p остаются неизвестными и как сообщают участие в увеличении продолжительности жизни возможно посредством не охарактеризованного независимого от ScSir2p пути (Lamming et al., 2005).
Hst3p и Hst4p участвуют в деацетилировании H3K56Ac, остатка, присутствующего в глобулярном домене гистона H3, которое происходит вне S-фазы (Celic et al., 2006; Maas et al., 2006). Глобальные уровни H3K56Ac зависят от хода S-фазы и, по-видимому, ассоциируют с преходящей стадией отложения гистона H3. Эта модификация является частью реакции на повреждения ДНК, зависящей от репликации. Фактически, Hst3p и Hst4p являются регуляторами клеточного цикла и ответственны за поддержание низких уровней H3K56Ac в течение всего клеточного цикла за исключением репликации (Celic et al., 2006; Maas et al., 2006). Однако в ответ на повреждения ДНК их экспрессия подавляется в ответ на гиперацетилирование H356Ac, механизм, который, по-видимому, является ключевым для реакций на повреждения ДНК и выживание в этих условиях (Masumoto et al., 2005). Кроме того недавние исследования подтвердили, что ScSir2p сама может деацетилировать H3K56Ac, и делает это, поддерживая тем самым образование гетерохроматина (Xu et al., 2007).
Организация и регуляция хроматина у делящихся дрожжей Schizosaccharomyces pombe совершенно отлична от таковой у S. cerevisiae. Во-первых, хроматин у S. pombe организован подобно его организации у высших эукариот. В частности она сопровождается метилированием H3K9 и содержит специфичный для гетерохроматина белок, Swi6p, который гомологичен HP1 метазоа (Grewal and Jia, 2007). В отличие от S. cerevisiae, который кодирует 5 sirtuins (ScSir2p, Hst1p - Hst4p), S. pombe обладает только тремя (SpSir2, SpHst2 и SpHst4) (Fig. 1) (Freeman-Cook et al., 2005). SpSir2, подобно ScSir2p, не существенен для жизнеспособности и локализуется в ядре. Подход ChIP-on-chip показал, что SpSir2 участвует в молчании гетерохроматина в теломерах, локусов типов спаривания и центромер, но, по-видимому, не ядрышковой рДНК (FreemanCook et al., 2005). Модель SpSir2-обеспечиваемого гетерохроматина использует деацетилирование H3 и H4, в частности H3K9Ac и H4K16Ac, метилирование H3K9 и рекрутирование Swi6p на эти регионы (Freeman-Cook et al., 2005; Shankaranarayana et al., 2003). Однако, по крайней мере, центромерный гетерохроматин, основная мишень для SpSir2p это H3K9Ac, а не H4K16Ac (Mellone et al., 2003). Т.о., деацетилирование H3K9Ac с помощью SpSir2p необходимо для триметилирования H3K9 с помощью Clr4, и последующей доставки Swi6 (Shankaranarayana et al., 2003).
SpHst2 белок является цитоплазматическим, но располагается в небольших количествах в определенных гетерохроматиновых регионах ядра с оставшимися sirtuins (Durand-Dubief et al., 2007). Между тем, SpHst4 регулирует клеточный цикл подобно Hst4p и возможно участвует в контроле H3K56Ac (Haldar and Kamakaka, 2008), хотя при некоторых условиях локализуется с SpSir2 и SpHst2. Заметим, что все 3 S. pombe sirtuins участвуют в замалчивании ретротранспозонов, но их точная роль в этом контексте неизвестна (Durand Dubief et al., 2007).
Protozoa
Знание функции sirtuin у одноклеточных эукариот в основном получены в исследованиях паразитических протозоа, которые вызывают заболевания у людей, такие как малярия, болезнь Chagas', сонная болезнь и лейшманозы. Исследования в основном ограничивались тремя родами: Plasmodium, Trypanosoma и их ближайшими родственниками Leishmania.
Среди различных видов рода Plasmodium, Plasmodium falciparum ответственен за наиболее тяжелую форму малярии. основной фактор, который предопределяет вирулентность инфекции является группа генов Plasmodium falciparum, которая кодирует белки клеточной поверхности. Эти белки экспрессируются инфицированными эритроцитами во время кровяной стадии жизненного цикла паразита и распознаются с помощью иммунной системы хозяина (Merrick and Duraisingh, 2006). Успешность паразитов обусловлена механизмами, которые развиваются, чтобы избежать распознавания с помощью иммунной системы. Один из таких механизмов, известный как антигенная изменчивость, который используется Plasmodium и др. паразитами, базируется на переключении экспрессии этих поверхностных белков так, что только один из их генов экспрессируется в данный момент времени (Scherf et al., 1998). Наиболее важными среди антигенных белков являются adhesins, кодируемые семейством генов var. Plasmodium содержит около 60 var генов, которые в основном распределены в кластерах вдоль субтеломерных регионов, хотя существуют некоторые копии вокруг центра хромосом. Гены var контролируются с помощью трех типов промоторов: upsA, B и C. UpsA и B располагаются в основном в теломерных регионах, тогда как UpC локализуется в более центральных позициях хромосом (Merrick and Duraisingh, 2006).
В противоположность Trypanosoma, антигенная изменчивость гена var у Plasmodium базируется не на событиях рекомбинации, а скорее на эпигенетическом молчании неактивных генов, которое в основном зависит от sirtuin PfSir2 (Duraisingh et al., 2005; Freitas-Junior et al., 2005). Хотя P. falciparum содержит два sirtuins, только PfSir2 был охарактеризован. PfSir2 обнаруживает как гистон деацетилазную, так и ADP-ribosyltransferase активность (Merrick and Duraisingh, 2007). Он преимущественно локализуется в субтеломерных регионах и в ядрышках. Интересно, что дрожжевой ScSir2p также локализуется в этих двух регионах, указывая на консервативную роль sirtuin в обоих местах.
Нарушение функции PfSir2 ведет к дерегуляции многих неактивных субтеломерных var генов, особенно тех, что регулируются с помощью upsA и в меньшей степени с помощью upsB (Gardner et al., 2002). Эксперименты по Chromatin immunoprecipitation (ChIP) показали, что активация генов var ассоциирует с гиперацетилированием гистона H4 по его промотору и 5' кодирующим регионам, также как и с потерей PfSir2 из этих регионов (Duraisingh et al., 2005). Эти находки указывают на то, что как и с sirtuins у почкующихся дрожжей они у P. falciparum участвуют в генерации гетерохроматин-подобных структур в субтеломерных регионах посредством деацетилирования гистона H4 и возможно H3.
Хотя не совсем понятна роль Sir2, замалчивание теломерных var генов может напоминать, в некоторых аспектах, локусы типов спаривания у S. cerevisiae. Однако в этом случае, в противоположность ScSir2p, PfSir2-зависимое молчание также использует метилирование H3K9. Это подтверждается исследованиями, продемонстрировавшими, что молчание генов var коррелирует с потерей ацетилирования в гистоне H3 по лизину 9 и с триметилированием лизина 9 по всему гену (Lopez-Rubio et al., 2007). Однако отвечает ли PfSir2 непосредственно за ацетилирование H3 lysine 9 и за рекрутирование H3K9me3 methyltransferase, и какова причина, почему PfSir2 влияет на определенные промотором-контролируемые var гены, остается неизвестным. Кроме того, роли PfSir2 в ядрышке и играют ли др. не охарактеризованные P.falciparum sirtuin в патогенности организмов, ещё не установлено. Такие исследования д. показать способ ингибирования антигенной селекции P. falciparum за счет прямого таргетинга членов его семейства Sir2. Тот факт, что PfSir2 чувствителен к nicotinamide in vitro, но не затрагивается др. лекарствами, которые модулируют эукариотические sirtuins, указывает на то, что лекарства способны ингибировать исключительно активность sirtuin этих паразитов, не затрагивая тех, которые д. быть развиты хозяином (Merrick and Duraisingh, 2007).
Др. хорошо охарактеризованные sirtuins принадлежат жгутиковым Tripanosoma brucei, которые отвечают за африканскую сонную болезнь. T. brucei содержит 3 sirtuins: два члена Type I, TbSIR2RP1 и TbSIR2RP3, и член Type II, TbSIR2RP2, родственные бактериальным sirtuins (Garcia-Salcedo et al., 2003). Подобно Plasmodium PfSir2, TbSIR2RP1 является ядерным и обнаруживает in vitro как deacetylase, так и ADP-ribosyltransferase активность гистонов и в частности H2A и H2B, и располагается в субтеломерных регионах, где участвует в формировании гетерохроматина (Garcia-Salcedo et al., 2003). Однако, TbSIR2RP1 не участвует в антигенной изменчивости. Кроме того, хотя потеря TbSIR2RP1 не приводит к летальности при нормальных условиях, он делает T. brucei гиперчувствительными к ДНК-повреждающим лекарства, таким как methanesulfonic acid methyl ester (MMS), указывая тем самым, что TbSIR2RP1 может также участвовать в репарации ДНК (Alsford et al., 2007). В противовес Trypanosoma, его ближайший родственник Leishmania , по-видимому, не обладает ядерными sirtuins. Его единственный sirtuin, LmSIR2, расположен в цитозоле (Vergnes et al., 2002). Др. sirtuin, по-видимому, родственен бактериальным sirtuins и поэтому, скорее всего, располагается в митохондриях (Frye, 2000). LmSIR2 ещё не охарактеризован энзиматически, но известно, что обязателен для выживания паразита, это один из плохо описанных важных sirtuins. Единственная роль. приписываемая LmSIR2, заключается в обеспечении жизнеспособности в стрессовых условиях во время определенных стадий жизненного цикла паразита (Vergnes et al., 2002; Vergnes et al., 2005). Однако механизм, с помощью которого LmSIR2 осуществляет это, полностью неизвестен, хотя возможна регуляция хроматина. Фактически, LmSIR2 принадлежит к Type I sirtuins, чьи члены в целом связаны с хроматином. Уже имеется прецедент для него у человека, этот цитоплазматический sirtuin SirT2 модулирует уровни H4K16Ac в ходе всего клеточного цикла (Vaquero et al., 2006).
C. elegans and Drosophila
Как и на предыдущих стадиях эволюции хроматина, sirtuins приобретают новые функции, которые появляются у многоклеточных эукариот, клеточная дифференцировка и развитие. Очевидной адаптацией является увеличение количества sirtuins по сравнению с таковым у низших эукариот, за исключением S. cerevisiae.
Доказательства указывают на то, что sirtuins участвуют в развитии и клеточных качественных особенностях у Drosophila и C. elegans. Геном C. elegans содержит 4 sirtuins, обозначенных как Sir-2.1 - 2.4. (Fig. 1). Знания о них ограничены из-за немногочисленных исследований и функциональных сравнений с хорошо известными аналогами млекопитающих. Пока не получено каких-либо доказательств ферментативной активности для sirtuins нематод.
Sir-2.1 это Type I sirtuin и sirtuin наиболее близкий ScSir2p. Тот факт, что Sir-2.1 локализуется в ядре и филогенетически близок к SirT1 млекопитающих (Frye, 2000) указывает на то. что он возможно является histone deacetylase и может выполнять роль в регуляции хроматина. Эта идея подкрепляется тем фактом, что Sir2.1 участвует в молчании повторяющихся трансгенов у C.elegans (Jedrusik and Schulze, 2003) и участвует в молчании зародышевой линии (Jedrusik and Schulze, 2007). Несмотря на это большинство исследований Sir-2.1 было сфокусировано на том, могут ли дополнительные копии этого гена способствовать увеличению продолжительности жизни (Tissenbaum and Guarente, 2001). наблюдался побочный эффект в условиях стресса, когда Sir-2.1 взаимодействует с insulin-like сигнальным путем посредством forkhead транскрипционного фактора DAF-16 и шаперонового белка 14-3-3 (Berdichevsky et al., 2006). Хотя мутации потери функции в insulin-like receptor DAF-2 , как известно, опровергают способность увеличения продолжительности жизни Sir-2.1 (Tissenbaum and Guarente, 2001), механизм. с помощью которого Sir-2.1 увеличивает продолжительность жизни, неизвестен. Т.к. sirtuins млекопитающих могут деацетилировать FOXO forkhead факторы и модулировать их транскрипционные активности (Giannakou and Partridge, 2004), тоже самое д. происходить у C. elegans. Интересно, что Sir-2.1 связан с феноменом жизнеспособности в др. исследованиях. Напр., он защищает от индуцированной polyglutamine дисфункции нейронов (Bates et al., 2006) и регулирует уровни ключевых медиаторов реакции на неупакованный в endoplasmic reticulum (ER) белок (Viswanathan et al., 2005).
Sir-2.2 b Sir-2.3 являются Type II sirtuins, и сходны с SirT4 млекопитающих, обладают гомологией с некоторыми митохондриальными белками. Однако учитывая, что Sir-2.2 был найден с помощью RNAi скрининга по всему геному промоторов геномной стабильности вместе с др. связанными с хроматином факторами (e.g. HDACs 1 - 4, lysine methyltransferases, the HDAC-related factor Sin3 и многими белками репарации ДНК) (Pothof et al., 2003), он может быть локализован в ядре, где он д. непосредственно регулировать функции хроматина. Фактически, хотя он и не участвует в увеличении продолжительности жизни, Sir-2.2, по-видимому, обладает сходством с Sir-2.1's способностью защищать C. elegans от нейродегенерации, тогда как подобного эффекта не наблюдается для Sir-2.3 (Bates et al., 2006).
Sir-2.4, подобно SirT6 и SirT7 млекопитающих,является Type IV sirtuin, и подобно Sir-2.2, не участвует в увеличении продолжительности жизни. Помимо этого его функция полностью неизвестна.
Drosophila melanogaster содержит 5 sirtuins, которые благодаря своей гомологии с sirtuins млекопитающих, наз. DmSir2 (или DmSirT1), DmSirT2, DmSirT6 и DmSirT7. Единственным подробно изученным из них является DmSir2, ортолог C. elegans Sir-2.1. Подобно ScSir2p и Sir-2.1, DmSir2 способствует увеличению продолжительности жизни посредством механизма, который участвует ограничении калорийности (Rogina et al., 2002). DmSir2 четко участвует в функциях хроматина. особенно в тех, которые связаны с развитием. Хотя DmSir2 участвует в PEV (Position effect variegation) (Newman et al., 2002; Rosenberg and Parkhurst, 2002)- предполагается. что он необходим для обусловленного гетерохроматином молчания - и несмотря на общую консервацию с sirtuins у низших эукариот, он, по-видимому, не регулирует теломерного гетерохроматина (Rosenberg and Parkhurst, 2002). Rosenberg and Parkhurst сообщили о некоторых спорных генетических и биохимических данных, показавших, что DmSir2 взаимодействует с репрессорами транскрипции Hairy и Deadpan, которые являются членами HES ( Hairy Deadpan Enhancer of Split) семейства (Rosenberg and Parkhurst, 2002). Семейство HES транскрипционных факторов содержит bHLH (basic helix-loop-helix) домен и играет ключевую роль в процессе развития благодаря репрессии транскрипции определенных ключевых генов (Younger-Shepherd et al., 1992). Hairy и Deadpan рекрутируют репрессоры, такие как histone deacetylases DmRpd3 и возможно DmSir2, на их гены мишени (Bianchi-Frias et al., 2004). Однако эти данные сегодня оспариваются (Astrom et al., 2003).
Др. находка, подтверждающая роль DmSir2 в процессах развития, это идентификация DmSir2 как части комплекса Polycomb, который содержит фактор E(Z) (Enhancer of zeste), histone methyltransferase, участвующую в дально-действующем эпигенетическом молчании пространственно ограниченного паттерна экспрессии, обнаруживаемой гомеозисными генами во время развития Drosophila (Furuyama et al., 2004). Эпигенетическое замалчивание с помощью факторов Polycomb базируется на триметилировании H3K27 и напоминает по некоторым аспектам ScSir2p-зависимое молчание гетерохроматина. DmSir2's участие в развитии, по-видимому, очень динамично (Furuyama et al., 2004; Newman et al., 2002; Rosenberg and Parkhurst, 2002). Напр., пик уровней мРНК DmSir2 приходится на ранние стадии эмбриогенеза, затем снижается прогрессивно вплоть до стабилизации у взрослых. Более того, локализация DmSir2 может изменяться от ядра к цитоплазме или имеет обе локализации одновременно во время разных стадий программы дифференцировки (Rosenberg and Parkhurst, 2002). Однако , мутанты с потерей функции DmSir2 жизнеспособны, это указывает на высокую перекрываемость среди Drosophila sirtuins (Astrom et al., 2003; Newman et al., 2002). Необходимы дальнейшие исследования.
Mammalian sirtuins
Знания о функции sirtuin недавно увеличились. Это частично явилось результатом характеристики функционального участия sirtuins млекопитающих в регуляции продолжительности жизни, раке, нейрологических заболеваниях (e.g. Alzheimer's и Parkinson's), и связанных с гормонами патологиями.
Все доказательства указывают на то, что sirtuins адаптировались к усложнению за счет приобретения новых функций благодаря таргетингу широкого круга субстратов (Fig. 3). 7 sirtuins (SirT1 - 7) млекопитающих являются четким примером эволюционной диверсификации. В терминах функции, SirT1 - 3 обнаруживают deacetylase активность in vivo, тогда как SirT4 и SirT6 обладают специфической и строгой mono ADP ribosyl-transferase активностью, а основные каталитические активности у SirT5 и SirT7 пока неизвестны (Saunders and Verdin, 2007; Vaquero et al., 2007b). SirT1, 2, 3 и 6 преимущественно находят гистоны, специфически H4K16Ac и/или H3K9A (Vaquero et al., 2004). Однако, SirT1-3 также находят негистоновые белки, включая разлияные ядерные факторы (SirT1), tubulin (SirT2) и митохондриальные мишени (SirT3) (Saunders and Verdin, 2007; Vaquero et
al., 2007b). Sirtuins млекопитающих являются ярким примером разнообразия и сложности паттернов клеточной локализации sirtuin. SirT1, SirT6 и небольшая фракция SirT3 и SirT2 присутствуют в ядре, SirT2 является цитоплазматическим, SirT3 - 5 являются митохондриальными и SirT7 является ядрышковым (Michishita et al., 2005). Более того, эти локализации могут быть продиктованы клеточными характеристиками, ст. развития, внешнесредовыми стимулами или ходом клеточного цикла (Saunders and Verdin, 2007; Vaquero et al., 2007b, Yamamoto et al., 2007). Напр., локализация SirT1 варьирует в зависимости от типа клеток, стадии развития и стрессовых условий.
SirT1
SirT1 и дрожжевой ScSir2p наиболее известны из всех sirtuins. Фактически, SirT1 является филогенетическим и функциональным ортологом как дрожжевого ScSir2p , так и Hst1pи обнаруживает самый широкий круг функций, а также самый широкий набор субстратов среди sirtuins (Yamamoto et al., 2007). Упомянутые функции могут быть классифицированы в 4 группы: организация хроматина; метаболическая регуляция; жизнеспособность клеток в стрессовых ситуациях; и клеточная дифференцировка и развитие (see below and Fig. 3).
Хотя он и ядерный белок, но локализация SirT1 варьирует в зависимости от типа клеток и ст. дифференцировки; он может быть исключительно цитоплазматическим или присутствовать во всей клетке (Chen et al., 2006; Moynihan et al., 2005).
Потеря SirT1 ведет к пренатальной и перинатальной гибели у половины индивидов; остальная половина страдает дефектами гаметогенеза, стерильностью, проблемами с открытием глаз, хроническая легочная инфекция и атрофия панкреас (McBurney et al., 2003a). SirT1 экспрессируется во всех органах, но наиболее преобладает в наиболее энергетически зависимых тканях (Michishita et al., 2005).
SirT1 and chromatin regulation
SirT1 обладает строгой histone deacetylase активностью
in vitro, особенно в отношении H4K16Ac и H3K9Ac. RNAi исследования выявили, что потеря SirT1 коррелирует с глобальным увеличением H4K16Ac и H3K9Ac вместе с потерей гетерохроматиновых меток, таких как H3K9me3 и H4K20me1, указывая тем самым, что SirT1 участвует в формировании гетерохроматина (Vaquero et al., 2004). Гетерохроматин подразделяется на две основные формы в соотв. со своей структурной функциональной динамикой: constitutive heterochromatin (CH) и facultative heterochromatin (FH) (Trojer and Reinberg, 2007). CH означает регионы, которые всегда поддерживаются как гетерохроматиновые, занимают большие участки хромосом и выполняют скорее структурную роль. Эти регионы содержат немногие гены и расположены в основном в перицентромерных регионах и теломерах. В противоположность FH относится к тем регионам, которые могут быть образованы как гетерохроматин в определенных ситуациях (например, определенные этапы программы развития, а также клеточный цикл), но может вернуться к эухроматин когда это необходимо. Факультативный гетерохроматин может охватывать от нескольких kilobases до целой хромосомы и обычно включает в регионы с высокой плотностью генов (Craig, 2005; Trojer
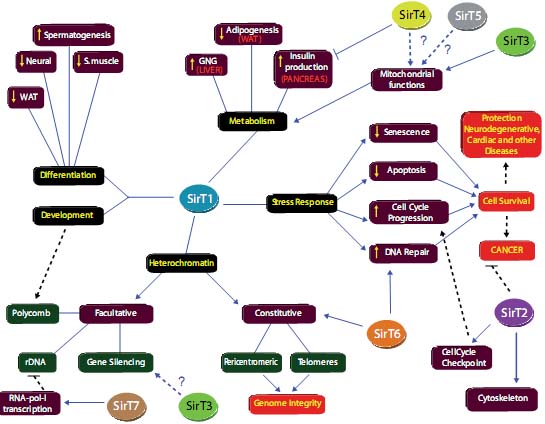 Fig. 3. Function of mammalian sirtuins. The main functions of SirT1 are indicated in black boxes. They are mediated through promotion of the indicated actions (maroon and green boxes) and consequences (red boxes). The functions of the remaining sirtuins are also listed. A question mark is used to indicate functions which have not been demonstrated. Polycomb, Ezh2 (Polycomb)-dependent silencing; WAT, white adipose tissue.
Fig. 3. Function of mammalian sirtuins. The main functions of SirT1 are indicated in black boxes. They are mediated through promotion of the indicated actions (maroon and green boxes) and consequences (red boxes). The functions of the remaining sirtuins are also listed. A question mark is used to indicate functions which have not been demonstrated. Polycomb, Ezh2 (Polycomb)-dependent silencing; WAT, white adipose tissue.
and Reinberg, 2007). Современные доказательства указывают на то, что SirT1 действительно участвует в обеих формах гетерохроматина. Среди наиболее важных и характерных признаков SirT1 является , в противоположность др. Class I и II HDACs, более, чем просто histone deacetylase: благодаря его удивительной способности соединяться со многими факторами и находить многие субстраты, SirT1 действительно является координатором образования гетерохроматина (Vaquero et al., 2004; Vaquero et al., 2007b) (Fig. 4).
Основная биологическая форма SirT1 является гомотримерным комплексом из ca. 350 kDa (Vaquero et al., 2004). Описан и др. биохимически стабильный, содержащий SirT1комплекс, PRC4 (Kuzmichev et al., 2005). Подобно др. sirtuins, SirT1 лишен способности непосредственно связывать ДНК и д.б. рекрутирован на регионы с ДНК мишенями. Хотя многочисленные SirT1-обнаруживаемые гены не идентифицированы, все данные указывают на то, что SirT1 участвует в регуляции многих генов благодаря образованию FH путем координации некоторых событий (Fig. 4) (Vaquero et al., 2004).
Первое событие, доставка SirT1 на хроматин, приводящая к деацетилированию H4K16Ac и H3K9Ac и прямому рекрутированию линкерного гистона H1, ключевого фактора формирования нити в 30 nm (Hansen, 2002). Фактически, SirT1, по-видимому, взаимодействует специфически с одним из пяти соматических вариантов, H1b (также известным как H1.4), которым особенно богат гетерохроматин, и собирается в хроматин во время поздней S-фазы (D'Incalci et al.,1986; Parseghian et al., 2001; Parseghian et al., 2000). SirT1 не только взаимодействует и рекрутирует histone H1, он может также деацетилировать гистон H1 по лизину K26 in vitro и in vivo (Vaquero et al., 2004). Некоторые находки подтверждают роль деацетилирования H1K26 для образования гетерохроматина, хотя это ещё не подкреплено. Во-первых, ацетилирование в H1 N-терминального домена может действовать сходным образом как и в стрежневых гистонах, ослабляя внутри- и межнуклеосомные взаимодействия и тем самым делая менее компактной структуру хроматина (Vaquero et al., 2004). Во-вторых, H1K26 метилируется с помощью Polycomb белка Ezh2, гомолога Drosophila E(Z) (Kuzmichev et al., 2004). Поэтому у млекопитающих, как и у Drosophila, SirT1 сосуществует с Ezh2 в комплексе PRC4, деацетилирование H1K26Ac с помощью SirT1 делает возможным скоординированное метилирование с помощью Ezh2. В-третьих, HP1 белки соединяются с деметилированным H1bK26 по всему хроматину, взаимодействие ингибируется за счет фосфорилирования соседнего serine 27 (Daujat et al., 2005; Nielsen et al., 2001a). Этот механизм может объяснить нахождение HP1 определенных регионов в отсутствие метилирования H3K9 у Xenopus (Meehan et al., 2003). Наконец, H1b также присутствует в комплексе, формируемом с помощью L3MBTL1, стержневыми гистонами, HP1γ и retinoblastoma (Rb). MBT (malignant brain tumor) фактор L3MBTL1 способствует образованию гетерохроматина путем связывания моно- и ди-метилированных H4K20 и H1K26me3 (Trojer et al., 2007).
После прибытия SirT1, наблюдается потеря активным хроматином метки H3K79me2 (Fig. 4). Потеря этой метки-которая используется транскрипционно активным хроматином, для реакция на повреждения ДНК и контроль мейотического и которая локализуется в глобулярном
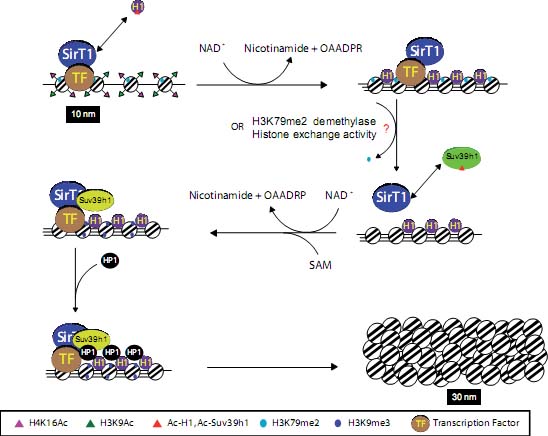 Fig. 4. Model of SirT1-mediated facultative heterochromatin. Upon recruitment by a DNA-binding factor (TF), SirT1 promotes histone deacetylation, particularly of H4K16Ac and H3K9Ac, as well as recruitment and deacetylation of H1 (upper panel). This arrival correlates with loss of the active mark H3K79me2. Next, SirT1 recruits and deacetylates Suv39h1, which becomes "superactive" (middle panel) and methylates the neighboring nucleosomes. This in turn attracts HP1 and triggers the spread of heterochromatin, resulting in the formation of the 30 nm fiber (lower panel). OAADPR, O-Acetyl-ADPribose; SAM, S-adenosyl-methionine.
Fig. 4. Model of SirT1-mediated facultative heterochromatin. Upon recruitment by a DNA-binding factor (TF), SirT1 promotes histone deacetylation, particularly of H4K16Ac and H3K9Ac, as well as recruitment and deacetylation of H1 (upper panel). This arrival correlates with loss of the active mark H3K79me2. Next, SirT1 recruits and deacetylates Suv39h1, which becomes "superactive" (middle panel) and methylates the neighboring nucleosomes. This in turn attracts HP1 and triggers the spread of heterochromatin, resulting in the formation of the 30 nm fiber (lower panel). OAADPR, O-Acetyl-ADPribose; SAM, S-adenosyl-methionine.
домене гистона H3 (Feng et al., 2002; Kouskouti and Talianidis, 2005)-распространяется на несколько kilobases от промоторных регионов. Интересно, что эта модификация очень важна для установления границ ScSir2p молчания у
S. cerevisiae, т.к. она ингибирует распространение ScSir2p/3p/4p комплекса и отсутствует в Sir2-замалчиваемых регионах (Ng et al., 2002). Тем не менее, механизм, скрывающийся за этой потерей неизвестен. Вовлекается ли SirT1 непосредственно или или нуждается в механизме, зависимом от активности замены гистонов или demethylase активности, предстоит установить.
Наконец, прибытие SirT1 способствует установлению гетерохроматиновых меток, в частности H3K9me3 и H4K20me1, которые распространяются по всей кодирующей области гена (Vaquero et al., 2004). Механизм, участвующий в установлении этих меток известен для H3K9me3, но не для H4K20me1. SirT1 способствует установлению H3K9me3 посредством интимных функциональных взаимоотношений с Suv39h1, главным энзимом, ответственным за модификацию (Vaquero et al., 2007a). Suv39h1 была первой lysine methyltransferase, когда-либо описанной (Rea et al., 2000), и оказалась основным игроком в организации хроматина посредством поддержания уровней H3K9me3 как в перицентромерном, так и теломерном CH (Peters et al., 2001). Она также участвует в формировании FH в определенных регионах (Nielsen et al., 2001b). Важность этой активности подтверждается рядом доказательств. Во-первых, потеря Suv39h1 и её ближайшего родственника Suv39h2 (Suv39DN) во время развития мыши ведет к полной потере H3K9me3 в перицентромерном гетерохроматине, а также к существенной редукции уровней H3K9me3 в теломерах (Peters et al., 2001). Это вызывает потерю гетерохроматина, что проявляется потерей HP1 белков и релокализацией H4K16Ac в гетерохроматиновые фокусы (Vaquero et al., 2007a), проблемами расхождения хроматина, задержкой перехода от G к M, повреждениями ДНК. Интересно, что потеря любого из них не влияет на уровни H3K9me3, указывая тем самым на важность поддержания уровней модификации посредством программы развития (Peters et al., 2001). Более того, во взрослых тканях Suv39h1 экспрессируется повсеместно, тогда как Suv39h2 ограничивается семенниками, где она, по-видимому, участвует в регуляции гетерохроматина во время мейоза (O'Carroll et al., 2000). Функциональные взаимоотношения между SirT1 и Suv39h1 вызывают споры о взаимодействии между гистоновыми деацетилазами и methyltransferases и указывают на более интимные ассоциации между этими группами энзимов, чем это предполагалось ранее. Фактически доказательства на S. pombe указывают на то, что подобные взаимоотношения законсервированы от дрожжей до человека (Shankaranarayana et al., 2003).
SirT1 способствует Suv39h1-зависимому метилированию H3K9me3 посредством 4-х разных механизмов (Vaquero et al., 2007a). Во-первых, SirT1 непосредственно рекрутирует Suv39h1 на регуляторные регионы посредством своей N-терминальной области (SirT1-Nt), он же используется для рекрутирования H1 (Vaquero et al., 2004). В случае Suv39h1, домен, участвующий во взаимодействии, использует первые 88 остатков, которые включают chromodomain (остатки 44 - 88), участвующие в соединении с HP1, и N-терминальный регион (остатки 1 - 43) с неизвестной функцией. Интересно, что chromodomain сам по себе сохраняет способность связывания SirT1, это указывает на то, что SirT1 может конкурировать с HP1 за связывание Suv39h1. Во-вторых, SirT1 деацетилирует H3K9Ac , чтобы сделать возможным метилирование того же самого остатка с помощью Suv39h1 в регуляторных регионах. В-третьих, SirT1-Nt специфическое соединение с Suv39h1 увеличивает его methyltransferase активность in vitro и in vivo, возможно посредством конформационного изменения. Как и в случае с H1, эта способность связывания специфична для SirT1, учитывая, что избыточная экспрессия SirT1 Nt домена, домена. специфичного для SirT1, ведет к глобальному увеличению H3K9me3 (Vaquero et al., 2007a). Наконец, SirT1 деацетилирует K266 в Suv39h1, остаток, расположенный в каталитическом домене SET, делая энзим более активным. K266 законсервирован в эволюции у всех высших эукариот в ортологах Suv39h1 и что удивительно в ряде SET-содержащих methyltransferases. Хотя роль K266 в формировании гетерохроматина и его значение для функций Suv39h1, остается неизвестным, сравнительные исследования кристаллической структуры S. pombe Clr4 строго подтверждает, что этот остаток, расположенный в экспозируемой петле, важен для собственно упаковки SET домена (Min et al., 2002). Это может объяснить, как ацетилирование и деацетилирование может модулировать ферментативную активность Suv39h1.
Хотя это известно только для случаев acetylation/deacetylation метилтрансфераз, степень консервации в SET-содержащем семействе HMTs-которое включает почти все lysine methyltransferases-указывает на то, что этот механизм может быть общим. Одним из наглядных случаев является Ezh2, H3K27me3 и H1K26me2/3 methyltransferase, которая содержит консервативный K266 от Drosophila до человека (Vaquero et al., 2007a). Возможно, что в контексте PRC4, SirT1 может модулировать активность Ezh2, не только посредством деацетилирования гистонов, но и также посредством непосредственного эффекта SET домена Ezh2.
Интригующий и необъяснимый аспект взаимоотношения SirT1 с Suv39h1 и с Ezh2 в формировании гетерохроматина является их роль в метилировании ДНК. Как Suv39h1, так и Ezh2 соединяются непосредственно с Dnmt1-а также с Dnmt3a в первом случае- и управляет метилированием ДНК специфических генов (Fuks et al., 2003; Vire et al., 2006). SirT1 также взаимодействует с Dnmt1 в ядрышковой рДНК. Однако, нокдаун SirT1 не влияет на уровни метилирования ДНК, тогда как потеря Dnmt1 ведет к гиперацетилированию H4K16Ac и H3K9Ac (Espada et al., 2007).
Все современные доказательства указывают на то, что в генах или затрагиваемых регионах собственно метилирование ДНК нуждается в присутствии определенных methyltransferases (e.g. Suv39h1, Ezh2 and G9a). Напротив, SirT1 heterochromatin-индуцированное молчание является феноменом, который возникает ниже метилирования ДНК. В согласии с этим потеря SirT1 ведет к потере молчания опредеденных генов опухолевых супрессоров, хотя она не нарушает уровней метилирования ДНК (Pruitt et al., 2006). Возможным объяснением этого является то, что разные Suv39h1 комплексы используются на обеих стадиях: установление метилирования ДНК и формирование гетерохроматина. это подтверждается несколькими линиями доказательств: во-первых, Suv39h1 взаимодействует с большинством хроматина и транскрипционными факторами, включая HDAC1, 2 и 3, и является частью Rb-repressing комплекса (Vaute et al., 2002); во-вторых, SirT1, как недавно было установлено, взаимодействует с Suv39h1 и H3K9me связывающим белком Nuclomethylin в рДНК локусах и индуцирует молчание этих генов в условиях энергетического стресса (Murayama et al., 2008).
Значение взаимоотношения между SirT1 и Suv39h1 действительно стоит за FH; т.к. в случае S. pombe, оно также затрагивает и CH, это подтверждает генеральную роль SirT1 в глобальной организации хроматина млекопитающих (Vaquero et al., 2007a). Мышиные эмбриональные фибробласты (MEFs), происходящие от SirT1-/- нокаутных мышей. обнаруживают полную потерю уровней H3K9me3 в фокусах CH приблизительно в 50% этих клеток. это коррелирует с неправильной локализацией HP1γ в тех же самых фокусах. Трансфекция SirT1 в этих клетках дает полное восстановление уровней H3K9me3, демонстрируя прямое участие SirT1 в этом фенотипе. Интересно, что такое восстановление нуждается как в N-terminal домене, так и в каталитической активности SirT1, т.к. трансфекция или SirT1, лишенной N-терминального домена, или каталитически-неактивной полной длины SirT1 точковой мутации ведет только к частичному восстановлению (Vaquero et al., 2007a).
Множество вопросов возникает в результате этого наблюдения. Т.к. SirT1 никогда не обнаруживается в HC фокусах в иммунофлюоресцентных исследованиях, то неясно как SirT1 способствует метилированию H3K9 в этих регионах. Возможным объяснением является то, что уровни SirT1 должны быть столь низки, что они падают ниже порога детекции с помощью иммунофлюоресценции, или что белок присутствует только в течение очень короткого промежутка клеточного цикла (напр.. на определенных стадиях S-фазы)-идея подтверждается массивной инвазией H4K16Ac на фокусы CH после потери Suv39h1 и 2 (Vaquero et al., 2007a). Учитывая очевидные ограничения техники иммунофлюоресценции, ChIP техника д. стать альтернативой для отслеживания SirT1.
Др. интересный вопрос, почему потеря SirT1 затрагивает только 50% MEFs. Потеря SirT1 во время развития может быть покрыта др. HDACs. В самом деле, обработка TSA мышиных L929 клеток индуцирует потерю H3K9me3 в фокусах CH, указывая тем самым, что как и у S. pombe Clr3p и Clr6p, др. Class I и II HDACs могут быть использованы и могут обладать частичным функциональным перекрыванием (Taddei et al., 2001). Др. возможность заключается в том, что участие SirT1 в поддержании уровней H3K9me3 ограничивается определенной стадией клеточного цикла или определенными условиями. Из-за близости Suv39h1 с её родственником Suv39h2, эффект SirT1 может быть обусловлен не только благодаря первому, но и второму. Необходимы дальнейшие исследования.
Наконец, SirT1 также используется для деградации H2A варианта, H2A.Z, который ассоциирует с активным хроматином и важен для развития. Деацетилирование H2A.Z с помощью SirT1 в условиях кардиальной гипертрофии индуцирует клеточный рост и ингибирует апоптоз (Chen et al., 2006).
SirT1 and metabolic regulation
Помимо регуляции хроматина, SirT1 является критическим для метаболизма во время голодания, во время которого он активируется. Эта роль действительно связывает два основных аспекта метаболизма: во-первых, благодаря непосредственному контролю определенных энзимов промежуточного метаболизма (напр. AceCS1, цитозольная изоформа Acetyl-CoA synthetase участвует в образовании жирных кислот из ) (Hallows et al., 2006); и, во-вторых, посредством регуляции передачи эндокринных сигналов, особенно углеводного и липидного метаболизма. Фактически, SirT1 связан с передачей сигналов от нескольких гормональных рецепторов, таких как рецепторы insulin-like growth factor (IGF) пути (Lemieux et al., 2005) и таких как печеночный LXR α и β , андрогеновые и глюкокортикоидные рецепторы (Amat et al., 2007; Fu et al., 2006; Li et al., 2007b). Особенно важной является роль SirT1 в гомеостазе глюкозы, посредством её комбинированного эффекта на панкреас печень и white adipose tissue (WAT) (Amat et al., 2007; Feige and Auwerx, 2008). Она способствует продукции инсулина в панкреатических β-клетках (Bordone et al., 2006; Moynihan et al., 2005), печеночному глюкогенезу посредством взаимодействия и деацетилирования транскрипционного регулятора PGC1α (Rodgers et al., 2005), и ингибированию адипогенеза и дифференцировки за счет соединения с транскрипционным активатором peroxisome proliferator-activated receptor γ (PPARγ ) (Picard et al., 2004b).
SirT1 and cell survival
Среди функций SirT1 , которыми она обладает, наиболее интересна её роль в ответ на оксидативные и генотоксические стрессы (Giannakou and Partridge, 2004; Haigis and Guarente, 2006). Как и в случае регуляции гетерохроматина, SirT1, по-видимому, координирует многие процессы, такие как опознавание повреждений ДНК, репарация ДНК и индукция аппарата детоксификации, ингибирование апоптоза и старения, клеточную пролиферацию и стимуляцию аутофагии. Она взаимодействует со многими разнообразными факторами, которые часто связаны со способностью к транскрипционному молчанию. Эта скоординированная реакция возникает, чтобы защитить нервы, сердце, печень и др. типы тканей и связывает активность SirT1 с раковыми процессами (Fig. 3).
SirT1 взаимодействует с и деацетилирует ключевые факторы, участвующие в реакциях на стрессы, включая семейство транскрипционных факторов forkhead FOXO (Brunet et al., 2004; Motta et al., 2004; van der Horst et al., 2004) и NF-κB (Yeung et al., 2004), путем модулирования их транскрипционной активности. Активность SirT1 индуцирует транскрипционную активацию репарации ДНК и аппарат детоксификации ДНК вместе с репрессией генов, контролирующих клеточный цикл, или индуцирует апоптоз. Др. интересный и неполностью изученный аспект функции SirT1 является её антагонизм с опухолевым супрессором p53, главным регулятором в контроле клеточного цикла. Деацетилирование p53 с помощью SirT1 ингибирует p53-зависимый апоптоз и старение (Luo et al., 2001; Vaziri et al., 2001). Интересно, что SirT1-/- MEFs обнаруживают гиперацетилирование p53 (Cheng et al., 2003) и ингибирующий эффект на транслокацию p53 на митохондрии в ответ на стресс (Han et al., 2008).
Второй уровень индукции клеточной жизнеспособности с помощью SirT1 осуществляется за счет непосредственного взаимодействия и доставки аппарата репарации ДНК к мишеням, для чего, кстати, описаны две разные мишени. Первая, Nijmegen breakage syndrome 1 (NBS1), является checkpoint белком, участвующим в обнаружении повреждений ДНК и индукции репарации ДНК (Yuan et al., 2007). SirT1 соединяется с и деацетилирует NBS1, индуцируя репарацию ДНК и клеточную жизнеспособность. Вторая - это фактор репарации ДНК Ku70, который участвуют в репарации разрывов двойной нити (DSB) за счет non-homologous end joining (NHEJ). SirT1 соединяется с и деацетилирует Ku70, это способствует его связыванию с проапоптическим фактором Bax. Соединение с Ku70 секвестрирует Bax вдали от митохондрий, ингибируя тем самым Bax-зависимый апоптоз (Cohen et al., 2004). Это взаимодействие SirT1-Ku70 может иметь значение для репарации DSB. Недавнее исследование показало, что после DSB разрывов, SirT1 рекрутируется на поврежденный сайт, событие, которое коррелирует с компакцией хроматина и молчанием в том же самом регионе (O'Hagan et al., 2008). Это рекрутирование, по-видимому, ассоциирует с перемещением SirT1 с её нативных локусов, это вызывает изменения в паттерне генной экспрессии, которые напоминают старение у млекопитающих (Oberdoerffer et al., 2008). Однако роль SirT1 в процессе репарации ДНК неизвестна.
Третий уровень регуляции осуществляется посредством контроля клеточного цикла. SirT1 не только используется для эффективного ответа на средовые стрессы, но и также способствует ходу клеточных делений. Фактически имеются доказательства, что SirT1 подавляется после выхода из клеточного цикла (Sasaki et al., 2006). Хотя до конца неясно, но имеющиеся данные указывают на то, что SirT1 регулирует определенных главных игроков контроля клеточного цикла, таких как retinoblastoma (Rb) и E2F1. Rb является опухолевым репрессором, который контролирует G
- S переход путем соединения с E2F транскрипционными факторами. Зависимое от клеточного цикла фосфорилирование Rb вызывает его связывание с E2F и последующую репрессию E2F-чувствительныхы генов, индуцируя тем самым ход клеточного цикла (Wong and Weber, 2007). Ацетилирование Rb ингибирует эту связь; поэтому можно предположить, что деацетилирование Rb с помощью SirT1 способствует его фосфорилированию и клеточной пролиферации (Wong and Weber, 2007). Фактически, Rb образует комплекс с Suv39h1 и HDAC1, 2 и 3 (Vaute et al., 2002), показывая тем самым, что функциональная связь между SirT1 и Suv39h1 может также использоваться. Кроме того, SirT1 соединяется с и деацетилирует E2F1, ингибируя его про-апоптическую активность и индуцируя клеточную пролиферацию (Wang et al., 2006). Недавние находки указывают на то, что SirT1 может также вмешиваться в транскрипционную репрессивную активность HDAC1-содержащего Rbp1 комплекса, ингибируя его активность по аресту роста (Binda et al., 2008). Однако данные указывают на то, что эта SirT1 индукция пролиферации в свою очередь ведет к аресту роста при хронических стрессовых условиях, указывая на более сложный и тонко-настраиваемый механизм SirT1 контроля клеточной жизнеспособности (Chua et al., 2005).
Наконец, недавние наблюдения показали, что SirT1 способствует аутофагии, механизму, участвующему в деградации поврежденных белков и органелл вследствие стресса.
SirT1-/- MEFs не могут поддерживать активацию аутофагии после стресса (Lee et al., 2008). Однако является ли этот эффект прямым или косвенным, пока неизвестно.
SirT1, development and cell differentiation
В мышиных ES (Embryonic stem) клетках уровни SirT1 высокие в не дифференцированных клетках и снижаются после дифференцировки (Kuzmichev et al., 2005), это указывает на то, что SirT1 имеет антагонистические взаимоотношения с дифференцировкой. Доказательства показывают, что функция SirT1 является ключевой в двух из наиболее метаболически-зависимых типов тканей: скелетные мышцы и WAT. При обычных условиях обе ткани являются крупными потребителями системной глюкозы. После голодания позитивная регуляция SirT1 вызывает молчание определенных ключевых генов в обоих типах. чтобы ингибировать дифференцировку. В скелетных мышцах гены myogenin и MHC является молчащими после того, как SirT1 формирует комплекс с транскрипционным фактором MyoD и HAT PCAF (p300/CBP associating factor). Молчание достигается посредством деацетилирования MyoD и PCAF и скорее всего благодаря образованию FH (Fulco et al., 2003). В WAT, SirT1 ингибирует активацию генов, таких как fatty-acid binding protein (aP2) за счет рекрутирования корепрессоров NCoR и SMRT на PPARγ-чувствительные гены, приводя к мобилизации жира, а также к ингибированию дифференцировки WAT (Picard et al., 2004a). недавние данные показали, что дифференцировка в нервной ткани скорее всего зависит от метаболических изменений и регулируется с помощью SirT1. При оксидативном стрессе мышиные neural progenitor cells (NPCs) прекращают пролиферировать и дифференцируются в клетки астроглии (вместо нейронов) посредством SirT1-зависимого механизма (Prozorovski et al., 2008). Этот механизм базируется на модуляции транскрипционного фактора Hes1 с помощью SirT1, который индуцирует молчание пронейрального гена Mash1.
SirT1 участвует также в активации дифференцировки в гаметогенезе. И самцы и самки
SirT1-/- нокаутных мышей стерильны и обнаруживают истощение дифференцирующихся зародышевых клеток (McBurney et al., 2003b). Однако соотв. механизмы пока неизвестны.
SirT2
SirT2 является типа I sirtuin подобен своему дрожжевому ортологу Hst2p, и локализован в цитоплазме за исключением момента перехода от G2 к M, когда он транспортируется в ядро и локализуется на хроматине (North and Verdin, 2007a, Vaquero et al., 2006). Хотя большинство аспектов функции SirT2 неизвестно, но все доказательства указывают на то, что он участвует в контроле клеточного цикла, особенно в G2 к M checkpoint. Интересно, что избыточная экспрессия SirT2 задерживает выход из митозов и укорачивает G1 (Bae et al., 2004; Dryden et al., 2003), тогда как SirT2-/- MEFs ассоциированы с более длинной G1 и более короткой S-фазой (Vaquero et al., 2006). Данные указывают на то, что уровни, активность и локализация SirT2 тонко регулируются с помощью фосфорилирования (Dryden et al., 2003; North and Verdin, 2007b). В противоположность SirT1, который ассоциирует с жизнеспособностью клеток и раковым процессом, SirT2 действует как опухолевый супрессор (Inoue et al., 2007). Избыточная экспрессия SirT2 у млекопитающих в условиях неконтролируемой пролиферации или митотического стресса способствует аресту клеточного цикла до вступления в митоз (Inoue et al., 2007), а избыточная экспрессия SirT2 или Hst2p в ооцитах морских звезд задерживает клеточные деления (Borra et al., 2002). В соответствии с этим, SirT2 подавляется при некоторых раковых опухолях (напр. glial и gastric карциномах) (Hiratsuka et al., 2003; Inoue et al., 2007) и обнаруживается мутантным в меланомах. (Lennerz et al., 2005)
Подобно SirT1, SirT2 также связан с ингибированием дифференцировки адипоцитов и нейральных олигодендроглиальных клеток (Jing et al., 2007; Li et al., 2007a). Более того, SirT2 также участвует в нейродегенеративных болезнях подобно SirT1, но , по-видимому, с противоположной ролью, которая непонятна (Outeiro et al., 2007).
Итак две основные мишени описаны для SirT2: хроматин и цитоскелет. Несмотря на его цитозольную локализацию, SirT2 обладает histone deacetylase активностью-высоко специфичной для H4K16Ac, и в меньшей степени, для H3K9Ac-, а в RNAi экспериментах потеря SirT2 ведет к высоким уровням H4K16Ac (Vaquero et al., 2006). SirT2 ответственен за глобально снижение уровней H4K16Ac непосредственно перед митозом, это может способствовать собственно компакции хромосом во время митоза. Учитывая, что H4K16Ac обнаруживает уникальную способность ингибировать образование хроматина организации высокого порядка (ShogrenKnaak et al., 2006), его удаление д. быть необходимым для прохождения клеточного цикла. Однако, SirT2-/- MEFs, которые обнаруживают гиперацетилирование H4K16 во время митоза, не обнаруживают какой-либо задержки хода митоза, но обнаруживают задержку со вступлением в S-фазу (Vaquero et al., 2006). Это может указывать на то, что любой возможный дефект в хроматине, вызываемый в ходе митоза в присутствии гиперацетилирования H4K16, может вызывать задержку вступления в S-фазу, если G/S checkpoint вынужден решать продолжать ли репликацию ДНК. Источник этого дефекта неизвестен, но он может быть связан с процессами репарации ДНК, учитывая, что главная H4K16 acetyltransferase в клетках млекопитающих, MOF (Gupta et al., 2008; Taipale et al., 2005), ассоциирует с аппаратом определения повреждений ДНК и ключевыми элементами G1 - S checkpoint (напр. p53) (Gupta et al., 2005), принимая во внимание. что глобальные уровни H4K16Ac достигают пика во время S-фазы и что эта модификация участвует в отложении гистонов у растений (Belyaev et al., 1997), то выявляются четкие тесные, но необъяснимые взаимоотношения между H4K16Ac и S-фазой. Дальнейшие исследования д. разъяснить, могут ли дефекты клеточного цикла, описанные после потери SirT2 быть полностью связаны с аберрантными уровнями H4K16Ac или с др. возможными мишенями.
Др. известная мишень для SirT2 описана подробно это α-tubulin, чье деацетилирование, как полагают, важно для регуляции динамики микротрубочек (North et al., 2003). Т.к. ацетилирование tubulin, по-видимому, стабилизирует структуры микротрубочек, то деацетилирование может разрушать и затем ингибировать ход клеточного цикла (Piperno et al., 1987). SirT2 действительно обнаруживает взаимодействие с др. tubulin deacetylase, HDAC6, но значение этой находки до конца неясно (North et al., 2003).
SirT3
SirT3 является близким родственником SirT2, он филогенетически связан с Hst2p и является единственным sirtuin, непосредственно участвующим в обеспечении продолжительности жизни человека (Rose et al., 2003). Он присутствует в основном в митохондриях, на которые он транслоцируется после отщепления 142 остатков от его N-конца (Onyango et al., 2002; Schwer et al., 2002). Клеточная роль SirT3 связана с метаболизмом и митохондриальной функцией, хотя не до конца понятно как. Несмотря на тот факт, что потеря SirT3 вызывает генерализованное гиперацетилирование митохондриальных белков (Lombard et al., 2007) и взаимодействует с Foxo фактором Foxo3a (Jacobs et al., 2008), описана лишь одна мишень: acetyl-CoA synthetase 2 (AceCS2) (Hallows et al., 2006; Schwer et al., 2006). Митохондриальная AceCS2 активируется после деацетилирования с помощью SirT3, индуцируя продукцию Acetyl-CoA (Ac-CoA), который в свою очередь вызывает увеличение скорости метаболизма в митохондриях. Хотя он и широко экспрессируется, SirT3 особенно важен для brown adipocyte tissue (BAT), головного мозга и почек, но очень слабо экспрессируется в WAT (Shi et al., 2005).
Неожиданно, SirT3 может участвовать в регуляции функции хроматина. Подобно SirT2, SirT3 обнаруживает сильную histone deacetylation активность, специфичную для H4K16Ac и H3K9Ac (Scher et al., 2007). Более того, некоторые полной длины SirT3 располагаются в ядре в определенных не охарактеризованных фокусах. Трансфекция SirT3 в эмбриональные 293 клетки человека может индуцировать молчание репортерного гена, интегрированного в эухроматиновые регионы, благодаря деацетилированию H4K16Ac и H3K9Ac в промоторных регионах. Однако в противоположность потере SirT2, потеряSirT3 не коррелирует с глобальным увеличением H4K16Ac или H3K9Ac, указывая тем самым, что если он и в самом деле участвует в регуляции транскрипции, то он имеет в качестве мишеней лишь небольшой субнабор генов. Однако гены кандидаты ещё не идентифицированы.
Стрессовые условия, вызываемые агентами, повреждающими ДНК, такими как Etoposide и облучение УФЛ, а также избыточная экспрессия SirT3, индуцируют обширные перемещения SirT3 из ядра в митохондрии для выполнения неизвестной функции (Scher et al., 2007). Ядерный SirT3 может быть представлен разными функциональными популяциями, большинство из которых присутствует в митохондриях; следовательно, транслокация в митохондрии может выполнять новые роли, такие как описанное участие SirT3 в апоптозе (Allison and Milner, 2007). Др. возможность заключается в том, что как и в случае SirT2, уровни SirT3 нуждаются в очень тонкой регулировке, а транслокация в митохондрии может преодолевать определенный порог, за которым может происходить специфическая реакция. Механизм перемещения в и из ядра, подобный недавно описанному для SirT2, предположен и для SirT3, чтобы объяснить эти наблюдения. Это базируется на том факте, что leptomycin A может блокировать транслокацию (Scher et al., 2007). Др. данные указывают на то, что избыточная экспрессия др. митохондриального sirtuin, SirT5, вызывает накопление в ядре SirT3 за счет полностью неизвестного механизма (Nakamura et al., 2008).
SirT4 and SirT5
SirT4 является митохондриального Type II sirtuin, участвующим в ADP-ribosylation митохондриальных белков и не обладает какой-либо deacetylase активностью или какой-либо известной ролью в хроматине. Он, по-видимому, участвует в метаболическом контроле и продукции инсулина в панкреатических β-клетках благодаря модуляции активности glutamate dehydrogenase (GDH), которая участвует в катаболизме глютаминовой кислоты и глютамина (Haigis et al., 2006).
SirT5 является Type III sirtuin, родственным прокариотическим sirtuins. Его функция неизвестна.
SirT6
SirT6 является Type IV ядерным связанным с хроматином sirtuin, существенным для жизнеспособности (Mostoslavsky et al., 2006). Его потеря ассоциирует с геномной нестабильностью, повышенной чувствительности и ионизирующей радиации (IR), и к оксидативным и генотоксическим стрессам, что ведет к уменьшению продолжительности жизни и к фенотипу. схожему со старением. SirT6 функционально связан с base excision repair (BER), механизмом репарации ДНК, ответственным за репарацию однонитчатых разрывов (Mostoslavsky et al., 2006). Однако неясно является ли это участие прямым, т.к. SirT6, по-видимому, не локализуется в фокусах BER, а его потеря не нарушает механизма BER . SirT6 действительно соединяется с GCIP, предполагаемым опухолевым супрессором и ингибитором пролиферации клеток, это указывает на то, что SirT6 может выполнять важную роль в опознании и передаче сигналов о повреждениях ДНК и при определенных условиях останавливать рост (Ma et al., 2007). В согласии с этой ролью недавно описанная позитивная роль в отношении p53 в контроле уровней SirT6 при нормальных условиях роста (Kanfi et al., 2008). Интересно, что уровни SirT6 также позитивно регулируются при ограничении калорий или условиях истощения пищи (Kanfi et al., 2008), это вместе с доказательствами, представленными выше, подтверждает роль SirT6 в реакциях на оксидативные стрессы.
SirT6 первоначально был обнаружен благодаря своей сильной ADP-ribosyltransferase активности, но не выявлено иных мишеней кроме самого себя. Однако SirT6 недавно наблюдался в теломерных регионах, где он, по-видимому, выполняет очень специфическую для H3K9Ac деацетилазную роль (Michishita et al., 2008). Потеря SirT6 вызывает гиперацетилирование H3K9Ac, а также дефекты теломер, такие как слияния хромосом конец-в-конец, ведущие к старению. Кроме того, SirT6 участвует в теломерной локализации белка Werner syndrome gene protein (WRN), ДНК helicase, участвующей в репликации теломер во время S-фазы, которая также взаимодействует с SirT1 (Narala et al., 2008). Эти доказательства указывают на то, что SirT6 участвует в обеспечении собственно репликации теломер. Однако, как эти данные коррелируют с ранее описанной функциональной связью с репарацией ДНК, и как активность по деацетилированию H3K9Ac у SirT6 участвует в этих функциях, неизвестно.
SirT7
SirT7, является др. Type IV sirtuin млекопитающих, он локализован в ядрышках и, по-видимому, обладает в основном ADP-ribosylation активностью (Michishita et al., 2005). Неожиданно, он, по-видимому, не участвует в замалчивании рДНК; вместо этого, он, по-видимому, непосредственно активирует RNA polymerase-I. Потеря SirT7 вызывает потерю RNA-polymerase I, связанной с регионами рДНК, индуцируя подавление клеточной пролиферации и апоптоза (Ford et al., 2006). Эта роль зависит от каталитической активности SirT7, но мишени пока не описаны. Напротив, SirT7-/- мыши обнаруживают гипертрофию сердца и воспалительную кардиопатию, а также существенную потерю способности противостоять стрессам (Vakhrusheva et al., 2008). Как эти наблюдения связаны с ролью SirT7 в регуляции ядрышковой рДНК покажет будущее.
Интересно, что др. sirtuin, обнаруживаемый в ядрышках, SirT1, обнаруживает противоположную роль по сравнению с SirT7: он соединяется с копиями рДНК благодаря взаимодействию с DNA-methyltransferase Dnmt1 и участвует в замалчивании этих регионов (Espada et al., 2007). Помимо гистонов, SirT1 ингибирует также RNA polymerase-I путем деацетилирования базового фактора TAF67 (Muth et al., 2001). Кстати, функциональные взаимоотношения между этими двумя sirtuins неизвестны.
Conclusions
The relevance of sirtuins to chromatin in archaea to humans makes them exceptional witnesses of the path followed by chromatin regulation and reflects the importance of chromatin functions in metabolism and stress adaptation. Despite this, the conserved role of sirtuins in chromatin dynamics has not garnered the same attention as most of the newly acquired sirtuin functions (e.g. cell survival under stress), and in particular in the context of human pathologies such as cancer and neurodegenerative diseases. Interestingly, a growing body of evidence suggests that in a significant number of these new functions, the main effect of sirtuins is exerted via a direct effect on chromatin. Elucidating sirtuins’ roles in chromatin is not only relevant to understanding said pathologies, but also to explaining the evolution and specialization of these proteins. Next years should be crucial to build a more complete and integrated perspective of all described sirtuin roles into a more accurate description of sirtuin global contribution to cell life basic functions.
Сайт создан в системе
uCoz Fig. 1. Classification of sirtuins. List of sirtuins from selected organisms from bacteria to humans classified phylogenetically (Type) according to Frye (2000). The denomination "Type" here and elsewhere in the text has been used instead of "Class", to avoid confusion with HDAC classification (HDAC Class I to III). The font color used for the sirtuins indicates current knowledge on their enzymatic activity: black for those with known deacetylase activity; white for those whose main activity is ADP-ribosylation; and black and white for both. The sirtuins shown in yellow have not yet been characterized; hence, no information on them is available.
Fig. 1. Classification of sirtuins. List of sirtuins from selected organisms from bacteria to humans classified phylogenetically (Type) according to Frye (2000). The denomination "Type" here and elsewhere in the text has been used instead of "Class", to avoid confusion with HDAC classification (HDAC Class I to III). The font color used for the sirtuins indicates current knowledge on their enzymatic activity: black for those with known deacetylase activity; white for those whose main activity is ADP-ribosylation; and black and white for both. The sirtuins shown in yellow have not yet been characterized; hence, no information on them is available. Fig. 2. Model of Sir2-dependent Heterochromatin formation in S. cerevisiae. (A) Mating-type loci: Sir1 participates in the establishment of the heterochomatin structure during S-phase through binding to silencer-bound proteins such as ORC1p, Rap1 and Abf1p and recruitment of the rest of the SIR machinery. Different models have been proposed to describe this process but it is commonly accepted that Sir4p (present in vivo as Sir4-ScSir2p complex) is probably responsible for binding to Sir1p, which in turn is believed to bring Sir3p to chromatin, resulting in hypoacetylation of H3 and H4 as well as silencing. Once the structure is established, it can spread without Sir1p. (B) Telomeres: The SIR complex is formed in the telomeric regions, through binding to Rap1. Sir3p and Sir4p bind to Rap1p independently and recruit ScSir2p. The complex spreads similarly as in the mating-type loci. (C) Nucleolar silencing of rDNA. Each of the 100-200 repeats distributed in tandem is around 9.1kb and composed of two regions: 35S (blue arrows), formed by 18S and 25S, and NTS (Non transcribed spacer). The latter consists of a 5S gene and two flanking regions named NTS1 and NTS2. Transcription of each repeat renders a RNA pol-I dependent 35S precursor rRNA and a RNA-pol III -dependent 5S rRNA precursor. The RENT complex binds to two regions, NTS1 and NTS2. In both cases, RENT recruitment to chromatin requires binding to specific factors, fob1p in the case of NTS1, and RNA-polymerase Ip (RNA-pol-I) in the case of NTS2. Binding of RENT to NTS2 spreads into the coding region of 18S (Huang and Moazed, 2003). Based on Huang and Moazed, 2003.
Fig. 2. Model of Sir2-dependent Heterochromatin formation in S. cerevisiae. (A) Mating-type loci: Sir1 participates in the establishment of the heterochomatin structure during S-phase through binding to silencer-bound proteins such as ORC1p, Rap1 and Abf1p and recruitment of the rest of the SIR machinery. Different models have been proposed to describe this process but it is commonly accepted that Sir4p (present in vivo as Sir4-ScSir2p complex) is probably responsible for binding to Sir1p, which in turn is believed to bring Sir3p to chromatin, resulting in hypoacetylation of H3 and H4 as well as silencing. Once the structure is established, it can spread without Sir1p. (B) Telomeres: The SIR complex is formed in the telomeric regions, through binding to Rap1. Sir3p and Sir4p bind to Rap1p independently and recruit ScSir2p. The complex spreads similarly as in the mating-type loci. (C) Nucleolar silencing of rDNA. Each of the 100-200 repeats distributed in tandem is around 9.1kb and composed of two regions: 35S (blue arrows), formed by 18S and 25S, and NTS (Non transcribed spacer). The latter consists of a 5S gene and two flanking regions named NTS1 and NTS2. Transcription of each repeat renders a RNA pol-I dependent 35S precursor rRNA and a RNA-pol III -dependent 5S rRNA precursor. The RENT complex binds to two regions, NTS1 and NTS2. In both cases, RENT recruitment to chromatin requires binding to specific factors, fob1p in the case of NTS1, and RNA-polymerase Ip (RNA-pol-I) in the case of NTS2. Binding of RENT to NTS2 spreads into the coding region of 18S (Huang and Moazed, 2003). Based on Huang and Moazed, 2003.  Fig. 3. Function of mammalian sirtuins. The main functions of SirT1 are indicated in black boxes. They are mediated through promotion of the indicated actions (maroon and green boxes) and consequences (red boxes). The functions of the remaining sirtuins are also listed. A question mark is used to indicate functions which have not been demonstrated. Polycomb, Ezh2 (Polycomb)-dependent silencing; WAT, white adipose tissue.
Fig. 3. Function of mammalian sirtuins. The main functions of SirT1 are indicated in black boxes. They are mediated through promotion of the indicated actions (maroon and green boxes) and consequences (red boxes). The functions of the remaining sirtuins are also listed. A question mark is used to indicate functions which have not been demonstrated. Polycomb, Ezh2 (Polycomb)-dependent silencing; WAT, white adipose tissue. Fig. 4. Model of SirT1-mediated facultative heterochromatin. Upon recruitment by a DNA-binding factor (TF), SirT1 promotes histone deacetylation, particularly of H4K16Ac and H3K9Ac, as well as recruitment and deacetylation of H1 (upper panel). This arrival correlates with loss of the active mark H3K79me2. Next, SirT1 recruits and deacetylates Suv39h1, which becomes "superactive" (middle panel) and methylates the neighboring nucleosomes. This in turn attracts HP1 and triggers the spread of heterochromatin, resulting in the formation of the 30 nm fiber (lower panel). OAADPR, O-Acetyl-ADPribose; SAM, S-adenosyl-methionine.
Fig. 4. Model of SirT1-mediated facultative heterochromatin. Upon recruitment by a DNA-binding factor (TF), SirT1 promotes histone deacetylation, particularly of H4K16Ac and H3K9Ac, as well as recruitment and deacetylation of H1 (upper panel). This arrival correlates with loss of the active mark H3K79me2. Next, SirT1 recruits and deacetylates Suv39h1, which becomes "superactive" (middle panel) and methylates the neighboring nucleosomes. This in turn attracts HP1 and triggers the spread of heterochromatin, resulting in the formation of the 30 nm fiber (lower panel). OAADPR, O-Acetyl-ADPribose; SAM, S-adenosyl-methionine.