Enteric Nervous System
ЭНТЕРИЧЕСКАЯ НЕРВНАЯ СИСТЕМА
|
Development of the mammalian enteric nervous system
Stavros Taraviras, Vassilis Pachnis
Current Opinion in Genetics & Development 1999, 9 No. 3:321-327. |
CNS—central nervous system;
Dom—Dominant megacolon;
ENS—enteric nervous system;
GDNF—glial cell line derived neurotrophic factor;
NC—neural crest;
NCSC—NC stem cell;
PNS—peripheral nervous system;
RTK—receptor tyrosine kinase.
Кишечная нервная система (ENS) позвоночных представлена большим числом взаимосвязанных ганглиев (enteric ganglia), которые располагаются по всей стенке кишки двумя концентричческими кругами; наружный myenteric и внутренний подслизистый
[1]. Основаня функция ENS заключается в контроле за перистальтикой стенки кишечника — путем регуляции сократимости внутренних гладких мышц — и в модуляции активности секреторных желез, присутствующих внутри или ассоциированных с ЖКТ .Многие годы энтерические ганглии рассматривались как специализированные парасимпатические ганглии [2]Однако теперь стало ясно, что ENS является независимой ветвью периферической нервной системы (ПНС)[3]. Многие свойства ENS, однако, отличаются от других частей ПНС. Она характеризуется большим числом нейронов и глиальных клеток, высокой степенью различий в\нейрональных фенотипов и прежде всего своей функционалной независимостью от ЦНС [3]. ENS состоит из локальных рефлекторных петель, котрые перерабатывают информацию в соответствии с состоянием просвета и стенки кишечника и контролируют мышечную сократимость и секрецию[1] [3]. Во многих отношениях ENS позвоночных сходна с ЦНС, что позволяет ее характеризовать как "вторичный головной мозг" ('second brain') [4].
Furness JB, Costa M:
The Enteric Nervous System.
Edinburgh:Churchill Livingstone,1987,
Kuntz A:
The Autonomic Nervous System.
Philadelphia:Lea & Febiger,1953,
Gershon MD, Kirchgessner AL, Wade PR:
Physiology of the Gastrointestinal Tract (vol. 1).
Edited by Johnson LR.New York:
Raven Press,1994,
381–422.
Gershon MD:
The Second Brain.
New York:HarperCollins,1998,
Le Douarin N:
The Neural Crest.
Cambridge:Cambridge University Press,1982,
Le Douarin NM, Teillet MA:
The migration of neural crest cells to the wall of the digestive tract in avian embryo.
J Embryol Exp Morphol1973,30:31–48.
Durbec PL, Larsson-Blomberg LB, Schuchardt A, Costantini F, Pachnis V:
Common origin and developmental dependence on c-ret of subsets of enteric and sympathetic neuroblasts.
Development1996,122:349–358.
Pomeranz HD, Rothman TP, Gershon MD:
Colonization of the post-umbilical bowel by cells derived from the sacral neural crest: direct tracing of cell migration using an intercalating probe and a replication-deficient retrovirus.
Development1991,111:647–655.
Pomeranz HD, Gershon MD:
Colonization of the avian hindgut by cells derived from the sacral neural crest.
Dev Biol1990,137:378–394.
Serbedzija GN, Burgan S, Fraser SE, Bronner-Fraser M:
Vital dye labelling demonstrates a sacral neural crest contribution to the enteric nervous system of chick and mouse embryos.
Development1991,111:857–866.
• Burns AJ, Douarin NM:
The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system.
Development1998,125:4335–4347.
Lin LF, Doherty DH, Lile JD, Bektesh S, Collins F:
GDNF: a glial cell line-derived neurotrophic factor for midbrain dopaminergic neurons.
Science1993,260:1130–1132.
Kotzbauer PT, Lampe PA, Heuckeroth RO, Golden JP, Creedon DJ, Johnson EM Jr, Milbrandt J:
Neurturin, a relative of glial-cell-line-derived neurotrophic factor.
Nature1996,384:467–470.
Milbrandt J, de Sauvage FJ, Fahrner TJ, Baloh RH, Leitner ML, Tansey MG, Lampe PA, Heuckeroth RO, Kotzbauer PT, Simburger KS et al.:
Persephin, a novel neurotrophic factor related to GDNF and neurturin.
Neuron1998,20:245–253.
Baloh RH, Tansey MG, Lampe PA, Fahrner TJ, Enomoto H, Simburger KS, Leitner ML, Araki T, Johnson EM Jr, Milbrandt J:
Artemin, a novel member of the GDNF ligand family, supports peripheral and central neurons and signals through the GFRalpha3-RET receptor complex.
Neuron1998,21:1291–1302.
Jing S, Wen D, Yu Y, Holst PL, Luo Y, Fang M, Tamir R, Antonio L, Hu Z, Cupples R, Louis JC et al.:
GDNF-induced activation of the ret protein tyrosine kinase is mediated by GDNFR-alpha, a novel receptor for GDNF.
Cell1996,85:1113–1124.
Treanor JJ, Goodman L, de Sauvage F, Stone DM, Poulsen KT, Beck CD, Gray C, Armanini MP, Pollock RA, Hefti F et al.:
Characterization of a multicomponent receptor for GDNF.
Nature1996,382:80–83.
Pasini B, Ceccherini I, Romeo G:
RET mutations in human disease.
Trends Genet1996,12:138–144.
Schuchardt A, D'Agati V, Larsson-Blomberg L, Costantini F, Pachnis V:
Defects in the kidney and enteric nervous system of mice lacking the tyrosine kinase receptor Ret.
Nature1994,367:380–383.
Moore MW, Klein RD, Farinas I, Sauer H, Armanini M, Phillips H, Reichardt LF, Ryan AM, Carver-Moore K, Rosenthal A:
Renal and neuronal abnormalities in mice lacking GDNF.
Nature1996,382:76–79.
Pichel JG, Shen L, Sheng HZ, Granholm AC, Drago J, Grinberg A, Lee EJ, Huang SP, Saarma M, Hoffer BJ et al.:
Defects in enteric innervation and kidney development in mice lacking GDNF.
Nature1996,382:73–76.
Sanchez MP, Silos-Santiago I, Frisen J, He B, Lira SA, Barbacid M:
Renal agenesis and the absence of enteric neurons in mice lacking GDNF.
Nature1996,382:70–73.
•• Cacalano G, Farinas I, Wang LC, Hagler K, Forgie A, Moore M, Armanini M, Phillips H, Ryan AM, Reichardt LF et al.:
GFRα1 is an essential receptor component for GDNF in the developing nervous system and kidney.
Neuron1998,21:53–62.
•• Enomoto H, Araki T, Jackman A, Heuckeroth RO, Snider WD, Johnson EM Jr, Milbrandt J:
GFR alpha1-deficient mice have deficits in the enteric nervous system and kidneys.
Neuron1998,21:317–324.
•• Natarajan D, Grigoriou M, Marcos-Gutierrez CV, Atkins C, Pachnis V:
Multipotential progenitors of the mammalian enteric nervous system capable of colonising aganglionic bowel in organ culture.
Development1999,126:157–168.
Chalazonitis A, Rothman TP, Chen J, Lamballe F, Barbacid M, Gershon MD:
Neurotrophin-3 induces neural crest-derived cells from fetal rat gut to develop in vitro as neurons or glia.
J Neurosci1994,14:6571–6584.
Lo L, Anderson DJ:
Postmigratory neural crest cells expressing c-RET display restricted developmental and proliferative capacities.
Neuron1995,15:527–539.
• Chalazonitis A, Rothman TP, Chen J, Gershon MD:
Age-dependent differences in the effects of GDNF and NT-3 on the development of neurons and glia from neural crest-derived precursors immunoselected from the fetal rat gut: expression of GFRα-1 in vitro and in vivo.
Dev Biol1998,204:385–406.
•• Hearn CJ, Murphy M, Newgreen D:
GDNF and ET-3 differentially modulate the numbers of avian enteric neural crest cells and enteric neurons in vitro.
•• Rossi J, Luukko K, Poteryaev D, Laurikainen A, Sun YF, Laakso T, Eerikainen S, Tuominen R, Lakso M, Rauvala H et al.:
Retarded growth and deficits in the enteric and parasympathetic nervous system in mice lacking GFR α2, a functional neurturin receptor.
Neuron1999,22:243–252.
•• Heuckeroth RO, Enomoto H, Grider JR, Golden JP, Hanke JA, Jackman A, Molliver DC, Bardgett ME, Snider WD, Johnson EM Jr, Milbrandt J:
Gene targeting reveals a critical role for neurturin in the development and maintenance of enteric, sensory, and parasympathetic neurons.
Neuron1999,22:253–263.
Widenfalk J, Nosrat C, Tomac A, Westphal H, Hoffer B, Olson L:
Neurturin and glial cell line-derived neurotrophic factor receptor-beta (GDNFR-beta), novel proteins related to GDNF and GDNFR-alpha with specific cellular patterns of expression suggesting roles in the developing and adult nervous system and in peripheral organs.
J Neurosci1997,17:8506–8519.
Pevny LH, Lovell-Badge R:
Sox genes find their feet.
Curr Opin Genet Dev1997,7:338–344.
Doolittle DP, Davisson MT, Guidi JN, Green MC:
Genetic Variants and Strains of the Laboratory Mouse (vol. 1).
Edited by Lyon MF, Rastan S, Brown SDM.
Oxford:Oxford University Press,1996,194:
•• Southard-Smith EM, Kos L, Pavan WJ:
Sox10 mutation disrupts neural crest development in Dom Hirschsprung mouse model.
Nat Genet1998,18:60–64.
•• Herbarth B, Pingault V, Bondurand N, Kuhlbrodt K, Hermans Borgmeyer I, Puliti A, Lemort N, Goossens M, Wegner M:
Mutation of the Sry-related Sox10 gene in Dominant megacolon, a mouse model for human Hirschsprung disease.
Proc Natl Acad Sci USA1998,95:5161–5165.
Kuhlbrodt K, Schmidt C, Sock E, Pingault V, Bondurand N, Goossens M, Wegner M:
Functional analysis of Sox10 mutations found in human Waardenburg- Hirschsprung patients.
J Biol Chem1998,273:23033–23038.
•• Pingault V, Bondurand N, Kuhlbrodt K, Goerich DE, Prehu MO, Puliti A, Herbarth B, Hermans-Borgmeyer I, Legius E, Matthijs G et al.:
SOX10 mutations in patients with Waardenburg-Hirschsprung disease.
Nat Genet1998,18:171–173.
Kuhlbrodt K, Herbarth B, Sock E, Hermans-Borgmeyer I, Wegner M:
Sox10, a novel transcriptional modulator in glial cells.
J Neurosci1998,18:237–250.
Hirata Y:
Endothelin peptides.
Curr Opin Nephrol Hypertension1996,5:12–15.
Puffenberger EG, Hosoda K, Washington SS, Nakao K, deWit D, Yanagisawa M, Chakravart A:
A missense mutation of the endothelin-B receptor gene in multigenic Hirschsprung's disease.
Cell1994,79:1257–1266.
Hosoda K, Hammer RE, Richardson JA, Baynash AG, Cheung JC, Giaid A, Yanagisawa M:
Targeted and natural (piebald-lethal) mutations of endothelin-B receptor gene produce megacolon associated with spotted coat color in mice.
Cell1994,79:1267–1276.
Baynash AG, Hosoda K, Giaid A, Richardson JA, Emoto N, Hammer RE, Yanagisawa M:
Interaction of endothelin-3 with endothelin-B receptor is essential for development of epidermal melanocytes and enteric neurons.
Cell1994,79:1277–1285.
Gershon MD:
Neural crest development. Do developing enteric neurons need endothelins?
Curr Biol1995,5:601–604.
• Yanagisawa H, Yanagisawa M, Kapur RP, Richardson JA, Williams SC, Clouthier DE, de Wit D, Emoto N, Hammer RE:
Dual genetic pathways of endothelin-mediated intercellular signaling revealed by targeted disruption of endothelin converting enzyme-1 gene.
Development1998,125:825–836.
Lahav R, Dupin E, Lecoin L, Glavieux C, Champeval D, Ziller C, Le Douarin NM:
Endothelin 3 selectively promotes survival and proliferation of neural crest-derived glial and melanocytic precursors in vitro.
Proc Natl Acad Sci USA1998,95:14214–14219.
• Wu JJ, Chen JX, Rothman TP, Gershon MD:
Inhibition of in vitro enteric neuronal development by endothelin-3: mediation by endothelin B receptors.
Development1999,126:1161–1173.
Pomeranz HD, Rothman TP, Chalazonitis A, Tennyson VM, Gershon MD:
Neural crest-derived cells isolated from the gut by immunoselection develop neuronal and glial phenotypes when cultured on laminin.
Dev Biol1993,156:341–361.
Rothman TP, Le Douarin NM, Fontaine-Perus JC, Gershon MD:
Developmental potential of neural crest-derived cells migrating from segments of developing quail bowel back-grafted into younger chick host embryos.
Development1990,109:411–423.
Rothman TP, Le Douarin NM, Fontaine-Perus JC, Gershon MD:
Colonization of the bowel by neural crest-derived cells remigrating from foregut backtransplanted to vagal or sacral regions of host embryos.
Dev Dyn1993,196:217–233.
•• Morrison SJ, White PM, Zock C, Anderson DJ:
Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells.
Cell1999,96:737–749.
Stemple DL, Anderson DJ:
Isolation of a stem cell for neurons and glia from the mammalian neural crest.
Cell1992,71:973–985.
Taraviras S, Marcos-Gutierrez, Durbee P, Jani H, Grigorlou M, Sukumaran M, Wang L-C, Hynes M, Raisman G, Pachnis V:
Signalling by the RET tyrosine kinase receptor and its role in the development of the mammalian enteric nervous system.
Development1999,in press.
|
Origin of the ENS
Несмотря на высокую сложность и ее сходство с ЦНС ENS она происходит из нейрального гребня (neural crest (NC)), источника и всех других ветвей ПНС [5]. Проспективные энтерические NC клетки мигрируют из двух основных областей нервной трубки: vagal области, которая соответствует сомитам 1–7, и копчиковой (sacral) области ниже сомита 28. Производные vagal ENS — которые дают большинство нейронов и гшлии энтерических ганглиев — вступают в мезенхиму передней кишки и мигрирруют в передне-заднем направлении, колонизируя кишку по всей длине [6]. Клональные и генетические исследования эмбрионов мыши показали, что энтерический компонент vagal NC генерирует два отдельных клона: первый, симпатоэнтерический клон, который происходит из нервной трубки на уровне сомитов 1–5 и вносит вклад в формирование энтерических ганглиев (по всей длине кишечника) и верхних шейных ганглиев симпатической цепи; и второй, симпатоадренальный клон, дающий потомство, которое колонизирует сначала энтерические ганглии передней кишки (пищевода и желудка) [7] ( Fig. 1).
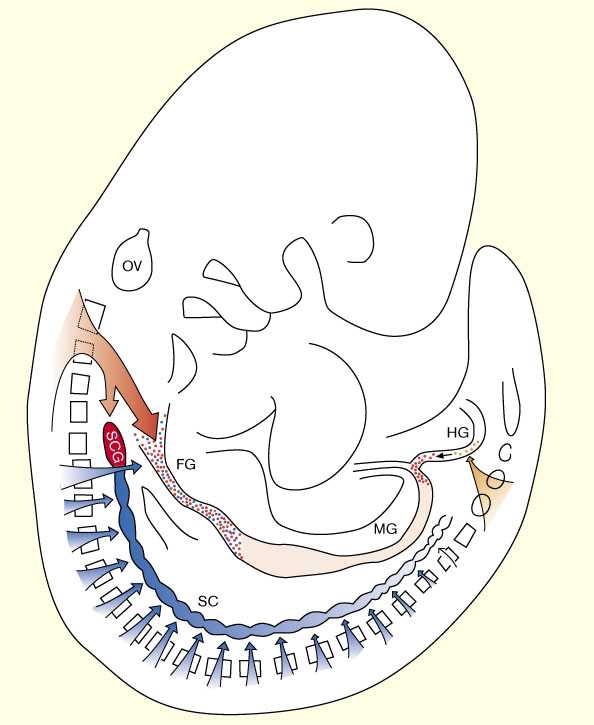 | | Рис. 1 Схематическое представление вклада vagal и sacral NC в формирование ENS. c-Ret-зависимый симпатоэнтерический (SE) клон (показан красным), происходит из vagal NC заднего мозга (соответствует уровню сомитов 1–5) и мигрирует вентрально, занимая весь кишечник и верхние шейные ганглии (SCG, первые ганглии симпатической цепи). c-Ret-независимый симпатоадренальный (SA) клон (показан голубым), происходит из туловищной части нервного гребня и занимает переднюю кишку (он исходит из НГ на уровне сомитов 6 и 7) а также ганглии симпатической цепи ниже SCG (голубые). Передняя кишка обеспечивается производными как SE так и SA. sacral нервный гребень (оранжевый) происходит из спиннгого мозга ниже уровня сомита 28 и колонизирует в основном заднюбю кишку . FG, пердняя кишкаt; HG, задняя кишка; MG, средняя; OV, слуховой пузырек ; SC, симпатическая цепь; SCG, верхний шейный ганглий (Modified from [7].) |
Помимо vagal области клетки НГ эмигрируют из sacral части нервной трубки (ниже сомита 28), мигрируют в кишечник и участвуют в формировании postumbilical ENS [6] [8] [9] [10]. У эмбрионов кур первноачально (E4.5)клетки sacral НГ мигрируют в хвост в ростральном направлении и формируют ганглии Remak вдоль дорсального аспекта (и вне) задней кишки вплоть до отверстий желчного и панкреатического протоков. Позднее (E7.5), первые клетки sacral NC вступают в заднюю кишку и в течение последующих 2–3 дней их число увеличивается существенно, достигая максимума между E10–12. Значительное большинство клеток sacral-derived НГ ограничено толстой и прямой кишкой, и лишь немного клеток присутствуют в слепой (ceca) и postumbilical тонкой кишке [11•] ( Fig. 1).
ENTERIC NERVOUS SYSTEM RET SIGNALLING PATHWAY ЭНТЕРИЧЕСКАЯ НЕРВНАЯ СИСТЕМА: Путь Передачи Сигналов RET
Несколько молекул было идентифицировано, которые контролируют или прямо или косвенно морфогенез и дифференцировку ENS. Среди них RET receptor tyrosine kinase (RTK) и его функциональные лиганды glial cell line derived neurotrophic factor (GDNF) нейртурин. GDNF и nuerturin принадлежат к небольшому семейству близко родственных нейротрофных факторов, куда входят также персефин и артемин [12] [13] [14] [15]. Взаимодействие между GDNF или нейртурином и RET обеспечивается с помощью GFRα-1 или GFRα-2, соответственно — GPI-сцепленными внеклеточными белками [16] [17].Описаны некоторые мутации с потерей функции c-RET у пациентов с болезнью Hirschsprung's (врожденный мегаколон или врожденный аганглионоз), при которой отсутствуют энтерические ганглии в толстом кишечнике на участках разной длины [18]. Мыши, гомозиготные по нулевой мутации c-Ret, Gfrα-1 и Gdnf имели почти идентичные фенотипы, характеризующиеся неспособностью формировать ENS в задних частях передней кишки (пищевод и cardiac желудка) и агенезом почек [7] [19] [20] [21] [22] [23••] [24••].
Хотя роль GDNF, GFRα-1 и RET в развитии ENS млекопитающих была четко установлена, однако некоторые вопрося, касающиеся механизма действия этих молекул все еще остаются открытыми. Чтобы определить, действуют ли c- Ret мутации клеточно-автономно и идентифицировать их клеточные мишени, Natarajan et al. [25••] получали химерный кишечник путем трансплантации энтерических клеток НГ, выделенных от эмбрионов дикого типа, в аганглиолярную кишку (от RET-дефицитных эмбрионов) в органой культуре. Оказалось, что эффект c- Ret-нулевой мутации в основном клеточно-автономен и что первоначальный тип клеток, в которых обычно необходима функция RET, происходит из НГ, предшественника ENS. Следовательно, неспособность колонизации кишечника плода клетками НГ у RET-дефицитных эмбрионов не является результатом вторичных эффектов мутации на мезенхиму кишки и что аганглиолярная стенка кишки способна поддерживать миграцию и пролиферацию производных НГ дикого типа [25••].
Функциональные лиганды RET, GDNF и neurturin, способствуют выживанию in vitro, пролиферации и дифференцировке мультипотентных ENS предшественников в кишке относительно молодых плодов [25••] [26] [27] [28•] [29••]. Однако, Эффекты этих факторов роста стадио-специфичны, так как сходные культуры от плодов поздних стадий обнаруживают заметное снижение реакции на GDNF и neurturin, но могут эффективно выживать в присуствии других нейротрофных факторов, таких как NT-3 ( [28•]; S Taraviras et al., unpublished data). Анализ ENS предшественников у RET-дефицитныъ мутантных эмбрионов показал, что они неспособны выживать и подвергаются апоптозу до или во время их инвазии мезенхимы передней кишки.
Исследования in vitro четко подтверждают роль RET синального пути в ENS нейрогенезе. Подтверждение этого предположения получено у нулевых мутантов по гену, кодирующему GFRα-2 и neurturin — молекул, способных к формированию RET-активируемых комплексов —, у которых возникают аномалии ENS. Таким образом, мыши с отсутствием этих молекул обнаруживают редукцию myenteric сплетения и нарушения желудочно-кишечной подвижности. Эти дефекты указывают на то, что neurturin является важным трофическим фактором для постмитотических энтерических нейронов и что он необходим для поддержания энтерических ганглиев [30••] [31••]. По-видимому, GDNF является критическим для выживания, прлиферации и дифференцировки во время ранних стадий формирования ENS и что нейртурин выступает как фактлор выживания во время поздних стадий. Известно, что очищенный энтерический НГ и энтерические нейроны отвечают сходным образом на GDNF и neurturin в культуре, очевидно, что неперекрывающаяся роль этих нейротрофных факторов является просто следствием их стадио-специфической экспрессии в кишечнике млекопитающих. Некоторые исследователи описывают экспрессию GDNF и neurturin в развивающемся кишечнике (см. [32]. Альтернативное объяснение этих находок заключается в том, что в противоположность in vitro результатам, GDNF и neurturin способны вызывать качественно различные реакции с помощью RET рецепторов in vivo. Эта гипотеза согласуется со сложностью внутриклеточных сигнальных путей, которые могут быть активированы двумя изоформами рецепторов RET (S Taraviras, V Pachnis, unpublished data).
SOX10Другая молекула, критическая для развития ENS у млекопитающих - это SOX10, член семейства Sry-родственных генов, содержащего транскрипционные регуляторы [33]. Роль Sox10 выявлена с помощью позиционного клонирования Dominant megacolon (Dom) локуса у мышей. Животные, гетрозиготные по мутациии Dom mutation ( Dom/+) обнаруживают региональные нехватки NC-производных энтерических ганглиев в толстой кишке, тогда как животные, гомозиготные по этой мутации ( Dom/Dom)погибают во время эмбриогенеза и имеют тяжелые дефекты всех производных НГ в ПНС, включая кишечный аганглионоз [34] [35••] [36••]. Более того, пациенты с врожденным мегаколоном несут различные мутации, которые скорее всего нарушают функцию SOX10 [37] [38••]. Sox10 экспрессирутся во всех мигрирующих клетках НГ, вносящих вклад в формирование ПНС, включая и предшественников ENS до и во время инвации в мезенхиму кишки [35••] [39]. Однако механизм действия SOX10 пока неясен.
Endothelin-3 (ET-3)и рецептора эндотелина B (EDNRB) сигнальный путь
Эндотелины-1, -2 и -3 (ET1-3) входят в состав небольшого семейства из 21 аминокислотных пептидов, которые активируют G-protein-coupled heptahelical рецепторы (см. [40]). Хотя физиологические функции эндотелинов интенсивно изучаются многие годы, однако их роль еще до конца не понята. Показано, что ряд естественно появившихся и полученных таргеттингом мутации затрагивают структуру или экспрессию генов, кодирующих ET-3 или их рецепторы (EDNRB), обусловливают врожденный мегаколон как у человека, так и у мышей [41] [42] [43] [44].
Зрелые эндотелины получаются из больших молекул-предшественников, называемых препроэндотелины, которые расщепляются энзиматически и продуцируют биологически неактивные промежуточные продукты длиной в 38–41 аминокислоту, называемые "большими эндотелинами" ('big endothelins'). Большие эндтелины постепенно расщепляются с помощью endothelin converting enzyme 1 (ECE-1) до биологически активных эндотелинов длиной в 21 аминокислоту. Биологическое значение биохимичекого пути генерации активных эндотелинов выяснено у мышей, дефицитных по ECE-1 [45•]. Эти мыши имеют черепнолицевые и сердечные аномалии (обусловленые отсутствием продукции биологически активного ET-1) и неспособны генерировать эпидермальные меланоциты и энтерические нейроны и тем самым репродуцирующие фенотип, характерные и для ET-3- и EDNRB-дефицитных животных. Эти находки показывают, что ECE-1 является протеазой, ответственной за формирование in vivo активных ET-1 и ET-3, и что межклеточные пути передачи сигналов с помощью ET-1/ECE-1/EDNRA оси и ET-3/ECE-1/EDNRB оси оба участвуют в развитии отдельных субнаборов NC клеточных клонов [45•].
Эффекты ET-3 на клетки НГ и их производные зависят от стадии дифференцировки этих клеток. Таким образом, добавление ET-3 в культуры NC, полученные из только что эмигрировавших из нервной трубки клеток, вызывает драматическое увеличение скорости пролиферации и генерацию большого числа меланоцитов [46]. Однако эффекты ET-3 на энтерические клетки НГ, выделенные из кишки эмбрионов позвоночных совсем другие. В этом случае активация сигнального пути ET-3/EDNRB, по-видимому, ингибирует дифференцировку клеток НГ в постмитотические нейроны и тем самым поддерживает их в пролиферативном недифференцированном состоянии [29••] [47•]. Этот эффект не зависит от клеточного цикла. Кроме того ET-3 влияет на созревание и дифференцировку мезенхимных клеток кишки. Таким образом, ET-3 способствует in vitro развитию энтерических гладкомышечных клеток и соответственно ингибирует экспрессию ламинина α1 с помощью этих клеток [47•]. Возможно, что и in vivo, ET-3 (который продуцируется исключительно клетками кишки, не происходящими из НГ ) также направлен на множественные клеточные мишени, такие как мезенхимные гладкомышечные клетки кишечника плода и энтерический нервный гребень, который экспрессирует EDNRB.
Онтогенетический потенциал энтерического НГ Нейральные стволовые клетки являются самовозобновляющимися мультипотенциальными предшественниками, которые могут генерировать широкий круг нейрональных и глиальных типов клеток внутри данного органа. In vitro исследования, в которых были выделены предшественники энтерической НС из кишки E14 эмбрионов крыс и помещены в клональные клеточные плотности было подтверждено, что вскоре после инвазии мезенхимы кишки, онтогенетический потенциал большой фракции энтерических клеток НГ ограничивается и что они необратимо детерминируются в направлении специфических путей дифференцировки [27]. Др. исследования, однако, указывают на то, что энтерические клетки НГ остаются в мультипотентном состоянии в течение обозримого периода после момента инвазии кишечника плодов млекопитающих. Так, производные НГ клетки, изолированные из кишечника эмбрионов крыс были способны давать потомство, экспрессирующее нейрональные или глиальные фенотипы в массовой культуре. [48]. Более того обратная трансплантация сегментов кишки в миграторные пути НГ у молодых эмбронов показали, что энтерические клетки НГ сохраняют свою способность мигрировать в удаленные сайты и экспрессировать нейрональные и глиальные маркеры [49] [50]. Энтерические Нг клетки вносили в кишку плода, поддерживаемую в органной культуре. Производные НГ клетки, взятые из кишечника эмбрионов мыши на ст. E11.5 самообновлялись и сохраняли множественый потенциал, генерируя потомство, экспрессирующее нейрональные и глиальные маркеры [25••]. Сходные самообновляющиеся мультипотентные предшественники идентифицированы в производных НГ клетках, выделенных из периферических нервов плодов крыс [51••]. Идентификация и изучение мультипотентных НГ стволовых клеток позволит ответить на некоторые вопросы детерминации и дифференцировки.
Conclusions
In vitro и in vivoидентифицированы некоторые внеклеточные и внутриклеточные молекулы, которые имеют (или скорее могут иметь) значение для разных аспектов гистогенеза энтерической НС. Описаны фенотипы многих мутаций генов млекопитающих и эффекты различных сигнальных путей in vitro. Имеющаяся информация позволяет очертить только в общем молекулярные и клеточные взаимодействия, управляющие формированием энтерических ганглиев ( Fig. 2). Согласно такой модели, большая часть предшествеников энтерической НС генерируется стволовыми клетками НГ (NCSCs) [52], которые эмигрируют из заднего мозга и передних частей спинного мозга и мигрируют вентрально к шейным веточкам лорсальной аорты и передней кишке ( Fig. 1 [7]). Во время этой пре-энтерической фазы миграции NCSCs, предназначенные для колонизации кишки экспрессируют SOX10, но негаивны в отношении RET RTK (SOX10 +/ RET -). Перед вступлением в переднюю кишку и под влиянием локальных сигналов НГ-производные предшественники энтерической НС (NCEPs) индуцируют экспрессию RET (SOX10 +/ RET +). Микроусловия в стенке кишки и влияние GDNF — и возможно других членов GDNF-related семейства нейротрофных факторов — SOX10 +/ RET + NCEP клетки поддерживают свою мультипотентну способность, пролиферируют и колонизируют весь кишечник. 'Assisting' the GDNF (neurturin)/RET сигнаьного пути являются другими диффундирующими молекулами, такими как ET-3 и ее рецептор EDNRB, активация которых предупреждает терминальную дифференцировку NCEP клеток и позволяет пролиферативным сигналам вызывать максимальный эффект. Параллельно с пролиферацией большинство клеток, фракция NCEP клеток, дифференцируется и дает зрелые (постмитотические) нейроны и позднее, клетки глии. Возможно, что подавление экспрессии c-Ret является пререквизитом для дифференцировки глиальных клеток
 | | Рис.2 Схематическое представление неоторых молекулярных и клеточных взаимодействий, которые важны для развития энтерической НС млекопитающих. NCSC, стволовые клетки НГ; NCEP, производные НГ предшественники энтерической НС (Modified from [25••].) |
Когда количество NCEP клеток в кишке увеличивается и значительное их число дифференцирующихся клеток накапливается (под комбинированным влиянием GDNF и ET-3), скорость увеличения числа клеток и дифференцировка снижаются, чтобы соответствующие количества типов зрелых клеток аггрегировали и формировали функциональыне энтерические ганглии. Это скорее всего связано со снижением эффективной концентрации нейротрофных факторов, продуцируемых стенкой кишки (таких как GDNF) и снижением чувствительности NCEP клеток к активации cognate signalling receptors (таих как RET). Однако, возможно, что небольшое число NCEP клеток выживает в кишке в течение все жизниживотного и что при соответствующих условиях таие клетки способны дифференцироваться в дополнительные нейрональные и глиальные клетки. RET-экспрессирующая субпопуляция энтерических нейронов, по-видимому, нуждается в нейртурине (neurturin) для своео выживания и нормальной функции. Пока неясно, участвую ли описанные выше молекулы и взаимодействия в пролиферации и дифференцировке НГ-производных предшественников кресцовой энтерической НС.
|

