История проблемы
Г.Шпеман и его сотрудница Х.Мангольд открыли у зародышей амфибий так называемый "организатор". Они выяснили, что если дорсальную губу бластопора на ранней гаструле пересадить на брюшную сторону другого зародыша, то в этом месте в яйце разовьется вторая зародышевая ось (Spemann and Mangold,1924). Недавние исследования истории этого вопроса (Sander,1993) выявили, что решающий эксперимент был проведен в 1921 году Хильдой Мангольд, когда она пересадила кусочек дорсальной губы округлого бластопора зародыша тритона на брюшную сторону другого зародыша на той же самой стадии. В результате на месте трансплантата сформировался второй комплекс осевых органов, включая структуры головы, иначе говоря, на месте трансплантата в яйце образовался второй зародыш. В другом опыте, когда трансплантат был взят из слабопигментированного зародыша Triturus cristatus и перенесен на зародыш T.vulgaris, характеризующийся обильной пигментацией, выяснилось, что вторая эмбриональная ось только частично происходила из трансплантанта, но в основном состояла из пигментированных клеток реципиента.
Участие дорсальной губы бластопора в программе развития нового зародыша можно свести к трем наиболее значительным результатам:
- формирование осевых структур и установление плана билатеральной симметрии;
- переопределение судьбы части клеток хозяина и включение их в структуры трансплантата;
- индуцирование нейральной системы.
Еще сам Г. Шпеман заметил некоторые региональные различия в индуцированных структурах нервной пластинки, когда некоторые из них оказывались более краниальными производными ЦНС, а другие, наоборот, более каудальными. Он вскоре показал, что фрагмент дорсальной губы, взятый со стадии ранней гаструлы, индуцировал передние нейральные структуры, тогда как та же самая область со стадии поздней гаструлы приводила к образованию каудальных нервных структур. Поэтому Г. Шпеман стал различать соответственно "головной" и "туловищный" организаторы ( Spemann,1938; Hamburger,1988).
После того как группа Г. Шпемана (Bautzmann et al.,1932) показала, что убитые ткани могут действовать как индукторы и что индуцирующие сигналы могут осуществляться в бесклеточной среде, был сделан вывод о химической природе индукторов. (см. обзоры: Саксен, Тойвонен,1963; Saxen,1997).
Параллельно с первым циклом химических работ были начаты работы по изучению специфичности индуцирующих агентов. Оказалось, что разные ткани взрослых животных различных видов обладают неодинаковым индуцирующим действием, вызывая образование различных региональных участков нервной системы. Все последующие усилия в 1940-1960 годы привели к формированию "гипотезы двойного градиента", согласно которой имеются два основных индуктора -"нейральный" и "мезодермальный", которые находясь в различных соотношениях, формируют весь спектр производных ЦНС ( Саксен, Тойвонен,1963). Эта точка зрения о существовании двух основных индукторов и о возможности получения самых различных направлений тканевой и клеточной дифференциации при смешении индукторов в разных соотношениях сохраняет сторонников до сих пор (Saxen,1997). Модификацией двуградиентной гипотезы с целью учесть больший круг экспериментальных данных можно рассматривать модель "трех сигналов", разработанную Дж.Слэком ( Слэк,1990; Slack,1991; Christian, Moon,1993а). Как дополнение в эту модель вошло открытие Ньюкоопа (Nieuwkoop,1969), согласно которому на стадии ранней бластулы из вентральной части яйца в сторону анимального полюса исходят индуцирующие сигналы, значение которых инициировать развитие мезодермы или организатора. Позднее эту область будущей вентральной губы бластопора стали называть центром Ньюкоопа.
Пионерской для этого этапа исследований можно считать работу Э. Льюиса (Lewis,1978) по картированию гомеозисных генов комплекса bithorax у дрозофилы. Оказалось, что эти гены располагались в одной хромосоме в едином кластере и в том же порядке они последовательно экспрессировались в раннем эмбриогенезе вдоль формирующейся оси тела в передне-заднем (ПЗ) направлении (Lewis,1978; Scott et al.,1983).
В начале 80-х годов молекулярные методы анализа ДНК резко прогрессировали. Это позволило ряду лабораторий приступить к расшифровке молекулярного строения некоторых гомеозисных генов дрозофилы. Удалось выяснить, что в кДНК каждого из этих генов содержится, кроме уникальных последовательностей, одна и та же довольно сходная последовательность. Это не было неожиданным, поскольку Э.Льюис предполагал, что гомеозисные гены возникли путем тандемной дупликации и в их составе должны встречаться сходные участки. Тем более удивительно, что значение этой последовательности, названной гомеобоксом, было сразу правильно оценено (McGinnis et al.,1984; Корж,1987; Корочкин,1987; Gehring,1997). Исследования, проведенные в аспекте эволюционных проблем, вскоре выявили наличие генов,содержащих гомеобокс и у других животных (Carrasco et al.,1984).
Гомеобокс, входящий в состав всех гомеозисных генов как у дрозофилы (комплекс НОМ-С), так и у других животных, состоит из довольно идентичной последовательности нуклеотидов, содержащей 180 пар. Он локализован в протеинкодирующей части соответствующих генов, кодируя гомеодомен из 60 аминокислот. Гомеодомен формирует характерную пространственную структуру helix-turn-helix, которая, по-видимому способна связываться с соответствующими участками ДНК в регуляторной области генов-мишеней, тем самым активируя или репрессируя их транскрипционную деятельность (Gehring,1997; Lewis,1998). Интересно, что гомеозисный комплекс НОМ-С с генами содержащими гомеобокс экспрессируется вдоль ПЗ оси в том самом порядке, в каком гены расположены на хромосоме в направлении от 3' к 5'. Позднее это соответствие между порядком генов в кластере на хромосоме и порядком их функциональной активности, установленное Льюисом (Lewis,1978) на дрозофиле, было названо колинеарностью. По-видимому, этот комплекс отвечает за организацию главной оси тела, обеспечивая спецификацию различных частей тела вдоль ПЗ оси.
Самым удивительным открытием нашего времени оказалось, что практически все Metazoa содержат в хромосомах такой же кластер с набором таких же, или точнее гомологичных, генов, сохраняющих и основную функцию: определять спецификацию различных частей тела вдоль ПЗ оси. Выяснилось, что этот комплекс существует и у позвоночных, с тем лишь отличием, что у высших животных он представлен в 4-х повторностях, располагающихся в 4-х разных хромосомах. Правило колинеарности в полной мере сохраняется и у позвоночных (Duboule and Dolle, 1989; Graham et al.,1989). У всех позвоночных этот кластер генов теперь обозначается как комплекс НОХ. Гены этого комплекса рассматриваются, по классификации Льюиса, как управляющие (master) гены, чьи протеиновые продукты соединяются с цис-регуляторной областью генов-мишеней последовательно направляющих дифференциацию клеток (Lеwis,1998).
Несколько позднее были выполнены исследования с целью скринирования генов, экспрессирующихся непосредственно в дорcальной губе, т.е. в области организатора. Первым был идентифицирован ген, который также содержал в своем составе гомеобокс. Этот новый ген, обнаруженный в области организатора у Xenopus, а затем и у мыши, назвали goosecoid (gsc) (Blumberg et al.,1991; Cho et al.,1991). Для того, чтобы выяснить роль гена gsc в эмбриональном развитии, были произведены микроинъекции его мРНК в вентральные бластомеры 4-х клеточного эмбриона. Оказалось, что у таких зародышей с большой частотой происходило образование второго осевого комплекса. В последующие годы был выявлен еще целый ряд молекулярных факторов (noggin, Xnot1,гены семейства Wnt, Xlim1) (Kessler, Melton,1994; De Robertis,1995; Saxen,1997), которые также после инъекции в эктопические части яйца способны вызвать развитие второго зародыша. В настоящее время выявлено уже около 20 генов, экспрессирующихся в зоне организатора (Lemaire and Kodjabechian,1996) и большинство из них способны индуцировать развитие нового осевого комплекса, после того как их инъецировали в вентральную область зародыша.
Итак, наблюдается довольно сложная и запутанная ситуация с цепочкой генов или их продуктов, запускающих процесс образования нового зародыша из материала клеток, которым предназначена совсем другая судьба в нормальном эмбриогенезе. Возможно, что одинаковый формообразующий эффект воздействия значительного числа генов (и не только из области организатора), способных инициировать развитие второго зародыша при введении их в эктопические части зародыша, можно объяснить тем, что все они являются ступенями многоэтапного каскада событий, которые участвуют в индуцировании развития сначала мезодермы, а затем и нейральной пластинки. Может быть он многократно дублируется или запускается из многих промежуточных состояний необратимо?
2. Судьба организатора в период гаструляции
Как было выяснено еще Г.Шпеманом, индуцирующие свойства дорзальной губы бластопора амфибий изменяются по мере хода гаструляции. Если на стадии ранней гаструлы эктопическая пересадка дорзальной губы индуцирует прежде всего развитие структур головы, то на поздней гаструле ею же вызывается развитие туловищных и хвостовых структур. Это доведенное до схемы обобщение следует все же уточнить: ранний организатор реально вызывает развитие не только структур головного отдела, но и более постериорных отделов, т.е.всего зародыша. Это различие в действиях раннего и позднего организаторов в области дорсальной губы Де Робертис (De Robertis,1995) объясняет тем, что первый имеет максимальную активность.
Все эти индукционные влияния происходят на фоне морфогенетических перемещений, которые описаны подробным образом на амфибиях, особенно на Xenopus (рис.1).
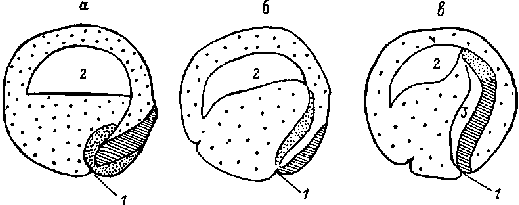
Рис. 1. Схема гаструляции у Xenopus laevis (по: Nieuwkoop and Faber,1967).
(а) Стадия 10. Начало гаструляции или ранняя дорзальная губа бластопора.
(б) Стадия 11. Организатор Шпемана вворачивается внутрь яйца,а в дор- зальной губе располагается предшественник хордомезодермы.
(в) Стадия 11,5. Инволюция мезодермы завершается. Материал ранней дор- зальной губы располагается в прехордальной зоне.
1 - дорзальная губа бластопора, 2 - бластоцель, 3 - архентерон. Густой пунктуацией отмечен организатор развития головных структур (собственно организатор Шпемана), штриховыми линиями - организатор туловищно-хвостовых структур.
Клетки, находящиеся в зоне губы бластопора на стадии ранней гаструлы и проявляющие свои организующие способности прежде всего в формировании головных отделов, первыми вворачиваются внутрь яйца и являются ведущим краем продвижения всей остальной массы инвагинирующего слоя клеток (Gerhart, Keller,1986). Рано инвагинирующие клетки становятся прехордальной мезодермой или прехордальной пластинкой. Все, что инвагинирует в процессе гаструляции вслед за ними становится хордомезодермой, из которой позднее формируются хорда и сомиты, т.е. структуры туловищного и хвостового отделов. С позиций этих данных вполне очевидно, что в начале и в конце гаструляции в дорсальной губе бластопора находятся совершенно разные клетки и после перемещения в составе единого пласта они оказываются в разных частях формирующегося зародыша. Тот факт, что при эктопических пересадках дорсальной губы клетки раннего и позднего организаторов вызывают преимущественно развитие либо головных, либо туловищно-хвостовых структур, может говорить о предопределенности их судьбы уже в составе дорсальной губы, а вероятнее, что еще до ее морфогенеза, задолго до того как они займут свое основное место в составе осевых органов зародыша. Это подтверждается регионализированной генной экспрессией в предшественницах бластопорной ткани в догаструляционный период. Соответственно в переднем (вегетативном) и заднем (анимальном) регионах были выявлены домены экспрессии Gsc (позднее найденный в прехордальной пластинке) и Xnot (позднее экспрессируемый в хорде) (Harland, Gerhart,1997). Следовательно, сегрегация паттернирующей активности для обоих организаторов может существовать еще до начала морфогенеза губы бластопора. К сходному заключению пришли Камус и Там (Сamus and Tam,1999).
Структуры, функционально эквивалентные организатору амфибий, были выявлены у других позвоночных на основе способности производить вторичные оси после гетеротопической пересадки этих структур на ранней гаструле. У рыб это стадия зародышевого узелка или щита (Shih, Freser,1996). У птиц и млекопитающих свойства организатора проявляет узелок (у птиц он называется узелком Гензена), расположенный на переднем конце первичной полоски (Beddington,1994; Psychoyes and Stern,1996).
Описываемые перемещения клеток организатора подтверждены наблюдениями за молекулами-маркерами, специфическими для области раннего организатора. Как указывалось выше, еще в 1991 г был выделен первый маркерный ген в организаторе gsc, который появляется еще в прегаструле, но в зоне предназначенной стать организатором. Затем его экспрессия обнаруживается в ранней дорзальной губе. С началом инволюции экспрессия gsc здесь постепенно затухает. Продолжается экспрессия этого гена только в клетках, которые покидают дорсальную губу, как у амфибий (Steinbeisser and De Robertis,1993), либо узелок Гензена, как у птиц (Izpisua-Belmonte et al.,1993). Клетки из глубоких слоев дорсальной губы, экспрессирующие gsc, мигрируют посредством ползающих (crawling) движений вдоль крыши архентерона и оказываются в составе прехордальной пластинки (Niehrs et al.,1993). По-видимому, благодаря экспрессии gsc клетки дорсальной губы получают импульс, вынуждающий их к миграции в будущую прехордальную зону. Выяснилось, что если ввести в вентральные клетки gsc mRNA, то это вынуждает их мигрировать в передние отделы зародыша и заселять пространство впереди хорды (Steinbeisser, De Robertis,1993). В конце концов, клетки, экспрессирующие gsc, оказываются в составе головной мезодермы, а точнее, в прехордальной ее части, структуре, подстилающей передний мозг.
Точно так же была прослежена экспрессия гена Xotx2: сначала она проявляется в зоне глубоких клеток ранней дорсальной губы , которые затем ползут вдоль крыши архентерона и далее оказываются в прехордальной мезодерме (Pannese et al.,1995). Такой же путь клеток из области организатора Шпемана в прехордальную мезодерму прослеживается в процессе гаструляции, когда наблюдали экспрессию генов Xlim-1 (Taira et al.,1992) и frizzled-8 (xfz8) (Deardorff et al.,1998).
Опыты с маркерами дополнили упомянутые выше наблюдения Герхарта и Келлера (Gerhart and Keller,1986) о миграции клеток организатора в период гаструляции в прехордальную зону и помогли установить, что клетки прехордальной пластинки возникают в глубоких слоях ранней дорсальной губы (Keller et al.,1992). В головном отделе нейрулы эта пластинка составляет относительно маленькую зону (Steinbeisser and De Robertis,1993; Izpisua-Belmonte et al.,1993). Наконец, пересадка прехордальной пластинки со стадии поздней гаструлы в зародыши на ранней гаструле может индуцировать развитие эктопического головного отдела, наподобие того как это происходит при эктопической пересадке ранней дорсальной губы (Gilbert,1994; Lemaire and Kodjabachian,1996). По сути это означает, что дорсальная губа на ранней гаструле и прехордальная мезодерма на поздней гаструле являются одной и той же популяцией клеток и что за время гаструляции организатор Шпемана переместился из губы бластопора в прехордальную зону (рис.1).
Аналогичным образом узелок Гензена у птиц, также теряет способность индуцировать развитие головных отделов нервной системы из клеток эпибласта аrea opaca, начиная со стадии дефинитивной первичной полоски (стадия НН4+ по: Hamburger, Hamilton,1951). Стадия 4+ маркируется появлением в составе прехордальной пластинки группы клеток, ранее мигрировавших из зоны узелка (Lemaire et al.,1997; Foley et al.,1997).
Недавно были получены новые факты, касающиеся раздельного существования головного и туловищного организаторов у зародышей млекопитающих. Я уже упомянул, что узелок на переднем конце первичной полоски у млекопитающих проявляет свойства организатора Шпемана. В то же время эти оси постоянно оказываются усеченными в области головного отдела, например, не развивается передний мозг (Beddington,1994; Tam et al.,1997). Теперь представлены данные о том, что головной и туловищный организаторы млекопитающихся разобщены и, по-видимому, располагаются даже в различных зародышевых слоях: первый - в передней висцеральной энтодерме (ПВЭ) и второй в клетках эпибласта (Beddington, Robertson,1999; Camus, Tam,1999). Оказалось, что ПВЭ проявляет свои организующие свойства в формировании головных структур еще за сутки до того, как формируется узелок (7.5 суток post coitum) , который у млекопитающихся рассматривается как двойник губы бластопора в зародышах амфибий (Beddington,1998). В другой работе (Knoetgen et al.,1999) удаляли ПВЭ из зародыша кролика на стадии, когда еще не образуются первичная полоска и узелок, пересаживали ее в область внешнего края area pellucida зародыша курицы на стадии HH3 и культивировали до стадии прехордальной пластинки (HH5). ПВЭ кролика была способна индуцировать экспрессию GANF - маркера головных нейральных валиков. Таким образом, эти данные демонстрируют факт разобщения головного и туловищного организаторов у зародышей млекопитающих как пространственно, так и по времени развития, что может подтверждать доказательства, представленные выше, согласно которым в других классах позвоночных оба эти организатора также исходно предетерминированы в разных клеточных субпопуляциях.
Помимо метода трансплантаций общие элементы гаструляции в разных классах позвоночных выявляются путем анализа молекулярных маркеров, как уже упомянутых, так и других. Например, ген Brachiury (T) является маркером для всей мезодермы и ее локализацию на ранних стадиях можно определить по экспрессии Т. У Xenopus и Danio rerio (zebrafish) будущую мезодерму можно видеть как кольцо вокруг сферического эмбриона: это так называемая маргинальная зона. Гомологом этого кольца у мышей является первичная полоска (De Robertis et al., 1994). Выяснилось также, что gsc, который является маркером дорсальной губы бластопора амфибий, также обнаруживается в гомологичных структурах указанных других групп позвоночных, являясь дополнительным доказательством гомологичности всех этих структур (Lemaire et al.,1997). Максимальная экспрессия gsc достигается у Xenopus как раз перед образованием дорсальной губы в начале гаструляции (стадия 10): зона экспрессии находится еще над дорсальной губой там, где локализуется организатор Шпемана (Gerhart et al.,1989). У цыпленка максимальная экспрессия gsc наблюдалась перед тем как первичная полоска достигнет наибольшего растяжения (ст.3+), у zebrafish - при 50% эпиболии (Stachel et al,1993) и у мыши - на стадии 6.7 сут (Blum et al.,1992). Предполагается, что эти стадии являются эквивалентными при гаструляции позвоночных (De Robertis et al.,1994).
3. Организаторские свойства прехордальной пластинки (мезодермы)
Прехордальная пластинка считается мезэндодермальной структурой, расположенной медиально вдоль оси, но непосредственно впереди хорды (Adelmann,1922; Meier,1981; Seifert et al.,1993; Knoetgen et al.,1999). Она выявляется у всех позвоночных и является временной структурой. У низших хордовых, асцидий (подтип Urochordata) и ланцетника Amphioxus (подтип Cephalochordata), прехордальная пластинка, по всей видимости, отсутствует (Pera, Kessel,1997; Baker, Browner-Fraser,1997; Yasui et al.,1998). Позволю себе в последующем тексте обозначать, по примеру других авторов (Gans, Northcutt,1983; Langille, Hall,1989), оба подтипа низших хордовых единым термином Protochordata (протохордовые).
Спрэтт (Spratt,1955) и Розенквист (Rosenquist,1983), работавшие на цыпленке, рассматривали прехордальную пластинку как часть всей мезодермы, возникшей путем инвагинации клеток через узелок Гензена в течение гаструляции. Джакоб и соавторы (Jacob et al.,1984) описали у цыпленка область мезодермы впереди проспективной хорды как продолжение мезодермального головного отростка. Они предложили термин "прехордальная мезодерма" для этой специальной осевой мезодермы. Термин "прехордальная пластинка" также используется для эмбрионов птиц и других позвоночных как в этом контексте, так и для описания медианного утолщения эндодермального эпителия впереди прехордальной мезодермы (Seifert et al.,1993).
Положение прехордальной мезодермы в центральной части головы, где эндо-, экто- и нейроэктодерма находятся в наибольшей близости к ней, предполагает ее стратегическую роль в индукции и паттернировании головных структур. В течение гаструляции прехордальная мезодерма возникает как прямое производное организатора и располагается перед хордой, имея впереди зачаток преоральной передней кишки. У птиц эта субстанция является производной от Гензеновского узелка первоначально как группа мезенхимных клеток (Pera and Kessel,1997). В течение развития раннего переднего мозга мезенхимная популяция клеток, составляющая прехордальную мезодерму, находится впереди хорды и дорсально по отношению к преоральной передней кишке (Meier,1982; Seifert et al.1993).
Следует отметить, что понятие о прехордальной пластинке у разных авторов неодинаково. Например, Пера и Кессель (Pera, Kessel,1997) определяют прехордальную пластинку как структуру, состоящую из прехордальной мезодермы со связанной с ней эндодермой, но не включая лежащей впереди эндодермальной пластинки. Зайферт и соавторы (Seifert et al.,1993), напротив, называют прехордальной эту эндодермальную пластинку, которая входит в состав крыши передней кишки. Книтген и др. ( Knoetgen et al.,1999) nоказывают на гистологических срезах , что клетки прехордальной мезодермы не отделяются от эндодермы и, таким образом, составляют единое образование прехордальной мезэндодермы.
Необходимо подчеркнуть, что клетки организатора, видимо, составляют только часть ПХМ; остальные клетки участвуют в формировании глазных мышц и некоторых костей хордального черепа (Сouly et al.,1992,1993), о чем будет сказано ниже.
Удаление прехордальной пластинки в опытах Пера и Кессель (Pera, Kessel,1997) приводит к значительному сужению передней нейральной трубки, но без укорочения ее, и к циклопии. Однако наиболее существенным, как нам кажется, является то, что дефекты в вентральной части переднего мозга, т.е. в зоне влияния прехордальной мезодермы, приводят к редукции размеров гипоталамуса и к полному отсутствию гипофиза (Kimura et al.,1996). Позже я поясню, почему я считаю этот факт существенным.
У амфибий способность индуцировать ростральные части и, по-видимому, всю нервную систему полностью проявляет только ранняя губа бластопора (De Robertis, 1995). В результате движений тканей в течение гаструляции клетки из ранней губы бластопора инвагинируют в архентерон и впоследствии становятся ПХМ. Как уже говорилось, последняя сохраняет свойства ранней дорсальной губы, так как на этой стадии способна индуцировать ростральные отделы ЦНС. Имеются прямые указания на то, что пересадки ПХМ зародышей на поздней гаструле в зародыши на ранней гаструле могут вызвать развитие эктопической головы (Gilbert,1994; Lemaire and Kodjabachian,1996). Идея о взаимосвязи или единстве ранней губы бластопора и ПХМ усиливается тем фактом, что многие гены экспрессируются в обеих структурах. Среди этих генов встречены секретируемые факторы (follistatin, noggin, chordin),а также некоторые гомеобоксные гены (gsc, Lim1, Otx2) (Blitz, Cho,1995; De Robertis,1995; Shawlot, Behringer,1995; Pera, Kessel,1997).
Недавно было выявлено, что сходные процессы происходят в гомологичных структурах птиц (Storey et al,1992; Foley et al.,1997). Последние авторы исходили из того, что узелок Гензена, гомолог организатора Шпемана у птиц, теряет способность индуцировать ростральные части нервной системы уже на стадии HH4 -4+ , т.е. спустя всего несколько часов после его появления (Dias, Schoenwolf,1990; Kintner, Dodd,1991). В этот же период от узелка Гензена отделяется прехордальная мезэндодерма (Нamburger, Hamilton,1951). Используя пересадки прехордальной мезэндодермы и получая химерных зародышей в модели курица-перепел, применив также ряд молекулярных маркеров, специфичных для разных отделов нервной системы, Фоли и соавторы (Foley et al.,1997) исследовали вопрос о том, сохраняет ли прехордальная ткань функции раннего Гензеновского узелка. Оказалось, что она способна, будучи пересажена в область презумптивного заднего мозга, заставить его клетки экспрессировать маркеры переднего мозга; например, клетки заднего мозга хозяина под воздействием прехордальной ткани начинают экспрессировать маркеры tailless и Otx2, специфичные для переднего мозга. Сходные результаты получены Дэйл и соавторами (Dale et al.,1997).
В других опытах после пересадки прехордальной мезодермы в область area opaca или area pellucida, где располагается эктодерма, предназначенная стать эпидермисом, выявили формирование структур подобных переднему мозгу, причем морфология подтверждалась выявлением молекулярных маркеров, специфичных для переднего мозга (Pera, Kessel,1997; Knoetgen et al.,1999. ).
Эти данные на птицах дают нам возможность увидеть аналогию в действиях не только между ранней дорсальной губой амфибий и узелком Гензена у птиц в начале гаструляции, но и между прехордальной мезодермой у эмбрионов обоих классов: как у амфибий способность индуцировать главным образом структуры головного отдела по мере гаструляции переходит к прехордальной мезодерме, точно такая же ситуация наблюдается у птиц.
4. Роль организатора в формировании головного отдела
Среди других генов, которые активируются в области организатора, идентифицирован гомеобоксный ген Xlim-1 (Taira et al.,1992). Он относится к классу гомеобоксных генов LIM, которые кодируют белки с двумя доменами LIM, расположенными амино-терминально к гомеодомену. Домен LIM определяется цистеин-богатым мотивом, который связывает железо и цинк и опосредует взаимодействие типа белок-белок (Taira et al.,1994; David et al.,1995; Glasgow et al.,1997 ). Ген Xlim-1 является гомологом гена lin-11,выявленного у Cоenoharbditis elegans. Эктопическая инъекция Xlim-1 в брюшную часть зародышей Xenopus может индуцировать образование вторичной оси (Taira et al.,1994). Гомологом Xlim-1 у мыши является Lim1, который был клонирован Барнес с соавт. (Barnes et al.,1994).
Lim1 экспрессируется в узелке первичной полоски, которая функционально гомологична дорзальной губе амфибий. Для того, чтобы определить имеет ли Lim1 существенное для зародыша значение, в популяции эмбриональных стволовых клеток были получены клетки с замещенной областью ДНК, кодирующей Lim1, клонированы и введены в бластоцисты, чтобы получить химерных мышей, способных к передаче геномов с "выбитыми" аллелями через зародышевую линию. Полученные затем гомозиготные мыши Lim1-/- характеризовались почти полным отсутствием всех головных структур, но туловищный и хвостовой отделы выглядели нормальными (Shawlot, Behringer,1995).
Для того, чтобы выяснить формируются ли у таких мутаций передние отделы головного мозга Шоулот и Беринджер ( Shawlot, Behringer,1995) исследовали экспрессию трех нейральных маркеров: Otx2 (экспрессируется в области переднего и среднего мозга), En (на границе между средним и задним мозгом) и Krox20 (в ромбомерах r3 и r5 заднего мозга). У Lim1-/- только экспрессия Krox20 была выявлена в обоих ромбомерах, причем домен r3 был локализован на самом переднем конце зародыша в редуцированном по размерам виде. Из этих экспериментов ясно, что у Lim1-/- отсутствуют передний и средний мозг, но сохраняется часть заднего мозга на уровне 3-го ромбомера.
В процессе развития у зародышей мышей с мутацией Lim1-/-, по сравнению с диким типом, на стадии нервной пластинки (7,5 сут pc) не были развиты узелок-организатор, головной отросток или ПХМ. Однако была обнаружена экспрессия gsc с неправильной локализацией, а другой ген-маркер области узелка HNF3-? экспрессировался только на стадии 8,5 сут. Этот ген в норме экспрессируется на стадии 7,5 сут в области ПХМ (Ang et al.,1993; Weinstein et al.,1994). Поэтому отсутствие экспрессии на этой стадии позволяет предполагать, что ПХМ тоже отсутствует.
В настоящее время трудно судить отсутствует ли ПХМ совсем или существует, но в редуцированном виде. В пользу последнего говорит факт экспрессии ряда генов (gsc, HNF3-?), хотя они проявляют себя не в том месте и не в то время. В любом случае, однако, очевидно, что ПХМ требуется для развития всего головного мозга, начиная от 3-го ромбомера. Значение же гена Lim1, видимо, состоит в том, что он необходим для образования и функционирования самой ПХМ, играющей роль организатора в формировании головы.
Сходный фенотипический эффект вызывает инактивация гомеобоксного гена Otx2, который тоже экспрессируется в области организатора (Acampora et al.,1995; Ang et al.,1996; Lumsden, Krumlauf,1996). У гомозиготной мутации Otx2-/- полностью отсутствовали все структуры переднего и среднего мозга, а задний мозг, как показало использование маркера Krox20, существовал на уровне r3. В то же время структуры туловища были нормальными ( Matsuo et al.1995). Отмечается также, что у Otx2-/- отсутствовали сердце и передняя кишка. Это интересно в связи с известными данными, что в отсутствии организатора сердце не формируется ( Sater and Jacobson,1990; Yuan and Schoenwolf,1999 ).
Следует отметить, что оба рассмотренных гена (Lim1 и Otx2) экспрессируются не только в организаторе Шпемана, но и в прехордальной мезодерме (Shawlot, Behringer,1996). Как они взаимодействуют между собой в процессе развития ростральной части головы, пока неизвестно.
Из данных материалов можно сделать наиболее вероятный вывод, что блокировка развития организатора прекращает образование всего головного отдела. Тот факт, что это может произойти в результате мутации всего в одном гене, причем без заметного нарушения развития всего остального тела, позволяет предполагать, что происхождение ПХМ было результатом макроэволюционного изменения по типу гетеротопии, которое способно создать условия для резкого ускорения эволюции по такому пути, который предусматривается теорией прерывистого равновесия (Eldredge and Gould,1972).
5. Граница между головой и туловищем у позвоночных
Голова обычно определяется как часть тела, расположенная ростральнее первого постоянного позвонка (Horder et al.,1993). Однако это упрощенное представление не совпадает с фактами, что будет показано ниже.
С позиций эволюционной морфологии, которая ставит позвоночных отдельно от других хордовых, наиболее значительной особенностью позвоночных является мощное развитие головы, включая, конечно, сложные подразделения мозга. Ганс и Норткат (Gans, Northcutt,1983) определили этот процесс как эволюцию "новой головы". Подчеркивая новизну этого образования, авторы полагают, что в известной мере голову позвоночных можно рассматривать как часть, добавленную к существующему телу бесчерепных протохордовых ( Cephalochordata).
Главным новоприобретением позвоночных являются головной мозг и скелет головы, составленный из хрящевых и костных тканей. Основным признаком всех хордовых является хорда, но у позвоночных хорда достигает только уровня базикраниального отверстия черепа, тогда как у бесчерепных протохордовых хорда пронизывает все тело, начинаясь от рострального края (рис.2).
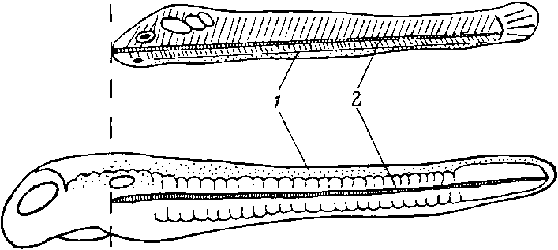
Рис. 2. Сравнение общего плана строения молодой личинки ланцетника (расположена вверху спинной стороной книзу) и зародыша рыбы (внизу). Ланцетник (Branchiostoma) относится к подтипу бесчерепных Cephalochor data, у представителей которых хорда начинается от ростральной части головы и проходит через все тело. У рыб и других позвоночных хорда начи нается на уровне слуховых пузырьков. Весь головной отдел в левой части рисунка от поперечной прерывистой линии является новообразованием позвоночных.
1 - нейральный тяж, 2 - хорда.
Действительно, почти все новоприобретения позвоночных связаны с развитием структур, которые лежат впереди от начального конца хорды (рис.2). Существует мнение о том, что развитие головного мозга, органов чувств, их окружающих и поддерживающих элементов будто бы происходит из эпидермального нервного сплетения (plexus) протохордат (Gans, Northcutt,1983; Holland and Garcia-Fernandez,1996 ).
Современные экспериментальные исследования, посвященные развитию новой головы или цефализации, показали, что в онтогенезе новой головы главную роль играют две структуры - нервный гребень и эпидермальные плакоды. Они участвуют в образовании всех сенсорных инноваций, а также в развитии всех соединительных тканей и костей черепа (Gans, Northcutt,1983; Northcutt, Gans,1983; Hall,1988). Нервный гребень является популяцией мезенхимных клеток, сформированных из эктодермы, на стыке между нейральной и эпидермальной эктодермами на протяжении всей нервной трубки ( Le Douarin,1982; Hall,1988). Эти клетки мигрируют по всей голове и участвуют в образовании очень многих структур головы. Эпидермальные плакоды, также возникающие из эктодермы, являются утолщениями, располагающимися с обеих сторон нервной трубки, латерально от нервного гребня в трех основных зонах - слуховой, обонятельной и наджаберной (Langille, Hall,1989). Практически почти все структуры, что развиваются в голове позвоночных, являются новыми образованиями, а не модификацией предшествующих структур. К числу таких новообразований относится и гипофиз (Поленов,1971).
Концепция "новой головы" получила блестящее подтверждение в последующих работах исследователей, использовавших межвидовые изотопические пересадки разных частей нейральных валиков или прилегающей к ним околоосевой мезодермы в области проспективной головы на стадиях нейрулы от зародышей перепела к зародышам курицы, или наоборот. Результаты означенных пересадок показали, что по происхождению череп позвоночных делится на две части: одна часть, которая расположена впереди начального кончика хорды ("прехордальный череп"), происходит из нейроэктодермы, а точнее из клеток так называемого нервного гребня в зоне головных отделов мозга прозэнцефалона и мезэнцефалона; вторая часть располагается на уровне переднего участка хорды ("хордальный череп"). Эта часть черепа формируется из костей, которые являются производными прехордальной мезодермы (basipostsphenoid, supraoccipital) или первых сомитов (basi- and exo-occipital, частично слуховая капсула). Кроме того, теменная кость и часть костей слуховой капсулы, входящие в состав хордального черепа, возникают из клеток нервного гребня (Couly et al.,1992,1993; Kontges, Lumsden,1996). Наконец, выяснилось, что граница частей черепа, имеющих разное происхождение, проходит через середину "турецкого седла", причем сама эта кость имеет двойное происхождение, а именно: ростральная часть происходит от клеток нервного гребня, а каудальная состоит из клеток, происходящих из мезодермы. Таким образом, середина турецкого седла является границей разделения двух частей черепа, имеющих разное тканевое происхождение (Couly et al.,1993). Уместно здесь напомнить, что в средней части турецкого седла находится углубление, где размещается гипофиз.
Интересно, что передний конец хорды достигает базипостсфеноидной кости и поэтому лежит примерно на уровне средней части седла (Couly et al.,1993). По сути эти поразительные совпадения вновь и вновь указывают на важность отмечаемой границы, разделяющей головную и туловищно-хвостовую части тела. Как раз на стыке этих частей расположился организатор, который, по-видимому, управляет формированием обеих частей организма. С позиций эволюционного происхождения указанная граница отделяет "новую голову" позвоночных от той части тела, которую они унаследовали от своих протохордовых предков.
Иногда границей разделения головных и туловищных структур считают слуховые или отические органы и соответственно тело разделяют на преотический (головной) и постотический (туловищный) отделы (Kingsbury and Adelmann,1924; Wachtler and Jacob,1986; Horder et al.1993). У зародышей рыб, у которых соотношения, касающиеся взаимного расположения между собой отических пузырьков, переднего кончика хорды и ромбомеров заднего мозга, легко наблюдать на живых дехорионизированных препаратах, так как они являются прозрачными, хорда начинается как раз на уровне отических пузырьков, а сами последние лежат на уровне 4-5 ромбомеров (r4 -r5) заднего мозга (рис.3).
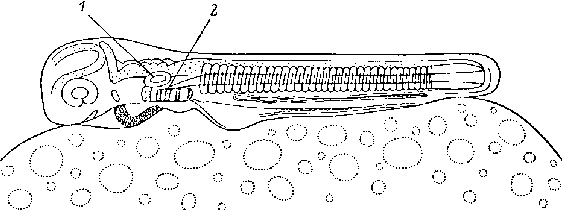
Рис. 3. Зародыш атлантического лосося в период сомитогенеза (стадия 40 пар сомитов). (из: Gorodilov,1996; Городилов,1998).
1 - слуховой пузырек, 2 - ростральный конец хорды.
Для других классов позвоночных нет достаточно четкой информации, связанной с этими соотношениями, так как их зародыши являются непрозрачными и, по-видимому, необходимо применение специальных методов для того, чтобы получить соответствующие данные. Видимо не случайно, что даже число ромбомеров у одних и тех же видов этих классов описывалось как разное. Например, у куриного эмбриона было описано только 5 нейро- или ромбомеров (Hamburger, Hamilton,1951), но позднее, когда были использованы специальные клеточные и молекулярные методы, число идентифицированных ромбомеров достигло 7 ( Lumsden, Keynes,1989).
Учитывая, что, по крайней мере, у рыб, слуховые пузырьки закладываются еще на ранних стадиях как раз на уровне r4 - r5 (рис.3 ), а также то, что ростральный конец хорды располагается на уровне слуховых пузырьков, можно считать, что: 1) понятия «преотический отдел» и «новая голова» практически совпадают; 2) граница действия мутаций генов Lim1-/- и Otx2-/-, при которых отсутствуют все головные структуры, проходит через ромбомер r3/4 , и в этом смысле можно говорить о генах, которые отвечают за формирование всей «новой головы».
Паттернирование развивающейся головы, по-видимому, основано на использовании механизмов, отличающихся от механизмов развития туловищно-хвостовой части тела. В последней наблюдаются перемещения клеток, результатом чего являются сужение и удлинение эмбрионального поля (конвергентное растяжение), в котором начинается закладка осевых органов. Ямaда (Yamada,1994) предложил различать "каудализацию", как явление конвергентного растяжения, имеющего существенное значение для морфогенеза постериорных (туловищных) осевых органов. Интересно, что границей процессов каудализации, по Ямада, является передний конец хорды. Миграции клеток в области головы имеют совсем другой характер (Keller et al.,1992). Оказалось также, что образование первых трех ромбомеров заднего мозга и остальных более каудальных происходит с помощью разных механизмов ( Kulesa and Fraser,1998). В литературе также часто подчеркивается различие в способе развития преотического и постотического отделов тела. Если сегментное строение туловищно-хвостового отдела позвоночных является очевидным, то утверждения о сегментном строении головы (Meyer,1981; Jacobson,1988) до сих пор находятся под сомнением (Wachtler and Jacob,1986; Couly et al.,1992).
6.Участие гомеобоксных и других семейств генов в образовании туловищно-хвостового и головного отделов тела
А. Система гомеобоксных генов Hox
Различие между головным и туловищно-хвостовым отделами проявляется и в том, что раннее развитие этих отделов происходит при участии гомеобоксных генов, относящихся к разным семействам этого типа генов. Наиболее обширный и хорошо изученный комплекс гомеобоксных генов Hox относится к семейству регуляторных генов, экспрессируемых вдоль ПЗ оси и обнаруженный у всех исследованных Metazoa (Duboule, Dolle,1989; Graham et al.,1989; McGinnis, Krumlauf,1992; Burke et al.,1995; Holland, Garcia-Fernandez,1996).
Было выяснено, что у позвоночных этот комплекс существует в 4-х повторах, полученных, по-видимому, за счет двух циклов дупликации из исходного кластера типа НОМ-С (Holland et al.,1996). В 4-х кластерах мыши и человека выявлено 38 генов семейства Hox, разделенных на 13 паралогических групп, хотя не все гены имеют 4-х гомологов. Последовательное сравнение генов НОМ и повторов Нox групп показывает, что часть паралогов в каждом кластере была потеряна. Например, у млекопитающих отсутствует один ген первой группы, а у рыб имеются все 4 паралога этой группы (Holland, Garsia-Fernandes,1996). В то же время гомологи группы Abd-b (паралоги 9-13), по-видимому, размножились ( Manak, Scott,1994).
Гены семейства Нox экспрессируются вдоль ПЗ оси в ЦНС и околоосевой мезодерме, каждый на своем соответствующем уровне. При этом консервативность набора этих генов, сохраняющих узнаваемость по степени гомологичности и по порядку их расположения на хромосоме почти у всех Metazoa от нематод до высших позвоночных, кажется парадоксальной на фоне огромного разнообразия форм носителей этого кластера. Кэррол (Carrol,1995) считает, что гены Нox только демаркируют относительное положение разных структур вдоль оси тела (как бы рисуют схему главного плана строения тела), но не определяют сами эти структуры. Гены Нox функционируют как регуляторные белки, управляя своими продуктами деятельность множества других генов. Например, по оценке Кэррола геном дрозофилы содержит от 85 до 170 генов, деятельность которых регулируется продуктами гена Ultrabithorax (Carroll,1995).
Принцип колинеарности, наблюдавшийся Льюисом на генах комплекса НОМ из генома Drosophila, сохраняет свое значение в комплексе Нox у позвоночных. Было выяснено, что гены, локализованные на 3' конце каждого из комплексов (это гены 1,2 и 3-й паралогических групп) имеют четкую переднюю границу экспрессии в пределах заднего мозга, причем гены 1-й группы имеют переднюю границу домена экспрессии на границе r3/r4 (Wilkinson,1993; Couly et al.,1998). Гены 4-й и 5-й паралогических групп имеют переднюю границу уже на уровне сомитов из числа теx, которые позднее войдут в состав шейного отдела (у птиц и млекопитающих), а гены, расположенные на 5' -конце (11-13-я группы), экспрессируются в сомитах на уровне будущих сакрального или каудального отделов (Gaunt,1994; Burke et al.,1995). Поскольку осевая формула позвоночника (соотношение позвонков разных отделов) у разных видов сильно различается, то границу экспрессии генов Нox ассоциируют не с численным номером сомита, а с морфологией соответствующего ему будущего позвонка. Например, у мыши число шейных позвонков равно 7, а у курицы 14, но на границе между шейным и грудным отделами у обоих видов экспрессируется один и тот же ген Нохс-6. Гены 9-й паралогической группы экспрессируются на уровне перехода от грудных к поясничным будущим позвонкам (Burke et al.,1995).
Коули и соавторы (Сouly et al.,1998) показали, что в области нервного гребня вдоль головного отдела нервной системы можно выделить две области: переднюю, соответствующую мезэнцефалону и части метэнцефалона (r1-r2), в которой гены кластера Нох не экспрессируются, и 2) заднюю, которая соответствует ромбомерам r3-r8 и в которой экспрессируются гены первых паралогических групп комплекса Нох. Было установлено, что при построении нижней челюсти участвуют только клетки нервного гребня (КНГ), в которых гены группы Нох не экспрессируются (Kontgens, Lumsden,1996; Couly et al.,1996,1998). Эти клетки мигрируют в зону формируемой нижней челюсти из задней области мезэнцефалона, а также из r1, r2 и небольшая группа клеток поступает из r3 ( ! - сравните с действием Lim1 -/-, описанным в разделе 4). Оказалось, что при замещении этих клеток более постериорными КНГ, которые способны экспрессировать гены Нох, нижняя челюсть не образуется. Более того, после замещения области r4-r6 фрагментами нейрального валика, состоящими из КНГ, не экспрессирующими гены Нох, у зародышей развивался зачаток второй нижней челюсти. Как известно, последняя является частью «новой головы» и эти результаты еще раз подчеркивают глубокое различие между головной и хордальной частями тела позвоночных.
По мнению Дюбуля (Duboule,1994), следует различать два типа колинеарности - "пространственную" и "временную". В одном случае речь идет о топографической последовательности экспрессии генов, во втором о времени начала их экспрессии. На самом деле лучше говорить о разных аспектах одного и того же процесса последовательной линейной экспрессии, поскольку один обусловливает другой. На наш взгляд, первичным является фактор времени (Городилов,1990; Gorodilov,1992).
Итак, весь комплекс гомеозисных генов семейства Нох экспрессируется последовательно вдоль ПЗ оси, причем передний край экспрессии первой паралогической группы находится на границе r3/r4. Это практически совпадает с той границей влияния генов Lim1 и Otx2, наличие каждого из которых оказывается необходимым для развития всех головных структур, лежащих впереди 3-го ромбомера. Эта же граница разделяет «новую голову» позвоночных - абсолютно новое приобретение животных - и остальное тело, доставшееся в наследство от протохордовых и от беспозвоночных животных (Yamada,1994; Holland et al.,1996). Вопрос о том, имеется ли группа или кластер генов, которые точно также лежали бы в основе развития головы позвоночных, рассматривается ниже.
Б. Система гомеобоксных генов для развития головы позвоночных
Если комплекс генов Нох определяет пространственную экспрессию и соответственно является планом развития только постотической части тела, то в раннем развитии преотической части, т.е. структур головы, играют роль тоже гомеобоксные гены, но не входящие в кластер Нох.
Было выяснено, что у дрозофилы имеются два гена типа "gap" - orthodenticle (otd) и empty spiracles (ems), - играющие роль в сегментации ее головы (Finkelstein et al.,1990; Cohen, Yurgens,1990; Finkelstein, Perrimon,1991). Оба гена кодируют гомеобоксные белки, что предполагает, как и в случае белков НОХ, что они действуют как транскрипционные факторы. Экспрессия их происходит в перекрывающихся доменах на переднем полюсе эмбриона мухи на стадии бластодермы.
Позднее у мыши были обнаружены 4 гена, экспрессирующиеся в головном мозге, которые, как оказалось, являются гомологами Otd и Ems, причем по два гомолога для каждого гена. Они были обозначены Otx1,Otx2, Emx1 и Emx2. Участки экспрессии этих генов в головном мозге содержались внутри друг друга, наподобие русских матрешек, в последовательности, где Emx1
При сравнении паттернов экспрессии генов группы Нох и 4-х генов Otx и Ems обращает на себя внимание одно поразительное отличие. Передняя граница экспрессии генов Нох по мере включения генов, порядок которого определяется порядком их расположения в кластере на хромосоме, отодвигается назад и на диаграммном изображении последовательных доменов вдоль главной оси тела (рис.4) эта особенность показана в виде ступенчатого смещения передней границы экспрессии.
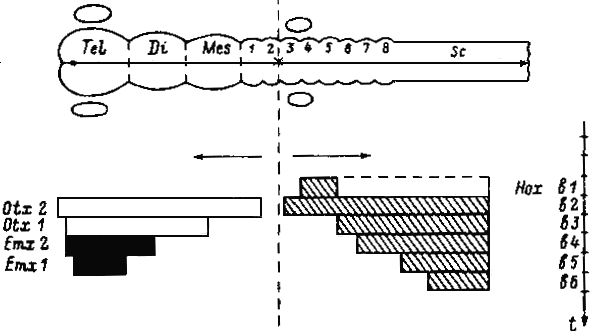
Рис. 4. Граница доменов экспрессии гомеобоксных генов Otx, Emx и комп лекса Нох в головном и спинном мозгу. Пределы экспрессии для каждого гена в соотношении с отделами центральной нервной системы изображены в виде прямоугольных брусков (Модифицировано из: Holland et al.,1992)
* - местоположение организатора (прехордальной мезодермы) после гаструляции; t - временная последовательность включения экспрессии генов; стрелки вдоль оси тела показывают направления движения экспрессии генов. Tel,телэнцефалон; Di, диэнцефалон; Mes,мезэнцефалон; 1-8, ромбомеры заднего мозга; sc,спинной мозг.
У сравниваемых с ними генов Otx и Emx, экспрессирующихся впереди от ПХМ, видна такая же ступенчатость, но как бы в зеркальном отражении. Поскольку эти ступеньки показывают передние границы экспрессии ( Simeone et al.,1992), то ясно, что фронт экспрессии продвигается в области головы не назад,а вперед. Действительно, время экспрессии у всех 4-х генов разное и следует в последовательности Otx2,Оtx1,Emx2 и Emx1, что указывает на факт перемещения границы экспрессии в задне-переднем направлении.
Итак, если для постотической части тела вектор последовательной экспрессии гомеобоксных генов продвигается в передне-заднем направлении, то для преотической части, т.е. головной, вектор экспрессирующихся здесь гомеобоксных генов направлен в противоположную сторону, иначе говоря, имеет задне-переднюю направленность.
В пользу последнего утверждения накапливается все больше фактов. Например, в работе Блиц и Хо (Blitz and Cho,1995), в которой прослеживали волну экспрессии Xotx2, проходящую через эктодерму гаструлы под влиянием передней (будущей прехордальной) мезодермы, была выяснена последовательность экспрессии данного гена от средней гаструлы до ранней хвостовой почки в таком порядке: средний мозг, передний мозг, зачаток цементной железы; т.е. волна генной экспрессии продвигается от задних структур головы к передним. Этот результат, предполагая роль Xotx2 в индукции цементной железы, согласуется с более ранними наблюдениями (Sive et al.,1989), в которых описано продвижение волны индуктивной активности в течение гаструляции, завершающейся тоже развитием цементной железы. Вероятно, что экспрессия Xotx2 является ранним проявлением этой индуктивной волны. Сходным образом экспрессия Sonic hedgehod (SHH) и вентрализация передней нейральной пластинки распространяются от проспективных заднего мозга к переднему (Pera, Kessel,1997). Недавно Фредо и соавторы (Fredieu et al.,1997) проследили, что обработка гаструлы Xenopus литием вызывает потери определенной части переднего мозга, причем динамика здесь такова, что чем раньше производится обработка, тем более постериорные части переднего мозга теряются (вначале части diencephalon, затем telеncephalon).
Следует заметить, что передне-задняя волна дифференциации, которую мы наблюдаем в туловищно-хвостовой части зародышей позвоночных, прослеживается с очевидностью. Можно легко наблюдать волну сомитогенеза, затем волны дифференциации сомитов, дифференциации хорды, которые всегда следуют от переднего конца хорды вдоль туловищно-хвостовой части тела к заднему концу. Это согласуется с тем, что волны дифференциации, по-видимому, вначале организуются по Картезианской сетке передачи позиционной информации, координаты которой соответствуют осям ПЗ и СБ (спинно-брюшной или дорзовентральной). Анализ судьбы клеток после экспериментальной ротации частей нейральной пластинки (Simon et al.,1955, цит. по: Lumsden and Krumlauf,1996) показал, что региональное предназначение определяется вначале вдоль ПЗ оси и происходит независимо от предназначения вдоль СБ оси. Распространение этих волн очевидно связано с продольными структурами, прежде всего с хордой (Cooke, Zeeman,1975).
Если ПЗ паттернирование осевой мезодермы и нейральной трубки в значительной мере совершается с участием генов семейства Нох, то первый шаг СБ паттернирования (вдоль второй Картезианской координаты) зависит, по-видимому, от детерминации вентральной средней линии на уровне средней линии основания нейральной пластинки. Этот процесс связан с экспрессией гена SHH в нижележащей мезодерме вдоль всей ростро-каудальной оси, исключая среднюю линию вентральной части диэнцефалона, где дополнительно индуцируется BMP7 (Chiang et al.,1996; Dale et al.,1997).
В. Значение генов других семейств для закладки головного и туловищно-хвостового отделов тела у зародышей позвоночных
Необходимо иметь в виду, что не только система гомеобоксных генов имеет значение в установке главного плана построения тела позвоночных животных. В последние годы были выявлены и идентифицированы многие новые молекулярные компоненты, участвующие в процессах образования организатора Шпемана и первичной эмбриональной оси. Они не только расширили информативную базу данных, но и существенно изменили представление о первичном состоянии и характере взаимодействий исходных зародышевых пластов.
Согласно классической эмбриологической концепции организатор Шпемана, по мере формирования, генерирует активные сигналы, которые могут превратить вентральные мезодерму и эктодерму в дорсальные, производя соответственно процессы дорсализации и нейральной индукции. Серия молекулярных исследований последних лет противоречит, по-видимому, представлению о доминирующей роли дорсальных сигналов со стороны организатора; напротив, оказывается, что именно вентральные сигналы являются исходными, первичными, блокирующими активность организатора. Эти сигналы осуществляются за счет деятельности группы генов, синтезирующих белки типа bone morphogenetic proteins (ВМР). Это стало ясно после того как было показано, что секретируемые в области организатора белки, chordin и noggin, скорее противодействуют угнетающим функцию организатора сигналам ВМР, чем направляют его развитие (Hemmati-Brivanlou and Melton,1997; Graff,1997).
В соответствии с новой концепцией блокирование влияний генов ВМР приводит к образованию организатора на стадии ранней гаструлы. Однако этого оказывается недостаточно, чтобы создать полноценно функционирующий организатор: ингибиторы белков ВМР ( noggin, chordin, follistatin и др.), будучи тестированые на образование организатора после инъекции в вентральную зону зародыша, индуцировали вторичные осевые комплексы с отсутствующими структурами головы впереди спинного мозга (Graff et al.,1994; Lemaire et al.,1995; Lemaire, Kodjabachian,1996). Очевидно, что для образования полной зародышевой оси требуются дополнительные факторы.
По-видимому, таковыми являются факторы, преодолевающие ингибирующее влияние, исходящее из вегетативной половины еще от одной группы генов WNT, гомологов гена дрозофилы wingless. У позвоночных известно, по крайней мере, 15 различных генов WNT (Nusse, Varmus,1992; Cadigan, Nusse,1997). Микроинъекции некоторых генов WNT в вентральные клетки зародышей Xenopus приводят к дупликации полной оси зародыша ( Christian, Moon,1993a; Cadigan, Nusse,1997; Deardorff et al.,1998). Полагают, что эта дупликация возникает из образования второго центра Ньюкоопа, который и индуцирует в расположенной выше ткани организатор Шпемана. Сигналы WNT, наподобие BMP, угнетают развитие организатора. Выяснили, что в последнем секретируются 3 мощных ингибитора сигналов WNT: это cerberus, frzb-1 и dickkope-1. Все они начинают экспрессироваться на стадии средней гаструлы в основном в прехордальной мезодерме, хотя каждый имеет свой особый рисунок экспрессии.
В области хордомезодермы (туловища) эти гены не экспрессируются, в отличие от антагонистов продуктов генов ВМР. Их общей функцией является подавление постеризующего влияния сигналов WNT, исходящих из центра Ньюкоопа, и, таким образом, обеспечение индукции головы (Niehrs,1999).
Что происходит при угнетении обоих (BMP и WNT) вегетативных типов сигналов? Показано, что ко-инъекция мРНК генов, являющихся ингибиторами как WNT, так и BMP сигналов, индуцирует гетеротопическое развитие только головного отдела (Glinka et al.,1997; Niehrs,1999). Последний автор представил двухингибиторную модель, согласно которой функцией организатора Шпемана является экспрессия ингибиторов, противодействующих инструктивным сигналам факторов BMP и WNT со стороны центра Ньюкоопа. Развитие головы индуцируется из комбинированной экспрессии ингибиторов, подавляющих оба типа сигналов, тогда как туловище индуцируется при подавлении только сигналов ВМР.
К настоящему времени выявлено большое количество молекулярных факторов, способных включать программы морфогенеза по построению комплекса осевых органов в гетеротопической области (среди них гомеобоксные гены в организаторе, гены семейств WNT и BMP, белки frizzled, и др.). Создается впечатление, что механизм включения этой программы либо дублируется много раз или может стартовать с различных промежуточных ступеней. Примером дублирования включения указанной программы является гомеобоксный ген Siamois, который обеспечивает независимый от антагонистов ВМР путь ее реализации ( Carnac et al.,1996). Другим примером является ген Smad10, который эктопически способен генерировать развитие полной дорсальной оси, мимикрируя организатор Шпемана, причем также не блокируя сигналов ВМР ( Le Sueur, Graff,1999).
Очевидно, что распутывание молекулярно-генетических процессов помогает все глубже проникать в природу организатора Шпемана. В то же время остается ощущение, что эти молекулярные схемы должны быть наложены на определенную пространственно-временнyю структуру, в рамках которой они совершаются.
7. К вопросу о единой продольной оси тела позвоночных
Как уже упоминалось, у цефалохордовых (Amphioxus) хорда является осевым стержнем, пронизывающим все тело животного от переднего до заднего конца (см.рис.2). Очевидно, что хорда является не только важнейшим формообразующим элементом всего тела животного, но и участвует как часть координатной системы в распространении сигналов позиционной информации в ростро-каудальном направлении. Важнейшими компонентами этого процесса являются комплекс гомеозисных генов Нох и наличие векторной структуры (в данном случае хордальной оси). Результатом данного процесса является последовательное разделение тела на определенное количество сегментов (регионов) с включением в каждом из сегментов автономной региональной программы. Уже только в пределах каждого региона, по-видимому, начинают работать механизмы СБ паттернирования. Выход из пространства, перекрываемого хордой, может означать выход из под контроля любой из региональных программ. У предковых форм бесчерепных, непосредственных предшественниках позвоночных, группа мезодермальных клеток, путем гетеротопического перемещения или каким-то иным способом, могла оказаться впереди хорды. Уход этих клеток из под жесткого влияния хордальных структур можно было бы оценить как предпосылку для быстрого и независимого развития новой (прехордальной) области. Постепенно разрастаясь и усложняясь в результате внутренних межклеточных взаимодействий и горизонтальных (планарных) влияний (Doniach et al.,1992) со стороны постериорных тканей это прехордальное образование могло послужить началом для эволюционного развития «новой головы» позвоночных, являющейся причиной стремительного прогресса всей этой группы.
Эволюционный механизм, с помощью которого часть мезодермы могла переместиться в несвойственное ей место, был теоретически рассмотрен Геккелем и назван им гетеротопией (Рэфф и Кофмен,1986). Значение этого типа изменений онтогенеза, которые могли бы объяснить особо крупные эволюционные достижения, до сих пор не оценено должным образом ( Городилов,1988).
У позвоночных, как мы знаем, хорда проходит лишь через часть тела, начинаясь на уровне 3-4 -го ромбомеров заднего мозга. Все, что лежит впереди хорды, - а это область всей «новой головы», - не перекрывается ею. Однако при ближайшем рассмотрении анатомического строения тела позвоночных можно прийти к выводу, что организация главной оси по принципу «стержня, пронизывающего все тело животного» здесь также имеет место, хотя главная ось состоит не из одного структурного элемента, а из нескольких взаимосвязанных между собой. Это можно видеть на схематическом изображении костистой рыбы, на котором отмечены осевые элементы, расположенные медиально вдоль всей длинной оси тела (рис.5).
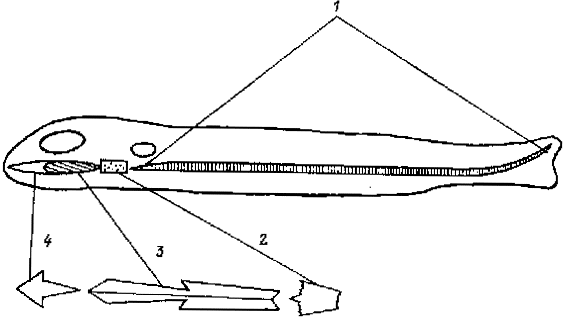
Рис. 5.Схематическое изображение полной продольной оси билатерального тела позвоночных от хвостового отдела до рострального конца.
1 - хорда; 2 - basioccipital; 3 - parasphenoid; 4 - vomer.
Весь туловищно-хвостовой отдел пронизывает хорда и этот факт хорошо известен и не нуждается в специальном рассмотрении. Конусовидный передний конец хорды как бы вмонтирован в лежащую впереди кость basioccipital. В своей средней части эта кость имеет углубление, называемое «турецким седлом», в котором размещается гипофиз. Впереди basioccipital совмещается с раздвоенным концом parasphenoid. Эта кость наиболее длинная и прямая среди всех костей черепа. Она входит в состав основания черепной коробки, располагается медиально и лежит на одной оси с хордой. Даже по ее длинной, вытянутой, стилетообразной форме можно заключить, что parasphenoid предназначен, по-видимому, заменить в головном отделе присутствовавшую в нем у протохордовых хорду. При этом наличие отростков и неравномерностей вдоль нее подчеркивает ее вторую важнейшую функцию - быть частью конструкции черепа. Впереди parasphenoid, слегка перекрываясь с ним , также вдоль общей оси, лежит небольшой вытянутый вдоль оси vomer, который завершает всю ось впереди, делая ее непрерывной от рострального конца до каудального.
Ранее было отмечено, что передний кончик хорды лежит на уровне средней части турецкого седла (Couly, Le Douarin,1988; Couly et al.,1993), где на стадиях поздней гаструлы и нейрулы располагается ПХМ, обладающая свойствами организатора Шпемана. Организационные свойства ПХМ проявляются не только в регуляции способности индуцировать структуры головы, но и в обеспечении экспрессии гомеобоксных генов, исходящей из этой точки зародыша как в направлении ПЗ (гены Нох), так и в противоположном направлении ЗП (гены Otx, Emx) (рис.4). Посредниками передачи сигналов из области организатора в каудальном направлении реально представить хорду и связанные с ней осевые образования (Domingo and Keller,1995), а в ростральном направлении это может осуществляться через parasphenoid или ту ткань, которая может ему предшествовать. Очередность сигналов, исходящих из организационного центра, может регулироваться механизмом отсчета времени, в доказательство существования которого представлен большой фактическом материал (Городилов,1990; Gorodilov,1992).
8. Онтогенетическое происхождение гипофиза
Выше мы стремились показать, что прехордальная пластинка мезодермы продолжает сохранять свои организующие свойства как преемница дорзальной губы бластопора у амфибий или ее соответствующих аналогов у других позвоночных. По сути своей ПХМ остается той же губой бластопора или Гензеновским узелком, но, оказавшись в другом месте и в другое время, сохраняет свои способности как организатора. На этом месте по мере развития зародыша она участвует в формировании туловищно-хвостового и головного отделов, по-видимому, обеспечивая генерацию сигналов, распространяющихся как каудально, так и рострально.
Какова последующая судьба данной субстанции после того как основные структуры тела зародышей позвоночных оказываются сформированными ? Рассмотрение анатомических, гистологических, сравнительно-эмбриологических материалов позволяет установить наличие тесной связи между ПХМ и формирующимся гипофизом. Нужно принять во внимание также ту исключительно важную роль, которую играют обе эти структуры в соответствующие периоды онтогенеза.
Гипофиз является важнейшей железой внутренней секреции, обеспечивающей реализацию нормального онтогенеза в постэмбриональный период. Передняя часть гипофиза - аденогипофиз или карман Ратке, как его именуют у птиц и млекопитающих, развивается из эпителиального выпячивания крыши ротовой полости (Adelmann,1922; Jacobson et al.,1979). Задняя часть или нейрогипофиз является выростом основания мозга.
Исследователи, которые рассматривали развитие аденогипофиза, отмечают тесную связь кармана Ратке и ПХМ. Особенно тщательно это прослежено в работе Джекобсона и соавторов (Jacobson et al.,1979) на куриных эмбрионах. Закладка аденогипофиза происходит рано, уже в начале сомитогенеза. Авторы выявили, что крыша и части стенок кармана относятся к вентральному основанию мозга. Главное же, что нас интересует в этой работе, это то, что карман Ратке находится в непосредственном контакте с ПХМ. Точку этого контакта они называют кончиком кармана. Последняя расположена как раз по медиальной линии зародыша. Далее авторы показывают, что кончик кармана является стержневой точкой, около которой окружающие ткани образуют складки стенок кармана. Большая часть стенок кармана образуется, когда происходит краниальный изгиб (flexure) мозга; именно на этой стадии фомируется карман Ратке.
Еще на стадии 10-12 (по Н.Н. 10-15 сомитов) голова удлиняется над проамнионом без изгибов (рис.6а).
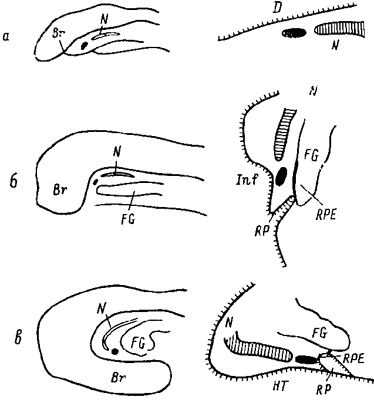
Рис. 6. Схема образования кармана Ратке в результате разрастания мозговых пузырей и краниального изгиба у зародыша цыпленка ( из: Денисьевский и Божок,1973, Jacobson et al.,1979). (а-в) Слева: общий план головы зародыша на разных стадиях эмбриогенеза; справа: расположение прехордальной мезодермы и вентрального края диэнцефалона на различных стадиях краниального изгиба.
(а) Голова зародыша до начала краниального изгиба;
(б) Вентральный поворот мозгового пузыря образует краниальный изгиб головы под прямым углом к зародышевой оси совпадает с началом формирования стенок будущего кармана Ратке.
(в) Краниальный изгиб разворачивает мозг около вентральной плоскости в каудальном направлении и образует складку кармана Ратке.
Br, мозг; D,диэнцефалон; FG,передняя кишка; Inf, инфундибулюм; Ht,гипоталамус; PCM, прехордальная мезодерма; RPE, эктодерма кармана Ратке (оральная ); RP, карман Ратке; N,хорда. Прехордальная мезодерма показана в виде черных овалов.
Когда мозговые пузыри начинают образовываться и голова еще остается прямой, прозэнцефалон уже опускается вентрально под прямым углом к длинной оси зародыша (рис.6в). Само краниальное искривление происходит за 5-ти часовой период между стадиями 12 и 14. За это время карман Ратке формируется как удлиненный мешок, лежащий ниже основания (пола) мозга. Поскольку совпадение образования краниального изгиба и формирования кармана найдено у многих позвоночных, то считается, что краниальный изгиб вынуждает к искривлению вентральную эктодерму, тем самым производя карман Ратке (рис.6 в,с) (обозрено Doscocil,1966,1970). По-существу, карман является пассивным результатом сдвигов и перемещений растущей мозговой ткани (Денисьевский и Божок,1973; Jacobson et al.,1979).
Этот вывод косвенно подтверждается наблюдениями после направленного разрушения (нокаута) гена Lhx3 из семейства LIM-гомеобоксных генов. В отсутствие этого гена практически все типы секреторных клеток аденогипофиза, кроме кортикотропных, не способны вырабатывать свои специфические гормоны, в то время как сам карман Ратке формируется, хотя в дальнейшем он тоже прекращает расти и дифференцироваться (Shеng et al.,1996). Еще более необязательность структуры типа кармана Ратке подтверждается наблюдениями образования гипофиза у zebrafish: у этих рыб ранняя спецификация клеток гипофиза происходит в группах клеток, лежащих латерально по обе стороны от медиальной линии, а не в структуре гомологичной карману Ратке (Glasgow et al.,1997).
Вероятно, что участие в формировании гипофиза принимает та часть эктодермы кармана Ратке, которая соединяется с прехордальной пластинкой в области кончика кармана (рис.6 в,с). По всей видимости, секреторная часть гипофиза - аденогипофиз - возникает или прямо из прехордальной пластинки или под ее непосредственным влиянием. Поскольку организатор обладает способностью определять судьбу окружающих клеток или даже переопределять, как это происходит при эктопических пересадках дорзальной губы бластопора, то, очевидно, таким же образом используется эктодерма из района кармана Ратке: она передетерминируется на построение гормональных клеток гипофиза.
В последнее время появились сообщения, что эктодерма, предназначенная для генерации клеток аденогипофиза, происходит не из ротовой полости, а из эпидермальных плакод, которые тоже возникают из эктодермальных утолщений, расположенных в головной части по обе стороны от нейральной трубки ( Kawamura and Kikuyama,1992; Kikuyama et al.,1993).
Экспериментальные пересадки участков ткани, взятых в области передней нейроэктодермы, а также картирование судьбы клеток у курицы (Couly, LeDouarin,1988), лягушек (Eagleson, Harris,1989; Kawamura, Kikuyama,1992) и мыши (Osumi-Yamashita et al.,1994) показали, что зачаток аденогипофиза происходит из зоны переднего края нейральной пластинки, причем он развивается не из поверхностной ткани, а из более глубоких слоев (Kawamura and Kikuyama,1992).
Как известно, в сформированном теле позвоночных гипофиз лежит в турецком седле. Выше уже упоминалось, что эта кость имеет двойное происхождение. Было также отмечено, что передний конец хорды лежит примерно на уровне средней части седла. Поскольку ПХМ граничила с передним концом хорды, то ясно, что она занимала как раз то место, на котором в дефинитивном организме находится гипофиз ( Couly, Le Douarin, 1985,1987,1988).
В области организатора на ранних стадиях также экспрессируются гены, которые, по-видимому, играют принципиальную роль в формировании гипофиза. У зародышей мышей недавно выявлен новый гомеобоксный ген, который активируется вначале в прехордальной пластинке, а затем в кармане Ратке (Hermesz et al.,1996). Он был обозначен как Rpx, тремя буквами, взятыми из трех слов Rathke's pouch homeobox. Этот ген также упоминается как Hesx1 (Thomas et al.,1995). Ортологами Rpx/Hesx1 являются гены Xanf у амфибий и Ganf у птиц (Zaraisky et al.,1995; Kazanskaya et al.,1997).
У мыши транскрипты Rpx впервые обнаруживаются in situ в самом начале стадии гаструлы ( 6,5 сут рс) в слое эндодермы. Позднее было уточнено, что экспрессия Rpx на этой стадии выявляется в очень ограниченной области эндодермы, в передней висцеральной эндодерме (ПВЭ), которая обладает способностью индуцировать структуры головы (Dattani et al.,1998; Beddington and Robertson,1999). На стадии 7 сут экспрессия Rpx была обнаружена в той части медиальной эндодермы/мезэндодермы, которая становится предшественником прехордальной пластинки. На стадии 7,5 сут Rpx обнаруживается в эктодерме цефалической нейральной пластинки, расположенной над эндодерм/прехордальной мезодермой. Решающее ограничение экспрессии Rpx происходит на 9-е сут. Экспрессия больше не обнаруживается в нейроэктодерме и ограничивается исключительно слоем эктодермальных клеток, которые входят в состав кармана Ратке, зачатка аденогипофиза.
Показано, что у мышей на стадии 9,5-10,0 сут передняя стенка кармана Ратке находится в прямом контакте с основанием диэнцефалона (Kimura et al.,1996; Sheng et al.,1996), будущего гипоталамуса. Впоследствие нейрогипофиз, происходящий из внешнего выроста нейроэктодермы диэнцефалона, граничащего с карманом Ратке, становится задней или нейральной долей гипофиза, которая содержит окончания аксонов нейросекреторных нейронов (Hermesz et al.,1996).
На стадии 11,5 сут Rpx усиленно экспрессируется фактически во всех клетках кармана. Спустя 1-1,5 сут в области кармана Ратке начинают дифференцироваться дефинитивные типы клеток гипофиза. В течение 3-х сут в последовательном временном порядке появляются друг за другом кортикотропы (12,5), тиреотропы (13,5), меланотропы (14,5 ) сомато-, лакто- и гонадотропы ( 15,5-16,0 сут ), т.е. практически все дефинитивные типы клеток аденогипофиза.
Rpx является наиболее ранним из известных генов, экспрессируемых в зачатке гипофиза и, видимо, определяет раннюю детерминацию или дифференциацию его клеток (Hermesz et al.,1996). Активность Rpx начинается на стадии ранней гаструлы в ПВЭ, которая, как предполагают, является одним из компонентов организатора для индуцирования нейральных структур головы (Beddington, Robertson,1999; Camus, Tam,1999). После этого активность Rpx появляется в прехордальной пластинке (эндомезодерме) и затем в области аденогипофиза, что явно указывает на взаимосвязь, а возможно и на преемственность этих структур.
Rpx является важным, но не единственным геном, участвующим в образовании гипофиза. К настоящему времени выявлено, по крайней мере, 5 гомеобоксных генов, принимающих участие в развитии аденогипофиза (Watkins-Chow and Camper,1998). Один из генов семейства LIM-гомеобоксных генов Lhx3, он же mLim3 или P-Lim, является существенным для формирования гипофиза и функционирования того же гена Rpx (Bach et al.,1995; Sheng et al., 1997; Sheng and Westphal,1999). Это было показано при направленном разрушении гена Lhx3. Оказалось, что у мышей, гомозиготных по отсутствию гена Lhx3-/- , ген Rpx экспрессировался нормально до стадии 10,5 сут, но после этого его активность снижалась и прекращалась. В итоге у таких мышей не развивались передняя и промежуточная доли гипофиза и,естественно, отсутствовали все 5 типов эндокринных клеток (Sheng et al.,1996,1997). Значение этого гена не только для дифференциации клеток в эмбриогенезе, но и для поддержания секреции соматотропного или ростового гормона, тиреотропного, лютеинизирующего, пролактинового гормонов в гипофизе взрослых мышей показано в самое последнее время (Glasgow et al.,1997).
Исследован еще один ген, экспрессия которого прослеживается от организатора Шпемана до зачатка гипофиза (Deardorff et al.,1998). Этот ген, изолированный у Xenopus был обозначен как ген Xfz8. Как уже говорилось выше, он относится к группе генов, которые производят белки frizzled, являющиеся рецепторами для Wnt лигандов. Эктопическая экспрессия Xfz8 приводит к образованию полной вторичной оси. Оказалось, что экспрессия Xfz8 начинается в ранней губе бластопора (стадия 10+) и затем концентрируется в медианных клетках ведущего края мигрирующей эндомезодермы. В течение поздней гаструлы и ранней нейрулы (стадии 12 и 13) Xfz8 обнаруживается в ПХМ. Наконец, на хвостовой почке (стадия 22) Xfz8 экспрессируется в stomadeal-hypophyseal , т.е. аденогипофизарном зачатке (Deardorff et al.,1998).
Влияние прехордальной пластинки, по крайней мере, на развитие головного мозга и затем, в обратном порядке, уже на гипофиз прослеживается на примере действия гена Т/ebp или Nkx2.1 ( Kimura et al.,1996; Pera and Kessel ,1997). Этот ген демаркирует вентральную часть переднего мозга, которая затем становится гипоталамусом и гипофизом (Lazzaro et al.,1991). Он экспрессируется в диэнцефалоне, который находится как раз над прехордальной пластинкой. Такое положение экспрессионного домена T/ebp предполагает существенное влияние вертикальных сигналов из ПХМ снизу вверх на вентральную часть переднего мозга с целью активизировать T/ebp. В последующем зона экспрессированного T/ebp действует в противоположном направлении, видимо, участвуя в формировании гипофиза (рис.7).
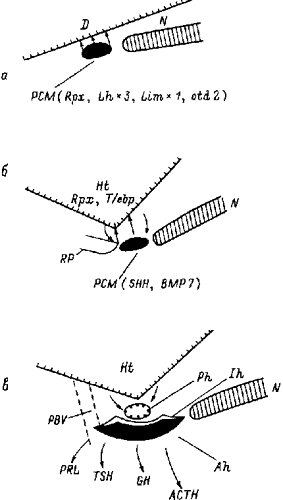
Рис. 7. Некоторые этапы развития прехордальной мезодермы и гипофиза.
(а) Стадия нейруляции. Участие прехордальной мезодермы (РСМ) в пост- роении мозга и головы позвоночных. Ряд генов, которые экспрессируются в границах РСМ и влияют на развитие мозга, указаны в скобках.
(б) Стадия вентрализации переднего мозга и образования гипоталамуса. Факторы вентрализации (напр., SHH, BMP7 ) из РСМ влияют на основание мозга; возвратное влияние генов Rpx, T/ebp и др., экспрессирующихся в вентральной части мозга, воздействуют на РСМ.
(в) Замещение РСМ аденогипофизом и появление клеток, секретирующих различные гормоны ( ACTH,адренокортикотропный; GH, ростовой; TSH, тиреотропный; PRL, пролактин) Ah, аденогипофиз; D, диэнцефалон; Ih, промежуточный гипофиз; Ht, гипоталамус; N, хорда; PBV, портальный кровеносный сосуд; PCM, прехордальная мезодерма ; Ph, задняя часть (нейральная) гипофиза; RP, карман Ратке. Закрашены черным цветом РСМ (а, б) и аденогипофиз (в).
Это было выявлено при разрушении гена T/ebp. Оказалось, что в случае T/ebp-/- были обнаружены значительные нарушения в вентральной части переднего мозга и полностью отсутствовал гипофиз.
9. Организатор Шпемана и происхождение позвоночных
Я позволю себе представить список основных фундаментальных новообразований, отличающих тип хордовых вообще и подтип позвоночных в частности от предшествующих Metazoa . Наиболее общими признаками, объединяющими и низших хордовых Protochordata и позвоночных Vertebrata является наличие хорды и нейрального дорсального тяжа. Указание на это можно видеть в таблице, в которой я попытался свести данные о главнейших новообразованиях, приобретенных в процессе эволюции и ставшими основополагающими для выделения в отдельный тип Chordata низших хордовых и позвоночных.
Таблица
Сравнительный список новых морфологических признаков высшего ранга, приобретенных низшими хордовыми и позвоночными в процессе эволюции. (+) и (-) показывают соответственно наличие или отсутствие признака| Признаки | Низшие хордовые | Позвоночные |
| Хорда | + | + |
| Дорсальная нейральная пластинка | + | + |
| Организатор Шп (головного отдела) | - | + |
| Прехордальная мезодерма | + | |
| Нейральный гребень | - | + |
| Эктодермальные нейральные плакоды | - | + |
| Головной мозг с подотделами | - | + |
| Черепная коробка | - | + |
| Висцеральный череп | - | + |
| Гипофиз | - | + |
| Органы чувств | Одинарные | Двойные |
Очевидно, что два первых признака (наличие хорды и нейрального тяжа) присущи животным всего типа хордовых. Последующие признаки, указанные в таблице, свойственны только позвоночным и расположены примерно в том порядке, в котором они появляются в онтогенезе и, что характерно, все они так или иначе связаны с развитием головы позвоночных.
Наиболее ранним событием в этом сценарии является возникновение мезодермы путем инвагинации, процесса, который является обычным в период гаструляции даже у многих беспозвоночных животных (рис.8а).
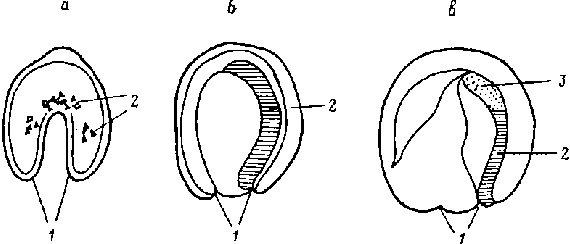
Рис. 8. Основные этапы эволюции организатора Шпемана.
(а) Инвагинация и образование мезодермы. Этот процесс постоянно можно наблюдать уже у беспозвоночных. 1 - бластопор; 2 - мезодерма.
( в) У протохордовых образование хорды обеспечивает билатеральную симметрию тела и индукцию дорзальной нейральной трубки. У них развивается туловищный организатор, который является одним из двух основных компонентов гетерогенного организатора Шпемана. 1 - бластопор, 2 - хордомезодерма или туловищный компонент организатора Шпемана.
(с) У позвоночных организатор головного отдела добавляется к туловищному компоненту. Первый из них является истинно новым приобретением для позвоночных. 1 - бластопор; 2 - туловищный (хордальный) компонент организатора Шпемана; 3 - головной компонент организатора Шпемана.
Этот же процесс обеспечивает развитие мезодермальных зачатков у протохордовых. Принципиально новым у протохордовых, по сравнению с беспозвоночными, является то, что средне-дорзальная мезодерма дифференцируется в хордомезодерму, из которой затем развиваются мышцы и зачаток хорды. Последняя индуцирует вышележащую дорзальную эктодерму, заставляя ее дифференцироваться в концентрированный слой нейральной ткани, нейральную пластинку (рис.8б). Образование обеих этих структур - зачатка хорды и нейральной пластинки - является предпосылкой для развития билатерально симметричного тела, свойственного всем хордовым. Описание развития хорды и нейрального тяжа у протохордовых (Conklin,1932) показывает, что способ их развития мало чем отличается от того, как происходит этот же процесс у позвоночных (Langille, Hall,1989). Ввиду этого можно представить себе, что если комплекс хордомезодермы определяет развитие билатеральной оси и индуцирует развитие нервной системы, то фактически он играет ту же роль, какую играет вторая часть организатора Шпемана, которая формирует туловищный отдел тела позвоночных. Остается лишь неясным вопрос, для того чтобы констатировать их почти полное тождество: являются ли потенции организовывать осевые органы протохордовых детерминироваными еще до начала гаструляции (как у позвоночных) ? По-видимому, ранняя детерминация мезодермальных зачатков является характерной для протохордовых. Например, у асцидий презумптивные клетки хорды специфицируются уже в периоде дробления (Jeffery,1997). В таком случае из двух частей гетерогенного организатора Шпемана только та часть, которая отвечает за индукцию головного отдела, является истинно новым приобретением позвоночных (рис.8в).
Далее я попытаюсь кратко обозреть последовательность событий, связанных с возникновением организатора Шпемана и его участия в процессах развития головы в онтогенезе позвоночных (на примере амфибий).
- Процессом, предшествующим образованию бластопора, является дорсализация зародышей, которая происходит через влияние сигнальных молекул (BMPs, WNTs). Они выделяются из вегетативной части яйца (у амфибий из центра Ньюкоопа) к клеткам маргинальной зоны (Kimelman et al.,1992; Christian, Moon,1993б; Hedgepeth et al.,1997). Поправки, внесенные в эту схему в последний период, заключаются в том, что дорсализация зародышей происходит после того как в зоне организатора экспрессируются гены noggin, chordin и, видимо, другие, продукты которых подавляют угнетающее организатор действие вентрализующих сигналов ( Hemmati-Brivanlou and Melton,1997; Graff,1997).
- Самой первой морфологической структурой, которая отмечает проспективную дорсальную сторону, является губа бластопора. Именно в ней на стадии ранней гаструлы располагается та часть организатора Шпемана, которая имеет отношение к развитию головы позвоночных.
- В результате инвагинации через бластопор и миграции внутрь яйца популяция клеток ранней дорсальной губы оказывается перемещенной в презумптивную переднюю часть эмбриона. Материал туловищного организатора, перемещающийся вслед за головным в том же самом слое (рис.1), позднее становится хордой, и таким образом ранее инвагинировавший материал получает название прехордальной мезодермы. ПХМ является производной или преемницей организатора Шпемана ранней гаструлы и является важнейшей новой структурой в зародышах позвоночных на стадиях поздней гаструлы-ранней нейрулы.
- ПХМ и нотохорд индуцируют - каждый на своем уровне вдоль билатеральной оси зародыша - выше лежащую эктодерму, чтобы сформировать нейральную пластинку. При этом специфические особенности каждого из организаторов, проявляемые в экспрессии генетических факторов, описанные отчасти в предыдущих разделах, определяют специфику в развитии нервной системы в головном и туловищном отделах. Напомним, что головной организатор обеспечивает развитие не только головных структур, но и способен к индукции полной зародышевой оси. Расположение организатора ПХМ в прехордальной зоне, в точке (рис.4), от которой начинается построение всей новой головы, пространственно наиболее выгодно: отсюда он способен влиять на развитие как головного, так и туловищного отделов. Для обеспечения передачи сигналов, по-видимому, используются среднеосевые структуры: в каудальном направлении - комплекс хорды, в ростральном - комплекс parasphenoid. Разнонаправленные паттерны экспрессии комплексов гомеобоксных генов имеют начало как раз в зоне, где расположена ПХМ (рис.4).
- Под контролем ПХМ начинается процесс формирования головного мозга. Необходимость этой организующей структуры для развития головы была ясно показана при описании мутации Lim1-/- (раздел 4), когда полному отсутствию головы у мутантов предшествовало отсутствие (или редукция) ПХМ (Shawlot, Beringer,1995). У протохордовых, у которых отсутствует ПХМ, мозг настолько слабо развит, что разные отделы мозга и первичные сенсорные органы практически неразличимы (Guthrie,1975; Lovtrup,1977; Jollie,1977; Langille, Hall,1989). У позвоночных как те, так и другие приобретают мощное развитие. Экспериментальное удаление ПХМ у куриного эмбриона (Pera, Kessel,1997), видимо делалось тогда, когда развитие головы уже начиналось, тем не менее оно приводило к значительному сужению передней нейральной трубки и к развитию циклопии. Кстати, наличие только одного глаза присуще всем низшим хордовым.
- В процессе формирования нейральной трубки на стыке между нейральной эктодермой и эпидермисом на протяжении всего нейрального зачатка появляется популяция клеток, образующая у позвоночных так называемый нейральный гребень. На этой стадии развития такая структура является главным приобретением, определяющим весь последующий процесс цефализации позвоночных. Нейральный гребень является уникальным образованием как источник мезенхимы, происходящей из эктодермы. Видимо все элементы краниальных нервов с сенсорными ганглиями, все элементы прехордального черепа и висцерального скелета, кожный покров, многие мышцы происходят из клеток нейрального гребня (Gans, Northcutt,1983; Couly et al.,1992,1993; Kontges, Lumsden,1996). В то же время следует отметить, что эти уникальные клетки являются новообразованием позвоночных, поскольку тщательные исследования у Amphioxus не смогли выявить клетки этого типа ( Holland et al.,1996; Baker and Browner-Fraser,1997). Так же, по-видимому, у протохордовых отсутствуют эпидермальные плакоды, которые у позвоночных в виде дорсальных утолщений эктодермы принимают участие в развитии парных органов чувств.
- Процесс цефализации головного мозга и развитие ротового и глоточного аппаратов осуществляют клетки эктомезенхимы, мигрирующие вентрально из нейрального гребня. Эта миграция начинается довольно рано, у куриного эмбриона на стадии 6-7 сомитов (Сouly et al.,1992). Одновременно ПХМ постепенно, видимо не прекращая функций организатора, преобразуется в аденогипофиз. В предыдущем разделе рассматривались данные морфологических и молекулярно-генетических исследований для доказательства в пользу этих преобразований. К ним могут быть добавлены данные эволюционно-морфологических исследований. Так, у низших хордовых, асцидий и ланцетника, не выявлено ни ПХМ, ни гипофиза (Conklin,1932; Satoh,1994). С учетом приведенных доказательств в этой статье в пользу преемственности этих структур и о причинно-следственной зависимости одной от другой, факт отсутствия их обеих у протохордовых становится понятным.
Итак, очевидно, что наиболее поразительные отличия позвоночных от всех предшествующих форм Metazoa , включая низших хордовых, относятся к возникновению новой головы. Количество принципиальных новоприобретений, связанных с происхождением и развитием этого отдела, является беспримерным в эволюционной истории животного мира. Среди них организатор Шпемана, ПХМ и гипофиз обнаруживают онтогенетическую преемственность между собой и каждая из этих структур играет исключительную роль в обеспечении развития и жизнедеятельности всего организма на разных этапах онтогенеза.
Выше (раздел 7) мы уже пытались обрисовать путь, каким могла возникнуть голова у позвоночных. Вначале это могло быть только небольшое тканевое образование, возможно отделившееся от хорды каким-либо путем, и занявшее место впереди ее (пример гетеротопической эволюционной изменчивости). По всей видимости, этот предшественник ПХМ, вышел из-под жесткого контроля со стороны хорды и осевых органов, поскольку именно через них обеспечивается развитие основного плана строения тела хордовых (сегментация и пр.). ПХМ как структура, впервые возникшая у позвоночных, теоретически оценивается как условие, необходимое для обеспечения направленного вперед роста головы (Jollie,1977). Возникновение ПХМ могло индуцировать сдвиг нервной трубки вперед и в последующем оказывать стимулирующее влияние на ее развитие в сторону все большего ее усложнения.
В последнее время появились работы, подтверждающие реальность такого хода событий. Ермакова и соавторы (Ermakova et al.,1999) экспериментально, с помощью эктопических инъекций гена Xanf, ортолога Rpx, вводимого в дорзальную эктодерму Xenopus, вызывали эффект разрастания головных отделов нейральной пластинки, причем это разрастание происходило в основном за счет превращения прилегающего эпидермиса в нейральную ткань. Следовательно, этот ген, который играет важнейшую роль сначала в структуре ПХМ, а затем в развитии аденогипофиза, как выясняется, способен индуцировать превращение эпидермиса в нейральную ткань. Возможно, что именно благодаря генам этого семейства ПХМ могла сыграть значительную роль в развитии всего головного мозга позвоночных. В другой работе (Knoetgen et al.,1999) показано, что noggin, обычно экспрессируемый в области организатора, также способен вызывать разрастание передней нейральной пластинки. Возможно, что это делается через Xanf и его ортологи, так как последние сами индуцируются под воздействием noggin (Sasai et al.,1995).
Благодаря этим или другим причинам передний мозг разрастался вперед от хорды, которая оставалась на том же месте, где была у предков Cephalochordata (Kingsbury, Adelmann,1924; Jollie,1977). Разрастанию прехордального мозга могло способствовать отсутствие сегментированности в этой части (Gans, Northcutt,1983). В результате достаточно свободного, слабо контролируемого разрастания передней массы нейроэктодермы могли возникнуть клетки с тотипотентными свойствами - предшественницы эктомезенхимы нейрального гребня. Эта эктомезенхима впоследствии смогла дать начало многим направлениям дифференциации клеток, в том числе нервных, мышечных, хрящевых, костных. При этом связи между ПХМ и прехордальным мозгом постепенно усложнялись и совершенствовались, и контролирующие и организационные функции ПХМ также развивались. Примером реципрокных индуктивных взаимодействий между ПХМ и выше расположенными частями мозга могут быть Rpx и T/ebp и другие гены. По мере роста массы и размеров головного мозга и всего организма, увеличения расстояний от центра к клеткам и органам- мишеням стала преобразовываться сама структура клеток ПХМ. Понадобились новые средства связи между этими клетками и клетками мишенями. Эту связь могла выполнять сеть кровеносных сосудов, а роль сигнальных веществ перешла к гормонам, выбрасываемым в кровь (рис.7в). Именно по этой причине структура ПХМ могла преобразоваться в комплекс железистых клеток.
После образования головы другим мощным новообразованием явилось развитие челюстей, что послужило основой разделения позвоночных на две обширные группы: Agnatha и Gnathostomata. Тот факт, что элементы челюстей являются производными жаберных дуг, выводится из морфологических и эмбриологических исследований (Maderson,1987; Carroll,1988). В серии глоточных карманов, развивающихся у Agnatha, самый передний был назван мандибулярным, так как он является предшественником нижней челюсти. Последующие карманы будут формировать гиоидную дугу и жаберный скелет и связанные с ним ткани (вместе называемые висцеральным скелетом или висцеральным черепом) (Hall,1988; Langille and Hall,1989; Horigome et al.1999).
Список литературы
Городилов Ю.Н. 1988. Исследование гетерохроний в раннем онтогенезе и оценка их роли в эволюции костистых рыб. В сб.тез. “Проблемы макроэволюции”. Москва “Наука”: 67-68.
Городилов Ю.Н. 1990. Значение фактора времени в регуляции эмбрионального развития (на примере низших позвоночных). Онтогенез 21(3): 319-330.
Городилов Ю.Н. 1998. Зародышевое и личиночное развитие атлантического лосося. В кн.: «Атлантический лосось». «Наука»:142-158.
Денисьеский А.В., Божок Ю.М. 1973. Значение промежуточного мозга в раннем аденогипофизе у птиц. Онтогенез 4 (2): 168-174.
Корж В.П. 1987. Гомеобокс. Факты и гипотезы.Онтогенез 18 (4): 345-354.
Корочкин Л.И. 1987. Новое в учении о гомеозисных генах. Онтогенез 18 (6): 565-572.
Поленов А.Л. 1971. Гипоталамическая нейросекреция. Л , Наука, 159 с.
Рэфф Р. и Кофмэн Т. 1986. Эмбрионы, гены и эволюция. М.,Мир. 402 с.
Саксен Л. и Тойвонен С. 1963. Первичная эмбриональная индукция. М. 343 с.
Слэк Дж.М.У. 1990. Коммитирование клеток в раннем развитии амфибий. Онтогенез 21 (2): 119-132.
Acampora,D.,Mazan,S.,Lallemand,Y.,Avantoggiato,V.,Mauri,M.,Simeone,A. and Brulet,P. 1995. Forebrain and midbrain regions are deleted in Otx2-/- mutants due to a defective anterior neuroectoderm specification during gastrulation. Development 121:3279-3290.
Adelmann,H.B. 1922. The significance of the prechordal plate:an interpretive study. Am.J.Anat. 31:55-101.
Andreazzoli,M.,Pannese,M. and Boncinelli,E. 1997. Activating and repressing signals in head development: the role of Xotx1 and Xotx2. Development 124:1733-1743.
Ang,S.L.,Wierda,A.,Wong,D.,Stevens,K.A.,Cascio,S.,Rossant,J. and Zaret, K.S. 1993. The formation and maintenance of the definitive endoderm lineage in the mouse: involvement of HNF3/forkhead proteins. Development 119:1301-1315.
Ang,S.L.,Jin,O.,Rhinn,M.,Daigle,N.,Stevenson,L. and Rossant,J. 1996. A targeted mouse Otx2 mutation leads to severe defects in gastrulation and formation of axial mesoderm and to deletion of rostral brain. Development 122:243-252.
Bach,I.,Rhodes,S.I.,Pearse,R.V., Heinzel,T.,Gloss,B.,Scully,K.M.,Sawchenko,P.E.,Rosenfeld,M.G. 1995. P-Lim, a LIM homeodomain factor, is expressed during pituitary organ and cell commitment and synergizes with Pit-1. Proc.Natl.Acad.Sci.USA 92:2720-2724.
Baker,C.V.H., and Bronner-Fraser,M. 1997. The origins of the neural crest. II. An evolutionary perspective. Mech.Dev.69:13-29.
Barnes,J.D.,Crosby,J.L.,Jones,C.M.,Wright,C.Y. and Hogan,B.L. 1994. Embryonic expression of Lim-1 the mouse homolog of Xenopus Xlim-1, suggests a role in lateral mesoderm differentiation and neurogenesis. Dev.Biol.161:168-178.
Bautzmann,H.,Holtfreter,J.,Spemann,H. and Mangold,O. 1932. Versuche zur Analyse der Induktionsmittel in der embryonalent-wicklung. Naturwissenschaften 20:971-974.
Beddington,R.S.P. 1994. Induction of a second neural axis by the mouse node. Development 120:613-620.
Beddington,R.S.P. 1998. Cripto-analysis of embryonic codes. Nature 395:641-642.
Beddington,R.S.P. and Robertson,E.J. 1999. Axis development and early assymetry in mammals. Cell 96:195-209.
Blitz I.L. and Cho,K.W.Y. 1995. Anterior neurectoderm is progressively induced during gastrulation:the role of the Xenopus homeobox gene orthodenticle. Development 121:993-1004.
Blum,M.,Gaunt J.,Cho,K.W.Y.,Steinbeisser,H.,Blumberg B.,Bittner,D. and De Robertis,E.M. Gatrulation in the mouse: the role of the homeobox gene goosecoid. Cell 69:1097-1106.
Blumberg,B.,Wright,C.V.E.,De Robertis,E.M. and Cho,K.W.Y. 1991. Organizer-specific homeobox genes in Xenopus laevis embryos. Science 253:194-196.
Burke,A.C.,Nelson,C.E.,Morgan,B.A. and Tabin,C. 1995. Hox genes and the evolution of vertebrate axial morphology. Development 121:333-346.
Cadigan,K.M. and Nusse,R. 1997. Wnt signalling: a common theme in animal development. Genes Dev. 11:3286-3310.
Camus,A., and Tam,P.P.L. 1999. The organizer of the gastrulating mouse embryo. Curr.Topics Dev.Biol. 45:117-153.
Carrasco,A.E.,McGinnis,W.,Gehring,W.J. and De Robertis,E.M. 1984. Cloning of an Xenopus laevis gene expressed during early embryogenesis coding for the peptide region homologous to Drosophila homeotic genes. Cell 37:409-414.
Carnac,G.,Kodjabachian,L.,Gurdon,J.B. and Lemaire,P. 1997. The homeobox gene Siamois is a target of the Wnt dorsalisation pathway and triggers organizer activity in the absence of mesoderm. Development 122:3055-3065.
Chiang,C.,Litingtung,Y.,Lee,E.,Young,K.E.,Corden,J.L.,Westphal,H. and Beachy,P.A. 1996. Cyclops and defective axial patterning in mice lacking Sonic hedgehog gene function. Nature 383:407-13.
Carroll,R.L. 1988. Vertebrate Paleontology and Evolution. W.H.Freeman & Co., New York.
Carroll,S.B. 1995. Homeotic genes and the evolution of artropods and chordates. Nature 376:479-485.
Cho,K.W.Y.,Blumberg,B.,Steinbeisser,H. and De Robertis,E.M. 1991. Molecular nature of Spemann's organizer: the role of the Xenopus homeobox gene goosecoid. Cell 67:1111-1120.
Christian,J.L. and Moon,R.T. 1993a. When cells take fate into their own hands: differential competence to respond to inducing signal generates diversity in the embryonic mesoderm. BioEssays 15:135-140.
Christian,J.L. and Moon,R.T. 1993б. Interactions between Xwnt-8 and Spemann organizer signaling pathways generate a dorso-ventral pattern in the embryonic mesoderm of Xenopus. Genes Dev.7:13-28.
Cohen,S. and Jurgens,G. 1991. Drosophila headlines. Trends Genet.7:267-272.
Conklin,E.G. 1932. The embryology of Amphioxus. J.Morphol.54: 69-151.
Cooke,J. and Zeeman,E.C. 1975. A clock and wavefront model for control of the number of repeated structures during animal morphogenesis. J.theor.Biol. 58:455-476.
Couly,G.F. and LeDouarin,N.M. 1985. Mapping of the early neural primordium in quail- chick chimeras.1.Developmental relationships between placodes facial ectoderm and prosencephalon. Dev.Biol. 110:422-439.
Couly,G.F. and Le Douarin,N.M. 1987. Mapping of the early neural primordium in quail- chick chimeras. II. The prosencephalon neural plate and neural folds: implications for the genesis of cephalic human congenital abnormalities. Dev.Biol. 120:198-214
Couly,G.F. and LeDouarin,N.M. 1988. The fate map of the cephalic neural primordium at the presomitic to the 3-somite stage in the avian embryo. Development 103, Supplement:101-113.
Couly,G.F.,Coltey,P.M. and LeDouarin,N.M. 1992. The developmental fate of the cephalic mesoderm in quail-chick chimeras. Development 114:1-15.
Couly,G.F.,Coltey,P.M. and LeDouarin N.M. 1993. The triple origin of skull in higher vertebrates: a study in quail-chick chimeras. Development 117:409-429.
Couly,G.,Grapin-Botton,A. and Le Douarin,N.M. 1996. The regeneration of the cephalic neural crest, a problem revisited: the regenerating cells originate from the controlateral or from the anterior and posterior neural fold. Development 122:3393-3407.
Couly,G.,Grapin-Botton,A.,Coltey,P.,Ruhin,B. and Le Douarin,N.M. 1998. Determination of the identity of the derivatives of the cephalic neural crest: incompatibility between Hox gene expression and lower jaw development. Development 125:3445-3459.
Dale,J.K.,Vesque C.,Lints,T.J.,Sampath,T.K.,Furley,A.,Dodd,J. and Placzek M. 1997. Cooperation of BMP7 and SHH in the induction of forebrain ventral midline cells by prechordal mesoderm. Cell 90:257-269.
Dattani,M.T.,Martinez-Barbera,J.-P.,Thomas,P.Q.,Brickman,J.M., Gupta,R., Martensson,I.-L.,Toresson,H.,Fox,M.,Wales,J.K.H.,Hindmarsh,P.C., Krauss,S, Beddington,R.S.P.,and Robinson,I.C.A.F. 1998. Mutations in the homeobox gene Hesx1 associated with septo-optic displasia in human and mouse. Nat.Genet.19:125-133.
David,I.B.,Toyama,R. and Taira,M. (1995). LIM domain proteins. C.R.Acad.Sci.III 318:295-306.
Deardorff,M.A.,Tan,C.,Conrad L.J. and Klein,P.S. 1998. Frizzled-8 is expressed in the Spemann organizer and plays a role in early morphogenesis. Development 125: 2687-2700.
De Robertis,E.M. 1995. Dismantling the organizer. Nature 374: 407-408.
De Robertis,E.M.,Fainsod,A.,Gont,L.K. and Steinbeisser,H. 1994. The evolution of vertebrate gastrulation. Development Supplement.: 117-124.
Dias,M.S. and Schoenwolf,G.C. 1990. Formation of ectopic neuroepithelium in chick blastoderms: age related capacities for induction and selfdifferentiating following transplantation of quail Hensen's node. Anat.Rec. 229:437-448.
Domingo,C. and Keller,R. 1995. Induction of notochord cell intercalation behavior and differentiation by progressive signals in the gastrula Xenopus laevis. Development 121:3311-3321.
Doniach,T., Phillips,C.R. and Gerhart,J.C. 1992. Planar induction of anteroposterior pattern in the developing central nervous system of Xenopus laevis. Science 257:542-545.
Doscocil,M. 1966. The study of the proliferative activity of cells of Rathke's pouch and its surroundings in the chick ontogenesis. Folia morphol. (Praha),14:107-116.
Doscocil,M. 1970. Development of the chick hypophysis. Acta Univ.Carol.Med.Monographia XI. Universita Karlova.Praha,CSSR,131 p.
Duboule,D. 1994. Temporal colinearity and the phylotypic progression: a basis for the stability of a vertebrate Bauplan and the evolution of morphologies through heterochrony. Development Supplement:135-142
Duboule,D. and Dolle,P. 1989. The structural and functional organization of the murine Hox gene family resembles that of Drosophila homeotic genes. EMBO J. 8:1497-1505.
Eagleson,C.W. and Harris,W.A. 1989. Mapping of the presumptive brain regions in the neural plate of Xenopus laevis. J.Neurobiol. 21:427-440.
Eldredge,N. and Gould,S.J. 1972. Punctuated equilibria: An alternative to phyletic gradualism. In: Models of Paleobiology, 82-115.
Ermakova,G.V., Alexandrova, E.M., Kazanskaya,O.V., Vasiliev,O.L., Smith,M.W., Zaraisky,A.G. 1999. The homeobox gene, Xanf-1, can control both neural differentiation and patterning in the presumptive anterior neurectoderm of the Xenopus laevis embryo. Development 126: 4513-4523.
Finkelstein,R., Smouse,D.,Capaci,T.M.,Sprading,A.C. and Perimon, N. 1990. The ortodenticle gene encodes a novel homeo domain protein involve in the development of the Drosophila nervous system and acellar visual structures.Genes and Dev.4: 1516-1527.
Finkelstein,R. and Perimon,N. 1991. The molecular genetics and head development in Drosophila melanogaster. Development 112: 899-912.
Finkelstein,R. and Bonchinelli,E. 1994. From fly head to mammalian forebrain: the story of Otd and Otx. Trends in Genetics 10: 310-315.
Foley,A.C.,Storey,K.G. and Stern, C.D. 1997. The prechordal region lacks neural inducing ability,but can confer anterior character to more posterior neuroepithelium. Development 124:2983-2996.
Fredieu,J.R.,Cui,Y.,Maier,D.,Danilchik,M.V. and Christian,J.L. 1997. X wnt-8 and lithium can act upon either dorsal mesodermal cells to cause a loss of forebrain in Xenopus embryos. Dev.Biol. 186: 100-114.
Gans,C. and Northcutt,R.G. 1983. Neural crest and the origin of vertebrates: a new head. Science 220: 268-274.
Gaunt,S.J. 1994. Conservation in the Hox code during morphological evolution. Int.J.Dev.Biol. 38: 549-552.
Gehring,W.J. 1997. The discovery of the homeobox in retrospective. Taniguchi Symposium on Developmental Biology IX. Kyoto,Japan, p.45-50.
Gerhart,J.,Danilchik,M.,Doniach,T.,Roberts,S.,Rowning,B. and Stewart,R. 1989. Cortical rotation of the Xenopus egg, consequences for the anteroposterior pattern of embryonic dorsal development. Development Supplement 107: 37-51.
Gerhart,J. and Keller,R. 1986. Region-specific cell activities in amphibian gastrulation. Ann.Rev.Cell Biol.2: 201-229.
Gilbert,S.F. 1994. Developmental Biology (4th edn), p.586-622.
Glasgow,Е.,Karavanov,A.A. and David,I.B. 1997. Neuronal and neuroendocrine expression of Lim3,a LIM class homeobox gene, is altered in mutant zebrafish with axial signaling defects. Dev.Biol.192: 405-419.
Glinka,A.,Wu,W.,Onichtchouk,D.,Blumenstock,C. and Niehrs,C. 1997. Head induction by simultaneous repression of Bmp and Wnt signalling in Xenopus. Nature 389: 517-519.
Gorodilov,Y.N. 1992. Rhythmic processes in lower vertebrate embryogenesis and their role for developmental control. Zool.Sci. 9: 1101-1111.
Gorodilov,Y.N. 1996. Description of the early ontogeny of the Atlantic salmon, Salmo salar, with a novel system of interval (state) identification. Envir.Biol.Fish 47: 109-127.
Graff,J.M. 1997. Embryonic patterning:to BMP or not to BMP, that is the question. Cell 89: 171-174.
Graff,J.,Theis,R.,Song,J,Celeste,A.,and Melton,D. 1994. Studies with a Xenopus BMP receptor suggest that ventral mesoderm-inducing signals override dorsal signals in vivo.Cell 79: 169-179.
Graham,A.,Papolopulu,N. and Krumlauf,R. 1989. The murine and Drosophila homeobox gene complexes have common features of organization and expression. Cell 57: 367-378.
Hall,B.K. 1988. The neural crest. Oxford University Press. Oxford.
Hamburger,V. 1988. The heritage of experimental embryology. Hans Spemann and the organizer. Oxford University Press. New York.
Hamburger,V. and Hamilton,H.I. 1951. A series of normal stages in the development of the chick embryo. J.Morphol.88: 49-92.
Harland,R.M., and Gerhart,J. 1997. Formation and function of Spemann's organizer. Annu.Rev.Dev.Biol. 13: 611-667.
Hedgepeth,C.M.,Conrad,L.J.,Zheung,J,Huang,H.-C.,Lee,V.M.Y., and Klein, P.S. 1997. Activation the WNT signaling pathway: a molecular mechanism for lithium action. Dev. Biol. 185: 82-91.
Hemmati-Brivanlou,A., and Melton,D. 1997. Vertebrate embryonic cells will become nerve cells unless told otherwise. Cell 88: 13-17.
Hermesz,E.,Mackem,S. and Mahon,K.A. 1996. Rpx: a novel anterior-restricted homeobox gene progressively activated in the prechordal plate and Rathke's pouch of the mouse embryo. Development 122: 41-52.
Horder,T.J.,Presley,R. and Slipke J. 1993. The segmental bauplan of the rostral zone of the head in vertebrates. Function.Devel.Morphol. 3: 79-89.
Holland,N.D.,Panganiban,G.,Henyey,E.L., and Holland,L.Z. 1996. Sequence and developmental expression of Amphi Dll, an Amphio xus Distal-less gene transcribed in the ectoderm,epidermis and nervous system: insights into evolution of craniate forebrain and neural crest. Development 122: 2911-2920.
Holland,P.W.H.,Ingham,P. and Krauss,S. 1992. Mice and flies head to head. Nature 358: 627-628.
Holland,P.W.H.,Garsia-Fernandez,J.,Williams,N.A. and Sidow,A. 1994. Gene duplication and the origins of vertebrate development. Development Supplement: 125-133.
Holland,P.W.H. and Garsia-Fernandez,J. 1996. Hox genes and chordate evolution. Dev.Biol.173: 382-395.
Horigome,N.,Myojin,M.,Ueki,T.,Hirano,S.,Aizawa,S., and Kuratani,S. 1999. Development of cephalic neural crest in embryos of Lampetra japonica, with special reference to the evolution of the jaw. Dev.Biol. 207: 287-308.
Hunt,P.,Culisano,M.,Cook,M.,Sham,M.,Faiella,A.,Wilkinson,L.,Bonchinelli,E. and Krumlauf,R. 1991. A distinct Hox code for the branchial region of the head. Nature 353: 861-864.
Izpisua-Belmonte,J.C.,De Robertis,E.M.,Storey,K.G. and Stern,C.D. 1993. The homeobox gene goosecoid at the origin of organizer cells in the early chick blastoderm. Cell 74: 645-659.
Jacob,M.,Jacob,H.J.,Wachtler,F. and Christ,B. 1984. Ontogeny of avian extrinsic ocular muscles. 1.A light-and electronmicroscopic study. Cell Tissue Res. 237: 549-557.
Jacobson,A.G. 1988. Somitomeres: mesodermal segments of vertebrate embryos. Development 104 Supplement: 209-220.
Jacobson,A.G.,Miyamoto,D.M. and Mai,S.H. 1979. Rathke's pouch morphogenesis in the chick embryo. J.exp.Zool. 207: 351-365.
Jeffery,W.R. 1997. Evolution of ascidian development. BioScience 47: 417-425.
Jollie,M. 1977. The origin of the vertebrate brain. New York Academy of Sciences. Annals 299: 74-86.
Kawamura,K.,and Kikuyama,S. 1992. Evidence that hypophysis and hypothalamus constitute a single entity from the primary stage of histogenesis. Development 115: 1-9.
Kazanskaya,O.V.,Severtzova,E.A.,Barth,K.A.,Ermakova,G.V.,Lukyanov,S.A.,Benyumov,A.O.,
Pannese,M.,Bonchinelli,E.,Wilson S.W., and Zaraisky,A.G. 1997. Anf: a novel class of vertebrate homeobox genes expressed at the antarior end of the main embryonic axis. Gene 200: 25-34.
Keller,R.,Shih,J. and Sater,A. 1992. The cellular basis of the convergence and extension of the Xenopus neural plate. Dev.Dynam.193: 199-217.
Kessler,D.S. and Melton,D.A. 1994. Vertebrate emmbryonic induction: mesodermal and neural patterning. Science 266: 596-604.
Kikuyama,S.,Inaco,H.,Jenks,B.G. and Kawamura,K. 1993. Development of the ectopically transplanted primordium of epithelial hypophysis (anterior neural ridge) in Bufo japonicus embryos. J.exp.Zool. 266: 216-220.
Kimelman,D.,Christian,J.L.,and Moon,R.T. 1992. Synergistic principles of development:overlapping patterning systems in Xenopus mesoderm induction. Development 116: 1-9.
Kimura,S.,Hara,Y.,Pineau,T.,Fernandez-Salguero,P.,Fox,C.H.,Ward, J.M. and Gonzales,F.J. 1996. The T/ebp null mouse: thyroid- specific enhancer-binding protein is essential for the organogenesis of the thyroid,lung,ventral forebrain,and pituitary. Genes and Develop. 10: 60-69.
Kingsbury,B.F. and Adelmann,H.B. 1924. The morphological plan of the head. Quart.J.Micr.Sci.N.S.68: 239-285.
Kintner,C.R. and Dodd,J. 1991. Hensen's node induces neural tissue in Xenopus ectoderm. Implications for the action of the organizer in neurainduction. Development 113: 1495-1505.
Knoetgen,H.,Viebahn,G.,and Kessel,M. 1999. Head inductioon in the chick by primitive endoderm of mammalian, but not avian origin. Development 126: 815-825.
Kontges,G.,and Lumsden,A. 1996. Rhombencephalic neural crest segmentation is preserved throughout craniofacial ontogeny. Development 122: 3229-3242.
Kulesa,P.M.,and Fraser,S.E. 1998.Segmentation of the vertebrate hindbrain: a time-lapse analysis. Int.J.Dev.Biol. 42: 385-392.
Langille,R. and Hall,B.K. 1989. Developmental processes,developmental sequences and early vertebrate phylogeny. Biol.Rev.64: 73-91.
Lazzaro,D.,Price,M.,De Felice,M. and DiLauro,R. 1991. The transcription factor TTF-1 is expressed at the onset of thyroid and lung morphogenesis and in restricted regions of the foetal brain. Development 113: 1093-1104.
Lemaire,L.,Roeser,T.,Izpisua-Belmonte,J.C. and Kessel,M. 1997. Segregating expression domains of two goosecoid genes during the transition from gastrulation to neurulation in chick embryos. Development 124:1443-1452.
Lemaire,P.,Garett,N., and Gurdon J. 1995. Expression of Siamois, a Xenopus homeobox gene expressed in dorsal-vegetal cells of blastulae and able to induce a complete secondary axis. Cell 81: 85-94.
Lemaire,P.and Kodjabachian,L. 1996. The vertebrate organizer: structure and molecules. Trends in Genetics 12: 525-531.
LeSueur,J.A.,and Graff,J.M. 1999. Spemann organizer activity of Smad 10. Development 126:137-146.
Lewis,E. 1978. A gene complex controlling segmentation in Drosophila. Nature 276: 565-570.
Lewis,E. 1998. The bithorax complex: the first fifty years. Int.J.Dev.Biol.42: 403-415.
Lumsden,A.,and Keynes,R. 1989. Segmental patterns of neuronal development in the chick hindbrain. Nature 337: 424-428.
Lumsden,A. and Krumlauf,R. 1996. Patterning the vertebrate neuraxis. Science 274: 1109-1115.
Maderson,P.F.A. 1987. Developmental and Evolutionary Aspects of the Neural Crest. Wiley Interscience, John Wiley & Sons. New York.
Manac,J.R. and Scott,M.P. 1994. A class act: conservation of homeodomain protein functions. Development Supplement: 61-77.
Matsuo,I.,Kuratani,S.,Kimura,C.,Takeda,N. and Aizawa,S. 1995. Mouse Otx2 functions in the formation and patterning of rostral head. Genes and Development 9: 2646-2658.
Meier,S. 1981. Development of the chick embryo mesoblast: morphogenesis of the prechordal plate and cranial segments. Dev.Biol. 83: 49-61.
McGinnis,W.,Levine,M.S.,Hafen,E.,Kuroiva,A. and Gehring,W.J. 1984. A conserved DNA sequence in homeotic genes of the Drosophila Antennapedia and Bithorax complexes. Nature 308: 428-433.
McGinnis,W., Krumlauf,R. 1992. Homeobox genes and axial patterning. Cell 68: 283-301.
Niehrs,C. 1999. The molecular nature of Spemann's head organizer. Trends Genet. 15:314-319.
Niehrs,C.,Keller,R.,Cho,K.W.Y. and De Robertis,E.M. 1993. The homeobox gene goosecoid controls cell migrations in Xenopus embryos. Cell 72:491-503.
Nieuwkoop,P.D. 1969. The formation of the mesoderm in urodelean amphibians. I. Induction by the endoderm. Roux's Arch.Entw.Mech. Org. 162: 341-373.
Nieuwkoop,P.D.,and Faber,J. 1967. Normal Table of Xenopus laevis (Daudin). North-Holland,Amsterdam.
Northcutt,R.G. and Gans,C. 1983. The genesis of neural crest and epidermal placods: a reinterpretation of vertebrate origins. Quart. Rev.Biol. 58: 1-28.
Nusse,R.,and Varmus,H.E. 1992. Wnt genes. Cell 69: 1073-1087. Osumi-Yamashita,N.,Ninomiya,Y.,Doi,H. and Eto,K. 1994. The contribution of both forebrain and midbrain crest cells to the mesenchyme in the frontonasal mass of mouse embryos. Dev.Biol.164: 409-419.
Pannese,M.,Polo,C.,Andreazzoli,M.,Vignaij,R.,Kablar,B.,Barsacchi,G. and Bonchinelli,E. The Xenopus homologue of Otx2 is a maternal homeobox gene that demarcates and specifies anterior body regions. Development 121: 707-720.
Pera,E.M. and Kessel,M. 1997. Patterning of the chick forebrain anlage by the prechodal plate. Development 124: 4153-4162.
Psychyos,D. and Stern,C.D. 1996. Restoration of the organiser after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development 122: 3 263-3273.
Rosenquist,G.C. 1983. The chorda center in Hensen's node of the chick embryo. Anat.Rec. 207: 349-355.
Sander,K. 1993. Akademie-J. 1/93: 7-10.
Sasai, Y., Lu, B., Streinbesser,H., De Robertis, E.M. 1995. Regulation of neural induction by the Chd and BMP-4 antagonistic patterning signals in Xenopus. Nature 376: 333-336
Sater,A.K. and Jacobson,A.G. 1990. The role of the dorsal lip in the induction of heart mesoderm in Xenopus laevis. Development 108: 461-470.
Satoh,N. 1994. Developmental Biology of Ascidians. Cambridge Univ.Press, Cambridge, U.K.
Saxen,L. 1997. Hans Spemann and the regionalization of CNS. Taniguchi Symposium on Developmental Biology IX. Kyoto, Japan, p.40-44.
Scott,M.,Weiner,A.,Haselrigg,V.,Polisky,B.,Pirrota,V.,Scalenghe,F., Kaufman,T. 1983. The molecular organization of the Anten napedia locus of Drosophila. Cell 35: 763-776.
Seifert,R,Jacob,M. and Jacob,H.J. 1993. The avian prechordal head region: a morphological study. J.Anat. 183: 75-89.
Shawlot,W. and Behringer,R.R. 1995. Requirement for Lim1 in head-organizer function. Nature 374: 425-430.
Sheng,H.Z.,Moriyma,K.,Yamashita,T.,Li,H.,Potter,K.A.,Westphal,H. 1997. Multistep control of pituitary organogenesis. Science 278: 1809-1812.
Sheng,H.Z., and Westphal,H. 1999. Early steps in pituitary organogenesis. TIG 15: 236-240.
Sheng,H.Z.,Zhadanov,A.B.,Mosinger Jr,B.,Fujii,T.,Bertuzzi,S.,Grinberg,A.,Lee,E.J., Huang,S.-P.,Mahon,K.A.,Westphal,H. 1996. Specification of pituitary cell lineages by the LIM homeobox gene Lhx3. Science 272: 1004-1007.
Shih,J. and Fraser,S.E. 1996. Characterizing the zebrafish organizer: microsurgical analysis at the early-shield stage. Development 122: 1313-1322.
Simeone,A.,Acampora,D.,Gulisano,M.,Stornajuolo,A.,Boncinelli,E. 1993. Nested expression domains of four homeobox rostral brain. Nature 358: 687-690.
Simeone,A.,Acampora,D.,Mallalaci,A.,Stornajoulo,A.,D'Apice,M.R., Nigro,V.,Boncinelli,E. A vertebrate gene related to orthodenticle contains a homeodomain of the bicoid class and demarcates anterior neuroectoderm in the gastrulation mouse embryo. EMBO J. 12: 2735-2747.
Sive,H.L.,Hattori,K. and Weintraub,H. 1989. Progressive determination during formation of the antero-posterior axis in Xenopus laevis. Cell 58: 171-180.
Slack,J.M.W. 1991. From egg to embryo. Determinative events in early development. Cambridge University Press. Cambridge.
Smith,J.C. 1989. Mesoderm induction and mesoderm-inducing factors in early amphibian development. Development 105: 665-677.
Spemann,H. 1938. Embryonic development and induction. Jale Univ. Press. New Haven, Connecticut.
Spemann,H. and Mangold,H. 1924. Uber Induction von Embryonalanlagen durch Implantation artfremder Organisatoren. Arch. EntwMech. Org. 100: 599-638.
Spratt,N.T. 1955. Analysis of the organizer center in the early chick embryo. 1. Localization of prospective notochord and somite cells. J.exp.Zool. 128: 121-163.
Stachel,S.E.,Grunwald,D.J. and Myers,P.Z. 1993. Lithium perturbation and goosecoid expression identify a dorsal specification pathway in the pregastrula zebrafish. Development 117:1261-1274.
Steinbeisser,H. and De Robertis,E.M. 1993. Xenopus goosecoid: a gene expressed in the prechordal plate that has dorsalizating activity. Compt.Rend.Acad.Scienc.Paris 316: 966-971.
Storey,K.G.,Crossley,J.M.,De Robertis,E.M.,Norris,W.E.,and Stern, C.D. 1992. Neural induction and regionalization in the chick embryo. Development 114: 729-741.
Taira,M.,Jamrich,M.,Good,P.J. and David,I.B. 1992 . The LIM domain-containing homeobox gene Xlim-1 is expressed specifically in the organizer region of Xenopus gastrula embryos. Genes and Development 6: 358-366.
Taira,M.,Otani,H.,Saint-Jeannet,J.-P.,David,I.B. 1994. Role of the LIM class homeodomain protein Xlim-1 in neural and muscle induction by the Spemann organizer in Xenopus. Nature 372: 677-679.
Tam,P.P.L.,Steiner,K.A.,Zhou,S.X., and Quiman,G.A. 1997. Lineage and functional analysis of the mouse organizer. Cold Spring Harb.Symp.Quent.Biol.LXII: 115-125.
Thomas,P.Q.,Johnson,B.V.,Rathjen,P.D. 1995. Sequence, genomic organization, and expression of the novel homeobox gene Hesx1. Jour.Biol. Chem. 270: 3869-3875.
Wachtler,F. and Jacob,M. 1986. Origin and development of the cranial skeletal muscles. Biblio.Anat. 29: 24-46.
Watkins-Chow,D.E. and Camper S.A. 1998. How many homeobox genes does it take to make a pituitary gland? Trends Genet. 14: 284-290.
Weinstein,D.C.,Ruiz Altaba,A.,Chen,W.S.,Hoodless,P.,Prezioso,V.R., Jessel,T.M. and Darnell,J.E. 1994. The winged-helix transcription factor HNF-3beta is required for notochord development in the mouse embryo. Cell 78: 575-588.
Wilkinson,D.G. 1993. Molecular mechanisms of segmental patterning in the vertebrate hindbrain and neural crest. BioEssays 15: 499-505.
Zaraisky,A.G., Ecochard,V., Kazanskaya,O.V., Lukyanov,S.A., Fesenko,I.V. and Duprat,A.M. 1995. The homeobox-containing Gene XANF-1 may control development of the Spemann organizer. Development 121: 3839-3847.
Yamada,T. 1994. Caudalization by the amphibian organizer: brachyuri, convergent extension and retinoic acid. Development 120: 3051-3062.
Yasui,K.,Zhang,S.,Uemura,M.,Aizawa,S.,Ueki,T. 1998. Expression of a twist-related gene, Bbtwist during the development of a lancelet species and its relation to cephalochordate anterior structures. Dev.Biol. 195: 49-59.
Yuan,S. and Schoenwolf,G.C. 1999. Reconstitution of the organiizer is both sufficient and required to re-establish a fully patterned body plan in avian embryos. Development 126: 2461-2473.
Городилов Юрий Николаевич Биологический научно-исследовательский институт Санкт-Петербургского государственного университета, г. Санкт-Петербург Служ.адрес: 198904 С.Петербург, Старый Петергоф, Ораниенбаумское шоссе 2, Биологический институт Дом.адрес: 198904 С.Петербург, Старый Петергоф, а/я 72 Тел.дом.: 428-7914; 428-8416 Факс: 812 - 427- 7310