Retinoic Acid, A Regeneration-Inducing Molecule DEVELOPMENTAL DYNAMICS 226:237 –244,2003 | |
|
Retinoic acid (RA)is the biologically active metabolite of vitamin A.It is a low molecular weight,lipophilic molecule that acts on the nucleus to induce gene transcription.In amphibians and mammals,it induces the regeneration of several tissues and organs and these examples are reviewed here.RA induces the "super-regeneration" of organs
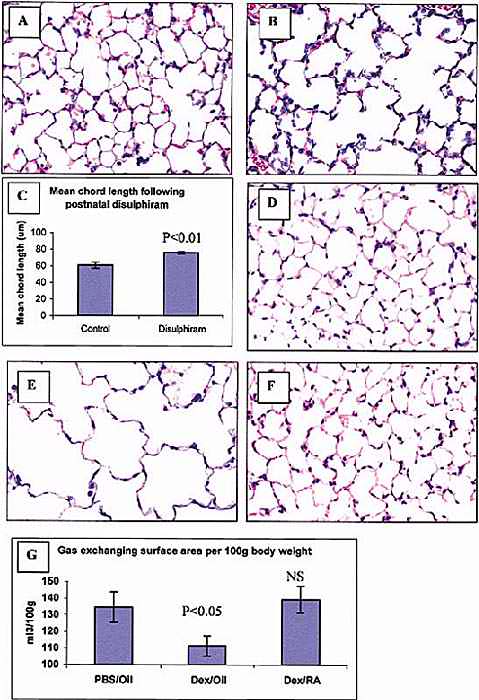
that can already regenerate such as the urodele amphibian limb by respecifying positional information in the limb.In organs that cannot normally regenerate such as the adult mammalian lung, RA induces the complete regeneration of alveoli that have been destroyed by various noxious treatments. In the mammalian central nervous system (CNS), which is another tissue that cannot regenerate, RA does not induce neurite outgrowth as it does in the embryonic CNS, because one of the retinoic acid receptors,RARb;2 is not up-regulated. When RARb;2 is transfected into the adult spinal cord in vitro,then neurite outgrowth is stimulated. In all these cases, RA is required for the development
of the organ,in the first place suggesting that the same gene pathways are likely to be used for both development and regeneration. This suggestion,therefore,might serve as a strategy for identifying potential tissue or organ targets that have the capacity to be stimulated to regenerate.
| |
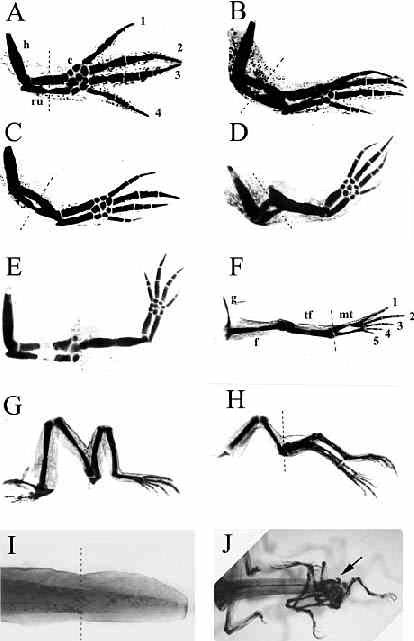 Fig.1.Retinoic acid (RA)induces super-regeneration in amphibian limbs and tails. Victoria blue .stained whole-mounts show the cartilage patterns.A:Control axolotl forelimb that had been amputated through the mid-radius and ulna (broken line) and regenerated perfectly.h,humerus;ru,radius andulna;c,carpals;1,2,3,4,digits.B:Limb amputated through the mid-radius and ulna (broken line)and treated with a low level of retinoids, which regenerated an extra radius and ulna in tandem with the original.C: Limb amputated through the mid-radius and ulna (broken line)and treated with a medium
level of retinoids,which regenerated an extra elbow joint and then forearm.D:Limb
amputated through the mid-radius and ulna (broken line)and treated with a high level of
retinoids,which regenerated a complete limb from the amputation plane.E:Limb amputated through the carpals (broken line)and treated with a high level of retinoids, which
regenerated a complete limb from the amputation plane.F:Control Rana temporaria
hindlimb, which was amputated through the foot (broken line)and regenerated perfectly.
g,girdle;f,femur;tf,tibia and fibula;mt,metatarsals;1,2,3,4,5,digits.G: Rana hindlimb
amputated through the foot (broken line)and treated with a high level of retinoids, which regenerated a complete limb from the amputation plane.H:Rana hindlimb amputated
through the foot (broken line)and treated with a high level of retinoids, which regenerated a pair of limbs,including the pelvic girdle from the amputation plane.I:Control Rana temporaria tail,which was amputated (broken line)and which regenerated perfectly.J: Rana temporaria tail amputated through the mid-point and treated with a high level of retinoids,which regenerated two pairs of hindlimbs,including the pelvic girdles (arrow) from the amputation plane.
Fig.1.Retinoic acid (RA)induces super-regeneration in amphibian limbs and tails. Victoria blue .stained whole-mounts show the cartilage patterns.A:Control axolotl forelimb that had been amputated through the mid-radius and ulna (broken line) and regenerated perfectly.h,humerus;ru,radius andulna;c,carpals;1,2,3,4,digits.B:Limb amputated through the mid-radius and ulna (broken line)and treated with a low level of retinoids, which regenerated an extra radius and ulna in tandem with the original.C: Limb amputated through the mid-radius and ulna (broken line)and treated with a medium
level of retinoids,which regenerated an extra elbow joint and then forearm.D:Limb
amputated through the mid-radius and ulna (broken line)and treated with a high level of
retinoids,which regenerated a complete limb from the amputation plane.E:Limb amputated through the carpals (broken line)and treated with a high level of retinoids, which
regenerated a complete limb from the amputation plane.F:Control Rana temporaria
hindlimb, which was amputated through the foot (broken line)and regenerated perfectly.
g,girdle;f,femur;tf,tibia and fibula;mt,metatarsals;1,2,3,4,5,digits.G: Rana hindlimb
amputated through the foot (broken line)and treated with a high level of retinoids, which regenerated a complete limb from the amputation plane.H:Rana hindlimb amputated
through the foot (broken line)and treated with a high level of retinoids, which regenerated a pair of limbs,including the pelvic girdle from the amputation plane.I:Control Rana temporaria tail,which was amputated (broken line)and which regenerated perfectly.J: Rana temporaria tail amputated through the mid-point and treated with a high level of retinoids,which regenerated two pairs of hindlimbs,including the pelvic girdles (arrow) from the amputation plane. 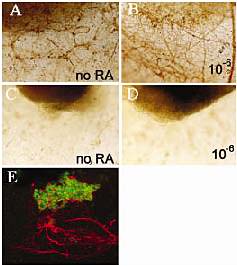 Рис.2.Retinoic acid (RA)receptor β2 (RARβ2) induces neurite outgrowth in adult mouse spinal cord in vitro. Neuro filament immunoreactivity of whole-mount cultures.A: Control embryonic day 13.5 mouse spinal cord cultured for 5 days in cellagen organ culture in delipidated serum.Some neurites grow out from the cord into the cellagen.B: Embryonic day 13.5 mouse spinal cord cultured for 5 days in cellagen organ culture with added RA (10-6 M).Many more neurites have grown out.C:Adult mouse spinal cord cultured for 5 days in cellagen organ culture in delipidated serum.No neurites grow out.D: Adult mouse spinal cord cultured for 5 days in cellagen organ culture with added RA (10-6M).No neurites grow out. E: Adult mouse spinal cord transfected with a lentiviral vector
containing the RARβ2 gene. The region of transfection is shown by .uorescein isothiocyanate .labelled anti-Flag immuno .uorescence (green).From this region and not from anywhere else, neurites have grown out,as visualised by Texas Red secondary labelling of neurofilament (NF-200)immunostaining (red).
Рис.2.Retinoic acid (RA)receptor β2 (RARβ2) induces neurite outgrowth in adult mouse spinal cord in vitro. Neuro filament immunoreactivity of whole-mount cultures.A: Control embryonic day 13.5 mouse spinal cord cultured for 5 days in cellagen organ culture in delipidated serum.Some neurites grow out from the cord into the cellagen.B: Embryonic day 13.5 mouse spinal cord cultured for 5 days in cellagen organ culture with added RA (10-6 M).Many more neurites have grown out.C:Adult mouse spinal cord cultured for 5 days in cellagen organ culture in delipidated serum.No neurites grow out.D: Adult mouse spinal cord cultured for 5 days in cellagen organ culture with added RA (10-6M).No neurites grow out. E: Adult mouse spinal cord transfected with a lentiviral vector
containing the RARβ2 gene. The region of transfection is shown by .uorescein isothiocyanate .labelled anti-Flag immuno .uorescence (green).From this region and not from anywhere else, neurites have grown out,as visualised by Texas Red secondary labelling of neurofilament (NF-200)immunostaining (red).