Основная функция нервной системы - интерпретация средовых сигналов, осуществляемая через различные органы чувств, и передача информации в мозг. Для решения этой задачи, поступающая информация должна быть организована соответствующим и эффективным образом. Наиболее эффективная организация достигается с помощью так называемых топографических карт, присутствующих во всем мозге (Kaas,1997).
Топографическая карта – это проекция из одной группы нейронов в другую, когда «получающая» группа клеток отражает связи соседних проецирующих клеток. В нервной системе высших позвоночных топографические карты включают сенсорные карты тела, tonotopic карты слуховых стимулов и карты визуального поля. Более того, топографические карты персистируют по схеме от первого порядка к более высокому порядку связей.
| |
|
THE ACCESSORY OLFACTORY SYSTEM
The vomeronasal organ (VNO), located in the ventral nasal
cavity, projects to the accessory olfactory bulb (AOB), found
posterior-dorsal to the main olfactory bulb using zonal topography.
Neurons in apical VNO project to anterior AOB, and
neurons in basal VNO project to posterior AOB (Figure 5).
VNO neurons expressing a given pheromone receptor form
multiple glomeruli within eachAOBhalf (Belluscio et al. 1999,
Rodriguez et al. 1999). The distributions and known activities
of several families of guidance molecules are described in
Figure 5. As in the visual system, distinct combinations of
attractive and repellent molecular activities guide VNO axons
to their topographically appropriate zones (Knoll & Drescher
2002). The possibility that neuropilin-2 shapes the gradient
of secreted semaphorins is an important concept to be considered
in all systems. Furthermore, the apparent use of the
GPI-linked ephrin-As as guidance receptors (or part of a receptor
complex) has important consequences for models of
topographic mapping. The accessory olfactory system, owing
to its expression of several molecular guidance families in
relatively simple patterns and its zonal topography, is an excellent
model system to examine the combinatorial interactions
between, and within, families of guidance molecules. |
Развитие топографических карт было изучено в нескольких проекционных системах позвоночных – таламокортикальной (Dufour et al. 2003, Vanderhaeghen & Polleux 2004), гиппокампсептальной (Gao et al. 1996, Yue et al. 2002), ольфакторно/вомероназальной (Sidebar 1), системе двигательных аксонов в мышцы (Feng et al. 2000, Nguyen et al.2002), и в сетчатке. Последняя система, сформированная аксонами ганглиозных клеток сетчатки (retinal ganglion cells - RGCs) к их наиболее известным мишеням среднего мозга – оптическому тектуму (optic tectum - OT) у рыб, амфибий и цыплят или к верхнему колликулусу (superior colliculus - SC) у млекопитающих, стала основной моделью для изучения развития топографических карт и градиентов сигнальных («управляющих») молекул, контролирующих их формирование. Авторы акцентировали свое внимание на зрительной системе и на механизмах картирования в мишенях с тем, чтобы детализировать развитие нейральной карты у позвоночных и осветить молекулярные механизмы контроля этого процесса. Роль ростовых конусов и запутанность множества взаимодействующих сигнальных путей рассмотрены в работах (обзоры Huber et al. 2003, van Horck et al. 2004). Наибольшее внимание уделяется млекопитающим и куриному эмбриону, у которых аксональные механизмы развития карты нуждаются в уникальных действиях топографических молекул-гидов (guidance molecules) в специфической временной последовательности. Наряду с этим приводятся примеры механизмов и молекул, участвующих в развитии карт низших позвоночных – лягушек и рыб. Репрезентация сетчатки на OT и SC может быть довольно простой для картирования двух ортогонально ориентированных осей – темпорально-назальной (temporal-nasal - TN) оси сетчатки вдоль передне-задней оси (anterior-posterior axis -AP) OT/SC, и дорсо-вентральной (dorsal-ventral - DV) оси сетчатки вдоль lateral-medial (LM) оси OT/SC (соответственно ventral-dorsal OT оси у немлекопитающих позвоночных).
Критерием топографических молекул-гидов в ретинотектальной проекции является их градуированная и ограниченная экспрессия в сетчатке или в OT/SC, а также тот факт, что RGC аксоны из различных частей сетчатки по разному реагируют на эти молекулы и оказывают эффект на RGS картирование in vivo.
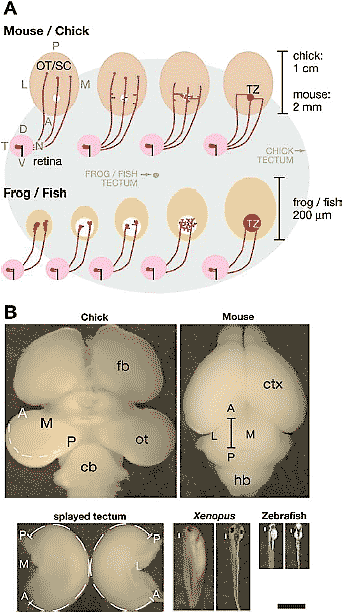 Figure 1
Development of the retinotopic projection and
relative scale of the tectum in primary model
species. (A, Top) In mouse and chick, RGC axons
enter the OT/SC and initially extend well
posterior to the location of their future
termination zone (TZ) (circle). Interstitial branches
form along the axon shaft in a distribution biased
for the AP location of the TZ and subsequently
exhibit bidirectional growth along the LM axis
toward their correct TZ. Upon reaching their TZ,
branches elaborate complex arbors and the initial
axon overshoot is eliminated. All arbors are
formed by interstitial branches. (A, Bottom) In frog
(Xenopus laevis) and zebrafish, the tectum and
retina expand throughout the development of the
retinal projection. During retinotopic map
development the tectum is much smaller in
relation to a typical growth cone in frog and fish
than in chick and mouse. RGC axons extend into
the tectum and elaborate many small branches
from the base of the growth cone. Arbors
elaborate from these backbranches and the
thinned growth cone. The TZ becomes dense and
refines as the tectum enlarges. (A, Background )
The two ovals in the background represent the
relative sizes of the chick tectum (large oval ) and
frog or zebrafish tectum (small oval ). (B ) The
photographs are at the same scale. The chick OT
rotates during development such that the posterior
pole (P) is near the midline. The OT is cut along
the AP axis at the LM midline (dashed line) and
splayed. The distance from the anterior to
posterior pole along the cut edge is 1 cm (dashed
lines in the splayed tectum). The mouse SC is about
2 mmalong the AP pole at the LM midline (bar).
For frog and zebrafish the entire animal is shown
in lateral and dorsal views. The white bar on the
left of each panel represents the approximate AP
position and size of the tectum. The tecta for these
organisms are approximately 200 µm along the
AP axis. cb, cerebellum; ctx, cortex; fb, forebrain;
hb, hindbrain. Scale bar = 2 mm. Adapted from
McLaughlin et al. 2003a.
Figure 1
Development of the retinotopic projection and
relative scale of the tectum in primary model
species. (A, Top) In mouse and chick, RGC axons
enter the OT/SC and initially extend well
posterior to the location of their future
termination zone (TZ) (circle). Interstitial branches
form along the axon shaft in a distribution biased
for the AP location of the TZ and subsequently
exhibit bidirectional growth along the LM axis
toward their correct TZ. Upon reaching their TZ,
branches elaborate complex arbors and the initial
axon overshoot is eliminated. All arbors are
formed by interstitial branches. (A, Bottom) In frog
(Xenopus laevis) and zebrafish, the tectum and
retina expand throughout the development of the
retinal projection. During retinotopic map
development the tectum is much smaller in
relation to a typical growth cone in frog and fish
than in chick and mouse. RGC axons extend into
the tectum and elaborate many small branches
from the base of the growth cone. Arbors
elaborate from these backbranches and the
thinned growth cone. The TZ becomes dense and
refines as the tectum enlarges. (A, Background )
The two ovals in the background represent the
relative sizes of the chick tectum (large oval ) and
frog or zebrafish tectum (small oval ). (B ) The
photographs are at the same scale. The chick OT
rotates during development such that the posterior
pole (P) is near the midline. The OT is cut along
the AP axis at the LM midline (dashed line) and
splayed. The distance from the anterior to
posterior pole along the cut edge is 1 cm (dashed
lines in the splayed tectum). The mouse SC is about
2 mmalong the AP pole at the LM midline (bar).
For frog and zebrafish the entire animal is shown
in lateral and dorsal views. The white bar on the
left of each panel represents the approximate AP
position and size of the tectum. The tecta for these
organisms are approximately 200 µm along the
AP axis. cb, cerebellum; ctx, cortex; fb, forebrain;
hb, hindbrain. Scale bar = 2 mm. Adapted from
McLaughlin et al. 2003a.
Благодаря успехам молекулярной биологии и расшифровке генома, можно предположить, что большинство «игроков» топографического «управления» известно, но их роли и взаимодействие пока не изучены. Странным является то, что в настоящее время единственными молекулами, удовлетворяющими критерию молекул топографического «управления», являются рецепторы и лиганды семейства
Eph/ephrin, причем не только в ретинотектальной, но и в других системах, где было изучено развитие топографической карты. Некоторые молекулы, например, RGM (repulsive guidance molecule) и semaphorins, также в некоторой степени удовлетворяют описанным выше критериям. Разнообразие и сложность паттерна экспрессии Ephs и ephrins в пространстве и времени и особенности их функций обеспечивают широкие возможности в отношении их сигнальных свойств и, следовательно, в отношении их активности в качестве молекул-гидов. Регуляция mRNA, локализация белка и внутриклеточная интеграция ориентиров-гидов (ориентиров управления), так же как и влияние на рост субстрата освещены в обзорах (Bassell & Kelic 2004, Huber et al. 2003, van Horck et al. 2004).
Многие молекулы-гиды, включая Ephs и ephrins, имеют множественную, нередко противоположную активность, и выбор доминирующей активности в определенном контексте является критическим для развития топографической карты. Сигнальные пути, соединяющие guidance рецепторы с цитоскелетом и с молекулами cell-attachment (например, integrins), определяют функциональную активность (Davy & Robbins 2000, Gallo & Letourneau 2004, Nakamoto et al. 2004).
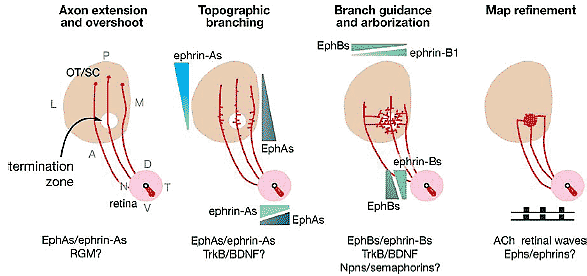 Figure 2
Mechanisms and molecules controlling retinotopic mapping in chicks and rodents. The names and/or distributions of molecules known, or potentially able, to control the dominant mechanisms at each stage
are listed. The gradients represent the consensus distribution for a combination of related molecules (i.e.,
ephrin-A’s), which are not listed individually owing to distinctions in the individual members expressed and the precise distributions between species. Molecules other than those listed are likely to participate.
Figure 2
Mechanisms and molecules controlling retinotopic mapping in chicks and rodents. The names and/or distributions of molecules known, or potentially able, to control the dominant mechanisms at each stage
are listed. The gradients represent the consensus distribution for a combination of related molecules (i.e.,
ephrin-A’s), which are not listed individually owing to distinctions in the individual members expressed and the precise distributions between species. Molecules other than those listed are likely to participate.
Успехи в изучении развития ретинотопической (retinotopic) карты доказали участие guidance molecules в картировании DV оси сетчатки вдоль LM оси OT/SC. Кроме того, идентифицирована роль молекул, участвующих в картировании TN оси сетчатки вдоль AP оси OT/SC. Благодаря компьютерным моделям и генетическим исследованиям ретинотопическая карта была значительно усовершенствована в последние годы.
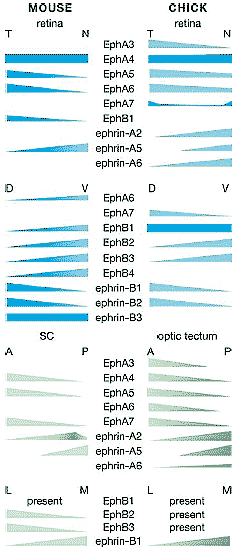 Figure 3
Expression of Ephs and ephrins in the
retinocollicular/retinotectal systems of mouse and
chick. The table represents our view of the
consensus expression patterns for individual Ephs
and ephrins in the retina (and likely RGCs) and
OT/SC (in positions likely to affect mapping)
during the primary molecular-dependent events in
topographic map formation (about E15-P7 in
mouse and E6-E14 in chick). The list may not be
complete, and exclusion from this chart does not
necessarily signify absence of expression in vivo.
The sizes and shapes of the gradients are
generalized, and relative expression levels should
not be inferred (for an example of relative
expression levels of Eph receptors see Reber et al.
2004).We have included only Eph family members
with published expression domains determined by
in situ hybridization with antisense riboprobes or
specific antibodies in preparations where the listed
pattern is evident at an appropriate age. A,
anterior; D, dorsal; L, lateral; M, medial; N, nasal;
P, posterior; present, receptor is expressed but the
pattern is unclear; T, temporal; V, ventral.
Toward Discovering Graded Topographic Guidance Molecules
Figure 3
Expression of Ephs and ephrins in the
retinocollicular/retinotectal systems of mouse and
chick. The table represents our view of the
consensus expression patterns for individual Ephs
and ephrins in the retina (and likely RGCs) and
OT/SC (in positions likely to affect mapping)
during the primary molecular-dependent events in
topographic map formation (about E15-P7 in
mouse and E6-E14 in chick). The list may not be
complete, and exclusion from this chart does not
necessarily signify absence of expression in vivo.
The sizes and shapes of the gradients are
generalized, and relative expression levels should
not be inferred (for an example of relative
expression levels of Eph receptors see Reber et al.
2004).We have included only Eph family members
with published expression domains determined by
in situ hybridization with antisense riboprobes or
specific antibodies in preparations where the listed
pattern is evident at an appropriate age. A,
anterior; D, dorsal; L, lateral; M, medial; N, nasal;
P, posterior; present, receptor is expressed but the
pattern is unclear; T, temporal; V, ventral.
Toward Discovering Graded Topographic Guidance Molecules
Механизмы, контролирующие развитие топографических карт, изучаются уже несколько десятилетий. Однако только в последнее время стала возможной идентификация молекулярного контроля этого процесса.
Хемоаффинная (chemoaffinity гипотеза, предложенная Roger Sperry почти полвека назад, предсказала молекулярные механизмы развития топографических карт (1963). Sperry предположил, что молекулярные метки (tags) на проецирующихся аксонах и их клетках-мишенях детерминируют специфичность аксональных связей в нейральной карте. Более того, он предположил, что такие молекулярные метки могут распределяться по градиенту, который метит соответствующие участки в сенсорных структурах и в их мишенях. И хотя гипотеза Sperry базировалась на изучении регенерации ретинотектальной проекции у тритонов и лягушек, она определила направление исследований в области изучения развития топографических карт. Основной принцип гипотезы был довольно прост (Benson et al. 2001), однако последующие математические модели усовершенствовали гипотезу - добавились контрградиенты аттрактантов ( Gierer 1983) и градуированные репелленты (Gierer,1987), проведены более точные расчеты, особенно последовательных фаз сложного поведения RGC аксонов во время развития карты в OT/SC высших позвоночных (Yates et al. 2004).
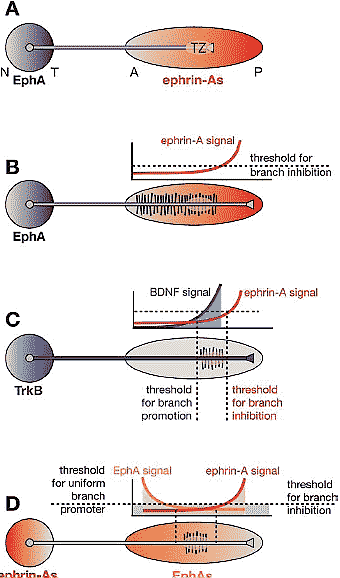 Figure 4
Requirement for two molecular activities to
control branch distribution along the AP axis.
(A) A gradient of repulsive guidance molecules,
such as ephrin-As, is in principle sufficient to guide
RGC axonal growth cones topographically to their
appropriate TZ. This is the mapping mechanism
in lower vertebrates. (B) However, a single
repulsive gradient cannot result in the topographic
branching observed in chicks and rodents. If the
inhibitory signal allows for branching at the TZ, it
must also allow for branching anterior to the TZ
at the same, or higher, levels. This is not observed
in vivo. (C) Gradients of molecules with
branch-promoting activities could act in concert
with inhibitory activities to result in branching
restricted to the topographically appropriate
domain. TrkB, in a similar distribution to EphAs in
the retina (and/or if TrkB were graded along each
RGC axon), and brain-derived neurotrophic factor
(BDNF), in the OT/SC, have the appropriate
activities to act with EphAs/ephrin-As in mapping.
(D) Gradients of branch-inhibiting molecules in
gradients opposite the EphA/ephrin-A gradients
depicted in (A) could also result in topographic
branching. Dual inhibitory gradients would
require either a branching mechanism intrinsic to
RGC axons or a branch-promoting molecule (blue
shading) distributed to allow branching at the low
point of the combined inhibitory gradients. The
distributions of ephrin-As in the retina and EphAs
in the OT/SC fulfill these requirements
Figure 4
Requirement for two molecular activities to
control branch distribution along the AP axis.
(A) A gradient of repulsive guidance molecules,
such as ephrin-As, is in principle sufficient to guide
RGC axonal growth cones topographically to their
appropriate TZ. This is the mapping mechanism
in lower vertebrates. (B) However, a single
repulsive gradient cannot result in the topographic
branching observed in chicks and rodents. If the
inhibitory signal allows for branching at the TZ, it
must also allow for branching anterior to the TZ
at the same, or higher, levels. This is not observed
in vivo. (C) Gradients of molecules with
branch-promoting activities could act in concert
with inhibitory activities to result in branching
restricted to the topographically appropriate
domain. TrkB, in a similar distribution to EphAs in
the retina (and/or if TrkB were graded along each
RGC axon), and brain-derived neurotrophic factor
(BDNF), in the OT/SC, have the appropriate
activities to act with EphAs/ephrin-As in mapping.
(D) Gradients of branch-inhibiting molecules in
gradients opposite the EphA/ephrin-A gradients
depicted in (A) could also result in topographic
branching. Dual inhibitory gradients would
require either a branching mechanism intrinsic to
RGC axons or a branch-promoting molecule (blue
shading) distributed to allow branching at the low
point of the combined inhibitory gradients. The
distributions of ephrin-As in the retina and EphAs
in the OT/SC fulfill these requirements
В соответствии с хемоаффинной гипотезой каждая точка в OT/SC должна иметь уникальный молекулярный адрес, детерминированный градуированным распределением топографических молекул-гидов вдоль двух тектальных осей и таким же образом каждая RGS должна иметь уникальный профиль рецепторов для этих молекул, что приводило бы к зависимой от расположения и дифференциальной реакции на них RGC аксонов. В последующие десятилетия была изучена специфика проекций RGC аксонов к тектальным клеткам с использованием анализа проекций аксонов у нормальных животных и после экспериментальных манипуляций – сначала в регенерирующей ретинотектальной системе рыб и амфибий и позже, по мере развития высокоразрешающих методов исследования (мечение аксонов), - в развивающихся ретинотектальных/ретиноколликулярных проекциях. Эти исследования подтвердили основной догмат хемоаффинной гипотезы о том, что в установлении топографических проекций участвуют RGC аксоны, реагирующие на позиционную информацию в OT/SC. Изучение молекул, имеющих свойства, которые могли бы играть роль в картировании, выполнялось множеством лабораторий. Несколько поверхностно-клеточных молекул, таких как TRAP (McLoon 1991) и TOPAP (Savitt et al. 1995), с градуированным или ограниченным паттернами в сетчатке и/или в OT/SC были идентифицированы еще в середине 1990-х годов, но их функциональная роль оставалась неизвестной (обзор Roskies et al. 1995). Первое описание graded (ранжированных, градуированных) молекул, имеющих свойства топографических молекул-гидов, появилось только 10 лет назад в связи с клонированием двух родственных генов -
ephrin-A2 (ранее Eph ligand family-1, или ELF-1) (Cheng et al. 1995, Cheng & Flanagan 1994) и
ephrin-A5, описанный Bonhoeffer, Drescher, и соавт. (изначально названый repulsive axon guidance signal или RAGS) (Drescher et al. 1995). Оба они являются лигандами receptor tyrosine kinase EphA3 (ранее MEK4), экспрессируемые в градуированном паттерне вблизи RGCs (Cheng et al. 1995). Позже было показано, что ephrin-A2 и ephrin-A5 соответствуют функциональным критериям для graded топографических управляющих молекул, т.е. они имели дифференциальную реакцию на них RGC аксонов (ephrin-A2: Nakamoto et al. 1996; ephrin-A5: Drescher et al. 1995, Monschau et al. 1997), оказывали влияние на ретинотопическое картирование in vivo, и были необходимы для корректного развития карты (ephrin-A2: Nakamoto et al. 1996, Feldheim et al. 2000; ephrin-A5: Frisen et al. 1998).
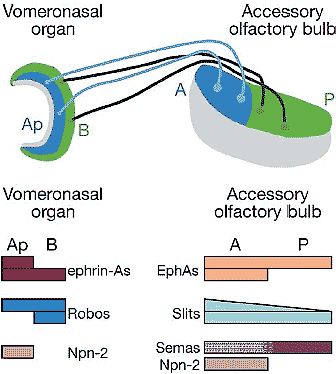 Figure 5
Representation of the accessory olfactory system in cross section. Apical (Ap, blue) vomeronasal (VNO) neurons (light blue) extend axons into the anterior (A, blue) accessory olfactory bulb (AOB) and form glomeruli. Basal (B, green) VNO neurons (dark green) extend axons into posterior (P, green) AOB and form glomeruli. This zonal topography is controlled by the guidance molecules charted below the illustration in representative form. Neuropilin-2 (Npn-2) in the AOB is present primarily in the anterior external plexiform layer of the AOB (gray) and may act to sequester secreted
semaphorins (Semas), thus converting the uniform expression of secreted
semaphorins in the AOB into a functional distribution of semaphorin
protein (purple stippled area) highest in posterior AOB by reducing the
availability of ligand in anterior AOB. Apical VNO neurons are guided to
anterior AOB by attractive ephrin-A/EphA interactions and repellent
Npn-2/sema interactions, whereas basal VNO neurons are guided to
posterior AOB by repellent Robo/Slit interactions (Cloutier et al. 2002,
2004; Knoll et al. 2001, 2003;Walz et al. 2002). Other activities may play a role as well, and the described activities likely act in concert with pheromone receptors and other guidance cues (such as MHC class
molecules; Loconto et al. 2003) to control the formation of glomeruli
(Belluscio et al. 1999, Rodriguez et al. 1999). The gray area in the VNO
represents the lumen.
Figure 5
Representation of the accessory olfactory system in cross section. Apical (Ap, blue) vomeronasal (VNO) neurons (light blue) extend axons into the anterior (A, blue) accessory olfactory bulb (AOB) and form glomeruli. Basal (B, green) VNO neurons (dark green) extend axons into posterior (P, green) AOB and form glomeruli. This zonal topography is controlled by the guidance molecules charted below the illustration in representative form. Neuropilin-2 (Npn-2) in the AOB is present primarily in the anterior external plexiform layer of the AOB (gray) and may act to sequester secreted
semaphorins (Semas), thus converting the uniform expression of secreted
semaphorins in the AOB into a functional distribution of semaphorin
protein (purple stippled area) highest in posterior AOB by reducing the
availability of ligand in anterior AOB. Apical VNO neurons are guided to
anterior AOB by attractive ephrin-A/EphA interactions and repellent
Npn-2/sema interactions, whereas basal VNO neurons are guided to
posterior AOB by repellent Robo/Slit interactions (Cloutier et al. 2002,
2004; Knoll et al. 2001, 2003;Walz et al. 2002). Other activities may play a role as well, and the described activities likely act in concert with pheromone receptors and other guidance cues (such as MHC class
molecules; Loconto et al. 2003) to control the formation of glomeruli
(Belluscio et al. 1999, Rodriguez et al. 1999). The gray area in the VNO
represents the lumen.
До обнаружения ephrins большинство доказательств о существовании управляющих топографических молекул следовало из работ группы Bonhoeffer, проводимых in vitro –membrane stripe оценка и изучение последствий коллапса ростовых конусов. Используя оценку membrane stripe, авторы показали, что темпоральные аксоны RGС куриного эмбриона, имеющие выбор между ростом на альтернативных lanes передних и задних тектальных мембран, росли преимущественно на своих топографически подходящих anterior мембранах, тогда как назальные RGС аксоны не проявляли никаких преимуществ.
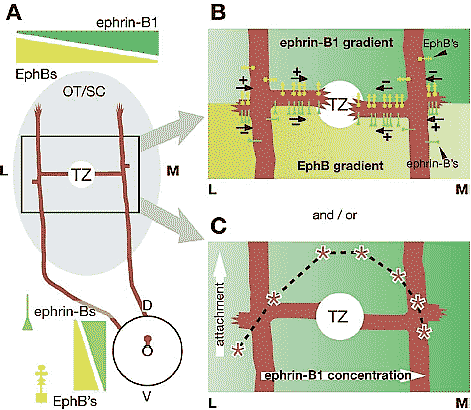 Figure 6
Potential bidirectional and bifunctional interactions resulting in topographic branch guidance along the
LM axis of the OT/SC. (A) Representation of the projection from two RGCs in the same retinal location. One RGC axon has extended lateral (L) to the TZ and preferentially extends branches medially,
toward the TZ. The other RGC axon has extended medial (M) to the TZ and preferentially extends branches laterally, toward the TZ. (B) EphBs and ephrin-Bs can cooperate via bifunctional and bidirectional signaling to guide branches appropriately both medially and laterally. The top half of this panel summarizes in vivo data demonstrating branch guidance by EphBs ( yellow icons) on RGC axons. Lateral to the TZ (left axon), EphB receptors encounter an ephrin-B1 level (green gradient) lower than
that at their TZ (circle) and, at that relatively low level of ephrin-B1, branches are attracted up the ephrin-B1 gradient. Branches initially probing down the ephrin-B1 gradient from this axon have no
incentive to do so and do not extend. Medial to the TZ (right axon), EphB receptors encounter a relatively high level of ephrin-B1 that repels branches down the ephrin-B1 gradient. The bottom half of
this panel illustrates potential reverse signaling events. Lateral to the TZ, ephrin-Bs (green icons) on RGC axons encounter a higher level of EphBs ( yellow gradient) than that at the TZ and thus are repulsed down the gradient. Medial to the TZ, ephrin-Bs along RGC axons encounter a relatively low level of EphBs, and branches are attracted up the EphB gradient laterally toward the TZ. (C) Branches may also be
guided to the TZ by forward signaling if EphBs act as ligand density sensors. Overlaid on the schematic are data from Huynh-do et al. (1999) showing EphB-expressing cell attachment ( y-axis) on substrates
containing different concentrations of ephrin-B1 (x-axis). At low concentrations (i.e., lateral to the TZ), attachment is favored at a higher concentration (i.e., medial positions). At high concentrations
(i.e., medial to the TZ) increased attachment is favored at a lower concentration (i.e., lateral positions). RGC axonal branches may be guided by a similar principle. The point of maximal attachment for each
RGC axon is centered on the TZ and is dependent on its EphB concentration.
Figure 6
Potential bidirectional and bifunctional interactions resulting in topographic branch guidance along the
LM axis of the OT/SC. (A) Representation of the projection from two RGCs in the same retinal location. One RGC axon has extended lateral (L) to the TZ and preferentially extends branches medially,
toward the TZ. The other RGC axon has extended medial (M) to the TZ and preferentially extends branches laterally, toward the TZ. (B) EphBs and ephrin-Bs can cooperate via bifunctional and bidirectional signaling to guide branches appropriately both medially and laterally. The top half of this panel summarizes in vivo data demonstrating branch guidance by EphBs ( yellow icons) on RGC axons. Lateral to the TZ (left axon), EphB receptors encounter an ephrin-B1 level (green gradient) lower than
that at their TZ (circle) and, at that relatively low level of ephrin-B1, branches are attracted up the ephrin-B1 gradient. Branches initially probing down the ephrin-B1 gradient from this axon have no
incentive to do so and do not extend. Medial to the TZ (right axon), EphB receptors encounter a relatively high level of ephrin-B1 that repels branches down the ephrin-B1 gradient. The bottom half of
this panel illustrates potential reverse signaling events. Lateral to the TZ, ephrin-Bs (green icons) on RGC axons encounter a higher level of EphBs ( yellow gradient) than that at the TZ and thus are repulsed down the gradient. Medial to the TZ, ephrin-Bs along RGC axons encounter a relatively low level of EphBs, and branches are attracted up the EphB gradient laterally toward the TZ. (C) Branches may also be
guided to the TZ by forward signaling if EphBs act as ligand density sensors. Overlaid on the schematic are data from Huynh-do et al. (1999) showing EphB-expressing cell attachment ( y-axis) on substrates
containing different concentrations of ephrin-B1 (x-axis). At low concentrations (i.e., lateral to the TZ), attachment is favored at a higher concentration (i.e., medial positions). At high concentrations
(i.e., medial to the TZ) increased attachment is favored at a lower concentration (i.e., lateral positions). RGC axonal branches may be guided by a similar principle. The point of maximal attachment for each
RGC axon is centered on the TZ and is dependent on its EphB concentration.
Одна из важных находок показала, что такое ростовое преимущество темпоральных аксонов не обусловлено аттрактантами или способствующей росту активностью, ассоциированной с передними тектальными мембранами, а обусловлено репеллентной активностью, ассоциированной с задними тектальными мембранами (Walter et al. 1987a,b). Задние тектальные мембраны также преимущественно вызывали коллапс ростовых конусов темпоральных аксонов – признак, который облегчал репеллентную активность к 33kDa - GPI-anchored белку (Cox et al. 1990, Stahl et al. 1990).
| |
|
EPH FAMILY OF RECEPTOR TYROSINE
KINASES
The Eph family of receptor tyrosine kinases (RTKs) is the
largest known family of RTKs, composed of 14 Ephs and 8
ephrins in mouse and 15 Ephs and 9 ephrins in chick. Signaling
through Ephs and ephrins has been implicated in a
wide variety of processes including axon guidance, cell migration,
vascular development, synapse development, structure
and plasticity, and midline fusion events (Himanen &
Nikolov 2003, Murai&Pasquale 2003, Palmer&Klein 2003,
Poliakov et al. 2004, Rossant & Hirashima 2003, Surawska
et al. 2004). Ephs and ephrins are separated into two subclasses
on the basis of homology, the EphA/ephrin-As and
EphB/ephrin-Bs, within which receptor-ligand binding and
activation are promiscuous. In addition, some cross talk occurs
between subclasses and may be functionally relevant in
some systems. Ephs and ephrins are membrane bound, Ephs
and ephrin-Bs are transmembrane proteins, and ephrin-As are
GPI-linked to the plasma membrane, allowing for complex
and precise patterns of expression within a single tissue or organ
and between a projecting set of neurons and their targets
(e.g., the retinocollicular/retinotectal projection; Figure 3).
Eph-ephrin binding initiates signal transduction cascades by
both Ephs and ephrins, resulting in bidirectional signaling.
Additionally, Eph/ephrin signaling can be bifunctional, resulting
in opposing responses (i.e., attraction or repulsion) to
the same cues, depending on context (e.g., level of signaling).
These features combine to make the Ephs and ephrins major
players in many intricate problems of development, including
the development of topographic maps described here. |
RGM имеет градуированный паттерн экспрессии в ОТ, сходный с ephrin-As, и инактивация RGM, используя CALI (chromophore assisted laser inactivation) метод привела к потере селективного репеллентного эффекта задних ОТ мембран на темпоральные RGS аксоны (Muller et al. 1996). Недавно клонированы куриные RGM, а рекомбинантные RGM, экспрессированные в 293Т клетках, имели репеллентный эффект на куриные RGC аксоны (Monnier et al. 2002). RGC аксоны, трансфицированные для экспрессии неогенина (neogenin) - anRGMreceptor, также отторгались RGM (Rajagopalan et al.2004). Предположили, что RGM играет роль в в ретинотопическом картировании. Однако мыши с таргетированной делецией RGMa не имели никаких дефектов топографического картирования в ретиноколликулярной проекции (Niederkofler et al. 2004), возможно из-за функциональной избыточности, например, других членов RGM семейства или ephrin-As.
MECHANISMS OF MAP FORMATION
Детерминация процессов, посредством которых RGCs образуют топографические связи, крайне важна для выявления роли graded guidance молекул в становлении карты и создания моделей этого процесса. Для решения этого вопроса исследования проводили, главным образом, на лягушках, рыбах, цыплятах, и грызунах – моделях развития ретинотопических карт у позвоночных. Эти виды различаются по развитию зрительной системы и ретинотопических карт, а также по абсолютным размерам OT/SC. Например, AT ось OT куриного эмбриона в 50 раз больше, чем у лягушек и рыб (РИС.1). Эти виды имеют и существенные различия в механизмах, управляющих RGC аксонами к мишеням их точных зон терминации (termination zone - TZ) и, следовательно, в функциях «управляющих» молекул в контроле топографического таргетирования RGC аксонов.
Развитие ретинотектальной топографии у цыплят (Nakamura & O’Leary 1989, Yates
et al. 2001) и грызунов (Hindges et al. 2002; Simon & O’Leary 1992a,b,c) является многоэтапным процессом, включающим «выброс» (overshoot) аксонов и их промежуточное ветвление. Тщательный количественный анализ показал, что это единственный механизм образования карты и в настоящее время начала вырисовываться относительная важность направления роста аксонов, их ветвления и роль «управляющих» молекул в контроле создания топографических карт (Hindges et al. 2002, McLaughlin et al. 2003b, Yates et al. 2001). Авторы рассматривают различия в направлениях роста аксонов (первичных ростовых конусов) и их промежуточного ветвления у разных моделей – цыплят и грызунов и у лягушек и рыб. Подробности достижения аксонами своих TZ см. на РИС.1. Авторы отмечают важную роль интерстициального ветвления аксонов, специфичное вдоль AP оси – наиболее высокая степень ветвления найдена в участке АР, являющимся будущей зоной терминации (Yates et al. 2001). Промежуточные ветви располагаются перпендикулярно по отношению к первичному аксону и распространяются, главным образом, по LM оси в направлении их будущих TZ (Hindges et al. 2002, McLaughlin et al. 2003b, Nakamura et al. 1989). Такое ветвление является единственным способом с помощью которого RGCs формируют постоянные упорядоченные синаптические связи (Yates et al. 2001).
Далее авторы рассматривают распространение аксонов во время AP картирования, механизмы височно-назального ретинотопического картирования с участием АР-специфического промежуточного ветвления, АР градиенты (параллельные и оппозитные) промотеров и результаты подавления ветвления аксонов, роль EphBs и Ephrin-Bs в молекулярном контроле DV и LM картирования у разных моделей, роль и механизмы «управляющих» молекул в росте первичных аксонов и промежуточном ветвлении, видоспецифические различия в развитии топографических карт у разных моделей, роль Eph семейства receptor tyrosine kinases (RTKs), идентификацию дополнительных генов-кандидатов, участвующих в ретинотопическом картировании, обсуждаются перспективы развития этого направления исследований.
 Figure 1
Development of the retinotopic projection and
relative scale of the tectum in primary model
species. (A, Top) In mouse and chick, RGC axons
enter the OT/SC and initially extend well
posterior to the location of their future
termination zone (TZ) (circle). Interstitial branches
form along the axon shaft in a distribution biased
for the AP location of the TZ and subsequently
exhibit bidirectional growth along the LM axis
toward their correct TZ. Upon reaching their TZ,
branches elaborate complex arbors and the initial
axon overshoot is eliminated. All arbors are
formed by interstitial branches. (A, Bottom) In frog
(Xenopus laevis) and zebrafish, the tectum and
retina expand throughout the development of the
retinal projection. During retinotopic map
development the tectum is much smaller in
relation to a typical growth cone in frog and fish
than in chick and mouse. RGC axons extend into
the tectum and elaborate many small branches
from the base of the growth cone. Arbors
elaborate from these backbranches and the
thinned growth cone. The TZ becomes dense and
refines as the tectum enlarges. (A, Background )
The two ovals in the background represent the
relative sizes of the chick tectum (large oval ) and
frog or zebrafish tectum (small oval ). (B ) The
photographs are at the same scale. The chick OT
rotates during development such that the posterior
pole (P) is near the midline. The OT is cut along
the AP axis at the LM midline (dashed line) and
splayed. The distance from the anterior to
posterior pole along the cut edge is 1 cm (dashed
lines in the splayed tectum). The mouse SC is about
2 mmalong the AP pole at the LM midline (bar).
For frog and zebrafish the entire animal is shown
in lateral and dorsal views. The white bar on the
left of each panel represents the approximate AP
position and size of the tectum. The tecta for these
organisms are approximately 200 µm along the
AP axis. cb, cerebellum; ctx, cortex; fb, forebrain;
hb, hindbrain. Scale bar = 2 mm. Adapted from
McLaughlin et al. 2003a.
Figure 1
Development of the retinotopic projection and
relative scale of the tectum in primary model
species. (A, Top) In mouse and chick, RGC axons
enter the OT/SC and initially extend well
posterior to the location of their future
termination zone (TZ) (circle). Interstitial branches
form along the axon shaft in a distribution biased
for the AP location of the TZ and subsequently
exhibit bidirectional growth along the LM axis
toward their correct TZ. Upon reaching their TZ,
branches elaborate complex arbors and the initial
axon overshoot is eliminated. All arbors are
formed by interstitial branches. (A, Bottom) In frog
(Xenopus laevis) and zebrafish, the tectum and
retina expand throughout the development of the
retinal projection. During retinotopic map
development the tectum is much smaller in
relation to a typical growth cone in frog and fish
than in chick and mouse. RGC axons extend into
the tectum and elaborate many small branches
from the base of the growth cone. Arbors
elaborate from these backbranches and the
thinned growth cone. The TZ becomes dense and
refines as the tectum enlarges. (A, Background )
The two ovals in the background represent the
relative sizes of the chick tectum (large oval ) and
frog or zebrafish tectum (small oval ). (B ) The
photographs are at the same scale. The chick OT
rotates during development such that the posterior
pole (P) is near the midline. The OT is cut along
the AP axis at the LM midline (dashed line) and
splayed. The distance from the anterior to
posterior pole along the cut edge is 1 cm (dashed
lines in the splayed tectum). The mouse SC is about
2 mmalong the AP pole at the LM midline (bar).
For frog and zebrafish the entire animal is shown
in lateral and dorsal views. The white bar on the
left of each panel represents the approximate AP
position and size of the tectum. The tecta for these
organisms are approximately 200 µm along the
AP axis. cb, cerebellum; ctx, cortex; fb, forebrain;
hb, hindbrain. Scale bar = 2 mm. Adapted from
McLaughlin et al. 2003a. 



