СВОЙСТВА, МЕХАНИЗМЫ ДЕЙСТВИЯ ИНСУЛЯТОРОВ ВЫСШИХ ЭУКАРИОТ ИХ РОЛЬ РЕГУЛЯЦИИ ТРАНСКРИПЦИИ | |
|
Одной из догм в регуляции транскрипции высших эукариот является существование
транскрипционных доменов, между которыми взаимодействия энхансеров
и промоторов генов отсутствуют. Были найдены регуляторные
элементы, названные инсуляторами, которые блокируют взаимодействие
между энхансером и промотором. Инсуляторам была приписана роль в
формировании границ транскрипционных доменов. В настоящем обзоре дается
общая характеристика хорошо изученных инсуляторов, найденных у
дрозофилы и позвоночных. На основе имеющейся информации
обсуждаются механизмы действия инсуляторов и их роль в регуляции
экспрессии генов.
|
У высших эукариот энхансер может активировать промотор на расстоянии, достигающем нескольких сотен тысяч пар нуклеотидов [1-6]. Недавно для
некоторых энхансеров млекопитающих было продемонстрировано, что
белки, связанные с энхансером, непосредственно взаимодействуют с
белками основного транскрипционного комплекса или вспомогательными
белками, собранными на промоторе, при этом ДНК между ними образует
петлю [3, 7]. Возникает вопрос, каким образом энхансер может
взаимодействовать с промотором на больших дистанциях и при этом
правильно узнавать свой промотор. Несмотря на то что к настоящему
моменту описано огромное количество энхансеров и промоторов, изучено
множество факторов транскрипции, вопрос о механизме специфичности
взаимодействия между энхансером и промотором остается открытым.
В понимании механизмов дальних взаимодействий между регуляторными элементами большую роль может сыграть изучение инсуляторов. Инсуляторами были названы
регуляторные элементы, которые блокируют взаимодействие между
энхансером и промотором, если находятся между ними [5, 8-10]. При этом
инсуляторы не влияют непосредственно на активность энхансе-ра и
промотора, т.е. промотор может быть активирован любым другим
энхансером, а энхансер может активировать любой другой промотор.
Наиболее хорошо инсуляторы исследованы у Дрозофилы и позвоночных,
именно они представлены в данном обзоре. ОБЩАЯ ХАРАКТЕРИСТИКА
ИНСУЛЯТОРОВ Drosophila melanogaster Инсуляторы генов теплового шока (scs и scs') Первые инсуляторы были выявлены на границах двух генов hsp70. Они были названы scs и scs'(specialized chromatin structure), так как
предполагалась их связь с ядерным матриксом. Исследование
свойств scs- и scs'-инсуляторов в трансгенных линиях позволило
сформулировать два основных критерия, на основе которых
исследуемый регуляторный элемент может быть отнесен к инсуляторам:
способность блокировать энхансеры и быть барьером между активным и
конденсированным хроматином.
Инсуляторы scs и scs' находятся в цитогенетическом локусе 87А7 хромосомы 3 [11, 12]. Между инсуляторами scs и scs' находятся (рис. 1) два гена теплового шока hsp70 (heat shock protein 70) и гены CG31211 и CG3281. scs-инсулятор содержит промоторы для CG31211 и
неидентифицирован-ного гена. В состав scs'-инсулятора входят
промоторы генов CG3281 и aurora. Высокий уровень
транскрипции hsp70 во время теплового шока приводит к
обратимой локальной деконденсации структуры хроматина, что на
политенных хромосомах слюнных желез 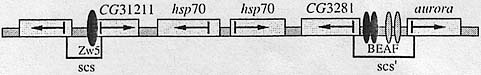 Рис. 1. Схема hsp70-домена (87A7), окруженного инсуляторами scs и scs'.
Стрелками показано направление транскрипции генов. См. текст. Рис. 1. Схема hsp70-домена (87A7), окруженного инсуляторами scs и scs'.
Стрелками показано направление транскрипции генов. См. текст.личинок можно наблюдать визуально как образование пуфа. Первоначально считалось, что инсу-ляторы scs и scs' находятся на границах этого пуфа и отвечают за независимую экспрессию генов во время теплового шока, устанавливая границу между активным и конденсированным хроматином [11, 12]. Однако последующие исследования показали, что инсуляторы scs и scs' не предотвращают процесс распространения деконденсиро-ванного хроматина [13] и находятся внутри, а не на границах деконденсированного хроматина. В структуре scs-инсулятора можно выделить три участка,обеспечивающих энхансер-блокиру-ющую функцию. Эти фрагменты не имеют значимой гомологии между собой по нуклеотидной последовательности ДНК, но являются функционально эквивалентными и, дополняя друг друга, участвуют в инсуляции [14, 15]. Каждый из этих участков в отдельности обладает более низкой эн-хансер-блокирующей способностью, чем
полноценный scs-инсулятор. Однако исходную силу инсуляции полного
scs-инсулятора можно восстановить мультимеризацией любого из этих участков.
Охарактеризованным белковым компонентом scs-инсулятора является
Scs-связывающий белок (SBP, Zw5), кодируемый геном zeste-white 5 (zw5).
Он содержит восемь цинковых пальцев и связывает последовательность ДНК
длиной 24 пн, находящуюся рядом с промотором гена CG31211 [14]. Другие
белки scs-инсулятора пока не обнаружены.
В scs'-инсуляторе были найдены две области, которые имеют кластеры
CGATA-последова-тельностей [16]. С этими последовательностями
связываются две изоформы белка BEAF, boundary-element-associated factor
(32А и 32В) и транскрипционный фактор DREF [16], который участвует в
регуляции работы генов клеточного цикла [17]. Мультимер, состоящий из
четырех CGATA-сайтов, обладает инсуляторной активностью, сравнимой с
scs', на основании чего был сделан вывод о том, что BEAF отвечает за
активность инсулятора.
Были клонированы два других геномных района, с которыми связывается
белок BEAF [18]. Один из них, ВЕ76, находится в области промотора
(-350, -670) гена инозинмонофосфатдегидро-геназы. Второй, ВЕ28, был
идентифицирован в составе умеренно повторяющихся последовательностей,
имеющих сайты связывания для белков BEAF и D1 [19]. Такие повторы были
обнаружены в прицентромерных участках на нескольких хромосомах
Drosophila, что дало основание предполагать их роль в формировании
границ между эу- и гетерохроматином [19], однако пока это не нашло
экспериментального подтверждения.
В составе инсуляторов scs и scs' были найдены А/Т-богатые районы,
которые связываются с белками ядерного матрикса и топоизомеразой II
[20]. Было выдвинуто предположение, что эти районы, являющиеся
участками прикрепления ДНК к ядерному матриксу (MARs/SARs),
ответственны за ин-суляторную активность. Однако в дальнейшем эта
модель не нашла экспериментального подтверждения, так как инсуляторная
активность scs и scs' не зависела от присутствия MARs/SARs [15].
Таким образом, вопрос о роли scs- и scs'-инсу-ляторов в формировании
независимого домена генов hsp70 остается открытым, так как in vivo не
было продемонстрировано влияние на транскрипцию генов hsp70 делеций
этих инсуляторов. Недавно было показано, что scs- и scs'-инсулято-ры
сближены в ядре, а белки BEAF и Zw5 взаимодействуют друг с другом in
vitro и in vivo [21]. На основании этих данных было высказано
предположение, что инсуляторы scs и scs', взаимодействуя друг с другом,
могут формировать независимый домен. Однако пока остается недоказанной
роль взаимодействия между инсуляторами в формировании независимого
хроматинового домена.
Su(Hw)-codepMauuie инсуляторы
Самый изученный инсулятор дрозофилы, состоящий из 12 сайтов связывания
для белка Su(Hw), был обнаружен в 5'-нетранслируемой области
ретротранспозона МДГ4 (gypsy). Эффективность действия
5и(Н\?)-инсулятора была проверена на примерно 20 энхансерах,
участвующих в регуляции на разных стадиях развития и тканях дрозофилы
[10]. Была продемонстрирована способность Su(Hw)-инсулятора защищать
экспрессию генов от негативного влияния гетерохрома-тина и от
репрессии, индуцированной белками группы Polycomb (Рс-белками) [10, 22,
23].
Главным компонентом инсулятора является ДНК-связывающий белок Su(Hw),
инактивация которого приводит к полной потере активности инсулятора
[24, 25]. Белок Su(Hw) содержит 12 цинковых пальцев, часть из которых
участвует в узнавании 5'-PyPuPyTGCATAPyPyPy-3' повторов в составе МДГ4
[26, 27]. Сайты связывания белка Su(Hw) разделены короткими АТ-богатыми
последовательностями, которые могут взаимодействовать с белками
ядерного матрикса [28]. Однако для активности Su(Hw))-инсулятора, как и
в случае scs-инсулятора, протяженные участки АТ-богатых
последовательностей не имеют большого значения [29].
Кроме Su(Hw)-инсулятора в геноме были охарактеризованы другие
элементы, связывающие белок Su(Hw). Первый эндогенный Su(Hw)-зависимый
инсулятор был идентифицирован между геном yellow, который определяет
пигментацию кутикулы дрозофилы, и генным комплексом achaete-scute,
участвующим в регуляции развития нервной системы [30,31]. Этот
инсулятор, названный 1А2 по месту локализации в 1 А2-районе, содержит
два сайта связывания для белка Su(Hw). При этом для инсуляции
необходимы как сами сайты связывания белка Su(Hw), так и прилежащие
последовательности, что можно объяснить тем, что для активности 1
А2-инсулятора требуется кооперация Su(Hw) с другими, пока не
идентифицированными, ДНК-связывающими белками. Недавно был проведен
скрининг геномных ДНК-последовательностей, способных связывать белок
Su(Hw) [32]. В результате были найдены геномные последовательности,
содержащие от одного до четырех сайтов связывания для белка Su(Hw).
Хотя для исследованных фрагментов эффективность инсуляции коррелировала
с количеством сайтов связывания белка Su(Hw), предполагается, что
Su(Hw) работает совместно с другими белками.
Детальный анализ выявил, что для связывания с инсулятором в
составе МДГ4 необходимы только 3-й, 5-й, 7-й и 11-й цинковые пальцы
[26, 27]. Изменения в 5-м цинковом пальце приводят к полной инактивации
инсулятора Su(Hw). Можно предположить, что связывание белка Su(Hw) с
последовательностью инсулятора и с некоторыми другими сайтами в геноме
осуществляется при помощи различных комбинаций цинковых пальцев.
Некоторые цинковые пальцы белка Su(Hw) также могут быть вовлечены в
белок-белковые взаимодействия и таким образом участвовать в образовании
инсуляторных комплексов. Так, ранее было показано, что домен,
содержащий 12-й цинковый палец, взаимодействует с белком Chip, который,
как предполагается, может участвовать в организации дальних
взаимодействий между энхансерами и промоторами [33]. Интересно, что
тот же домен белка Su(Hw) связывается с белком Е(у)2, который,
вероятно, рекрутирует комплекс, ответственный за формирование границы
между активным и неактивным хроматином (А. Краснов, неопубликованные
данные).
Кроме ДНК-связывающего домена, в структуре Su(Hw)-белка можно
выделить: два домена, богатых кислыми аминокислотами; консервативный
участок, имеющий некоторое сходство с доменом лейциновой молнии; и три
высококонсервативных для всех исследованных видов дрозофилы участка, но
не имеющих выраженной гомологии с известными доменами [26, 27].
Роль кислых доменов белка Su(Hw) в инсуляции пока не известна, так
как удаление этих доменов сильно на активность делетированного варианта
белка Su(Hw) не влияет [26,27,34]. Наибольшую роль в инсуляции играет
домен "лейциновая молния" и прилежащие к нему консервативные участки В
и С [26, 27, 34]. Было показано, что с этим районом своим С-концом связывается белок Mod(mdg4)-67.2 [35, 36], который является одной из изоформ белков, кодируемых геном
mod(mdg4)IE(var)3-9 [37]. На N-конце находится высококонсервативный
BTB/POZ-домен, который был найден у целого семейства белков, являющихся
регуляторами транскрипции. BTB/POZ-домен определяет взаимодействие
между белками и приводит либо к гомодимеризации, либо (реже) к
гетеродимеризации белков [38]. Интересно, что помимо ВТВ-домена белок
Mod(mdg4)-67.2 содержит как минимум еще один димеризующий домен (А.
Головнин, неопубликованные данные). На политенных хромосомах для белка
Su(Hw) практически везде показана колокализация с белком Mod(mdg4)-67.2
[39], что предполагает ключевую роль белка Mod(mdg4)-67.2 в
формировании инсуляторного комплекса.
Третьим, недавно открытым компонентом Su(Hw)-инсулятора является
ВТВ-содержащий белок СР190, Centrosomal Protein 190 [40]. На политенных
хромосомах белок CP 190 колокализу-ется с белком Su(Hw). Кроме этого,
он представлен и в альтернативных геномных сайтах, не содержащих белки
Su(Hw) и Mod(mdg4)-67.2. Белок CP 190 имеет три цинковых пальца,
которые потенциально могут взаимодействовать с ДНК, но консенсус
связывания для белка пока не известен. Интересно, что CP 190 не
связывается in vitro с ДНК Su(Hw)-инсулятора, но взаимодействует с
белками Su(Hw) и Mod(mdg4)-67.2 [40].
Наконец, четвертым компонентом Su(Hw)-инсулятора может стать
белок dTopors (Topoi-somerase I - interacting RS protein) [41]. dTopors
относится к классу убиквитиновых лигаз, известной функцией которых
является специфичное узнавание белков-мишеней для их последующего
убик-витинирования, основным результатом которого является мечение
белков для их последующей деградации в протеосомах. Примерно 30-40%
сайтов для Su(Hw) на политенных хромосомах содержат dTopors. Пока не
известно, какую роль dTopors, помимо участия в утилизации белков, может
играть в активности Su(Hw)-инсулятора.
В диплоидных ядрах белки Su(Hw), Mod(mdg4)-67.2 и СР190 собраны в
15-20 видимых ядерных телец. Это дало основание предложить модель, по
которой индивидуальные сайты связывания белка Su(Hw), локализованные в
различных частях хромосом, приближены друг к другу посредством белков
инсуляторного комплекса, что приводит к формированию структур, подобных
розетке, которые были названы "инсуляторными тельцами" [39-42]. К
сожалению, эта интересная модель пока не имеет экспериментального
подтверждения, так как не было показано, что ДНК инсуляторов
колокализуется с "инсуляторными тельцами" в ядрах. Известно, что 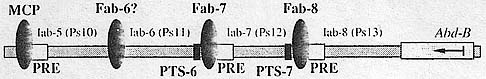 Рис. 2. Схема регуляторной области гена АЫ1-13. Регу-ляторная область
гена Abd-B состоит из четырех эн-хансероп: Iab-5, lab-6, lab-7, Iab-8,
которые отделены друг от друга граничными элементами МСР, Fab-7, Fab-8.
К ним с одной стороны примыкают элементы PRE, с другой стороны - PTS.
Между регуляторными доменами Iab-б и Iab-5. возможно, существует еще
один граничный элемент - Fab-6.
Рис. 2. Схема регуляторной области гена АЫ1-13. Регу-ляторная область
гена Abd-B состоит из четырех эн-хансероп: Iab-5, lab-6, lab-7, Iab-8,
которые отделены друг от друга граничными элементами МСР, Fab-7, Fab-8.
К ним с одной стороны примыкают элементы PRE, с другой стороны - PTS.
Между регуляторными доменами Iab-б и Iab-5. возможно, существует еще
один граничный элемент - Fab-6. многие белки, в том числе ВТВ-содержащие PLZF и BCL-6, формируют в ядре тельца, которые, возможно, являются местами сборки активных комплексов. Поэтому можно предположить, что белки Su(Hw), Mod(mdg4)-67.2 и СР190 формируют аналогичные образования и, следовательно, "инсуляторные тельца" являются обычными скоплениями белков в ядре. Инсуляторы в регуляторной области гена Abd-B
В регуляторной области гена Abd-B, участвующего в формировании
парасегментов дрозофилы, была найдена группа инсуляторов [43]. Эта
регуляторная область, размером примерно в 50 тпн, находится на З'-конце
гена и состоит из отдельных парасегмент-специфичных регуляторных
доменов, содержащих по одному энхансеру, Iab (Intraabdominal domain).
Каждый энхансер регулирует экспрессию гена Abd-B только в одном
определенном парасегменте дрозофилы, при этом регуля-торные домены
расположены на хромосоме в том же порядке, в каком распределены
парасегменты вдоль оси эмбриона. Так, энхансеры Iab-5-Iab-8 определяют
экспрессию гена в парасегментах Ps 10—Ps 13 соответственно (рис.
2).
В регуляции гена Abd-B можно выделить два этапа. В процессе
раннего эмбриогенеза регуля-торные белки, отвечающие за первые этапы
диф-ференцировки, активируют в каждом парасегменте строго определенный
энхансер гена Abd-B [43]. Например, набор белков в области
парасег-мента Psll, активируя только энхансер lab-б, но не Iab-7 или
Iab-8, приводит к запуску в парасегменте Psl 1 правильной программы
экспрессии гена Abd-B. После исчезновения первичных факторов
дифференцировки активный или неактивный статус регуляторных доменов,
установленный в данном парасегменте, продолжает поддерживаться. За этот
процесс отвечают белки группы Poly-comb (Рс), оказывающие негативное
влияние на экспрессию генов, и их антагонисты из группы Trithorax
(Тгх), принимающие участие в системах активации транскрипции.
По-видимому, эти белки способны связываться с одними и теми же
регуляторными элементами (PRE), найденными в каждом из регуляторных
доменов гена Abd-B. Предполагается, что Рс- и Trx-белки могут
стабилизировать активное или неактивное состояние энхансеров в процессе
развития за счет поддержания открытого или конденсированного состояния
хроматина. Таким образом, регуляция гена Abd-B предполагает
существование достаточно независимых по структуре хроматина
регуляторных доменов, статус которых должен поддерживаться специальными
границами. Существование границ между регуляторными доменами было
доказано с помощью делеций междоменных участков, которые приводили либо
к одновременной активации, либо к одновременной репрессии двух
энхансеров, находящихся в соседних регуляторных доменах. В результате
были выявлены три граничных элемента между регуляторными доменами: МСР,
Fab-7 и Fab-8 [43-45]. Стоит отметить, что эти элементы, имеющие размер
400-800 пн, располагаются в непосредственном соседстве с PRE. В составе
всех трех граничных элементов были найдены инсуляторы [45-48], которые
обладают и энхансер-блокирующей, и барьерной активностями. Для участков
Fab-7 и МСР было показано, что за эти активности в составе инсуляторов
отвечают разные регуляторные элементы ([44]; С. Родин и О. Кырчанова,
неопубликованные данные).
Из-за присутствия границ-инсуляторов между регуляторными доменами
возникает вопрос: каким образом энхансеры, окруженные инсулято-рами,
активируют промотор гена Abd-B. Так, энхансер Iab-7 окружен
инсуляторами Fab-7 и Fab-8, но при этом участвует в активации
экспрессии гена Abd-B и определяет развитие парасегмента 12. Это
противоречие объяснимо, если принять гипотезу о том, что данные
граничные элементы обладают инсуляторной активностью только в
трансгенных модельных системах, а в контексте гена Abd-B выполняют
более тонкие регуляторные функции. Например, рядом с инсуляторами Fab-8
и Fab-7 были обнаружены дополнительные регуляторные элементы, названные
PTS (promoter targeting sequence), которые способны ней-трализовывать
действие инсулятора и усиливать специфичные дальние взаимодействия
между эн-хансером и промотором в экспериментах с репор-терными генами
[49, 50]. Предполагается, что эти элементы могут осуществлять
коммуникацию между Iab-энхансерами и промотором гена Abd-B. Однако
делеция PTS в контексте гена Abd-B оказывает сравнительно слабое
влияние на активность энхансера Iab-7, что, по всей видимости,
свидетельствует об участии и других регуляторных элементов в
поддержании взаимодействия между Iab-энхансером и промотором гена Abd-B
[4]. В области промотора были обнаружены протяженные регуляторные
районы, которые, озможно, принимают участие в дальних взаимодействиях с
Iab-энхансерами [4]. Интересно, что комбинация PRE с инсулятором
способна осуществлять сверхдальние взаимодействия между регуляторными
элементами в геноме. Например, было показано, что находящийся на
Х-хромосоме транспозон, содержащий граничный элемент Fab-7 и PRE, может
эффективно взаимодействовать с Fab-7-районом в эндогенном локусе Abd-B,
который расположен на 3-й хромосоме [51].
Так же было продемонстрировано существование сверхдальних
взаимодействий между транс-позонами, содержащими инсулятор и PRE из
элемента МСР [52]. Пока точно не известно, какой из регуляторных
элементов, инсулятор или PRE, вносит основной вклад в наведение
сверхдальних взаимодействий. По предварительным данным, полученным для
элемента МСР, главная роль в этом процессе отводится инсулятору (О.
Кырча-нова, неопубликованные данные). Если инсулято-ры действительно
способны поддерживать дальние взаимодействия, то именно они могут
участвовать в осуществлении взаимодействия между Iab-энхансерами и
промотором. Таким образом, инсуляторные элементы в регуляторной области
гена Abd-B могут выполнять сразу несколько функций: барьера между
Iab-энхансерами, блокирования неправильных и поддержания правильных
взаимодействий между Iab-энхансерами и промотором Abd-B. Механизмы
действия этих ин-суляторов и белки, отвечающие за их функционирование,
пока неизвестны. Стоит отметить, что последовательности ДНК инсуляторов
из регуляторной области гена Abd-B не содержат выраженных гомологичных
участков, которые могли бы быть сайтами связывания для инсуляторных
белков. Например, Fab-7-инсулятор имеет семь сайтов связывания для
белка GAF (GAGA binding factor). Было показано, что частичная
инактивация GAF снижает активность Fab-7-инсулятора, что можно
объяснить либо прямым участием GAF в активности инсулятора, либо
известной способностью этого белка помогать связыванию с хроматином
других транскрипционных факторов. Интересно, что в составе
Fab-8-инсулятора было обнаружено два сайта связывания для гомолога
белка CTCF, который определяет активность всех известных инсуляторов
позвоночных [53]. Было продемонстрировано, что dCTCF необходим для
активности Fab-8-инсулятора. Так как dCTCF, возможно, имеет широкий
спектр потенциальных сайтов связывания, нельзя исключить возможность
связывания dCTCF с другими инсу-ляторами из регуляторного района гена
Abd-B. Краткий обзор других инсуляторов дрозофилы
В заключение можно упомянуть еще четыре описанных у дрозофилы
инсулятора. Неожиданно инсулятор был обнаружен в З'-нетранслируемой
области гена white (Д. Четверина, неопубликованные данные). Интересно,
что этот инсулятор также присутствует в гене mini-white (клонированный
ген white с удаленным интроном), который часто используют в качестве
маркера в трансгенных конструкциях. Этот инсулятор, названный
mini-white (mw), может эффективно блокировать эн-хансеры генов yellow и
white, а также Рс-зависимую репрессию.
Другой инсулятор был обнаружен в составе длинного концевого
повтора (ДКП) ретротранс-позона Idefix [54]. Этот инсулятор, названный
IdefixU3, был локализован внутри фрагмента 470 пн, соответствующего U3
области ДКП, таким образом, что З'-конец предполагаемого инсулятора
находится на расстоянии 5 пн от старта транскрипции. ИеПхШ-инсулятор
специфично блокирует активацию гена white энхансером другого мобильного
элемента ZAM. Способность IdefixU3-инсулятора блокировать другие
энхансеры, в том числе глазной энхансер гена white, пока не выяснена.
Стоит также упомянуть об инсуляторе Faswb (facet-strawberry),
который находится непосредственно перед сайтом начала транскрипции гена
Notch и представляет собой последовательность ДНК длиной 880 пн [55].
Ра^-инсулятор блокирует активность глазного энхансера. На политен-ных
хромосомах инсулятор находится в области междиска, который разделяет
диски ЗС6 и ЗС7, а транскрипционная единица гена Notch находится внутри
диска ЗС7. Делеция инсулятора Faswb приводит к исчезновению междиска
ЗС6-ЗС7 и слиянию ЗС7-диска с более дистальным ЗС5.6 дублетом [55].
Еще один инсулятор, SF1, был обнаружен в регуляторной области
комплекса Antennapedia (Ant) [56]. Этот инсулятор находится между
энхансером и промотором гена Scr и его роль в регуляции транскрипции
пока не понятна. Было показано, что SF1-инсулятор может блокировать
активность энхансеров, работающих на разных стадиях развития.
Последовательность инсулятора является высококонсервативной среди
разных видов дрозофилы и содержит три сайта связывания для белка GAF,
частичная инактивация которого снижает способность инсулятора
блокировать энхан-серы. Однако роль GAF в инсуляции пока не понятна,
так как простая мультипликация сайтов связывания белка GAF не приводит
к проявлению инсуляторной активности [57]. Возможно, GAF принимает
участие в формировании открытой структуры хроматина, что позволяет
другим компонентам инсулятора связываться с ДНК. 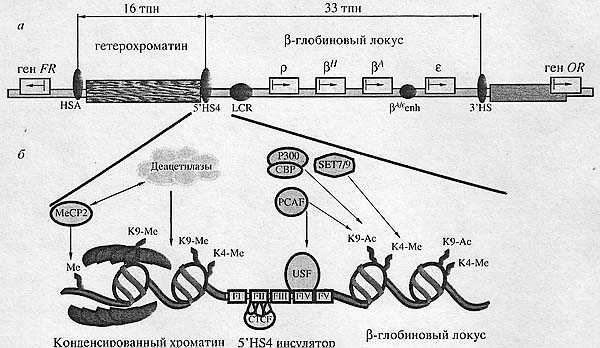 Рис. 3. Схема куриного β-глобинового локуса. а - структура β-глобинового локуса и прилегающих последовательностей, р, βH,βA, ε - гены β-глобинового локуса; ген FR - ген фолатного рецептора; ген OR - ген обонятельного рецептора. Стрелками показано направление транскрипции этих генов. HSA, 5'HS4, 3'HS - инсуляторы; LCR, βA/ε - энхансеры β-глобинового локуса; б - структура и активность 5'НS4-инсулятора. См. текст. ИНСУЛЯТОРЫ ПОЗВОНОЧНЫХ
До открытия роли белка CTCF (СССТС-связывающего фактора) в
активности (3-глобинового инсулятора [58] было описано всего несколько
инсуляторов позвоночных: в β-глобиновом локусе кур - 5'HS4, человека
- HS5, в α/δ локусе Т-клеточного рецептора (TCR) - BEAD-1, в межгенном
участке РНК-рибосомальных генов шпорцевой лягушки - RO, только
предполагалось возможное наличие инсулятора в импринтинговом локусе
Igf2/H19 [59]. В дальнейшем было показано, что все эти инсуляторы
являются CTCF-зависимыми.
Ранее белок CTCF был известен как транскрипционный фактор,
принимающий участие в системах регуляции экспрессии многих генов либо в
качестве активатора, либо в качестве репрес-сора. CTCF, как и
вышеописанные инсуляторные белки дрозофилы, имеет ДНК-связывающий
домен, состоящий из 11 цинковых пальцев, в то же время других
характерных доменов, сходных по своей структуре, не найдено. Интересно,
что белок CTCF у дрозофилы гомологичен белку CTCF позвоночных только по
ДНК-связывающему домену [53]. После открытия ведущей роли CTCF в
активности β-глобинового инсулятора оказалось, что почти все
идентифицированные регуляторные элементы, содержащие сайты связывания
для CTCF, являются инсуляторами. Но, стоит отметить, что эти инсуляторы
сильно отличаются друг от друга по проявляемым свойствам. К настоящему
времени все обнаруженные инсуляторы позвоночных являются
CTCF-зависимыми, а CTCF - единственным охарактеризованным инсу-ляторным
белком с энхансер-блокирующей активностью.
Одним из наиболее хорошо изученных инсуляторов позвоночных
является куриный β-глобиновый инсулятор (Н54-инсулятор),
расположенный на 5'-конце β-глобинового локуса [60]. Этот локус
содержит четыре гена β-глобинового семейства (рис. 3,я),
экспрессирующихся на разных стадиях развития. Регуляторные элементы
этих генов разделены сериями эритроид-специфичных
ДН-КазаI-гиперчувствительных сайтов (HS), но у 5'-конца локуса
находится конститутивный гиперчувствительный сайт, представленный во
всех протестированных тканях [61]. Анализ структуры хроматина вокруг
этого сайта выявил область открытого хроматина размером 33 тпн внутри
активного β-глобинового локуса куриных эритроцитов, гетерохроматиновую
область размером 16 тпн выше этого сайта [61] и перед
гетерохроматиновым районом - ген, кодирующий фолат-ный рецептор (рис.
3,я) [62]. Этот конститутивный гиперчувствительный сайт длиной 1200 пн,
оказавшийся границей между зонами активного и конденсированного
хроматина, был назван HS4-инсулятором. В нем был выявлен коровый участок длиной 250 пн (рис. 3,6), обладающий полной инсуляторной активностью и содержащий пять белок-связывающих фрагментов (FI, FII, Fill, FIV, FV). В участке FII содержится сайт связывания для белка CTCF, являющегося необходимым и достаточным для проявления энхансер-блоки-рующей активности этого инсулятора [58, 63]. Мутации сайтов связывания для белка CTCF приводят к потере способности инсулятора блокировать энхансер, а увеличение числа сайтов связывания усиливает эффект инсуляции [58]. Очень интересным наблюдением является тот факт, что барьерные свойства β-глобинового инсулятора не ассоциированы с последовательностями ДНК, связывающими белок CTCF [64]. Инактивация сайтов связывания для этого белка никак не сказывается на способности инсулятора блокировать хромосомный эффект положения. Подобная картина наблюдается и при функционировании с-myc-инсулятора, для которого также было показано, что за энхансер-блокирующую и барьерную активности отвечают разные участки инсулятора [65]. По-видимому, в реализации барьерной активности у инсулятора HS4 основную роль выполняет белок USF, для которого был найден сайт связывания в участке FIV. Наиболее вероятно то, что USF рекрутирует на НS4-инсулятор белки, участвующие в модификации гистонов (рис. 3,6) [64, 66]. В результате формируется барьер между активным и конденсированным хроматином. Однако для реализации полной барьерной активности инсулятора наличия только участка для связывания USF недостаточно [66]. Можно предположить, что пока не идентифицированные белковые компоненты, связывающиеся с участками Fill и FV, либо помогают взаимодействию USF с ДНК, либо кооперативно с USF формируют барьер между зонами активного и конденсированного хроматина.
На З'-конце β-глобинового локуса курицы был найден второй инсулятор, 3'HS (рис. 3,я). Он разделяет Р-глобиновый локус и ген обонятельного рецептора, которые имеют различные программы экспрессии. Последовательность 3'НS-инсулятора содержит участок гиперчувствительности к ДНКазе I, в состав которого входит сайт связывания для белка CTCF [67]. З'НS-инсулятор не обладает выраженной барьерной активностью и не содержит сайтов связывания для белка USF. Кроме этого, З'НБ-инсулятор, в отличие от НS4-инсулятора, не является областью гиперацетилирова-ния, а конденсированный хроматин у З'-конца локуса - факультативный, что необходимо для экспрессии гена обонятельного рецептора, в то время как за 5'-концом локуса у конденсированного хроматина статус конститутивный [63]. То есть в случае З'НS-инсулятора отсутствие барьерной активности можно объяснить тем, что статус хроматина в области гена обонятельного рецептора не влияет на экспрессию Р-глобинового локуса.
Таким образом, [3-глобиновый локус с двух сторон фланкирован инсуляторными элементами. Возможно, эти элементы необходимы для автономной экспрессии р-глобиновых генов [62]. Показано, что инсуляторы HS4 и 3'HS могут быть стерически связаны между собой, так как их ДНК-последовательности в ядре находятся достаточно близко друг от друга [7].
Вышеописанные свойства инсуляторов курицы хорошо согласуются с их ролью в создании независимого домена экспрессии β-глобиновых генов (особенно 5'НS4-инсулятор, который обладает и энхансер-блокирующей и барьерной активностями). Однако делеция мышиного 5'-инсулятора (HS5), сильно уступающего куриному по уровню своей инсуляторной активности, не оказывает значительного влияния на экспрессию Р-глобино-вого локуса [68]. Можно было бы предположить, что сильный энхансер (LCR) также обладает барьерной активностью. Однако при делеции мышиного LCR структура хроматина внутри β-глобинового локуса оставалась открытой [69]. То есть в данном примере, по всей видимости, важно наличие нескольких регуляторных модулей, которые осуществляют комплексный контроль за экспрессией Р-глобинового локуса, возможно подстраховывая друг друга и таким образом отвечая за тонкую и бесперебойную регуляцию. В 5'-области Р-глобинового локуса человека тоже был найден CTCF-зависимый инсулятор, HS5, но его инсуляторная активность оказалась значительно ниже по сравнению с куриным и мышиным инсуляторами [70]. Гиперчувствительный сайт, в котором расположен этот инсулятор, не является конститутивным [71]. Кроме этого, выше 5'-конца человеческого Р-глобинового локуса, в отличие от куриного, вместо обширной гетерохроматиновой области присутствует открытая хроматиновая структура, поэтому инсулятору не нужно участвовать в установлении границы между зонами активного и конденсированного хроматина. Существует предположение, что в контексте Р-глобинового локуса активность HS5-инсулятора человека сильно зависит от этапа развития организма и пик активности наблюдается в эмбриональных эритроидных клетках. Возможно, что в данном случае инсулятор препятствует активации LCR'om какого-нибудь промотора, расположенного выше β-глобинового локуса [71]. Таким образом, на примере 5'-инсуляторов из β-глобинового локуса разных организмов видно, что, даже несмотря на наличие одного и того же инсуляторного белка CTCF, гомологичного локуса с приблизительно одинаковой программой экспрессии, инсуляторы, по всей видимости, не только обладают разной силой, но и, возможно, несут разную функциональную
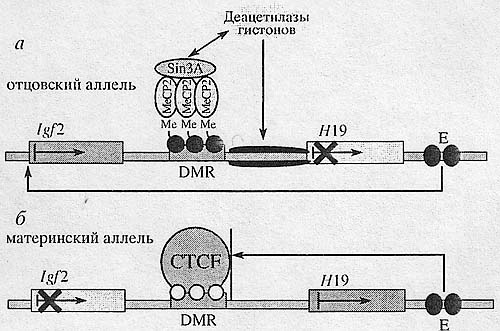 Рис. 4. Схема локуса мыши Igf2/H19. Локус Igf2/H19 содержит два гена - Н19 и Igf2, направление транскрипции которых показано стрелками. Е - энхансеры в З'-области гена Н19, DMR - участок дифференцированного метилирования, в состав которого входит сайт связывания для белка CTCF. а - в отцовском аллеле ДНК-последовательность участка DMR метилирована, что приводит к привлечению метил-связывающего белка МеСР2. МеСР2 рекрутирует белки Sin3A и гистоновые деацетилазы, которые приводят хроматин в неактивный статус, в результате отцовская копия гена Н19 не экспрессируется. Белок CTCF с метилированной последовательностью связаться не может, инсулятор не работает, и энхансеры из З'-области гена HI9 активируют промотор гена Igf2; б -в материнском аллеле ДНК-последовательность участка DMR не метилирована, поэтому CTCF связывается со своим сайтом, в результате этого блокируется взаимодействие между энхансерами и промотором гена Igf2. Ген Н19 находится в активном состоянии и нормально экспрессируется.
Рис. 4. Схема локуса мыши Igf2/H19. Локус Igf2/H19 содержит два гена - Н19 и Igf2, направление транскрипции которых показано стрелками. Е - энхансеры в З'-области гена Н19, DMR - участок дифференцированного метилирования, в состав которого входит сайт связывания для белка CTCF. а - в отцовском аллеле ДНК-последовательность участка DMR метилирована, что приводит к привлечению метил-связывающего белка МеСР2. МеСР2 рекрутирует белки Sin3A и гистоновые деацетилазы, которые приводят хроматин в неактивный статус, в результате отцовская копия гена Н19 не экспрессируется. Белок CTCF с метилированной последовательностью связаться не может, инсулятор не работает, и энхансеры из З'-области гена HI9 активируют промотор гена Igf2; б -в материнском аллеле ДНК-последовательность участка DMR не метилирована, поэтому CTCF связывается со своим сайтом, в результате этого блокируется взаимодействие между энхансерами и промотором гена Igf2. Ген Н19 находится в активном состоянии и нормально экспрессируется. нагрузку в контексте β-глобинового локуса, что свидетельствует о существовании сложных систем регуляции, отвечающих за проявление тех или иных активностей данными инсуляторами. Делеция куриных инсуляторов β-глобинового локуса, возможно, дала бы ответ о значимости этих инсуляторов in vivo для установления независимого транскрипционного домена. Для CTCF-зависимых инсуляторов было показано наличие нескольких механизмов регуляции их активности.
Характерной особенностью белка CTCF является то, что он взаимодействует только с немети-лированными сайтами связывания. Поэтому метилирование сайта ДНК приводит к инактивации CTCF-зависимого инсулятора. Так, инсулятор HS4 находится в деметилированном состоянии [60], именно поэтому белок CTCF способен связываться с последовательностью инсулятора.
Наиболее же ярким примером регуляции активности CTCF-зависимого инсулятора с помощью метилирования является Igf2/H19-локус мыши и человека (рис. 4). Это импринтинговый локус, для которого было показано, что при
наследовании по материнской линии экспрессируется аллель H19, а по отцовской - Igf2 [63]. В З'-области гена Н19 располагаются энхансеры, а выше промотора гена Н19 находится участок дифференцированного метилирования (DMR), в состав которого входит и CTCF-инсулятор. Метилирование DMR в отцовском аллеле приводит к привлечению метил-связывающего белка МеСР2, который взаимодействует с метилированными CpG-последовательностями. МеСР2 рекрутирует белки Sin3A и гистоновые деацетилазы, в результате чего отцовская копия гена Н19 не экспрессируется [72]. Кроме этого, с метилированным сайтом связывания в DMR белок CTCF связаться не может, так как метилирование препятствует взаимодействию CTCF с ДНК-последовательностью, что позволяет энхансерам, расположенным в З'-области гена Н19, активировать промотор гена Igf2 (рис. 4,я). Материнская копия DMR не является метилированной, поэтому CTCF связывается со своим сайтом, что приводит к блокированию взаимодействия между энхансерами и промотором гена Igf2, а это, в свою очередь, вызывает инактивацию материнского аллеля гена Igf2 (рис. 4,6) [73]. Интересно то, что CTCF не участвует в установлении статуса метилирования про-моторной области гена H19, однако само связывание белка CTCF способно поддерживать уже существующий статус гипометилирования в данном импринтинговом локусе [74].
Некоторые CTCF-связывающие сайты были найдены в непосредственной близости от сайтов связывания для рецептора тиреоидного гормона. Например, инсуляторы из с-mус и лизоцимового генов состоят из сайтов связывания для белка CTCF и тиреоидного рецептора [75, 76]. В отсутствие лиганда (тиреоидного гормона) CTCF и рецептор тиреоидного гормона обладают энхансер-блокирующей активностью. В присутствии тиреоидного гормона инсулятор перестает работать, при этом белок CTCF остается связанным со своим сайтом. Возможно, в присутствии тиреоидного гормона происходят привлечение и сборка деацетилазного комплекса, приводящие к модификации и последующей частичной инактивации инсуляторного комплекса. То есть в данном случае энхансер-блокирующая активность CTCF-связывающих элементов может регулироваться соседними сайтами для рецептора тиреоидного гормона, функционирование которого зависит от наличия тиреоидного гормона.
Еще одним способом регуляции активности CTCF-инсуляторов может являться тканеспеци-фичное поли-АДФ-рибозилирование белка CTCF. Влияние процесса поли-АДФ-рибозилирования белка CTCF на проявление инсуляторной активности также было продемонстрировано на примере локуса Igf2/Hl9. Так, при ингибировании поли-АДФ-рибозилполимеразы энхансер-блокирующая активность инсулятора из локуса Igf2/H19 уменьшалась, что приводило к активации материнского аллеля гена Igf2 [77].
Недавно был обнаружен негативный регулятор энхансер-блокирующей активности белка CTCF. Им оказался BTB/POZ-содержащий белок Kaiso, для которого был найден сайт связывания, расположенный на расстоянии 34 пн выше CTCF-связывающего сайта в 5' (З-глобиновом инсулято-ре человека [78]. Для связывания с Kaiso данный сайт должен быть неметилированным. При удалении сайта связывания для Kaiso энхансер-блокирующая активность инсулятора увеличивалась. Было показано, что BTB/POZ-домен Kaiso может взаимодействовать с С-концом белка CTCF. Возможно, это взаимодействие приводит к нарушению сборки инсуляторного комплекса.
Все эти примеры, показывающие возможности альтернативной регуляции активности CTCF-зависимых инсуляторов, демонстрируют широкий спектр факторов, которые могут влиять на функционирование этих элементов. Но, тем не менее, хотелось бы отметить, что все эти обширные возможности способствуют и проявлению разных по силе эффектов инсуляции и, возможно, тканеспецифичной и зависимой от стадии развития организма активности CTCF-зависимых инсуляторов. По-видимому, не существует единой схемы работы CTCF-инсуляторов и контроль над их активностью является комплексным, т.е. в рамках генома постоянно происходит многоуровневая комбинаторика разных регуляторных сигналов, управляющих активностями CTCF-зависимых инсуляторов в том или ином генном контексте. МЕХАНИЗМЫ ДЕЙСТВИЯ ИНСУЛЯТОРОВ И ИХ РОЛЬ В РЕГУЛЯЦИИ ТРАНСКРИПЦИИ К настоящему времени для большинства изученных инсуляторов найдены специфичные ДНК-связывающие белки, сходные между собой только по ДНК-связывающему домену, который обычно состоит из большого числа цинковых пальцев. Так, даже белки CTCF у млекопитающих и дрозофилы имеют высокую степень гомологии только по ДНК-связывающему домену [53]. Известно, что эти домены, состоящие из цинковых пальцев, способны эффективно и специфично связываться с ДНК, упакованной в нук-леосомы. Так, для CTCF было показано, что он остается ассоциированным со многими своими сайтами связывания, в том числе в локусах H19, myc-N, β-глобиновом, DM1, даже во время митоза [79]. Возможно, это свойство помогает осуществлять эпигенетическую регуляцию, т.е. инсуляторы могут играть роль особых эпигенетических модулей памяти во время клеточного деления и облегчать связывание с хроматином других компонентов инсуляторных комплексов.
В рекрутировании белков, определяющих две основные функции инсуляторов - блокирования взаимодействия между энхансером и промотором и барьера между активным и репрессированным хроматином, могут участвовать другие домены ДНК-связывающих белков. Так, белок Su(Hw) взаимодействует с ВТВ-содержащими белками Mod(mdg4) и СР190 (которые, в свою очередь, возможно, участвуют в поддержании взаимодействия между инсуляторами и блокировании активности энхансеров) и с белком Е(у)2, который может рекрутировать комплекс, участвующий в барьерной активности инсуляторов. В случае р-глобинового инсулятора за такое рекрутирование, необходимое для проявления двух инсуляторных активностей, отвечают разные ДНК-связывающие белки - CTCF и USF.
Существуют экспериментальные данные, полученные in vivo и подтверждающие ассоциацию CTCF с белками ядерного матрикса [80]. В этом процессе одним из вероятных кофакторов CTCF является ядерный белок нуклеофосмин, молекулярный шаперон, принимающий участие в транспорте рибосомных субъединиц и гистонов из цитоплазмы в ядро. Интересно, что нуклеофосмин, CTCF и инсулятор 5'HS4 колокализуются на периферии ядра [81, 82]. Для Su(Hw)-инсуляторов была экспериментально продемонстрирована способность к формированию оснований хроматино-вых петель [83], но, к сожалению, взаимодействие Su(Hw)-инсулятopa с белками ядерного матрикса пока было показано только в системе in vitro [28]. Цитологические исследования по локализации локуса cut в присутствии и в отсутствие МДГ4 дали основания предполагать, что Su(Hw))-инсулятор способствует перемещению этого локуса на периферию ядра и, возможно, именно белки инсуляторного комплекса взаимодействуют с белками ядерной поры или ламином [42]. Интересно то, что посредником такого взаимодействия может являться белок Е(у)2 (С. Георгиева, неопубликованные данные). Однако стоит отметить, что для направления Su(Hw)-инсулятора к периферии ядра необходимы дополнительные регуляторные элементы в составе МДГ4, так как транспозоны, содержащие только Su(Hw)-инсулятор, не обладают никакими предпочтениями к локализации в данной области ядра [84]. Функциональная роль таких взаимодействий инсуляторов с белками ядерного матрикса и ядерной оболочкой пока не известна.
При тестировании способности регуляторного элемента быть инсулятором обычно используют системы, в которых исследуемый элемент расположен на сравнительно маленьких расстояниях между энхансером и промотором. В то же время
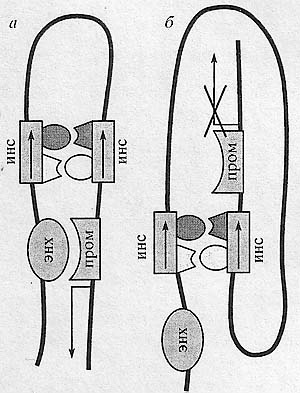 Рис. 5. Образование петли при взаимодействии инсуляторов. С инсуляторами связываются белки, которые, эффективно взаимодействуя между собой, формируют достаточно стабильный комплекс, а - между энхансером и промотором гена находятся два иисуля-тора, направленные в разные стороны (направление показано стрелками). Происходит усиление взаимодействия между энхансером и промотором за счет их сближения друг с другом; б - между энхансером и промотором гена находятся два инсулятора, направленные в одну сторону (направление показано стрелками), при этом взаимодействие между энхансером и промотором полностью блокируется.
Рис. 5. Образование петли при взаимодействии инсуляторов. С инсуляторами связываются белки, которые, эффективно взаимодействуя между собой, формируют достаточно стабильный комплекс, а - между энхансером и промотором гена находятся два иисуля-тора, направленные в разные стороны (направление показано стрелками). Происходит усиление взаимодействия между энхансером и промотором за счет их сближения друг с другом; б - между энхансером и промотором гена находятся два инсулятора, направленные в одну сторону (направление показано стрелками), при этом взаимодействие между энхансером и промотором полностью блокируется. постулируемые транскрипционные домены могут иметь большие размеры, достигающие десятков тысяч пар оснований. Возникает вопрос, будет ли на больших дистанциях сохраняться способность инсуляторов блокировать взаимодействие между энхансерами и промоторами. Существуют экспериментальные подтверждения такой возможности. Так, мутации в локусе cut и генном комплексе achaete-scute, индуцированные МДГ4, и искусственно созданные инсерции Su(Hw))-инсулятора в локусе Abd-B демонстрируют, что Su(Hw)-инсулятор способен блокировать взаимодействие между энхансерами и промоторами, которые находятся на больших дистанциях друг от друга [2]. Было также показано, что одна копия Su(Hw)-инсулятора полностью блокирует взаимодействие между энхансером и промотором гена yellow, которые находятся на расстоянии 8 тпн, вне зависимости от места инсерции транспозона в геноме [85]. Энхансеры остаются полностью заблокированными и в случае, когда два Su(Hw)-инсулятора вплотную окружают энхансеры. Однако при увеличении расстояния между этими инсуляторами происходит нейтрализация их способности блокировать энхансеры [85]. Такая же нейтрализация инсуляции происходит, когда два Su(Hw)-инсулятора расположены между энхансером и промотором [86, 87]. Вероятно, взаимодействие между Su(Hw)-инсуляторами является эффективным и высоко специфичным, поскольку Su(Hw)-инсуляторы могут взаимодействовать на сверхдальних расстояниях, достигающих нескольких миллионов пар оснований [88]. Возникает вопрос, насколько распространено это явление взаимодействия между инсуляторами. Для ответа на него независимо в двух лабораториях были протестированы наиболее изученные инсуляторы дрозофилы на способность нейтрализовывать активность друг друга [89, 90]. Оказалось, что эффект нейтрализации инсуляции не наблюдался ни для одной из пар инсуляторов. Этот результат дал основания высказать предположение о том, что большая часть инсуляторов не взаимодействует друг с другом, либо при их взаимодействии не происходит нейтрализации их активности. Однако недавно было показано, что инсуляторы из элемента МСР не только нейтрализуют активность друг друга [46], но и могут взаимодействовать на сверхдальних расстояниях (О. Кырчанова, неопубликованные данные). Интересно, что взаимная ориентация МСР-инсуля-торов играет решающую роль в проявлении эффектов их функционального взаимодействия. Когда два инсулятора были встроены между энхансером и промотором в обратной ориентации по отношению друг к другу, происходило усиление взаимодействия между энхансером и промотором (рис. 5,я). Наоборот, если инсуляторы были однонаправлены, они полностью блокировали взаимодействие между энхансером и промотором (рис. 5,6) (О. Кырчанова, неопубликованные данные). Однако если энхансер поместить внутри петли, то взаимодействие между энхансером и промотором восстанавливается. Аналогичным свойством обладает и mw-инсулятор (Д. Четверина, неопубликованные данные). Вероятным объяснением эффектов такого направленного действия может быть предположение о том, что с инсуляторами МСР и mw связываются как минимум два белка, которые, эффективно взаимодействуя между собой, формируют достаточно стабильный комплекс. Тогда, если инсуляторы находятся в одной ориентации, в результате взаимодействия между ними формируется петля, позволяющая регуляторным элементам, которые находятся внутри и с внешней стороны петли, взаимодействовать друг с другом. Наоборот, в случае, когда инсуляторы находятся в разных ориентациях, происходит сближение регуляторных элементов, расположенных с внешней стороны петли, формируемой инсуляторами (рис. 5,я). Так как большинство инсуляторов имеет сложное строение, отсутствие эффекта нейтрализации в исследованиях можно объяснить тем, что инсуляторы
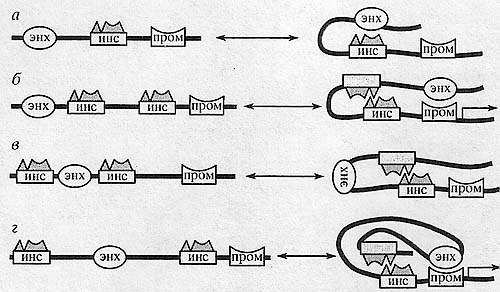 Рис. 6. Механизмы действия инсуляторов. я - между энхансером и промотором гена расположен инсулятор. Возможно, за счет формирования нестабильных контактов между инсуляторным комплексом и белками, связанными с энхансером, продвижение компонентов энхансера к промотору блокируется; б- между энхансером и промотором гена расположены два инсулятора. При этом происходит нейтрализация эффекта инсуляции за счет того, что между инсуляторами образуются стабильные контакты, что способствует сближению энхансера с промотором; в - два инсулятора вплотную окружают энхансер гена. Инсуляторы эффективно взаимодействуют друг с другом. В результате энхансер, оказавшийся внутри петли, сформированной инсуляторами, не может активировать промотор, который находится вне петли достаточно далеко от энхансера; г - два инсулятора, разнесенные на достаточно большое расстояние друг от друга, окружают энхансер гена. В этом случае, как и в предыдущем, энхансер оказывается внутри петли, образованной за счет взаимодействия двух инсуляторов. Однако из-за увеличения расстояния между инсуляторами происходит нейтрализация их способности блокировать энхансер, так как облегчается возможность сближения энхансера с промотором.
Рис. 6. Механизмы действия инсуляторов. я - между энхансером и промотором гена расположен инсулятор. Возможно, за счет формирования нестабильных контактов между инсуляторным комплексом и белками, связанными с энхансером, продвижение компонентов энхансера к промотору блокируется; б- между энхансером и промотором гена расположены два инсулятора. При этом происходит нейтрализация эффекта инсуляции за счет того, что между инсуляторами образуются стабильные контакты, что способствует сближению энхансера с промотором; в - два инсулятора вплотную окружают энхансер гена. Инсуляторы эффективно взаимодействуют друг с другом. В результате энхансер, оказавшийся внутри петли, сформированной инсуляторами, не может активировать промотор, который находится вне петли достаточно далеко от энхансера; г - два инсулятора, разнесенные на достаточно большое расстояние друг от друга, окружают энхансер гена. В этом случае, как и в предыдущем, энхансер оказывается внутри петли, образованной за счет взаимодействия двух инсуляторов. Однако из-за увеличения расстояния между инсуляторами происходит нейтрализация их способности блокировать энхансер, так как облегчается возможность сближения энхансера с промотором. были встроены в одной ориентации. Действительно, два Fab-7-инсулятора, вставленные между энхансером и промотором в противоположной ориентации, полностью нейтрализуют активность друг друга [91], в то время как ранее было показано, что сонаправленные Fab-7-инсуляторы усиливают активность друг друга [90]. Для инсулятора Idefix эффект нейтрализации инсуляции был продемонстрирован также при встраивании двух элементов в противоположной ориентации [54]. Таким образом, взаимодействие и способность к взаимной нейтрализации, скорее всего, является общим свойством идентичных или структурно сходных инсуляторов. Можно выделить два наиболее хорошо экспериментально обоснованных механизма блокирования энхансеров инсуляторами. Эти механизмы могут функционировать и совместно, взаимно дополняя друг друга. Первый механизм основан на стерических и топологических препятствиях, возникающих для взаимодействия между энхансером и промотором в результате образования стабильных контактов между инсуляторами. Такой механизм действия инсуляторов был продемонстрирован с помощью искусственно созданных инсуляторов, состоящих из сайтов связывания для белков, способных эффективно взаимодействовать друг с другом и образовывать стабильные петли [92, 93]. В результате энхансер, расположенный внутри петли, не мог стимулировать промотор, который находился вне петли. Вероятно, этот механизм эффективен только в том случае, когда инсуляторы расположены рядом с блокируемыми ими энхансерами и промоторами (рис. 6,в,г).
Второй механизм основан на предположении о существовании прямого взаимодействия между инсуляторным комплексом и белками, связанными либо с энхансером, либо с промотором [6, 10]. Так как эти взаимодействия не должны нарушать активность промотора или энхансера, то предполагается, что нестабильные контакты между белками препятствуют только продвижению компонентов энхансера к промотору (рис. 6,а). Такой механизм работает в том случае, когда эти регуляторные элементы находятся на одной цепи ДНК, поскольку инсуляторы не способны блокировать транс-взаимодействия между энхансером и промотором, расположенными на гомологичных хромосомах [88]. В то же время эффекты нейтрализации инсуляции, с этой точки зрения, связаны с тем, что при взаимодействии белковых комплексов двух инсуляторов происходит частичная или полная потеря способности к образованию контактов с белками энхансеров (рис. 6,6). Пока существуют только косвенные данные в пользу такого механизма блокирования действия энхансеров. Так, тандемная дупликация энхансера способна преодолевать блок 8и(Н\у)-инсулято-ра и стимулировать транскрипцию [29, 89]. Кроме этого, было показано, что сайты связывания для белка GAF не обладают инсуляторной и энхан-серной активностями, однако они могут частично нейтрализовать активность Su(Hw)-инсулятора в результате взаимодействия между ВТВ-содержа-щими белками GAF и Mod(mdg4)-67.2 [57]. Наконец, существуют косвенные данные о прямом взаимодействии Su(Hw)-инсулятора с промотором гена yellow [94].
Вероятно, что в зависимости от свойств самого инсулятора, его локализации относительно эн-хансера и промотора и присутствия других инсуляторов основную роль играет только один из двух вышеописанных механизмов действия инсуляторов. Не исключено, что взаимодействие инсуляторов с белками ядерного скелета также может модулировать (усиливать или ослаблять) эффективность блокирования энхансеров. Наконец, активность инсуляторов, способных создавать границы между активным и неактивным хроматином, возможно, реализуется за счет привлечения инсу-ляторами комплексов, модифицирующих гистоны нуклеосом. Аналогичный механизм создания барьера хорошо исследован у дрожжей [95].
Какую роль могут играть инсуляторы в регуляции экспрессии генов, пока неизвестно. Изначально инсуляторам приписывали роль в создании границ между транскрипционными доменами. К настоящему времени такая модель функционирования инсуляторов наиболее согласуется с работой (β-глобинового локуса курицы. Однако картированные сайты связывания для CTCF-белка, обладающие инсуляторной активностью, часто встречаются в интронах генов и в области промотора [96], что не согласуется с их ролью в определении границ между транскрипционными доменами. Такое же произвольное распределение было показано для сайтов связывания белка Su(Hw) [32]. Интересно, что многие инсуляторные белки являются активными компонентами энхансеров, сай-ленсеров и промоторов. Так, наиболее сильный, Su(Hw)-инсулятор, возможно, является промотор-специфичным стимулятором транскрипции МДГ4 [97]. Кроме этого, было показано, что Su(Hw)-инсулятор стимулирует транскрипцию с промотора Adh [98] и с ослабленного промотора гена yellow [94]. Белок BEAF конкурирует за сайты связывания с белком DREF, одной из функций которого является рекрутирование TRF2, аналога ТВР. Наконец, описана роль CTCF в составе сайленсеров и энхансеров. Так, в непосредственной близости от старта транскрипции гена амилоидного белка-предшественника расположены необходимые для обеспечения активности промотора сайты связывания для белков CTCF и USF, работающие в паре и в случае [З-глобинового инсулятора [99]. Так же было показано участие CTCF в репрессии гена hTERT [100] и специфичной репрессии в эритроидных клетках гена домашнего хозяйства ggPRX, находящегося рядом с α-глобиновым локусом кур [101].
Таким образом, пока не существует достоверных данных о том, что основной функцией инсуляторов, как предполагалось ранее, является разграничение транскрипционных доменов. Более того, большинство найденных инсуляторов. возможно, являются функциональными частями либо энхансеров, либо промоторов. Можно предположить, что одной из функций регуляторных элементов, обладающих свойствами инсуляторов. является контроль над установлением правильных взаимодействий между энхансерами и промоторами. За счет эффективного и селективного взаимодействия на больших дистанциях инсуляторы могут регулировать пространственную локализацию хромосом в ядре и, в том числе, поддерживать спаривание гомологичных хромосом в соматических клетках. Наконец, цитологические исследования последних лет показали, что при активации ген перемещается в зоны активной транскрипции, названные "транскрипционными фабриками", в то же время неактивные гены аналогичным образом группируются в зонах с повышенным содержанием репрессоров [6]. Возможно, что инсуляторы с регулируемой активностью могут участвовать в процессах перелокализации генов в ядре. В настоящее время в нашей лаборатории ведется экспериментальная работа по проверке предложенных моделей.
|