У многих внутриклеточных белков имеется всего один или совсем небольшое число «партнеров», с которыми они взаимодействуют. В качестве примера можно привести рецептор и его лиганд, под ходящие друг к другу, как замок и ключ. На другие типы рецепторов данный лиганд не действует,
| |
|
|
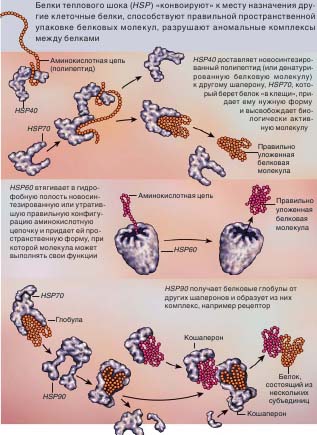
Белки теплового шока (шапероны) способствуют правильной пространственной укладке белковых молекул, дос тавляют их к месту назначения, предотвращают нежелательные контакты с другими клеточными компонентами |
и каждый рецептор как правило активируется своим структурно близким лигандом или веществом. В отличие от этого, шапероны взаимодействуют с широким кругом белков, что позволяет им выполнять различную работу. Например, они помогают новосинтезированным аминокислотным цепочкам принимать правильную пространственную конфигурацию, при которой те могут выполнять свои функции; демонтируют поврежденные белковые молекулы; сопровождают белки к месту назначения, охраняя их от разного рода опасностей, и т.д.
Рассмотрим ряд примеров, иллюстрирующих, насколько важна каждая функция, и показывающих, как именно работают шапероны. Для того чтобы белок выполнил свою миссию, он должен не только оказаться в нуж ном месте в нужное время, но и «быть в форме», т.е. иметь подходящую конфигурацию. Только что сошедшей со «сборочного конвейера» (рибосомы) цепочке из аминокислот помогают разные факторы. Так, каждая ее аминокислота по-своему реагирует на водное окружение — цитоплазму. Гидрофобные аминокислоты стараются избежать контакта с водой и «прячутся» внутри белковой глобулы. В отличие от этого, гидрофильные аминокислоты предпочитают находиться в воде и выступают из глобулы наружу. Однако для обеспечения правильной пространственной укладки цепочки этого недостаточно, и здесь на помощь приходят шапероны, в частности HSP60 (врезка на стр. 53).
В нашем понимании механизма действия HSP60 мы во многом бяза ны Артуру Горвичу (Arthur L.Hor wich) из Йельского университета. Он показал, что данный шаперон по своей структуре напоминает плод малины, состоящий из множества субъединиц. Его внутренняя полость высокогидрофобна и «втягивает» в себя гидрофобные аминокислоты еще не полностью свернувшейся белковой молекулы, заставляя последнюю изменить конфигурацию. Такой процесс может иметь многоступенчатый характер, полость многократно захватывает и отпускает белковую молекулу, оптимизируя ее форму. Благодаря своей способности укладывать правильным образом белковые глобулы шаперон HSP60 получил название фолдазы (от англ. to fold — «укладывать, сворачивать»). Белок HSP100 напротив называют антифолдазой (от to unfold — «разворачивать»). Он тоже имеет субъединичную структуру, и в сотрудничестве с шапероном HSP70 демонтирует белки, получившие необратимые повреждения, разрушает ошибочно образовавшиеся агрегаты и даже заставляет развернуться полностью упаковавшуюся молекулу.
В отличие от белков типа HSP60, большинство шаперонов не втягивают в себя субстрат, а «берут его в клещи» или «сажают на крючок». Например, у HSP70 есть пептид-связывающая щель, находящаяся в открытом состоянии, когда этот шаперон несет АТФ. В отсутствие АТФ щель схлопывается, обхватывает присоединившийся ранее короткий участок белковой молекулы и доставляет последнюю к месту назначения. Способность HSP70 связываться с разными пептидами позволяет ему участвовать во множестве процессов, протекающих в клетке. Он по-
могает новосинтезированным полипептидам принимать биологически активную конформацию, облегчает сборку сложных белков, предотвращает их денатурацию при высоких температурах.
Белки теплового шока функционируют и в клетках, находящихся в обычных условиях, но насколько возрастает их роль, когда ситуация меняется! В экстремальных ситуациях — при очень высоких либо при очень низких температурах, кислородном голодании, дефиците воды и питате льных веществ — клетка бросает все силы на то, чтобы выжить, и шапероны смягчают последствия стресса, спасая жизненно важные белки, демонтируя безнадежно поврежденные и повторно используя их компоненты. В условиях стресса клетке выгодно вырабатывать как можно больше шаперонов, свидетелем чего и стал молодой ученый Ритосс а 46 лет назад. А в 1980-х гг. ученые получили неопровержимые доказательства того, что шапероны способны на большее — они спасают не только клетки,но и организм в целом.
Антигенная дактилоскопия
В начале 1980-х гг., когда я был аспирантом Центра клеточной и молекулярной биологии в Хайдарабаде (Индия), меня заинтересовало одно явление, обнаруженное еще в 1940-х гг., но не нашедшее объяснения. В опытах на животных было неоднократно показано, что грызунам можно делать прививку против рака аналогично тому, как вакцинируют от инфекционных заболеваний. Вспомним, что белки патогена воспринимаются иммунной системой млекопитающих как чужаки, а раковые клетки образуются из нормальных клеток организма и никаких чужеродных антигенов не несут. Что же в таком случае вызывает иммунный ответ? На этот вопрос я и намеревался ответить.
В ходе работы над диссертацией я идентифицировал белок gp96, который мог отвечать за реакцию иммунной системы на раковые клетки. К моему удивлению, он оказался членом семейства шаперонов HSP90, присутствующих как в нормальных, так и в раковых клетках. Два года спустя независимо от меня этот же белок обнаружил Стивен Ульрих
(Stephen J. Ullrich) из Национальных институтов здоровья. Аминокислотная последовательность gp96, выделенного из раковых клеток, ничем не отличалась от таковой обычного белка, так что он не был канцероспецифичным. Чем же определялась его способность вызывать иммунную реакцию?
Ответа пришлось ждать 10 лет. В 1990 г. Хэихиро Удоно (Heiichiro Udono), работавший в то время в моей лаборатории в Медицинской школе Синайские горы (Нью-Йорк), выделил из опухолевой ткани шаперон HSP70, намереваясь проверить, обладает ли он теми же свойствами, что и HSP90. Оказалось, что да. Но самое удивительное началось потом: когда мы использовали для очистки
| ОБ АВТОРЕ
Прамод Шривастава (Pramod K. Srivastava) — профессор медицины, возглавляет Центр иммунотерапии рака и инфекционных заболеваний при Медицинской школе Коннектикутского университета. Пионер в области исследования роли белков теплового шока в активации иммунной системы.Один из основателей компании Antigenics, которая занимается созданием противораковой вакцины на основе шаперонов, полученных от больных раком.
В настоящее время является научным консультантом компании и продолжает изучение роли шаперонов в работе иммунной системы. |
| |
|
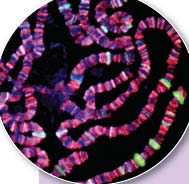 РЕАКЦИЯ НА СТРЕСС
РЕАКЦИЯ НА СТРЕСС
Хромосомы дрозофилы, получившей тепловой удар, у толщаются в местах расположения генов, кодирующих шапероны (белый и зеленый цвета). Для того чтобы клетка могла синтезировать белки, двойная спираль ДНК должна локально расплестись, открыв доступ к генам соответствующих ферментов. Такие локально расплетшиеся участки выглядят на рисунке как утолщения |
HSP70 так называемую АТФ-аффинную хроматографию, его мощное иммуностимулирующее действие исчезло!
Мы сразу поняли, что при взаимодействии с АТФ HSP70 утрачивает то самое вещество (по нашему предположению, пептид), которое наделяет его упомянутым свойством. В ходе дальнейших исследований выяснилось, что при таком взаимодействии изменяется конформация HSP70, и связывание его с каким-либо пептидом становится невозможным. На самом деле
члены всех семейств шаперонов — HSP60, HSP70 и HSP90 — выполняли функции переносчиков пептидов, вырабатываемых клетками. Все эти белки, выделенные из раковых клеток либо клеток, зараженных каким-нибудь вирусом, возбудителем туберкулеза, другим инфекционным агентом, несли пептиды – сегменты соответствующих антигенов. Иными словами, HSP-ассоциированные пептиды представляли собой «антигенные отпечатки» клеток или тканей, из которых их выделили.
ПОДДЕРЖАНИЕ ПОРЯДКА
Способность некоторых шаперонов захватывать пептиды, специфичные для клеток-хозяев, сделала их участниками одного из основополагающих событий в работе иммунной системы, а именно — распознавания Т-лимфоцитами антигенов на поверхности клеток. Почти все антигены, образуемые внутри клетки, распадаются на пептиды. Они связываются с шаперонами HSP60,
70 и 90 (последовательность этапов данного процесса пока не известна), а в конце концов — с особым типом белков, главным комплексом гистосовместимости I (MHC I, от major histocompatibility complex I), находящимся на поверхности большинства клеток млекопитающих. Т-лимфоциты распознают комплекс MHC/пептид и вместе с другими компонентами иммунной системы разрушают дефектную клетку (врезка на следующей стр.).
Сам MHC I никакими антигенными свойствами не обладает и Т-клетками не распознается. Гипотеза об участии связанных с HSP пептидов в презентации антигенов была высказана мною в 1994 г. и получила экспериментальное подтверждение. Именно способность HSP связывать специфические пептиды раковых и инфицированных клеток лежит в основе иммуностимулирующего действия выделенных из раковых клеток HSP. Но у комплекса HSP/пептид есть и другая функция: взаимодействуя с антигенпредставляющими клетками иммунной системы, они способствуют распознаванию Т-клетками своих и чужих антигенов.
Сигнал тревоги
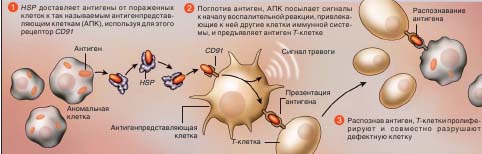
Стражи иммунной системы, антигенпредставляющие клетки, присутствуют практически во всех тканях человеческого тела и непрерывно «обследуют местность» на наличие антигенов. Они «представляют» свои находки Т-клеткам, те разыскивают антигенсодержащие клетки (раковые, инфицированные) и уничтожают их. Как оказалось, антигенпредставляющие клетки несут на своей поверхности рецепторы, с которыми могут связываться шапероны, нагруженные пептидами. Первый такой рецептор, CD91, был идентифицирован Робертом Байндером (Robert J. Binder), когда он работал в моей лаборатории (сейчас Байндер — доцент Питтсбургского университета).
|
АКТИВАЦИЯ ИММУННОЙ СИСТЕМЫ
Когда клетка превращается в раковую, или в нее проникает какой-нибудь патоген, в ней начинается синтез необычных белков. Фрагменты белков — антигены — провоцируют иммунный ответ. Но для этого иммунные клетки должны быть поставлены в известность о возникшей аномалии. Белки теплового шока, прежде всего члены семейств HSP90 и HSP70, берут на себя функции глашатаев. Они включаются в систему оповещения и идентификации возмутителей спокойствия
|
Когда антигенпредставляющая клетка встречается с комплексом HSP/пептид, она его захватывает CD91-рецептором и представляет пептид Т -клеткам. Последние начинают размножаться и уничтожают несущие данный антиген клетки. В этом кроется причина того, что HSP, выделенные из организма больного раком, вызывают иммунный ответ на раковые клетки, а HSP здорового индивида — нет.
В дополнение ко всему сказанному выше, HSP, по-видимом у, способны посылать сигнал тревоги. Вместе со Срейаши Басу (Sreyashi Basu) из Медицинской школы при Коннектикутском университете мною было показано, что одно только присутствие антигенпредставляющих кле-
ток приводит к целому ряду изменений шаперонов семейств HSP70 и HSP90 ; в частности они инициируют воспалительную реакцию — составную часть системы защиты организма при вторжении чужеродного агента. У HSP хватает работы и внутри клеток, но в условиях стресса некоторые шапероны высвобождаются в окружающую среду или размещаются на поверхности клеток в небольшом, но ощутимом количестве. По-видимому, активация антигенпредставляющих клеток под действием HSP и генерация сигнала тревоги обусловливаются простым появлением последних на клеточной поверхности, где в норме им находиться не полагается.
В основе моих работ по использованию комплексов HSP/пептид, полученных от больных раком, для борьбы с этим заболеванием лежат способность комплексов активировать иммунную систему и уникальность опухоли каждого больного по своим антигенным свойствам. Мною разработан метод получения комплекса HSP/пеп тид от конкретного больного и введения его в чистом виде этому же человеку. По сути это является методом иммунизации, благодаря которой иммунна я система начинает активно атаковать клетки, несущие ассоциированные с данной опухолью антигены. Такой подход был апробирован в США и Европе в ходе клинических испытаний (фазы I и II) на больных с разными онкологическими заболеваниями, а недавно завершена III фаза рандомизированных испытаний на больных меланомой и раком почек в США, Европе, А встралии и России. Показано, что больные меланомой, получившие вакцину на основе комплекса HSP/пептид, у которых симптомы ограничивались поражениями кожи, лимфатических узлов и легких, жили гораздо дольше, чем те, кто прошел стандартный курс лечения, включавший химиотерапию. Вакцинация при раке почек продлевала ремиссию у некоторых больных
более чем на полтора года.
Российские ученые (группа под руководством Б.А. Маргулиса из Института цитологии РАН в Петербурге) создали индивидуальную вакцину против рака, и первым больным уже удалось вылечиться с ее помощью. Ожидается, что вскоре данный метод будет разрешен к применению
в странах Европы. Управление по контролю над качеством пищевых продуктов, медикаментов и косметических средств США занимает пока выжидательную позицию. Тем временем обнаружилось, что HSP-вакцинация эффективна также при таких заболеваниях, как генитальный герпес и туберкулез. Сейчас соответствующая вакцина проходит клинические испытания.
Перспективы
Применение HSP в медицинских целях не ограничивается созданием вакцин на их основе. Исследование, проведенное Сюзанной Ратерфорд (Suzanne L. Rutherford) из Вашингтонского университета и Сузан Линдквист (Susan L. Lindquist) из Института биомедицинских исследований
Уайтхеда в Кеймбридже (штат Массачусетс), выявило удивительную эффективность шаперонов в выполнении их основной работы — демпфировании губительных для клетки стрессовых воздействий. Ими показано, что при подавлении активности HSP90 у дрозофилы демаскируется большое число скрытых мутаций, эффект которых не проявлялся ранее благодаря шаперонам. Ратерфорд и Линдквист пришли к выводу, что живые системы обладают мощным потенциалом в отношении изменчивости, который обычно не дает о себе знать, поскольку его подавляют шапероны. Такой эффект способствует незаметному накоплению генетических изменений, и как только действие шаперонов ослабевает (например, при экстремальных температурах), вариантные признаки проявляются и становятся мишенью естественного отбора. Таким образом, HSP90, благоприятствуя изменчивости, ускоряет эволюцию.
Линдквист получила дополнительные свидетельства участия HSP90 в быстром приобретении новых признаков, в частности резистентности к лекарственным веществам у разных видов грибов. Отсюда было сделано заключение, что видоспецифичные ингибиторы HSP90 можно использовать как антибиотики нового поколения. Поскольку HSP90 влияет на гораздо более широкий круг сигнальных механизмов, чем любой другой тип шаперонов, его блокирование могло бы сделать раковые клетки более чувствительными к стрессовым воздействиям, например к химиотерапии.
Исследуя эффективность комплексов HSP/пептид как иммуностимуляторов при раке, я обнаружил странное явление. В очень высоких дозах HSP оказывает не активирующее, а подавляющее действие на иммунную систему, т.е. шапероны могут быть не только иммуностимуляторами, но и им муносупрессантами. Опыты на мышах показали, что в высоких дозах HSP эффективен при диабете 1-го типа (аутоиммунном заболевании) и энцефалите. Ирун Коэн (Irun R. Cohen) из Вейцмановского института в Реховоте (Израиль) уже давно высказывал предположение, что HSP60 в комплексе с одним из пептидов выполняет функцию аутоантигена при диабете 1-го типа, инициируя атаку иммунной системы на инсулинпродуцирующие клетки. Клинические испытания показали, что блокирование пептида частично смягчает симптомы заболевания.
Благодаря наличию у шаперонов различных свойств их можно пытаться использовать для лечения многих болезней, однако такая универсальность имеет и отрицательную сторону: намеренное повышение уровня HSP в организме может привести к нарушению разнообразных систем, в работе которых шапероны принимают участие. К счастью, у клиницистов и фармакологов
на коплен богатый опыт использования веществ широкого спектра действия, и он несомненно поможет избежать нежелательных побочных эффектов применения шаперонов.
Подводя итог, можно сказать, что шапероны были инструментом природы с момента зарождения жизни, поскольку они активно участвовали в создании инфраструктуры живых систем. В их обязанности входит обеспечение конформационной стабильности белков, устранение безнадежно поврежденных белковых молекул, защита первых полипептидов от
стрессовых воздействий со стороны агрессивной среды, существовавшей на первобытной Земле, а также противодействие вредным последствиям мутаций. В ходе эволюции у шаперонов появлялись новые функции, благодаря которым теперь мы можем использовать их в медицине. Я не думаю, что нам известно о шаперонах все. И чем больше тайн этих необычных молекул мы раскроем, тем шире будет круг их применения.
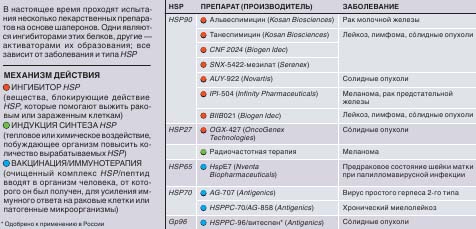
ПРОХОДЯТ ИСПЫТАНИЯ
Перевод Н.Н. Шафрановская
Сайт создан в системе
uCoz
 РЕАКЦИЯ НА СТРЕСС
РЕАКЦИЯ НА СТРЕСС 

