Мы полагаем, что при регенерации конечности действует механизм обмена сигналами, сходный с тем, который запускается АЭГ. Кроме того, Хироюки Идэ (Hiroyuki Ide) из Университета Тохоку в Японии обнаружил, что потеря способности к регенерации у головастиков лягушки тесно связана с невозможностью активировать ФРГ-цикл. При введении головастикам старшего возраста (уже не способным восстанавливать конечность) ФРГ-10 удается запустить сигнальный цикл и стимулировать частичную регенерацию ампутированной лапы. Энтузиазм, вызванный такими результатами, несколько омрачается тем фактом, что индуцированная регенерация была ненормальной: полученная конечность состояла из неправильно расположенных частей. Однако именно благодаря этому нам удалось понять, что контроль над процессом регенерации, при котором все необходимые анатомические структуры, утерянные при ампутации, восстанавливаются в естественном порядке, осуществляется при участии фибробластов.
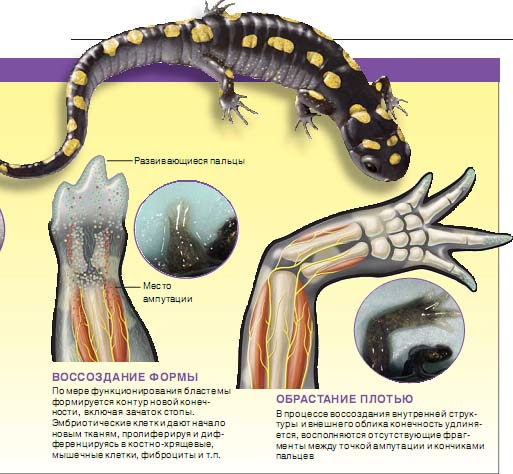
Итогом экспериментов по выращиванию дополнительной конечности стал вывод, что одно лишь присутствие фибробластов не запускает процесс регенерации, т.к. они присутствуют и на месте небольшой раны, заживление которой не приводит к появлению новой конечности. Исследования показали, что лапа восстанавливается только тогда, когда в месте ранения присутствуют фибробласты с противоположной стороны конечности. Данное открытие иллюстрирует, насколько важную роль в осуществлении механизма запуска регенерационного процесса играет расположение клеток. В процессе развития эмбриона последовательность событий всегда такова: сначала образуется основание конечности - плечо или бедро, затем по порядку достраиваются более дистальные структуры и, наконец, процесс завершается формированием пальцев. Регенерация у взрослой саламандры протекает в нормальной последовательности независимо от того, на каком участке была расположена точка ампутации, причем восстанавливаются всегда только утраченные части конечности. Это значит, что клетки на поверхности культи обладают информацией о своем расположении относительно остальных клеток лапы. Подобная информация, определяемая активностью специфических генов, позволяет контролировать клеточные и молекулярные процессы, приводящие к полному замещению утраченных частей конечности. Установив, какие гены активируются в течение данного процесса, ученые смогут выявить механизмы, контролирующие этап регенерации.
Несмотря на то что в ходе эмбрионального развития при "обучении" клетки ее местоположению задействовано огромное количество генов, решающее значение имеет активность генов семейства hox. В процессе формирования лапы клетки почки конечности большинства животных используют позиционный код, обеспечиваемый активацией генов hox, но когда клетки дифференцируются и становятся более специализированными, такая способность утрачивается. Клетки как будто "забывают" информацию. Фибробласты взрослой саламандры наоборот сохраняют память о вышеописанной информационной системе и могут снова получить доступ к hox коду, отвечающему за местоположение клеток, в процессе регенерации.
В момент инициации формирования бластемы, когда фибробласты мигрируют по раневой поверхности, они приносят с собой позиционную информацию и обмениваются ею с соседними клетками, что позволяет организму животного "оценить" масштабы повреждения. Пока неизвестно, как происходит передача информации внутри бластемы, понятно лишь, что одним из последствий обмена является воссоздание контура утраченной конечности, в результате чего восстанавливаются недостающие участки от культи до кончиков пальцев.
С учетом того, что основной объем конечности составляют мускулатура и кости, важно понять, откуда берется исходный материал для этих тканей, и какие механизмы контролируют его формирование. В самом начале регенерационного процесса, сразу после образования апикальной эпителиальной шапочки, начинается ключевой и малопонятный пока процесс дедифференциации клеток. Этот термин используется для описания реверсии зрелой специализированной (например, мускульной) клетки к стадии примитивной эмбриональной, в результате чего клетка становится способной к делению и может дать начало клеткам одного или нескольких типов тканей. Впервые это явление было описано довольно давно, когда ученые, под микроскопом наблюдавшие за регенерацией саламандры, обнаружили, что на месте хорошо структурированной области культи на границе разреза формируется пролиферирующая масса неотличимых друг от друга дедифференцированных клеток, формирующих бластему. На сегодняшний день установлено, что дедифференциации мускульной ткани не происходит, т.к. пролиферирующие клетки происходят от недифференцированных стволовых, в норме встречающихся в мускульной ткани. Так или иначе процесс, обозначаемый как дедифференциация, наблюдается во всех типах тканей регенерирующей конечности. Входящие в бластему фибробласты, будучи слабо дифференцированными клетками, в дальнейшем способны дифференцироваться в хондроциты костно-хрящевой ткани или в фиброциты, которые будут формировать соединительно-тканную основу новой конечности. Второй вид клеток, участвующих в формировании бластемы, - это клетки эпидермиса, которые также претерпевают изменения, приближающие их к состоянию эмбриональных клеток. В эктодерме эмбриона активирован ряд генов (включая гены Fgf8 и Wnt7a), работа которых принципиально важна для развития конечности. По мере того как эктодерма эмбрионов дифференцируется, образуя многослойный эпидермис взрослого животного, эти гены переходят в неактивное состояние. В начале процесса регенерации у взрослой особи в эпидермальных клетках, мигрирующих через ампутационную рану и образующих раневой эпидермис, активны гены, не являющиеся специфическими для регенерационного процесса (например, ген, обеспечивающий синтез заживляющего рану кератина). Позже в этих клетках активируются два важнейших гена развития - Fgf8 и Wnt7a. Таким образом, основной задачей дедифференцировки (как в случае эпидермиса, так и применительно к другим типам тканей) является специфическая реактивация основных генов, отвечающих за развитие эмбриона, т.е. восстанов-
 ПЕРИОД ЭМБРИОНАЛЬНОГО РАЗВИТИЯ.
ПЕРИОД ЭМБРИОНАЛЬНОГО РАЗВИТИЯ.
На стадии формирования пальцев в лапе мыши синтезируется фактор роста, называемый BMP-4 (лиловый цвет), который также вырабатывается при естественной регенерации кончиков пальцев
ление уровня активности этих генов, свойственного им в период эмбрионального развития.
Наши исследования на саламандрах показали, что процесс регенерации может быть разделен на несколько основных стадий. Первым идет этап реакции затягивания раны, за ним следует формирование бластемы из клеток, в какой-то степени вернувшихся к эмбриональному состоянию, и, наконец, активизируются гены, программирующие развитие новой конечности.
Потенциал на кончиках пальцев
Обнадеживающим знаком того, что регенерация конечностей человека - достижимая цель, можно считать тот факт, что кончики наших пальцев сохраняют внутреннюю способность к регенерации. Это открытие впервые было сделано более 30 лет назад при наблюдении детей, однако недавно сходные результаты были получены для подростков и даже взрослых. Для стимуляции процесса регенерации при ампутации кончиков пальцев достаточно таких простых действий, как очистка раны и покрытие ее поверхности простым перевязочным материалом. Если позволить подобному повреждению "лечиться" естественным путем, кончики пальцев восстанавливают свой контур, папиллярные линии, чувствительность и удлиняются до нужной степени. Интересно то, что в современной медицине в качестве альтернативы принято лечить подобные ранения с помощью пересадки кожного лоскута на ампутационную рану, что, как известно, останавливает процесс регенерации даже у саламандры, т.к. это препятствует формированию раневого эпидермиса. Краеугольным камнем наших исследований служит идея, что люди все же имеют врожденную способность к регенерации.
В последние годы двое из нас (Мунеока и Хань) занимались детальным изучением регенерационных процессов при повреждении кончиков пальцев у мышей разного возраста. Мы обнаружили, что после ампутации у грызунов формируется раневой эпидермис, покрывающий регенерирующую рану гораздо медленнее, чем это происходит у саламандры. Мы также выявили, что в процессе восстановления в недифференцированных пролиферирующих клетках на поверхности раны активируются важные эмбриональные гены. Это указывает на то, что они являются клетками бластемы. Также есть косвенное свидетельство, что они образовались из фибробластов, постоянно находящихся в интерстициальной соединительной ткани и костном мозге.
Для того чтобы исследовать роль специфических генов и факторов роста в процессе регенерации у мышей с ампутированным кончиком пальца, мы создали культуру ткани, которая может служить моделью эмбриональной регенерации. С ее помощью было обнаружено, что если мы устраним из зародышевой ампутационной раны фактор роста - костный морфогенетический протеин 4 (BMP-4), то мы остановим регенерацию. Вдобавок мы показали, что мутантные мыши, испытавшие нокауты по гену Msx1 (кодирующему этот белок), не способны восстанавливать ампутированный кончик пальца. Ген Msx1 необходим для продуцирования BMP-4 при формировании кончиков пальцев у эмбрионов, и нам удалось восстановить способность к регенерации Msx1-дефицитных мышей введением BMP-4 в рану, что подтверждает необходимость данного белка для осуществления процесса восстановления. Исследования Кори Эйбэт-Шен (Cory Abate-Shen) из Медицинской школы им. Роберта Вуда Джонсона также продемонстрировали, что протеин, кодируемый Msx1, подавляет дифференциацию различных типов клеток в период эмбрионального развития. Существует предположение, что данный белок играет важную роль и в реакции регенерации, т.к. вызывает дедифференцировку клеток. Несмотря на то что Msx1 не активен на ранней стадии дедифференцировки при восстановлении у саламандры, его сестринский ген Msx2 является одним из первых генов, возобновляющих свою работу в процессе регенерации конечности и, похоже, обеспечивает аналогичные функции.
Трудности регенерации у человека
Регенерация конечности человека до сих пор кажется скорее фантастической идеей, чем реальной возможностью, однако благодаря описанным выше открытиям, мы считаем, что на одну логическую ступеньку приблизились к возможности ее осуществления. Ампутированная конечность человека имеет огромную комплексную раневую поверхность, которая проходит через все типы тканей, включая эпидермис, дерму, интерстициальную соединительную ткань, жировую ткань, мускулы, кости, нервы и кровеносные сосуды. Если рассматривать столь различные виды тканей по отдельности, то можно заметить, что большая их часть в действительности способна к регенерации после небольших ранений.
Единственная ткань, которая плохо регенерирует, - это дерма. Она образована гетерогенными популяциями клеток, значительную часть которых составляют фибробласты (играющие столь важную роль в регенеративном процессе саламандры). В результате ранения у человека и других млекопитающих формируется рубцовая ткань, т.е. фибробласты претерпевают фиброзные изменения и начинают секретировать вещества межклеточного матрикса, благодаря чему происходит заживление раны. Регенерация у саламандры существенно отличается от описанного процесса тем, что фибробласты амфибии не формируют рубец. Фиброзная реакция млекопитающих не только тормозит восстановление, но может стать серьезной медицинской проблемой. Например, фиброз печени или легких является тяжелым заболеванием, препятствующим нормальному функционированию органов.
Как показали исследования, при глубоких ранениях в области повреждения обнаруживаются две популяции фибробластов, участвующих в процессе восстановления. Часть клеток изначально находится в дерме, другие же происходят из подвижных фибробласто-образных стволовых клеток. Оба типа фибробластов мигрируют к раневой поверхности, реагируя на сигналы клеток иммунной системы, которые первыми устремляются к травмированному участку. Оказавшись в ране, фибробласты мигрируют и пролиферируют, в конечном итоге создавая внеклеточную структуру ткани. Этот первичный процесс, происходящий в теле млекопитающих, не слишком отличается от регенерационной реакции саламандры, однако фибробласты млекопитающих производят избыточное количество межклеточного матрикса, который по мере созревания рубцовой ткани чрезмерно уплотняется. У амфибии же наоборот сразу после восстановления нормальной тканевой структуры секреция веществ межклеточного матрикса фибробластами прекращается.
Тем не менее даже у млекопитающих происходят процессы, идущие без образования рубцовой ткани. Например, восстановление поврежденной кожи эмбриона, при котором отсутствует фиброзная реакция. При этом организм демонстрирует отличную способность к регенерации, утрачиваемую по мере созревания кожи. Можно предположить, что различия в течение данных процессов обусловлены разницей в биологии фибробластов, однако более вероятно, что это является результатом действия различных химических сигналов межклеточной раневой среды, которые влияют на поведение фибробластов. Следовательно, терапевтическое изменение сигналов может привести к определенному лечебному эффекту. Однако ампутация конечностей на стадии внутриутробного развития не приводит к восстановлению утраченных частей тела, несмотря на то, что образования рубцовой ткани и не происходит. Таким образом, отсутствие рубца еще не гарантирует протекания полноценной регенерации, а лишь служит одним из необходимых, но не достаточных условий восстановления. Для того чтобы лучше понять, что поможет индуцировать регенерацию конечностей у человека, мы продолжили работу с мышами. Наша исследовательская группа уже описала естественные бластемы на месте культи у грызунов, поэтому после похожих экспериментов с саламандрой логично было бы попробовать на мышах индуцировать появление бластемы там, где она обычно не возникает. Мы надеемся, что наши предположения относительно того, что бластема сама производит критические сигналы, предотвращающие развитие фиброза на месте повреждения, подтвердятся.
Добившись успеха в создании бластемы у млекопитающих, мы столкнулись с серьезным препятствием - необходимостью стимуляции восстановления целого пальца. Эта задача значительно сложнее, чем регенерация его кончика, т.к. целый палец включает в себя суставы, которые считаются наиболее сложными структурами, формирующимися в теле в процессе эмбрионального развития. Ученые, занимающиеся биологией развития, до сих пор пытаются понять, как естественным путем образуются суставы. Таким образом, восстановление целого пальца мыши будет заметной вехой в области изучения регенерации. Мы надеемся, что в будущем этого добьемся и перейдем к следующим задачам: восстановлению целой кисти мыши, а затем - и всей лапы.
Все то, что мы узнали о регенерации в процессе исследований на различных животных, приводит нас к волнующему выводу: от возможности регенерировать отдельные части тела человека нас отделяют всего лишь одно-два десятилетия. Учитывая разительный контраст между поведением фибробластов у регенерирующей саламандры и при фиброзной реакции млекопитающих, можно предположить, что путь успешного восстановления проходит в направлении изучения этих клеток.
Наш оптимизм поддерживает недавнее открытие Говарда Ченга (Howard Y. Chang) и Джона Ринна (John L. Rinn) из Стэнфордского университета, обнаруживших, что фибробласты взрослого человека подобно фибробластам саламандры сохраняют память о пространственной координационной системе, используемой для воссоздания плана строения тела на ранней стадии эмбрионального развития. Зная, как важна эта информация для процесса восстановления у саламандры, легко понять, что существование подобных структур в фибробластах человека обещает неминуемый прорыв в данной области исследований, что приведет к возможности активировать программу развития, необходимую для регенерации конечностей у людей. Глядя на то, как амфибия восстанавливает утраченные лапы, мы думаем, что воспроизведение подобного процесса у человека - уже не такое чудо, как казалось раньше. Возможно, вскоре люди смогут неограниченно использовать эту способность, заменяя поврежденные или больные части тела по собственному желанию.
Перевод: Т.А. Митина
|
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Limb Regeneration. Panagiotis A. Tsonis. Cambridge University Press, 1996.
Ontogenetic Decline of Regenerative Ability and the Stimulation of Human Regeneration. David M. Gardiner in Rejuvenation Research, Vol. 8, No. 3, pages 141–153; September 1, 2005.
Limb Regeneration in Higher Vertebrates: Developing a Roadmap. Manjong Han et al. in Anatomical Record Part B: The New Anatomist, Vol. 287B, Issue 1, pages 14–24; November 2005.
Appendage Regeneration in Adult Vertebrates and Implications for Regenerative Medicine. Jeremy P. Brockes and Anoop Kumar in Science, Vol. 310, pages 1919–1923; December 23, 2005.
|
Сайт создан в системе
uCoz

 РАЗЛИЧИЯ В СТРАТЕГИЯХ ЗАЖИВЛЕНИЯ
Первичные реакции тканей на серьезные повреждения у млекопитающих и саламандр не слишком различаются (на схеме выделены красным). Однако у первых значительно ниже скорость заживления раны, а также отсутствуют химические соединения, стимулирующие полноценную регенерацию. Раны амфибии затягиваются в течение нескольких часов, не формируя при этом рубцовую ткань. Вместо этого клетки пораженного участка начинают обмениваться химическими сигналами, благодаря которым в течение нескольких дней начинается процесс восстановления утраченных фрагментов тела. Заживление ран млекопитающих заключается лишь в затягивании поверхности поврежденного участка сперва струпом, а затем - рубцовой тканью. К тому моменту, когда рана на теле млекопитающего полностью покроется раневым эпидермисом, тело саламандры уже сформирует бластему, готовую к регенерации
РАЗЛИЧИЯ В СТРАТЕГИЯХ ЗАЖИВЛЕНИЯ
Первичные реакции тканей на серьезные повреждения у млекопитающих и саламандр не слишком различаются (на схеме выделены красным). Однако у первых значительно ниже скорость заживления раны, а также отсутствуют химические соединения, стимулирующие полноценную регенерацию. Раны амфибии затягиваются в течение нескольких часов, не формируя при этом рубцовую ткань. Вместо этого клетки пораженного участка начинают обмениваться химическими сигналами, благодаря которым в течение нескольких дней начинается процесс восстановления утраченных фрагментов тела. Заживление ран млекопитающих заключается лишь в затягивании поверхности поврежденного участка сперва струпом, а затем - рубцовой тканью. К тому моменту, когда рана на теле млекопитающего полностью покроется раневым эпидермисом, тело саламандры уже сформирует бластему, готовую к регенерации  ПЕРИОД ЭМБРИОНАЛЬНОГО РАЗВИТИЯ.
ПЕРИОД ЭМБРИОНАЛЬНОГО РАЗВИТИЯ.