A short-lived mRNA linked to blindness | |
|
Age-related macular degeneration is associated with an unstable ARMS2 (LOC387715) mRNA
Fritsche et al. (2008) Nature Genetics 40 (7): 892-896 |
Age-related macular degeneration (AMD), мультифакториальное нейродегенеративное заболевание становится всё более частой причиной нарушения зрения среди пожилых индивидов из развивающихся стран (1). Заболевание ассоциирует в половине случаев обычной слепоты в Западных популяциях после 65 лет, в США 30% индивидов после 75 лет обнаруживает некоторые признаки болезни (2). Одним из важных изменений является фокальное отложение полиморфного дебриса, наз. друзами, которые обнаруживаются при обследовании глазного дна и составляют одну из основ для классификации по стадиям (Table 1). Средовые и генетические факторы участвуют, с возрастной и семейной историей, рассматриваемой сегодня как факторы высочайшего риска (2).
Существенный прогресс достигнут в результате идентификации хромосомной области 10q26, сцепленной с AMD (3, 4). HTRA1 (high-temperature requirement factor A1) и ARMS2 (age-related maculopathy susceptibility 2) оказались потенциальными кандидатами, вносящими вклад в риск болезни (5), хотя взаимоотношения ранее описанных HTRA1 промоторных вариантов с болезнью остаются неясными (6-8). Более того, из-за сильного нарушения равновесия сцепления в ARMS2-HTRA1 области, исследования генетических ассоциаций недостаточны, чтобы сделать различия между этими двумя генами.
Внтури интервала ARMS2-HTRA1 Fritsche et al. определили генотип 28 single nucleotide polymorphisms (SNPs) среди 794 индивидов с не-семейной AMD и идентифицировали 5 SNPs, которые обнаруживали высокую корреляцию с AMD и не обнаруживались среди неродственного контроля. Эти мутации, включая ранее идентифицированные A69S ARMS2 вариант и функциональный вариант HTRA1 промотора, были подтверждены с помощью
Table 1. The presence and diameter of drusen at fundoscopic examination constitute the basis of several classification systems currently used for AMD (15) Fundoscopic examination changes in AMD various stages Early Multiple small (<63µm) or intermediate (>63 and <125µm) drusen No evidence of advanced AMD Intermediate Extensive intermediate or large (>125µm) drusen No evidence of advanced AMD Advanced Geographic atrophy or neovascular AMD AMD, age-related macular degeneration. анализа гаплотипов, располагающихся внутри области в 23.3 kb региона неравновесного сцепления. Повторное секвенирование этого региона у 16 неродственных AMD индивидов выявило 54 вариантов, 15 из которых появились в установленных гаплотипах риска. В одном из этих вариантов, indel, комбинированная инсерция и делеция внутри 3'-нетранслируемого региона ARMS2 удаляет последовательность полиаденилирования и вносит 54-bp AU-богатый элемент, который включает два законсервированных мотива AUUUA, которые как известно, ассоциируют с быстрым распадом РНК. Вариант indel обнаруживает достоверную ассоциацию с AMD (42.4% по сравнению с 19.3% iв контроле). AU-богатые элементы были первоначально определены как AUUUA последовательность (9), а др. мотивы описанные впоследствии, как было показано, обладают общими сходными свойствами (10). Более чем 4000 транскриптов, содержащих эти элементы были идентифицированы (10, 11), а недавний анализ установил, что они представляют приблизительно 8% мРНК с транскрибируемых генов человека (12) и кодируют разнообразную группу белков, участвующих в столь разнообразных функциях, как регуляция иммунного ответа, клеточный рост и дифференцировка, сигнальная трансдукция и метаболизм.
Fritsche et al. осуществили РНК-блот анализ, чтобы сравнить стабильность ARMS2 изоформ, гетерозиготных как по варианту indel , так и по полимофизму A69S, с таковыми из транскриптов дикого типа. В EBNA 293 клетках заметно редуцировано количество РНК для indel, мутантной изоформы. Более того, когда авт. исследовали 20 плацент, гетерозиготных и одной гомозиготной по гаплотипу indel, то экспрессия ARMS2 белка отсутствовала у гомозиготного носителя, указывая тем самым, что indel изоформа нестабильна на уровне мРНК и ассоциирует с заметно сниженной экспрессией белка. Важно отметить, что др.кодирующий полиморфизм, идентифицированный Fritsche et al. вносит преждевременный стоп кодон на аминокислоте R38 и может быть интересным (Fig. 3).
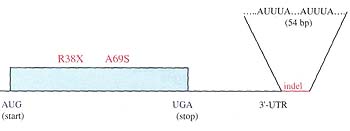 Fig. 3. The introduction of a premature stop codon at R38 of ARMS2 and a combined insertion and deletion within the 3'-untranslated region of the gene that introduces a 54 bp AU-rich element are two potential mechanisms that decrease ARMS2 stability and protein levels and could be involved in age-related macular degeneration. Белковый блот анализ выявил повсеместную экспрессию ARMS2 в различной степени в разных тканях, а иммунолокализация показала, что белок, ассоциированный с палочковыми и колбочковыми фоторецепторами внутренних сегментов сетчатки. Иммуноокрашивание открывает его локализацию в регионе, богатом элипсоидными митохондриями, внутренних сегментов. Базируясь на этом эксперименте и дополнительных доказательствах, подтверждающих локализацию ARMS2 в наружной мембране митохондрий клеток млекопитающих (6), Fritsche et al. предположили участие этого белка в гомеостазе митохондрий. i
Предыдущие исследования связали митохондриальную патологию с патогенезом AMD (13, 14). Митохондрии всё больше оказываются связанными с патогенезом нейрологических, сердечно-сосудистых и эндокринных заболеваний, а AMD оказывает самым последним заболеванием, связанным с митохондриальным наследованием. Fritsche et al. открыли две интересные мутации, indel, которая снижает стабильность мРНК, и R38X, которая может потенциально оказывать то же самое влияние на уровень белка ARMS2. Понимание этих вызывающих болезнь мутаций в деталях поможет охарактеризовать молекулярные механизмы, ответственные за AMD и понять дисфункцию митохондрий в контексте др. возможно неродственных нейродегенеративных заболеваний.
References
1. Recalde S, Fernandez-Robredo P, Altarriba M et al. Age-related macular degeneration genetics. Ophthalmology 2008: 115:916-916.el.
2. Abecasis GR, Yashar BM, Zhao Y et al. Age-related macular degeneration: a high-resolution genome scan for susceptibility loci in a population enriched for late-stage disease. Am J Hum Gen 2004: 74: 482-494.
3. Fisher SA, Abecasis GR, Yashar BM et al. Meta-analysis of genome scans of age-related macular degeneration. Hum Mol Genet 2005: 14: 2257-2264.
4. Jakobsdottir J, Conley YP, Weeks DE et al. Susceptibility genes for age-related maculopathy on chromosome 10q26. Am J Hum Genet 2005: 77: 389^07.
5. Francis PJ, Zhang H, Dewan A et al. Joint effects of polymorphisms in the HTRAl, LOC387715/ARMS2, and CFH genes on AMD in a Caucasian population. Mol Vis 2008: 14: 1395-1400.
6. Kanda A, Chen W, Othman M et al. A variant of mitochondrial protein LOC387715/ARMS2, not HTRA1, is strongly associated with age-related macular degeneration. Proc Natl Acad Sci U S A 2007: 104: 16227-16232.
7. Dewan A, Liu M, Hartman S et al. HTRAl promoter polymorphism in wet age-related macular degeneration. Science 2006: 314: 989-992.
8. Yoshida T, DeWan A, Zhang H et al. HTRAl promoter polymorphism predisposes Japanese to age-related macular degeneration. Mol Vis 2007: 13: 545-548.
9. Shaw G, Kamen R. A conserved AU sequence from the 3 untranslated region of GM-CSF mRNA mediates selective mRNA degradation. Cell 1986: 46: 659-667.
|