Telomeres in Disease | |
|
Telomeres have been linked to numerous diseases over the years, but how exactly short telomeres cause diseases and how medicine can prevent telomere erosion are still up for debate. |
Называемые теломерами концы хромосом служат для защиты кодирующей ДНК генома. Когда в клетках теломеры укорачиваются до критической длины, клетка стареет. Т.о., теломеры диктуют продолжительность жизни клетки- правда иногда это происходит неправильно. Работы последних нескольких десятилетий выявили активный, хотя и ограниченный, механизм нормальной энзиматической репарации потери теломер в определенных пролиферативных клетках.[1. E.H. Blackburn et al., "Telomeres and telomerase: the path from maize, Tetrahymena and yeast to human cancer and aging," Nat Med, 12:1133-38, 2006.] Теломеры удлиняются в раковых клетках, однако наделяют их при этом аномальной пролиферативной способностью.
Кроме того, в раковых опухолей теломеры,как было установлено, участвуют в многочисленных др. болезнях, включая дисфункцию печени и апластическую анемию, заболевания, при которых костный мозг не продуцирует достаточных количеств новых кровяных клеток.[2. R.T. Calado et al., "Telomere diseases," N Engl J Med, 361:2353-65, 2009.] Неадекватная репарация теломер и ускоренное изнашивание теломер может быть молекулярной причиной этих болезней, а воздействие на эти процессы может приводить к разработке новой терапии.
Chromosome tails Теломеры состоят из гексамерных нуклеотидных последовательностей (TTAGGG у человека), которые повторяются от сотен до тысяч раз на каждом конце хромосомы. Теломерная ДНК покрыта группой белков, коллективно наз. shelterin, которые служат для защиты теломерной структуры. Поскольку ДНК может быть синтезирована только в одном направлении, РНК праймеры на хромосомных концах не могут быть заполнены и поэтому небольшие количества ДНК теряются при каждом делении клетки-потеря, которая происходит в теломерах. Во время нормального старения животных или в культуре клеток клетки делятся, а теломеры укорачиваются. Поскольку теломерные последовательности не содержат генов, то не происходит стирания важной генетической информации во время репликации ДНК. Когда теломеры становятся критически короткими, то клетка стареет-она прекращает делиться-или подвергается апоптозу-она погибает.
Изнашивание теломер объясняет " правило Hayflick" , то количество делений клетки, которое возможно в тканевой культуре перед остановкой клеточных делений. Длина теломеры, следовательно, является типом "митотических часов", которые измеряют пролиферативную историю клетки. При условиях, при которых пролиферация клеток продолжается, несмотря на критически короткие теломеры (обычно в несколько сотен повторов гексануклеотидов), защитная функция теломер теряется. Субтеломерная генетическая информация может быть потеряна и, что более важно, происходит рекомбинация между хромосомами, приводящая к нестабильности хромосом, анеуплоидии и возможно к трансформации в раковый фенотип.
Некоторые пролиферативные клетки могут удлинять теломеры энзиматически посредством теломеразного комплекса. Telomerase (TERT) является обратной транскриптазой, которая использует малую молекулу РНК (TERC) в качестве матрицы для удлинения теломеры клетки. Т.о., теломераза нейтрализует эффекты клеточных делений и клеточного генетического "старения" , предупреждая старение, апоптоз и генетическую нестабильность. Зависимая т теломеразы репарация теломер происходит естественным образом в некоторых клетках, таких как эмбриональные и взрослые стволовые клетки и в некоторых клетках иммунной системы-в типах клеток, которые делятся регулярно, чтобы поддерживать развитие, сохранять ткани и защищать от инфекции, соотв.
Поддержание теломер также возможно с помощью др. механизмов, таких как alternative pathway (ALT), который использует рекомбинацию между хромосомами, чтобы поддерживать длину теломер. При ALT, теломеры не удлиняются вновь, а скорее переносятся с одной хромосомы на др., давая в результате некоторые дочерние клетки, чьи хромосомы содержат более короткие теломеры, и др. клетки с более длинными теломерами. Детали компонентов и регуляция, однако, не совсем понятны. Telomere Timeline В 1930s, Hermann Muller и Barbara McClintock наблюдали, что фрагментированные хромосомы стремятся сливаться др. с др., тогда как нормальные хромосомы стабильны и они предсказали характеристики "натуральных хвостов", чтобы объяснить эти различия. Muller назвал эти концы "теломерами".
Спустя почти 40 лет, Alexey Olovnikov, на теоретических основах, и James Watson, базируясь на экспериментах с фагами, распознали фундаментальную проблему касательно механики репликации ДНК, во время которой небольшое количество генетической информации теряется при каждом клеточном делении. В конце 1970s Elizabeth Blackburn и Joseph Gall описали структуру теломер-короткие, многократно повторяющиеся, некодирующие нуклеотидные последовательности-у реснитчатого простейшего Tetrahymena. В 1982, Blackburn и Jack Szostak установили, как теломеры у дрожжей могут служить в качестве буфера для кодирующей ДНК во время репликации и постулировали существование энзима, который д. перестраивать теломеры-энзима открытого спустя 3 года Blackburn и Carol Greider у Tetrahymena. В 1988 стала известна последовательность теломеры человека и исследователи начали активно изучать их роль при старении и в раковых опухолях. Последующие работы показали, что теломеры в определенных пролиферативных клетках активно репарируют. За свои работы по теломерам Blackburn, Greider и Szostak получили в 2009 Нобелевскую премию по Физиологии и Медицине. Telomere shortening and cancer Большинство клеток, у которых теломеры достигают критической короткой длины, или погибают или подвергаются старению. В тех немногих клетках, которые выживают, вообще-то в результате неадекватного мониторинга с помощью p53 и родственных мер безопасности, отвечающих на повреждения ДНК, репарация теломер становится предметом мощного селективного давления. В самом деле, в большинстве случаев озлокачествления, усиление активности гена теломеразы или активация ALT пути, как полагают, необходимы для становления клеточного бессмертия. Теломераза столь часто увеличена в опухолях и линиях раковых клеток, что рассматривается как подходящая терапевтическая мишень. Сегодня проводится несколько клинических испытаний с использованием ингибиторов теломеразы для лечения разных раковых опухолей, но результаты пока не опубликованы. Укорочение теломер д. также вызывать эквивалентный "mutator фенотип" за счет увеличения спонтанных хромосомных аберраций-от изменений в числе до структурных аномалий-и должны тем самым увеличивать пул аберрантных клеток, на который затем д. действовать отбор.
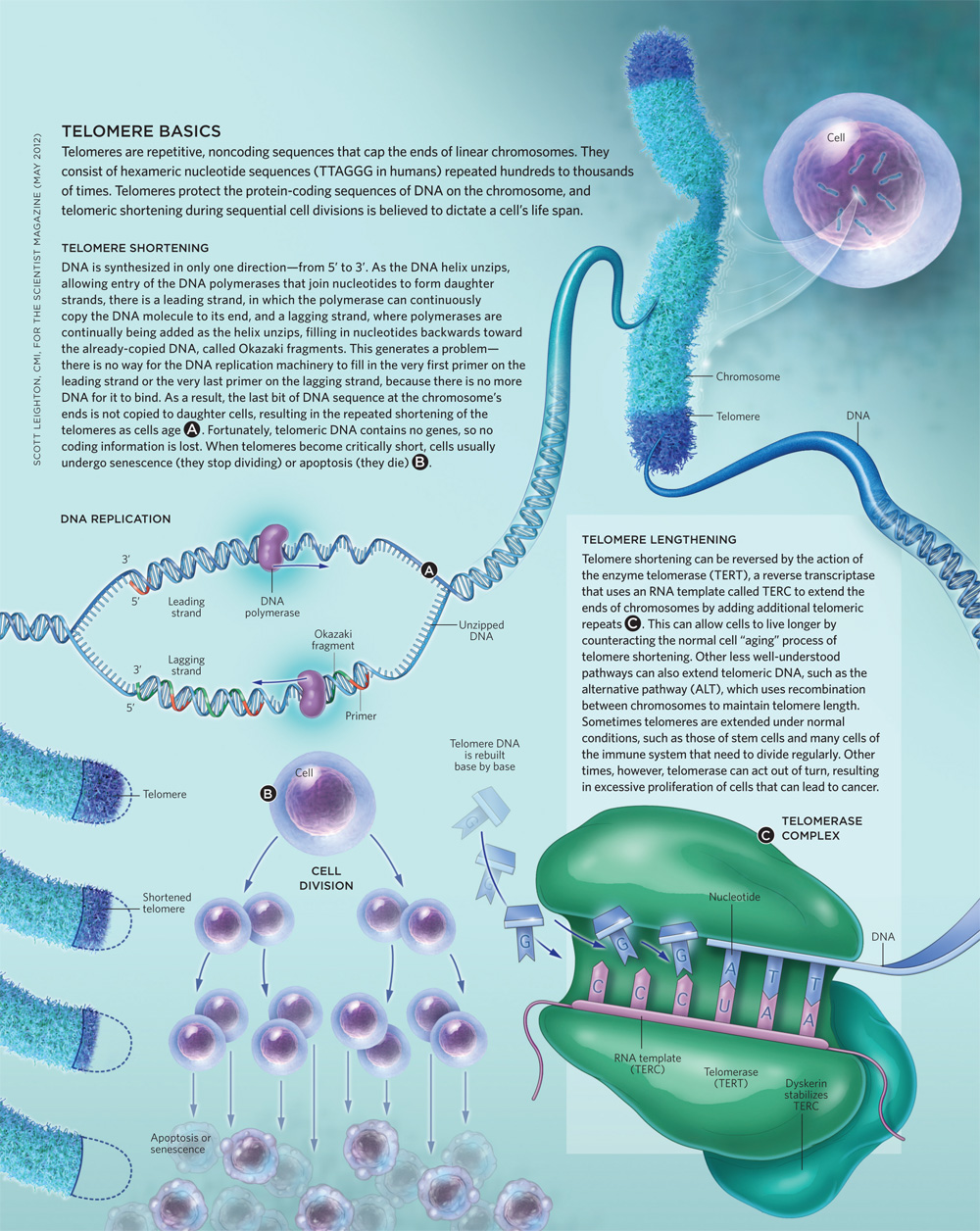 Infographic: Telomere Basics
Infographic: Telomere Basics
Имеется множество источников доказательств, подтверждающих, что изнашивание теломер связано с и, скорее всего, является этиологическим для рака. Пациенты с dyskeratosis congenita, редкой наследственной болезнью неспособности костного мозга, характеризуются дисфункцией теломеразы,[3. B.P. Alter et al., "Very short telomere length by flow fluorescence in situ hybridization identifies patients with dyskeratosis congenita," Blood, 110:1439-47, 2007.] обнаруживая 1,000-кратное увеличение риска рака языка и почти 100-кратное увеличение риска острой миелоидной лейкемии.[4. B.P. Alter, et al, "Cancer in dyskeratosis congenital," Blood, 113:6549-57, 2009.] При апластической анемии пациенты с наиболее короткими теломерами (в отсутствие мутаций) в 4- to 5-раз более склонны к злокачественной трансформации своей болезни в myelodysplasia и лейкемию.[5. P. Scheinberg et al., "Association of telomere length of peripheral blood leukocytes with hematopoietic relapse, malignant transformation, and survival in severe aplastic anemia," JAMA, 304:1358-64, 2010.] Теломер лишенные концы хромосом и анеуплоидия могут обнаруживаться в культивируемом костном мозге за годы до превращения в лейкемию. Более того, некоторые пациенты с острой миелоидной лейкемией без предварительной недостаточности костного мозга имеют наследуемые мутации в TERT и TERC.[6. R.T. Calado et al., "Constitutional hypomorphic telomerase mutations in patients with acute myeloid leukemia," PNAS, 106:1187-92, 2009.]
Сходным образом, короткие теломеры в лейкоцитах предсказывают развитие рака у пациентов с Barrett's esophagitis, заболеванием, при котором выстилка пищевода повреждается кислотой из желудка, или язвенного колита, типа воспалительной болезни толстого кишечника. При этих заболеваниях механизм менее ясен. Короткие теломеры в лейкоцитах крови могут отражать длину теломер в повреждаемых органах. Альтернативно, они могут быть биомаркерами воздействия реактивными видами кислорода, продуцируемого в результате хронического воспалительного процесса, который может, как повреждать теломеры, так и вызывать рак. Доказательства в пользу последней гипотезы получены при наблюдении клеток, культивируемых в воздухе помещений, обнаруживающих избыточное укорочение теломер по сравнению с клетками, культивируемыми при низком напряжении кислорода.
В более общем смысле геномный анализ идентифицировал полиморфизмы одиночных нуклеотидов в TERT в качестве факторов риска большинства раковых опухолей. В недавнем сообщении короткие теломеры в лейкоцитах были ассоциированы с повышенным риском всех раков и гибели от раковых опухолей в крупной популяции в течение декады. Косвенно изнашивание теломер сопровождает старение, само по себе являющееся крупным фактором риска рака. Более того, вторичное озлокачествление часто происходит после химиотерапии и облучения, которые считаются причиной причиной стрессов костного мозга и укорочения теломер. Более прямые данные получены в экспериментах на животных. При нокауте мышиных моделей, животные с пониженной теломеразной активностью в комбинации с снижение p53 надзора за повреждениями ДНК, развиваются разнообразные эпидермальные раковые опухоли, необычные для грызунов, но типичные для людей. Telomeres and Cancer  DNA INTEGRITY: Tumor suppressor protein p53 helps detect DNA damage that may lead to cancer. DNA INTEGRITY: Tumor suppressor protein p53 helps detect DNA damage that may lead to cancer. Когда теломеры достигают критически короткой длины, то большинство клеток или прекращает делиться или погибает. При многих раковых опухолях, однако, теломераза усиливает свою активность или активируется ALT путь, приводя к аномальному удлинению теломер и пролиферативному росту. Благодаря этой связи между теломерами и раком исследователи активно изучали теломеразу (TERT) в качестве мишени для терапии рака, сегодня проводятся несколько клинических испытаний.
Доказательства связи между теломерами и раком:
Other telomere diseases Помимо рака и др. болезни связаны с теломерами. Гематопоэтические стволовые клетки экспрессируют теломеразу в ответ на огромную ежедневную потребность в эритроцитах и тромбоцитах. Поскольку избыточная экспрессия теломеразы в др. тканях, то несовершенная репарация теломер в стволовых клетках крови также может вызывать тяжелые заболевания, вызываемые неспособностью стволовых клеток.
Одна из таких "теломерных болезней" это dyskeratosis congenita, Х-сцепленное нарушение костного мозга, характеризующееся такими симптомами как аномальные ногти, сетеподобная кожная сыпь, белые участки или бляшки во рту и апластическая анемия. Болезнь обычно проявляется впервой декаде жизни. Печень и легкие также могут повреждаться, как это часто наблюдается после трансплантации гематопоэтических стволовых клеток, осуществляемых для коррекции болезни костного мозга. Причины вовлечения печени и легких неясны, но химиотерапия, используемая для улучшения мер физического состояния трансплантата и новые воспалительные клетки в трансплантируемом костном мозге могут ускорять повреждения этих органов.
Пациенты, страдающие от dyskeratosis congenita наследуют мутацию в гене, наз. DKC1, идентифицированного Inderjeet Dokal из Hammersmith Hospital в Лондоне, которые предпринял исследование сцепления в крупных родословных. [7. N.S. Heiss et al., "X-linked dyskeratosis congenita is caused by mutations in a highly conserved gene with putative nucleolar functions," Nat Genet, 19:32-38, 1998.] DKC1 кодирует dyskerin, белок, который соединяется с РНК компонентом теломеразного комплекса и стабилизирует его. Позднее гетерозиготные мутации в TERC также были найдены в некоторых семьях с dyskeratosis congenita. Тяжелый фенотип X-сцепленного dyskeratosis congenita , скорее всего, обусловлен потеря функционального DKC1 и заметно редуцированной функцией теломеразы, это приводит к дефектам репарации теломер и ведет к ускоренному изнашиванию теломер, вызывая старение клеток и неспособность функционирования органов.2
В то время как dyskeratosis congenita вызывается мутациями в гене DKC1 , обычно начинается в детстве, мутации в TERC и ферментативном компоненте, кодируемым с помощью TERT, по-видимому, воздействует на более поздний период жизни. Первые мутации TERT были найдены у взрослых пациентов с приобретенной апластической анемией, которые были лишены физических аномалий и не имели в семье подобных случаев болезней, связанных с теломерами. Пенетрантность фенотипов мутаций TERT и TERC сильно варьирует между семьями и внутри семьи, отличаясь по тяжести, времени начала и затрагиваемым органам. Внутри родословных члены с идентичными мутациями могут обнаруживать минимальные или отсутствие клинических проявлений, позднее у них развивается апластическая анемия или возникает легочный фиброз (рубцы в легких) или цирроз печени (рубцы в печеночной ткани). Разные системы органов могут затрагиваться у разных членов семьи и в разное время, и случайные пациенты обнаруживают болезнь костного мозга, легких и печени.2 Как5 несовершенная репарация теломер приводит к таким болезням не совсем ясно.
Даже при неопределенности, которая остается, ассоциация мутаций теломеразы с болезнью в таких разных системах органов, имеет важное практическое значение для пациентов и их врачей. Семейная история, присутствие даже умеренных аномалий крови, легочный фиброз и цирроз печени, а также острая миелоидная анемия являются важными признаками для диагностики теломеропатии. Участие многих медицинских работников с узкой специализацией может приводить к путанице; некоторые пациенты даже ставят свой собственный диагноз после поиска в интернете. Длина теломер в лейкоцитах может быть измерена платно и является реальным маркером этих болезней, если она сильно уменьшена. Соотв. находки дефицита теломеразы важны для прогноза, лечения и генетического консультирования. Но поскольку диагностика теломеропатий может быть несложной, могут возникать осложнения. Некоторые типичные семьи могут быть лишены известных мутаций и длина теломер может быть даже нормальной в присутствии этиологических нуклеотидных замен. Более того, редкие мутации в генах shelterin , кодирующих белки, которые защищают структуру теломер, могут продуцировать тяжелый дискератоз, но не нарушать репарирующей способности теломеразы. А регуляторные регионы генов, обычно не подвергающиеся скринингу, могут быть ответственны за некоторые случаи болезни. Telomeres and aging Теломеры укорачиваются с возрастом. По аналогии с клеточными митотическими часами, теломеры, как полагают, являются маркерами "генетического возраста" и длина теломер, как было установлено, является простым предсказателем продолжительности жизни. Анализ длины теломер может влиять на рекомендации по изменению стиля жизни и прием лекарств независимо от соотв. клинических исследований. Простые, но обращающие на себя внимание, аргументы, связанные с теломерами и старением, сегодня противоречивы, скорее упрощенные и потенциально вредные. Длина теломер и в самом деле отражает последнюю пролиферативную историю клеток и будущую предрасположенность к апоптозу, старению и трансформациям. Клеточное старение, , однако,, не эквивалентно старению органов или организма.
Имеется несколько представлений относительно биологии теломер в связи со старением. Bo-первых, физиологически имеется перекрывание между самыми короткими длинами теломер у детей и самыми длинными теломерами у стариков. Большинство укорочений теломер происходит в ранней жизни в связи с ростом и тогда скорость болезни в целом ниже. Пример теломерного синдрома, dyskeratosis congenita, не является вовсе типичной прогерией, наследуемыми синдромами, при которых пациенты выглядят старыми и страдают от старческих болезней, таких как преждевременный атеросклероз или деменция. Более того, поврежденные при dyskeratosis congenita органы не очень похожи на обычные старческие костный мозг, легкие и печень. Костный мозг содержит несколько меньшее количество клеток у старых индивидов, но количества стволовых клеток могут быть в действительности повышены, а формула крови остается стабильной; и обычно ни печень, ни лёгкие не становятся фибротическими с возрастом, как это часто наблюдается у пациентов с сyskeratosis congenita. Хотя у взрослых относительно короткие теломеры лейкоцитов часто ассоциируют с сердечно-сосудистыми изменениями-широко распространенная заболеваемость старой популяции-клинические корреляции не согласуются и могут быть связаны с общим воздействием реактивных видов кислорода.
Исследования на людях попытались связать длину теломер с продолжительностью жизни. В дерзкой первоначальной статье из University of Utah в 2003, индивиды около 60 лет, которые имели самые длинные теломеры жили дольше, чем субъекты с наиболее короткими теломерами, но основной причиной смерти в последней группе неожиданно оказались инфекционные болезни; лица с более короткими теломерами не обнаруживали более высокого показателя гибели от раковых болезней.[8. R.M. Cawthon et al., "Association between telomere length in blood and mortality in people aged 60 years or older," Lancet, 361:393-95, 2003.] Более того, эти находки не были подтверждены в джр. исследованиях более старых субъектов. В др. исследовании оценивали разные популяции, длина теломер не была способна предсказывать жизнеспособность, но что интересно она коррелировала с годами жизни в здравии.[9. O.T. Njajou et al., "Association between telomere length, specific causes of death, and years of healthy life in health, aging, and body composition, a population-based cohort study," J Gerontol A Biol Sci Med Sci, 64:860-64, 2009.] Исследование людей в Дании в возрасте 73 - 101 года показало, что теломеры коррелируют с вероятной продолжительностью жизни при простом однофакторном анализе, но только тогда, когда исследователи скорректировали возраст, исходя из предположения, что корреляция управляется просто тем фактом, что более молодые субъекты имеют более длинные теломеры. Но и в том Датском исследовании обнаруживались 78-летние старики, длина теломер которых уменьшалась в зависимости от возраста, но она не коррелировала со смертностью.[10. J.M. Houben et al., "Telomere length and mortality in elderly men: the Zutphen Elderly Study," J Gerontol A Biol Sci Med Sci, 66:38-44, 2011.] Это расхождение может иметь несколько причин. При некоторых анализах длины теломер были изучены как суррогатный показатель возраста. Кроме того, ретроспективные исследования могут идентифицировать "позитивные" ассоциации, которые случайны и не могут быть воспроизведены в последующих исследованиях.
Теломерная гипотеза старения была также смоделирована на мышах. Напр., на мышиных моделях при дефиците теломеразы и ускоренном изнашивании теломер было установлено, что нарушены определенные внутриклеточные пути, связанные с функцией митохондрий и метаболизмом глюкозы, наиболее частыми проявлениями у стареющих индивидов, вызывая в конечном итоге болезни сердечной мышцы. Интересно, что реактивация теломеразы у таких мышей восстанавливает продукцию глюкозы и функцию сердца. Однако эти аномалии, наблюдаемые у дефицитных по теломеразе животных, были не типичны для людей с очень короткими теломерами; пациенты с теломеропатиями обычно не страдают от сердечных заболеваний. В самом деле, перенос мышиных экспериментов на теломерах на физиологию и болезни человека д. осуществляться с осторожностью. Мыши не являются идеальной моделью изнашивания теломер и его эффекта на старение, поскольку мышиные теломеры в 5 -10 раз длиннее, чем теломеры человека, несмотря на то, что мыши имеют меньшую продолжительность жизни. Когда теломераза в нокауте у мышей, они живут здоровой жизнью в течение нескольких поколений и даже животные поздних генераций, с очень короткими теломерами, не обнаруживают фенотипических отклонений, характерных для теломеропатий у человека. Дефицитные по теломеразе мыши не обнаруживают также увеличение показателя раковых опухолей, которое происходит только, если ген p53 также изменен, в противоположность человеку с дефицитом теломеразы, у которого обнаруживается высокий риск развития рака. Implications for medicine теломеры и их репарация важны для регенеративной медицины. Овца Dolly имела хромосомы с более короткими теломерами возможно из-за того, что она была клонирована из клетки молочной железы взрослых. Это возможно и внесло вклад в болезненность Dolly's, особенно в её прогрессирующую болезнь легких. Эмбриональные стволовые клетки, однако, экспрессируют теломеразу и способны поддерживать длину их теломер, несмотря на многочисленные клеточные деления. Недавно репрограммирование клеток взрослой кожи в плюрипотентное состояние было достигнуто внесением немногих определенных ядерных факторов. Во время этого процесса ревертирования клеток в более незрелое и плюрипотентное состояние, теломеры репрограммированных клеток оказывались сильно удлиненными. На первой ступени ремоделирования и возможно на ранней стадии эмбриогенеза клетки могут удлинять и тем самым "омолаживать" свои теломеры. Поскольку укорочение теломер ограничивает клеточную пролиферацию, то механизмы, которые удлиняют теломеры, очень важны для эффективной регенеративной медицины.
Экспрессия теломеразы тонко регулируется в клетке; лишь немного копий комплекса присутствует в клеточном ядре и они осуществляют свою функцию во время определенных специфических периодов клеточного цикла. Механизмы, которые модулируют экспрессию гена теломеразы, изменяют в результате ферментативную активность, поэтому элонгация теломер в фокусе интенсивных исследований. Протоонкоген MYC, который регулирует экспрессию многих генов и клеточную плюрипотентность, активирует экспрессию теломеразы. Половые гормоны также активируют экспрессию. теломеразы в репродуктивных и не репродуктивных органах, таких как костный мозг. Промоторный регион гена теломеразы содержит регуляторные последовательности, которые модулируются с помощью estrogen; клетки, подвергающиеся действию эстрогенов (или андрогенов, превращающихся в эстрогены) усиливают экспрессию теломеразы.[11. R.T. Calado et al., "Sex hormones, acting on the TERT gene, increase telomerase activity in human primary hematopoietic cells," Blood, 114:2236-43, 2009.] В ретроспективе клиническое проявление улучшения количества кровяных клеток у пациентов с апластической анемией, особенно у детей с врожденными нарушениями костного мозга, на андрогены может быть приписано этому механизму. Однако может ли высокий уровень в крови половых гормонов или воздействие внешними половыми гормонами вызывать удлинение теломер, всё ещё неизвестно.
Conclusions Telomeres and telomere repair are basic molecular processes in cells possessing linear DNA chromosomes. Accelerated telomere attrition due to genetic defects in telomerase and in the shelterin protein genes is etiologic in several human diseases not previously considered related in the clinic. These include aplastic anemia, pulmonary fibrosis, and hepatic cirrhosis. The telomeropathies, especially in their milder and more chronic forms, may not be rare and almost certainly are often unrecognized by physicians. The importance of telomere repair in tissues under regenerative stress is of special interest, particularly in the reactive responses of fibrogenesis in the liver and the lungs. The maintenance of adequate telomere lengths also may be important in embryonic and adult stem cells to enable proliferation while preventing chromosome instability, thus avoiding potential malignant transformation. Also of interest is the connection linking telomere attrition and chronic inflammation to cancer and other diseases. (See “An Aspirin for Your Cancer,” The Scientist, April 2011.)
There is still much to be learned about how telomerase gene mutations cause disease, why they only affect certain organs, and how telomeres can be targeted for therapies. Both the genetic regulation of telomerase expression and the effect of an organism’s environment on telomere attrition are poorly understood. Drugs or hormones that might modulate telomerase expression and maintain or elongate telomeres would be appealing in the treatment of the telomeropathies and in conditions in which telomere attrition has known medical consequences. Whether telomere shortening mediates human aging—and conversely, whether telomere elongation may reverse aging or prevent age-related diseases—are still controversial issues.
|