глиобластома; CRISPR/Cas9 генотерапия; CRISPR/Cas9-Mediated Gene Therapy for Glioblastoma: A Scoping Review
Ползователи: 
ГЛИОБЛАСТОМА
CRISPR/Cas9 генотерапия
CRISPR/Cas9-Mediated Gene Therapy for Glioblastoma: A Scoping ReviewEmir Begagic 1,*ORCID,Hakija Beculic 2,3,Nermin Duzic et al.
 Biomedicines 2024, 12(1), 238; https://doi.org/10.3390/biomedicines12010238
|
This scoping review examines the use of CRISPR/Cas9 gene editing in glioblastoma (GBM), a predominant and aggressive brain tumor. Categorizing gene targets into distinct groups, this review explores their roles in cell cycle regulation, microenvironmental dynamics, interphase processes, and therapy resistance reduction. The complexity of CRISPR-Cas9 applications in GBM research is highlighted, providing unique insights into apoptosis, cell proliferation, and immune responses within the tumor microenvironment. The studies challenge conventional perspectives on specific genes, emphasizing the potential therapeutic implications of manipulating key molecular players in cell cycle dynamics. Exploring CRISPR/Cas9 gene therapy in GBMs yields significant insights into the regulation of cellular processes, spanning cell interphase, renewal, and migration. Researchers, by precisely targeting specific genes, uncover the molecular orchestration governing cell proliferation, growth, and differentiation during critical phases of the cell cycle. The findings underscore the potential of CRISPR/Cas9 technology in unraveling the complex dynamics of the GBM microenvironment, offering promising avenues for targeted therapies to curb GBM growth. This review also outlines studies addressing therapy resistance in GBM, employing CRISPR/Cas9 to target genes associated with chemotherapy resistance, showcasing its transformative potential in effective GBM treatments.

|
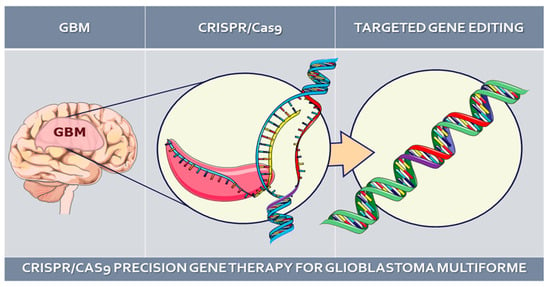
Глиобластома (GBM) является преобладающей и высокоагрессивной первичной опухолью головного мозга у взрослых, составляя около 45,2% всех опухолей, поражающих головной мозг и центральную нервную систему (ЦНС) [1]. Это новообразование классифицируется как диффузная астроцитарная глиома IV класса, отличающаяся повышенной клеточной плотностью, ядерными аномалиями, пролиферацией микрососудов, некрозом и инвазивными характеристиками. Молекулярные особенности, определяющие GBM, включают мутации в промоторе обратной транскриптазы теломеразы (TERT), амплификацию гена рецептора эпидермального фактора роста (EGFR) и вариации числа копий хромосом (+7/-10) [2]. Примечательно, что GBM характеризуется выраженной гетерогенностью как в гистологическом, так и в молекулярном аспектах, что в значительной степени обусловливает ее устойчивость к терапевтическим вмешательствам и неутешительный прогноз [3].
Первичные и вторичные GBM представляют собой отдельные заболевания, отличающиеся несхожими генетическими путями, демографическими характеристиками пациентов и прогностическими результатами. Первичные GBM возникают de novo у пожилых людей и характеризуются повышением уровня гена рецептора эпидермального фактора роста (EGFR), мутациями в гомологе фосфатазы и тензина (PTEN), делециями в гене ингибитора циклин-зависимой киназы 2A (CDKN2A) и, иногда, амплификацией гена гомолога мышиной двойной минуты 2 (MDM2) [1]. С другой стороны, вторичные GBMs возникают из низкосортных или анапластических астроцитом и обычно встречаются у молодых пациентов. Для них характерны мутации в гене TP53, служащие самым ранним выявляемым генетическим изменением. В целом, первичные и вторичные GBM являются отдельными подтипами в спектре GBM, демонстрирующими контрастные генетические и клинические характеристики [4].
Преобладающим стандартом лечения вновь диагностированных GBM является обширная хирургическая резекция с последующим одновременным химио-лучевым лечением с использованием temozolomide и последующей temozolomide адъювантной химиотерапией [5]. Несмотря на агрессивность этой схемы лечения, ее влияние на улучшение показателей выживаемости незначительно [1]. Следовательно, существует настоятельная потребность в новых и эффективных терапевтических подходах к лечению GBM. В последние два десятилетия наблюдается повышенный интерес к изучению целевых агентов и иммунотерапии GBM, о чем сообщают Begagic et al [1]. К сожалению, эти усилия не привели к существенному влиянию на выживаемость пациентов. GBM остается неизлечимым заболеванием, и его лечение по-прежнему представляет собой одну из самых сложных задач в области нейроонкологии [6]. Кроме того, существует настоятельная необходимость в разработке терапевтических стратегий, которые были бы одновременно более мощными и менее токсичными, специально разработанными с учетом уникальных биологических особенностей GBM [7].
Как уже упоминалось ранее, наличие генетических мутаций, включая хромосомные изменения, такие как потеря хромосом 10 и 9p, а также приобретение хромосом 7 и 19, указывает на потенциальную полезность ген-ориентированной терапии в качестве одного из вариантов лечения GBM [8,9]. Одним из таких подходов, вызвавших значительный интерес в последнее десятилетие в различных областях медицины, является система Clustered Regularly Interspaced Short Palindromic Repeat CRISPR-associated (Cas) nuclease 9 (CRISPR-Cas9) [10], которая облегчает технологию редактирования генов [11]. CRISPR признана самым быстрым, дешевым, универсальным и надежным инструментом редактирования генов, широко используемым для выявления генетических изменений, онкогенных мишеней и эпигенетической регуляции. CRISPR-Cas9 является предпочтительным выбором для редактирования генов или геномов при различных видах рака, включая GBM [12-15]. Учитывая современную тенденцию в медицинских исследованиях к более доступным методам лечения различных патологий [16], а также стремление к расширению возможностей применения и вариантов лечения в странах с низким и средним уровнем дохода [17], потенциал редактирования генов с помощью этого метода появился даже в случае GBM. Существуют исследования, использующие этот метод для лечения GBM, хотя данные разрознены по отдельным исследованиям. Поэтому целью данного обзора является критический анализ и обобщение различных преимуществ и способов применения системы CRISPR-Cas9 в контексте прецизионной генотерапии GBM.
2. CRISPR/Cas9 Gene Editing
2.1. Brief Historical Overview of CRISPR/Cas9 Technology
Технология CRISPR/Cas9 развивалась на фоне бактериальных систем иммунной защиты, где CRISPR и Cas9 впервые выступили в роли хранителей врожденного иммунитета [18]. Первые страницы истории CRISPR/Cas9 посвящены новаторским открытиям ученых, особенно Jennifer Doudna и Emmanuelle Charpentier, которые прояснили молекулярные вариации системы. Их революционные открытия открыли научному сообществу путь к использованию CRISPR/Cas9 для точного изменения генома. За свой вклад в развитие технологии они получили Нобелевскую премию по химии в 2020 году [18]. С открытием в 1990-х годах мегануклеаз для редактирования генома стремление к точному нацеливанию на определенные участки ДНК стало реальностью. Эти молекулярные ножницы, которые есть во многих организмах, разрезают определенные последовательности ДНК, позволяя точно заменять, удалять и изменять ДНК с минимальными последствиями [19].
CRISPR/Cas получила признание с момента ее включения в качестве технологии редактирования генома в 2012 году, превзойдя своих предшественников в точности редактирования и вызвав интерес к возможному использованию в генотерапии и других приложениях [20,21,22]. История CRISPR/Cas9 - от скромного старта до широкого присутствия в современных лабораториях по всему миру - отличается балансом открытий, инноваций и научного любопытства. Путешествие CRISPR/Cas9 охватывает понимание основных биологических механизмов и реакций. В настоящее время CRISPR/Cas9 известен как гибкий и трансформирующий инструмент для модификации генома [23].
2.2. CRISPR/Cas9 Technology
Тщательное изучение современной технологической среды CRISPR/Cas9 открывает динамичную картину текущих исследований, изобретений и преобразующих результатов. Литература по CRISPR/Cas9 представляет собой динамичное хранилище информации, демонстрирующее повсеместное влияние технологии во многих научных областях. Литература по медицине свидетельствует о растущих перспективах CRISPR/Cas9 как терапевтического инструмента. Помимо традиционной функции точного редактирования генома, этот метод теперь используется для исправления инфекционных мутаций, открывая новые возможности для целенаправленного лечения [24-28]. В литературе можно встретить обнадеживающие истории, в которых CRISPR/Cas9 становится светочем для решения генетических проблем, которые раньше считались неразрешимыми.
Xing and Meng [24] представили CRISPR/Cas9 как один из самых мощных инструментов для идентификации онкогена - гена с трансформирующими способностями, который приводит к образованию опухолевой клетки. Как отмечается в литературе, технология обладает потенциалом при различных видах рака, от колоректального до острого миелоидного лейкоза (AML). Jiang и другие [25] считают, что технология CRISPR/Cas9 - это самая мощная технология в мире персонализированной медицины. Она не только оптимальна для удаления генов, вызывающих заболевания, но и тесно связана с оказанием терапевтического воздействия путем вставки "защитных" генов [29]. Wang et al. [26] и Hazafa et al. [27] упоминают случай CRISPR/Cas9-опосредованного нокаута ATG5, способствующего трансформации "плохих" или злокачественных клеток в "хорошие".
Hsu и др. [28] отметили проблемы, связанные с этой технологией. Проблема предсуществующего иммунитета все еще существует, наряду с потенциальной возможностью удаления человеческих плюрипотентных стволовых клеток. Несмотря на оптимизм и обещания, в литературе подчеркиваются этические проблемы и законы и правила, которые будут сопровождать широкое использование CRISPR/Cas9 [30], особенно после таких случаев, как манипуляции китайских исследователей с человеческими эмбрионами в 2015 году и заявление доктора He Jiankui’s о ген-модифицированных близнецах в 2018 году. Эти события подчеркивают необходимость этического руководства при применении CRISPR, балансирующего между научным прорывом и общественными ценностями и проблемами [31,32].
2.3. Applications in Gene Therapy
CRISPR/Cas9 становится маяком надежды в области персонализированной медицины, предлагая индивидуальные вмешательства, основанные на уникальном генетическом профиле человека [27]. Точность CRISPR/Cas9 в редактировании генов открывает новую парадигму в терапевтических подходах, способную уменьшить количество побочных реакций и усилить положительные результаты терапии. Имеющиеся исследования, изобилующие примерами из практики и экспериментальными результатами, рисуют картину будущего, в котором CRISPR/Cas9 преобразует терапевтический ландшафт, предлагая индивидуальные решения ранее нерешаемых генетических проблем.
В области генотерапии революционная технология CRISPR/Cas9 стала мощным инструментом для точной и целенаправленной модификации последовательностей ДНК клеток [33]. Эта возможность позволяет исправлять генетические дефекты, открывая новые возможности для терапевтических вмешательств. В отличие от традиционных методов, CRISPR/Cas9 позволяет удалять, вставлять или изменять конкретные гены с поразительной точностью.
Генотерапия открывает большие перспективы для лечения различных генетических заболеваний, поскольку система CRISPR/Cas9 позволяет напрямую исправлять вредные мутации в геноме. Такой подход позволяет излечивать заболевания с известной генетической основой, устраняя первопричину, а не просто снимая симптомы. Изначально ранние этапы генотерапии были связаны с доставкой терапевтических трансгенов с помощью вирусных векторов, в основном для лечения рака или моногенных заболеваний [34]. Система CRISPR/Cas, в частности CRISPR/Cas9, получила широкое распространение благодаря своей низкой стоимости, простоте использования, а также эффективному и точному действию [35]. Однако сохраняются опасения по поводу ее доставки с помощью векторов адено-ассоциированного вируса (AAV), что заставляет искать альтернативные варианты доставки [36].
Достижение точного редактирования генома имеет решающее значение для успеха CRISPR-генотерапии. Хотя пути гомологически-направленной репарации (HDR) обладают потенциалом для желаемого редактирования, их низкая эффективность ограничивает их применение в клинической практике [37]. Как отмечают Wang и другие [37], стратегии повышения эффективности HDR, такие как подавление пути соединения не гомологичных концов (NHEJ), были изучены, но проблемы остаются. Контроль стадии клеточного цикла и другие усовершенствования предлагают потенциальные возможности для благоприятного восстановления с помощью шаблонов и повышения эффективности HDR.
Инновационное достижение - система редактирования оснований CRISPR - позволяет осуществлять прецизионное редактирование генов независимо от механизмов ответа на повреждение ДНК [38]. Эта система, использующая каталитически неактивную мертвую Cas9 (dCas9), конъюгированную с деаминазой, позволяет редактировать один нуклеотид, не вызывая двухцепочечных разрывов. В практическом применении CRISPR/Cas9 упростил создание трансгенных моделей животных для изучения генетических заболеваний и потенциальных терапевтических вмешательств [34]. Прямое введение белка Cas9 и транскрибируемой направляющей РНК в оплодотворенные зиготы позволяет осуществлять наследственные модификации генов. Этот метод сокращает время, необходимое для создания мутантных моделей животных, что делает его экономически выгодным и эффективным подходом для исследований in vivo [34].
Таким образом, генотерапия, особенно с использованием технологии CRISPR/Cas9, претерпела значительное развитие, открывая новые возможности для точного редактирования генома. Продолжающиеся исследования и усовершенствования методов доставки, инструментов редактирования генома и соображений безопасности продолжают формировать ландшафт генотерапии, конечной целью которой является обеспечение эффективных и безопасных терапевтических вмешательств для лечения множества генетических заболеваний.
2.4. Principles of CRISPR/Cas9 Gene Editing Technology
Система CRISPR/Cas9 представляет собой настраиваемую РНК-направляемую эндонуклеазу, состоящую из фермента Cas и направляющей РНК (gRNA) (Рисунок 1A) [39]. По сути, фермент Cas (Рисунок 1B) вызывает двухцепочечный разрыв в определенном месте генома, направляемый gRNA посредством сопряжения оснований Watson–Crick (Рисунок 1C). gRNA состоит из двух взаимосвязанных сегментов: CRISPR-РНК (crRNA) и транс-активируемой crRNA (tracrRNA) [40]. Конструкция crRNA удобна для пользователя, что позволяет программировать систему. crRNA распознает протоспейсер, соответствующий последовательности-мишени, а фермент Cas запускается мотивом примыкания протоспейсера (PAM) - короткой последовательностью, следующей за протоспейсером. В случае Cas9 двухцепочечный разрыв происходит на три основания выше PAM (рис. 1D). Редактирование генома разворачивается во время репарации двунитевых разрывов, инициированных системой CRISPR-Cas, с участием двух основных путей репарации: гомологично направленной репарации и негомологичного соединения концов (NHEJ), причем NHEJ более распространено в клетках млекопитающих (Рисунок 1E,F) [41]. Стратегия гомологически-направленной репарации требует наличия донорского шаблона с гомологией к контекстной последовательности, интегрирующегося в место двунитевого разрыва для точного редактирования генома. Несмотря на то, что гомологически-направленная репарация появилась раньше CRISPR-Cas, эта система значительно повышает ее эффективность [42]. Этот метод позволяет вносить точные исправления, вставлять мутации или гены в зависимости от совместной доставки донорских шаблонов. Несмотря на в целом низкую эффективность и распространение исключительно в делящихся клетках, он повышает точность редактирования генома. И наоборот, NHEJ восстанавливает двухцепочечные разрывы почти случайным образом, приводя к незначительным вставкам или делециям в месте разрыва. Результаты могут быть самыми разнообразными, часто вызывая мутации со сдвигом рамки считывания и нарушая функцию целевого гена [42,43]. Несмотря на отсутствие точности, NHEJ работает без донорского шаблона, функционирует как в делящихся, так и в не-делящихся клетках и в целом более эффективен [44,45].
 Figure 1. Principles of CRISPR/Cas9 technology. Guided RNA (gRNA) (A) and Cas9 (B) form a complex (C), followed by targeting (D) of the specific gene. Subsequently, the gene is edited to remove a specific mutation (E), and non-homologous end joining (F) takes place.
3.1. Targeting Specific Genetic Mutations in GBM
Отличительные генетические полиморфизмы, воздействие ионизирующей радиации и химических канцерогенов на клетки мозга являются одними из ключевых патогенетических факторов, определяющих развитие GBM [46]. В настоящее время ведутся исследования многообещающего потенциала CRISPR/Cas9 как передовой технологии редактирования генов в области иммунотерапии GBM. Эта инновация набирает обороты в различных исследованиях и обещает стать ключевым инструментом для продвижения генных исследований и инженерных стратегий в терапии глиомы [47,48].
3.1. Targeting Specific Genetic Mutations in GBM
Предыдущие исследования не дали четкой классификации точной генотерапии GBM. На основании исследования Begagic et al. [1] можно сделать вывод, что основными направлениями в терапии GBM являются протеинкиназный путь, механизмы, связанные с клеточным циклом, а также микроокружение и иммуномодулирующие мишени. В области редактирования генов CRISPR/Cas9 для лечения GBM в данном обзоре конкретные гены-мишени разделены на отдельные группы, а именно: регуляция клеточного цикла, регуляция, связанная с микроокружением, регуляция во время интерфазы клеток, а также мишени, связанные со снижением резистентности к терапии.
3.1.1. Cell Cycle Regulation
Клеточный цикл, тщательно регулируемый и сложно регулируемый биологический процесс, является фундаментальным механизмом, определяющим рост, развитие и поддержание живых организмов [1]. Состоящий из серии точно скоординированных событий, приводящих к делению клетки, клеточный цикл обеспечивает точную передачу генетической информации от одного поколения клеток к другому. В тех случаях, когда генетические мутации предшествуют этой передаче, измененная информация передается клеткам-потомкам в процессе клеточного деления. Эта парадигма особенно актуальна для GBM, поскольку нарушения в регуляции клеточного цикла, вызванные генетическими изменениями, способствуют чрезмерному делению и пролиферации неопластической ткани GBM.
Учитывая строгий контроль генов над клеточным циклом, изменения в этих генах приводят к дисрегуляции механизмов контроля клеточного цикла, способствуя неконтролируемому делению и пролиферации неопластических клеток GBM. Было выявлено несколько мутаций, связанных со злокачественным течением GBM, в том числе мутации, затрагивающие такие гены, как рецептор эпидермального фактора роста (EGFR), тирозинкиназа 2 рецептора Erb-B2 (ERBB2), изоцитратдегидрогеназа 1 (IDH1), Нейрофибромин 1 (NF1), каталитическая субъединица альфа фосфатидилинозитол-4,5-бисфосфат-3-киназы (PIK3CA), регуляторная субъединица 1 фосфоинозитид-3-киназы (PIK3R1), гомолог фосфатазы и тензина (PTEN) и другие. Применение технологии CRISPR/Cas9 направлено на вмешательство в клеточный цикл неопластических клеток с целью вызвать апоптоз или аутофагию в этих аберрантных клетках, как показано на рисунке 2.
 Figure 2. Representation of the CRISPR/Cas9 precise gene editing process. Normal cells refer to cells before neoplastic changes in GBM, followed by gene editing of the target gene to halt the proliferation of malignant cells, slow down the expression of the target gene (knockdown), or completely halt it (knockout).
Способствование апоптозу и аутофагии с помощью технологии CRISPR-Cas9 было подтверждено исследованиями, проведенными на клеточных линиях GBM и моделях in vitro. В этом контексте были изучены различные гены-мишени, включая Podoplanin (PDPN), C14orf166 (C14-IP-3), белок связывания инсулиноподобного фактора роста 3 и 5 (IGFBP3 и IGFBP5), сигнал эндоплазматического ретикулума к ядру 1 (ERN1), активирующий фактор транскрипции 4 (ATF4), Autophagy Related 5 (ATG5), Chromatin Assembly Factor 1 Subunit A (CHAF1A), FAT Atypical Cadherin 1 (FAT1), Cytokine-Inducible SH2-Containing Protein (CIS), Autophagy Related 7 (ATG7) и PIN1 (Peptidylprolyl Isomerase NIMA-Interacting 1) (Таблица 1).
Таблица 1. Обзор исследований, в которых изучалось редактирование генов CRISPR/Cas9 с целью регуляции клеточного цикла в злокачественных клетках GBM.
В контексте технологии CRISPR-Cas9 необходимо различать стратегии нокаута, нокдауна и knock-in. В то время как нокаут подразумевает полное удаление целевого гена (рис. 1), примером чего является нокаут гена FAT1 в клетках GBM для повышения восприимчивости к апоптозу, нокдаун избирательно снижает экспрессию гена, как показано в исследовании нокдауна гена PDPN, с целью модуляции апоптоза и клеточной пролиферации.
Wang и другие [49] использовали стратегию нокдауна, направленную на ген PDPN, для сложной модуляции апоптоза и клеточной пролиферации. Этот подход был направлен на манипулирование поверхностно-мембранными молекул PDPN клеток. Наличие мутаций в PDPN связано со злокачественностью, агрессивностью и инвазивностью GBM. Выявленная связь между избыточной экспрессией PDPN и облегчением поляризации макрофагов M2 и дегрануляции нейтрофилов подчеркивает иммуно-модулирующее воздействие PDPN в микроокружении опухоли. Наблюдаемый сдвиг в сторону М2-поляризации макрофагов и индукция дегрануляции нейтрофилов в совокупности указывают на скоординированные усилия PDPN по созданию среды, способствующей уклонению от иммунитета и прогрессии опухоли [49]. Этот нюанс ставит под сомнение традиционные взгляды на PDPN, позиционируя его как ключевого организатора в формировании иммуно-супрессивной среды именно в глиомах дикого типа IDH. Эти данные подчеркивают сложную и многогранную роль PDPN во влиянии не только на клеточные аспекты апоптоза и пролиферации, но и на сложную иммунологическую динамику в опухолевом микроокружении. Используя стратегию, инициирующую апоптоз через механизм реакции нерасщепленного белка (UPR), IGFBP3 и IGFBP5 были подвергнуты нокауту, что пролило свет на их влияние на динамику клеточного цикла [51]. Дальнейшее понимание было получено благодаря исследованию нокаута ATG5, выявившему его двойное влияние на апоптоз и аутофагию и обеспечившему понимание в рамках процессов клеточного цикла, связанных с GBM [52]. Кроме того, CHAF1A был подвергнут CRISPR-Cas9 нокауту, что позволило выявить его последствия для AKT/FOXO3a/Bim пути и повлиять на механизмы пролиферации и репарации ДНК, неотъемлемые от регуляции клеточного цикла [53]. Нацеливание на нокаут гена FAT1 выявило его активное участие в апоптозе через Death-Inducing Signaling Complex (DISC), что внесло ценный вклад в понимание ключевых молекулярных игроков, влияющих на клеточный цикл во время прогрессии GBM [54]. Переключив внимание на ген CIS, исследователи попытались выяснить его роль в активации NK-клеток и апоптозе, установив связь между иммунными реакциями и сложными молекулярными механизмами, влияющими на клеточный цикл [55]. Кроме того, исследователи изучали последствия нокаута ATG5 и ATG7 для мембраны аутофагосом [56]. Это пролило свет на потенциальное значение аутофагии в регуляции клеточного цикла в контексте GBM. PIN1, подвергнутый нокауту, позволил всесторонне изучить его многогранную роль во влиянии на клеточный цикл при развитии GBM, охватывающую аспекты апоптоза, миграции и прогрессии клеточного цикла. Исследование нокаутов генов ATM, PTEN, p85a и XIAP выявило их роль в качестве опухолевых супрессоров, что позволило расширить наши представления о сложных регуляторных механизмах, управляющих клеточным циклом в GBM [58]. Дальнейшие исследования, сфокусированные на нокауте RGS4, изучили его влияние на апоптоз через сигнализацию G-белков, расширив репертуар молекулярных мишеней с потенциальными терапевтическими последствиями в контексте регуляции клеточного цикла. Наконец, изучение участия GLI1 в апоптозе через путь PI3K/Akt способствовало выяснению критических сигнальных путей, влияющих на клеточный цикл в патофизиологии GBM [60].
Таким образом, сложный ландшафт применения CRISPR-Cas9 в исследованиях GBM открывает спектр стратегий манипулирования генами, каждая из которых предлагает уникальное понимание регуляции апоптоза, клеточной пролиферации и иммунных реакций в микроокружении опухоли. Представленные здесь исследования расширяют наше понимание сложной молекулярной оркестрации, формирующей прогрессию GBM, от нокаутов, направленных на такие гены, как FAT1, ATM, PTEN и GLI1, до расшифровки роли PDPN, IGFBP3 и CHAF1A с помощью подходов нокдаун и нок-ин. Эти результаты не только опровергают традиционные взгляды на конкретные гены, но и подчеркивают потенциальные терапевтические последствия манипулирования ключевыми молекулярными игроками в запутанной сети динамики клеточного цикла. По мере того как специалисты продолжают изучать сложности технологии CRISPR-Cas9 в контексте GBM, эти данные открывают перспективы для продвижения целевых терапевтических вмешательств и совершенствования нашего подхода к борьбе с этой грозной злокачественной опухолью.
3.1.2. Cell-Interphase-Related Targets
Исследуя сферу генотерапии CRISPR/Cas9 в контексте GBM, исследователи изучили разнообразные мишени, связанные с клеточной интерфазой, чтобы раскрыть тонкости регуляции генов на критических фазах клеточного цикла. Внимание к клеточной интерфазе - периоду между клеточными делениями, включающему фазы G1, S и G2, - имеет решающее значение для понимания динамики прогрессирования GBM и определения потенциальных терапевтических путей [61].
В последних исследованиях различные гены были подвергнуты воздействию с помощью технологии редактирования генов CRISPR-Cas9 для выяснения их роли в клеточной пролиферации и связанных с ней функций. Fierro et al. [62] сосредоточились на PD-L1, используя стратегию нокаута для изучения его влияния на пролиферацию, инвазию и поляризацию макрофагов. Lumibao et al. [63] нацелились на CHCHD2, стремясь с помощью нокаута понять его влияние на митохондриальное дыхание, состояние глутатиона и ингибирование клеточного роста, особенно в контексте EGFRvIII. Toledano и другие [64] исследовали Plexin-A2 с помощью нокаута, проливая свет на его участие в цитоскелетной организации, уплощении клеток и остановке клеточного цикла с акцентом на β-галактозидазу, MAPK и FARP2. Gallo и другие [13] исследовали нокаут 14-3-3β, выявив его влияние на пролиферацию, формирование сфероидов и взаимодействие с Bad, FBI1, Raf-1 и Cdc25b. Кроме того, Mengи другие [65] исследовали CDK7, используя стратегию нокаута, чтобы понять её роль в клеточном росте. Guda и другие [59] выбрали нокаут RGS4, изучая его влияние на MMP2 и пролиферацию. Zhang и другие [66] использовали стратегию нокаута Nanos3, изучая его влияние на CD133, Oct4, а также его воздействие на пролиферацию, миграцию и химиорезистентность. Godoy и другие [67] использовали нокдаун NRF2, изучая его роль в самообновлении и пролиферации клеток, в частности в отношении SOD. Zhang et al. [68] сосредоточились на Dazl, используя нокаут для изучения его участия в регуляторной оси CD133/Oct4/Nanog/Sox2 и его влияния на пролиферацию. Наконец, Liu и др. [69] исследовали ERβ с помощью нокаута, выясняя его влияние на пролиферацию и апоптоз путем воздействия на ERβ1, ERβ2, ERβ3, ERβ4, ERβ5 (экзон 8), mTOR и STAT-3 (табл. 2).
Таблица 2. Обзор исследований, в которых изучалось редактирование генов CRISPR/Cas9 с целью регуляции клеточной интерфазы в злокачественных клетках GBM.
В исследованиях по обновлению клеток с использованием технологии CRISPR/Cas9 изучались конкретные гены и их роль в регулировании важнейших аспектов этого процесса. В работе Bulstrode et al. [70] основное внимание уделялось Foxo3, при этом использовался подход нокдауна для оценки его влияния на дифференцировку. В частности, исследование было направлено на FOXG1, SOX2, EGFR и EGFRvIII, чтобы определить их участие в путях клеточного обновления. Saenz-Antonanzas et al. [71] изучили роль SRR2 путем делеции, стремясь понять его влияние на способность к самообновлению с особым акцентом на SOX2. Кроме того, Song et al. (2019) исследовали SRSF3 с помощью методов нокаута, раскрыв его значение в процессах альтернативного сплайсинга с участием SR-белков, связанных с глиомой.
Исследования, направленные на миграцию клеток с помощью технологии CRISPR/Cas9, позволили получить ценные сведения о молекулярных основах этого важнейшего клеточного процесса. Ogawa et al. [73] сосредоточились на TP53, используя методы рекомбинации для изучения его влияния на миграцию. Smolkin и другие [74] исследовали NRP2, Plexin-A4, Plexin-D1 и Semaphorin-3C с помощью нокаутных стратегий, пролив свет на их роль в регулировании процессов миграции. Prolo et al. [75] изучили MAP4K4 с помощью нокаута, выяснив его влияние на миграцию и инвазию. Wang et al. [76] исследовали нокаут BRG1, выявив его участие в миграции, пролиферации и устойчивости к TMZ. Shao и др. [77] выбрали для нокаута PIK3CD, а также PAK3 и PLEK2, выяснив их роль в миграции и инвазии. Chen и др. [78] исследовали THBS1 и TNF с помощью нокаута, проливая свет на их вклад в пролиферацию и миграцию. Ozyerli-Gokna et al. [79] сосредоточились на ASH2L и SET1/MLL, используя нокаут для понимания их роли как в пролиферации, так и в миграции. Nieland et al. [80] нацелились на miR21 и SOX2, используя нокаут, что позволило понять их вклад в миграцию, инвазию и пролиферацию. Наконец, Uceda-Castroо и др. [81] исследовали GFAP, GFAPa и GFAPd путем нокаута, выявив их участие в процессах инвазии.
Таким образом, всестороннее исследование генотерапии CRISPR/Cas9 в запутанном ландшафте GBM позволило получить важные сведения о регуляции важнейших клеточных процессов, охватывающих межфазное состояние клеток, их обновление и миграцию. Благодаря точному нацеливанию на конкретные гены исследователи разгадали сложную молекулярную оркестровку, управляющую клеточной пролиферацией, ростом и дифференцировкой на критических фазах клеточного цикла. Исследования клеточного обновления пролили свет на роль Foxo3, SRR2 и SRSF3 во влиянии на способность к самообновлению и процессы альтернативного сплайсинга. Кроме того, исследования молекулярных основ миграции клеток, направленные на такие гены, как TP53, NRP2, MAP4K4, BRG1, PIK3CD, THBS1, PD-L1, ASH2L, SET1/MLL, miR21, SOX2 и GFAP, позволили получить ценные сведения о регуляции миграции, инвазии и пролиферации в контексте GBM.
3.1.3. Microenvironmental CRISPR/Cas9 Targets in GBM Cells
В области исследования GBM сложная модуляция микроокружения опухоли, особенно в контексте ангиогенеза, стала фокусом для терапевтических вмешательств. Исследование Han et al. [82] было направлено на ген Notch1 и использовало стратегию нокдауна для решения проблем гипоксии, ангиогенеза и роста опухоли. Notch1 известен своим участием в различных клеточных процессах, и его модуляция в данном исследовании была направлена на нарушение ключевых путей, связанных с ангиогенезом, отличительной особенностью прогрессирования GBM. Используя технологию CRISPR/Cas9 для снижения экспрессии Notch1, авторы исследования стремились разгадать сложную взаимосвязь между гипоксией, ангиогенезом и общей динамикой роста злокачественных клеток GBM. Eisemann et al. [83] изучили роль PDPN, используя нокаут-стратегию для исследования его влияния на созревание и целостность развивающейся сосудистой системы в мышином мозге. PDPN, взаимодействуя с лектиноподобным рецептором 2 на тромбоцитах, участвует в развитии сосудов. Используя CRISPR/Cas9 для нокаута PDPN, мы стремились нарушить тонко настроенные механизмы, регулирующие созревание сосудов, и потенциально препятствовать сосудистой поддержке, имеющей решающее значение для роста и прогрессирования GBM. Целевой ген PDPN служит молекулярным фокусом, проливающим свет на его сложное участие в оркестровке сосудистого микроокружения в контексте GBM. Szymura et al. [84] исследовали роль DDX39B в регуляции внеклеточного матрикса (ECM) и содействии ангиогенезу через путь NF-κB. Используя стратегию нокдауна, исследование было направлено на расшифровку вклада DDX39B в модуляцию сложной сети сигналов, вовлеченных в ангиогенез и регуляцию ECM. Путь NF-κB, известный своим участием в различных клеточных процессах, включая воспаление и ангиогенез, был специально направлен на изучение его роли в микроокружении GBM. Это исследование углубляет наше понимание того, как можно манипулировать конкретными генами, чтобы влиять на сложный баланс проангиогенных факторов в контексте GBM. Продолжая изучение генов, связанных с ангиогенезом, Lu и др. [85] исследовали гены BIG1 и BIG2, направленные на VEGF с помощью нокдауна в 2019 году. VEGF является ключевым игроком в ангиогенезе, способствуя образованию новых кровеносных сосудов для поддержания роста опухоли. Используя CRISPR/Cas9 для нокаута BIG1 и BIG2 и последующего снижения уровня VEGF, исследование направлено на нарушение ангиогенных сигналов, которые способствуют васкуляризации опухолей GBM. Модуляция этих специфических генов позволяет понять сложные регуляторные механизмы, лежащие в основе ангиогенеза, и открывает потенциальные возможности для терапевтических вмешательств, направленных на сдерживание роста и прогрессирования GBM посредством контроля микроокружения (рис. 3) (табл. 3).
 Figure 3. CRISPR/Cas9-related targets within the microenvironment. Angiogenesis is attenuated or entirely halted through the reduction (marked as ?) in VEGF (Vascular Endothelial Growth Factor) and its receptor (VEGFR), as well as PDPN and NF-kB. CRISPR/Cas9 technology has effectively directed an inflammatory response against GBM cells in in vitro models, activating Natural Killer Cells (NKC) and increasing IL-1 and IL-18 (marked as ?), inducing pyroptosis in the cells. Inhibiting (marked as X) the actions of M2 macrophages has proven effective in the immune regulation of GBM.
Таблица 3. Обзор исследований, в которых изучалось редактирование генов CRISPR/Cas9 с целью регуляции микроокружения в злокачественных клетках GBM.
В таблице 3, наряду с мишенями, связанными с ангиогенезом, указаны дополнительные мишени, связанные с микроокружением, с акцентом на воспаление в контексте GBM. Nakazawa и другие [55] исследовали ген CIS, используя CRISPR/Cas9-нокаут для усиления действия естественных клеток-киллеров (NKC) и усиления воспалительного ответа против GBM. Аналогичным образом Wei и другие [87] нацелились на нокаут гена OPN, что привело к уменьшению количества макрофагов М2 и одновременному повышению эффекторной активности Т-лимфоцитов, тем самым повлияв на воспалительный ландшафт в микроокружении опухоли. Кроме того, Chen и другие [88] использовали нокдаун CRISPR/Cas9 для модуляции гена AIM2, что привело к снижению уровня интерлейкинов IL-1β и IL-18 и индуцированию пироптоза, воспалительной запрограммированной клеточной смерти.
В целом, результаты этих исследований подчеркивают потенциальную роль технологии CRISPR/Cas9 в раскрытии сложной динамики микроокружения GBM. Благодаря точным манипуляциям с ключевыми генами, участвующими в ангиогенезе, такими как Notch1, PDPN, DDX39B и гены, связанные с VEGF (BIG1 и BIG2), исследователи получили представление о молекулярных тонкостях, регулирующих васкуляризацию, и потенциальных мишенях для терапевтического вмешательства. Многогранное воздействие CRISPR/Cas9 продемонстрировано в Таблице 3, где внимание сосредоточено на воспалении в микроокружении GBM. Затрагивая такие гены, как CIS, OPN и AIM2, эти исследования используют CRISPR/Cas9 для усиления действия естественных клеток-киллеров, модуляции макрофагов M2 и индуцирования пироптоза, что в совокупности способствует иммунной регуляции GBM. Универсальность редактирования генов CRISPR/Cas9 для манипулирования этими связанными с микроокружением мишенями открывает многообещающие возможности для разработки целевых терапий для сдерживания роста и прогрессирования GBM, демонстрируя его потенциал в качестве преобразующего инструмента в поисках эффективных методов лечения GBM.
3.2. Contribution of CRISPR/Cas9 Technology in Alleviating Therapy Resistance of GBM
В таблице 4 представлены результаты нескольких исследований, в которых изучалось применение технологии CRISPR/Cas9 для решения проблемы резистентности к терапии при GBM. В исследовании Wu et al. [89] ген ALDH1A3 был отправлен в нокдаун с целью снижения устойчивости к temozolomide (TMZ), распространенному химиотерапевтическому средству. Аналогичным образом Han и др. [90] в 2023 году использовали нокдаун, направленный на ген MGMT, специально для борьбы с резистентностью к TMZ. Tong и другие [91], также в 2023 году, использовали методы нокдауна, направленные на ген MUC1, связанный с EGFRvIII, для преодоления резистентности к TMZ. Liu et al. [92] сосредоточились на гене GSS, используя нокаут для решения проблемы резистентности к радиотерапии, особенно в контексте Angiopep-2. Rocha et al. [93] в 2020 году нацелились на множество генов, включая MSH2, PTCH2, CLCA2, FZD6, CTNNB1 и NRF2, сосредоточившись на трансмембранных белках для борьбы с резистентностью к TMZ с помощью нокаута CRISPR/Cas9. Наконец, Yin et al. [94] выбрали для нокаута ген HPRT1, сфокусировавшись на AMPK, чтобы снизить резистентность к ТМЗ.
Таблица 4. Вклад технологии CRISPR/Cas9 в снижение резистентности GBM к терапии.
Редактирование генов CRISPR/Cas9 доказало свою эффективность в борьбе с резистентностью к лечению при GBM. и другие [89] нацелились на ALDH1A3, добившись значительного влияния на резистентность к TMZ, особенно в дозах =300 µМ. Han et al. [90] успешно использовали нокдаун MGMT для сенсибилизации клеток GBM к лечению TMZ. Кроме того, Tong и др. [91] продемонстрировали успешное воздействие на MUC1, выявив его роль в восстановлении повреждений ДНК во время химиотерапии и облучения.
Однако не все вмешательства привели к успешным результатам. Rocha et al. [93] нацелились на MSH2, PTCH2, CLCA2, FZD6, CTNNB1 и NRF2 для борьбы с резистентностью к TMZ путем нокаута, но глушение трех первых генов не привело к сенсибилизации клеток GBM к TMZ.
4. Efficacy and Safety Considerations
CRISPR/Cas9 - мощный инструмент для редактирования генома с большим потенциалом для развития терапии, улучшения иммунотерапии рака путем регулирования цитотоксичности CAR T-клеток и пролития света на генетические модификации опухолевых клеток. Однако его эффективность и долгосрочная безопасность остаются главными проблемами при клиническом применении. Вне-целевое редактирование, большие делеции и перестройки ДНК - основные проблемы безопасности, которые необходимо решить в доклинических исследованиях. Высокая частота вне-целевых эффектов и потенциальная возможность непредвиденных последствий целевой активности являются существенными ограничениями для безопасного и эффективного клинического применения. Кроме того, CRISPR/Cas9 вызывает опасения в отношении иммуногенной токсичности, и механизм доставки в нужную клетку-мишень в организме все еще остается ограничением. Понимание и смягчение этих проблем безопасности имеет решающее значение для успешного клинического применения технологии CRISPR/Cas9. Белок Cas9 и sgRNA подавляют экспрессию PD-1 в Т-клетках EvCAR и оказывают ингибирующее действие на клетки EGFRvIII GBM, не влияя на другие рецепторы контрольных точек. Результаты in vivo еще предстоит выяснить. Редактирование генов с помощью CRISPR-Cas9 позволяет нарушать сигналы нескольких контрольных точек, что повышает противоопухолевую эффективность. Одним из рисков CRISPR-терапии является возможность вне-целевого мутагенеза. Чтобы правильно оценить эффективность и безопасность CRISPR/Cas9, необходимо провести дополнительные клинические исследования.
p53, признанный хранитель генома, играет ключевую роль в обнаружении повреждений ДНК и организации клеточных реакций, таких как остановка клеточного деления и индуцирование запрограммированной клеточной гибели [95]. Этот врожденный защитный механизм служит барьером против рака и осложнений, возникающих в результате повреждения ДНК. В контексте редактирования генов CRISPR - процесса, включающего расщепление обеих нитей ДНК, - возникает неотъемлемая проблема [95]. Манипуляция может вызвать реакцию p53, в результате чего отредактированные клетки будут идентифицированы как поврежденные и впоследствии уничтожены. Такая реакция, хотя и является защитной мерой, может снизить эффективность процесса редактирования генов. Взаимодействие между р53 и редактированием генов усложняется тем, что клетки, которые избегают CRISPR-индуцированных изменений, могут делать это из-за нарушения функциональности р53 [95,96]. Следовательно, эти клетки могут демонстрировать сниженную способность обнаруживать повреждения ДНК или помечать клетки для запрограммированной гибели. Этот сценарий создает потенциальное осложнение, при котором процедура редактирования генов может непреднамеренно способствовать выживанию популяций клеток с нарушенным p53, делая их менее способными поддерживать стабильность генома. Такая нарушенная стабильность увеличивает вероятность накопления дополнительных мутаций, тем самым повышая риск развития злокачественных новообразований [97,98].
В стремлении изменить биологию GBM с помощью редактирования генов CRISPR/Cas9 в различных исследованиях были достигнуты успешные результаты. Fierro et al. [62] успешно использовали стратегию нокаута PD-L1, что привело к заметному снижению уровня белка PD-L1 в клетках U87 на 64 %. Lumibao et al. [63] использовали CRISPR Cas9-нокаут CHCHD2 в клетках U87, экспрессирующих EGFRvIII, что привело к изменению митохондриального дыхания, статуса глутатиона, снижению роста и инвазии клеток. Toledano et al. [64] добились положительных результатов благодаря нокауту Plexin-A2, показав, что пролиферативные эффекты Plexin-A2 опосредованы FARP2, FYN и доменом GTPase activating (GAP) в его внутриклеточном домене. Кроме того, Guda и другие [59] нацелились на RGS4 с помощью нокаута, что привело к снижению пролиферации. Zhang и другие [66] использовали стратегию нокдауна Nanos3, что привело к снижению пролиферации, миграции и инвазии клеток GBM in vitro, повышению чувствительности к DOX и TMZ и подавлению роста опухоли in vivo.
И наоборот, некоторые терапевтические вмешательства не принесли ожидаемого успеха и привели к неожиданным результатам. Например, Ogawa и другие [73] нацелились на TP53 путем рекомбинации, но влияние на миграцию не было определено. Smolkin и другие [74] использовали CRISPR/Cas9 нокаут NRP2, Plexin-A4, Plexin-D1 и Semaphorin-3C, показав, что Sema3D и Sema3G не могут передавать сигналы без neuropilins. Prolo et al. [75] нацелились на MAP4K4, что привело к снижению инвазии на 41 % по сравнению с контролем. Wang et al. [76] добились положительных результатов благодаря нокауту BRG1, подавившему миграцию и инвазию клеток GBM и повысившему чувствительность клеток к TMZ. Однако в некоторых случаях нокаут или нокдаун не приводили к ожидаемым результатам, что подчеркивает сложность биологии GBM и необходимость дальнейших исследований для разработки эффективных терапевтических стратегий.
В области редактирования генов CRISPR/Cas9 для лечения GBM в нескольких исследованиях сообщалось об успешных результатах по модуляции ангиогенеза. Han и другие [82] использовали метод нокдауна для воздействия на Notch1, показав, что ксенотрансплантаты с пониженным уровнем Notch1 значительно увеличились в объеме, достигнув шестикратного начального объема за 18,3 дня, по сравнению с контрольными ксенотрансплантатами, которым потребовалось 13,4 дня. Eisemann et al. [83] нацелились на PDPN с помощью стратегии нокаута, наблюдая схожие показатели пролиферации, апоптоза, ангиогенеза и инвазии в контрольных и podoplanin-deleted опухолях. Szymura et al. [84] сфокусировались на DDX39B, используя метод нокдауна, продемонстрировав, что CRISPR-опосредованное истощение DDX39B увеличило фосфорилирование p65 и сделало клетки U87 высокоустойчивыми к TMZ. Кроме того, Lu и другие [85] использовали нокдаун BIG1 и BIG2 для значительного снижения уровня мРНК и белка VEGF в клетках GBM U251 и эндотелиальных клетках пупочной вены человека (HUVECs). Lee и др. [86] использовали нокаут ANGPT2, а лечение агонистическим антителом против Tie2, 4E2, привело к нормализации сосудов в тканях GBM.
И наоборот, при устранении воспаления некоторые терапевтические вмешательства не принесли ожидаемого успеха. Nakazawa et al. [55] использовали нокаутирующий подход к CIS для усиления действия естественных клеток-киллеров (NKC), однако в группе NK dCIS общая выживаемость оказалась выше, чем в группе NK mock, что привело к неожиданному результату. Кроме того, Wei и другие [87] использовали стратегию нокаута osteopontin (OPN), намереваясь уменьшить количество М2-макрофагов и повысить эффекторную активность Т-лимфоцитов. Хотя дефицит OPN во врожденных иммунных клетках и клетках глиомы снизил количество М2-макрофагов, наблюдаемое повышение эффекторной активности Т-клеток, проникающих в глиому, стало неожиданным результатом. Кроме того, Chen и др. [88] использовали нокдаун, чтобы нацелить AIM2 на пироптоз (pyroptosis), но иммунореактивность AIM2 концентрировалась в ядре опухоли, что показало неожиданные результаты в отсутствие иммунодетекции PCNA. Эти случаи подчеркивают сложность биологических реакций в GBM на вмешательство CRISPR/Cas9 и необходимость дальнейших исследований для уточнения терапевтических стратегий.
5. Future Directions and Considerations
5.1. Ethical and Regulatory Considerations
Применение системы CRISPR/Cas9 в рутинной клинической практике для лечения GBM связано с несколькими соображениями. Критической проблемой является потенциальное увеличение частоты возникновения мутаций de novo в клетках-мишенях, особенно при использовании вирусных нуклеаз Cas9 [99,100]. Неточность системы CRISPR/Cas9 может привести к появлению непреднамеренных последовательностей ДНК, вызывающих новые мутации, способные вызывать гибель клеток или их трансформацию в неопластические образования [101-103]. Кроме того, эффективная и безопасная доставка CRISPR-Cas9 к клеткам-мишеням представляет собой серьезную проблему, учитывая большой размер Cas9 и сложность его инкапсуляции в системах доставки. В связи с этим возникает необходимость в разработке высокоточных транспортных систем, способных преодолевать грозный гематоэнцефалический барьер, таких как наночастицы или экзосомы [104,105]. Кроме того, дополнительным препятствием является нормативно-правовая база, связанная с патентованием таких систем доставки. Этическая проблема возникает из-за потенциального приоритета экономической выгоды для биотехнологических компаний и ускорения разработки новых иммуно-терапевтических методов над пользой их для пациентов.
5.2. Possibilities for Personalized Gene Editing in GBM
Продвижение персонализированного лечения рака, подбирающего препараты и протоколы на основе индивидуальных геномных или эпигеномных мутаций, характерных для опухолевых клеток, открывает перспективы для различных видов рака. В частности, исследования пациентов с GBM выявили целый спектр мутаций в опухолевых клетках, включая TP53, INK4A/ARF, PTEN или NF-1 [12,106]. Эти мутации способствуют развитию GBM и ее распространению в тканях мозга [107]. Хирургические образцы пациентов с GBM демонстрируют значительное гистологическое разнообразие, что свидетельствует о снижении эффективности традиционных терапевтических подходов, обусловливающих плохой прогноз и агрессивный характер заболевания [108]. Персонализированная медицина, основанная на препаратах, разработанных с учетом молекулярных изменений пациента и выявленных мутаций опухолевых клеток, предлагает перспективное направление для пациентов с GBM. Новые методы лечения GBM должны учитывать межопухолевую гетерогенность и специфические иммунологические характеристики этих клеток. Однако в отношении клональной гетерогенности в образцах GBM сохраняется неопределенность, что представляет собой серьезную проблему при разработке таргетных препаратов. Мультиагентный подход может представлять собой потенциальный метод предотвращения рецидивов GBM путем избирательного уничтожения специфических клонов, инициирующих опухоль, однако для подтверждения этого факта необходимы дальнейшие исследования [109].
5.3. Limitations and Challenges of the CRISPR/Ca9 Therapy
С 2015 года в многочисленных клинических исследованиях изучалась система CRISPR/Cas9 для редактирования генов, что продемонстрировало многообещающий прогресс в ее применении для лечения пациентов с GBM [46]. Однако остаются нерешенные проблемы, главным из которых является значительный размер нуклеазы Cas9, препятствующий ее эффективной доставке. Новые исследования направлены на разработку эффективной системы доставки CRISPR-Cas9 с использованием липидных наночастиц для подавления дальнейшего развития опухоли после однократного или двукратного применения и одновременного решения проблемы низкой проницаемости гематоэнцефалического барьера (BBB) для обычных противораковых препаратов [110,111].
Несмотря на потенциал CRISPR/Cas9 в качестве новой стратегии лечения GBM, основным ограничением является его вне-целевое воздействие на сторонние клетки из-за отсутствия абсолютной специфичности используемых ДНК и РНК для целевого гена. Предлагаемое решение включает в себя нацеливание на различные последовательности в определенных генах с помощью нескольких различных коротких интерферирующих РНК (siRNA), а также комбинирование CRISPR-Cas9 с siRNA для смягчения этих off-target эффектов [102]. Кроме того, в настоящее время точность редактирования генов CRISPR/Cas9 в GBM недостаточна [104]. Неточное разрезание последовательностей ДНК нуклеазой Cas9 может привнести новые мутации в нормальные клетки, способствуя росту GBM [105]. Кроме того, нуклеаза Cas9, обычно получаемая из бактерий, может быть распознана иммунной системой хозяина как инородное тело, что может вызвать опасную иммунную реакцию [106]. Следовательно, повторное введение Cas9 может вызвать побочные эффекты, связанные с иммунитетом, что приведет к прекращению лечения пациента. Это подчеркивает необходимость разработки инженерных систем доставки, которые требуют минимального введения и могут эффективно лечить GBM после однократного воздействия препарата.
5.4. Toxicology of CRISPR/Cas9 in GBM Therapy
В дополнение к ранее рассмотренным ограничениям и проблемам крайне важно рассмотреть токсикологические последствия применения технологии CRISPR/Cas9, особенно в контексте терапии GBM. На сегодняшний день понимание потенциальных негативных эффектов технологии CRISPR/Cas9 на человека, особенно в отношении центральной нервной системы, остается ограниченным и в значительной степени теоретическим [23,112]. Наиболее серьезные опасения связаны с эффектами off-target, когда из-за редактирования CRISPR/Cas9 генов, отличных от предполагаемых мишеней, могут возникнуть непреднамеренные генетические мутации. Такие off-target мутации, если они затронут центральную нервную систему, потенциально могут нарушить нормальную функцию нейронов или привести к неврологическим расстройствам.
Кроме того, вызывает беспокойство иммунный ответ на белок Cas9 бактериального происхождения, поскольку он может вызвать воспалительные или иммунные осложнения в центральной нервной системе [113]. Эти риски подчеркивают сложность и потенциальную непредсказуемость применения технологии CRISPR/Cas9 в неврологических контекстах у человека [114].
Помимо нейротоксичности, CRISPR/Cas9 может проявлять системные токсические эффекты [115]. Иммуногенность белка Cas9, обычно получаемого из бактерий, создает риск возникновения неблагоприятного иммунного ответа, который может привести к системному воспалению или аутоиммунным реакциям [95,116,117]. Повторное введение компонентов CRISPR может усугубить эти эффекты, что требует разработки систем доставки, которые минимизируют иммунное распознавание [118,119].
Решение этих токсикологических проблем необходимо для безопасного применения CRISPR/Cas9 в лечении GBM. Последние достижения в области систем адресной доставки направлены на снижение вне-целевых эффектов и иммуногенных реакций. Например, изучаются системы доставки липид-наночастиц для повышения точности и снижения системного воздействия компонентов CRISPR [120,121].
Таким образом, несмотря на значительный потенциал CRISPR/Cas9 в терапии GBM, необходимо всестороннее понимание его токсикологического профиля. Будущие исследования и клинические применения должны тщательно взвесить терапевтические преимущества и потенциальные нейротоксические и системные эффекты, чтобы обеспечить безопасное и эффективное лечение GBM с помощью технологий редактирования генов. Кроме того, долгосрочные последствия редактирования генов CRISPR/Cas9 у человека, особенно в нервной системе, до конца не изучены, в первую очередь из-за новизны технологии, а также этических и нормативных ограничений на проведение экспериментов на людях. Отсутствие обширных данных о людях ограничивает возможность окончательно определить безопасность и эффективность CRISPR/Cas9 для применения в неврологии. Этические соображения особенно актуальны в исследованиях по редактированию генов, что привело к введению строгих правил и тщательному изучению применения CRISPR/Cas9 на людях. Поэтому, хотя CRISPR/Cas9 открывает большие перспективы для лечения различных заболеваний, в том числе неврологических, необходимы всесторонние исследования и клинические испытания, чтобы полностью убедиться в его безопасности и возможных побочных эффектах при применении на людях.
6. Conclusions
В заключение следует отметить, что данный обзор представляет собой всеобъемлющий обзор перспективных применений редактирования генов CRISPR/Cas9 для решения сложных проблем, связанных с GBM. Систематическая классификация генов-мишеней по отдельным группам раскрывает многогранную природу вмешательства CRISPR-Cas9, проливая свет на важнейшие клеточные процессы, включая апоптоз, пролиферацию клеток и иммунные реакции в микросреде GBM. Представленные исследования бросают вызов традиционным представлениям о конкретных генах и подчеркивают терапевтический потенциал манипуляций с ключевыми молекулярными игроками в динамике клеточного цикла. В частности, изучение генотерапии CRISPR/Cas9 в GBM открывает значительные перспективы в регуляции клеточных процессов, обеспечивая тонкое понимание динамики клеточной интерфазы, обновления и миграции. Точно нацеливаясь на определенные гены, исследователи раскрывают молекулярную оркестровку, управляющую пролиферацией, ростом и дифференцировкой клеток на важнейших этапах клеточного цикла.
Кроме того, коллективные результаты подчеркивают преобразующий потенциал технологии CRISPR/Cas9 в раскрытии сложностей микроокружения GBM, что открывает перспективные пути для разработки целевых терапий, направленных на смягчение роста и прогрессирования GBM. Исследования, посвященные устойчивости к терапии с помощью CRISPR/Cas9, предлагают стратегический подход к преодолению проблем, связанных с устойчивостью к химиотерапии, демонстрируя адаптивность и эффективность CRISPR/Cas9 в качестве преобразующего инструмента в поисках жизнеспособных методов лечения GBM. Несмотря на сохраняющиеся препятствия, развивающийся ландшафт применения CRISPR/Cas9 в исследованиях GBM открывает большие перспективы для развития точной генотерапии и совершенствования терапевтических вмешательств в эту грозную злокачественную опухоль.
|

 Figure 1. Principles of CRISPR/Cas9 technology. Guided RNA (gRNA) (A) and Cas9 (B) form a complex (C), followed by targeting (D) of the specific gene. Subsequently, the gene is edited to remove a specific mutation (E), and non-homologous end joining (F) takes place.
Figure 1. Principles of CRISPR/Cas9 technology. Guided RNA (gRNA) (A) and Cas9 (B) form a complex (C), followed by targeting (D) of the specific gene. Subsequently, the gene is edited to remove a specific mutation (E), and non-homologous end joining (F) takes place.
 Figure 2. Representation of the CRISPR/Cas9 precise gene editing process. Normal cells refer to cells before neoplastic changes in GBM, followed by gene editing of the target gene to halt the proliferation of malignant cells, slow down the expression of the target gene (knockdown), or completely halt it (knockout).
Figure 2. Representation of the CRISPR/Cas9 precise gene editing process. Normal cells refer to cells before neoplastic changes in GBM, followed by gene editing of the target gene to halt the proliferation of malignant cells, slow down the expression of the target gene (knockdown), or completely halt it (knockout).
 Figure 3. CRISPR/Cas9-related targets within the microenvironment. Angiogenesis is attenuated or entirely halted through the reduction (marked as ?) in VEGF (Vascular Endothelial Growth Factor) and its receptor (VEGFR), as well as PDPN and NF-kB. CRISPR/Cas9 technology has effectively directed an inflammatory response against GBM cells in in vitro models, activating Natural Killer Cells (NKC) and increasing IL-1 and IL-18 (marked as ?), inducing pyroptosis in the cells. Inhibiting (marked as X) the actions of M2 macrophages has proven effective in the immune regulation of GBM.
Таблица 3. Обзор исследований, в которых изучалось редактирование генов CRISPR/Cas9 с целью регуляции микроокружения в злокачественных клетках GBM.
Figure 3. CRISPR/Cas9-related targets within the microenvironment. Angiogenesis is attenuated or entirely halted through the reduction (marked as ?) in VEGF (Vascular Endothelial Growth Factor) and its receptor (VEGFR), as well as PDPN and NF-kB. CRISPR/Cas9 technology has effectively directed an inflammatory response against GBM cells in in vitro models, activating Natural Killer Cells (NKC) and increasing IL-1 and IL-18 (marked as ?), inducing pyroptosis in the cells. Inhibiting (marked as X) the actions of M2 macrophages has proven effective in the immune regulation of GBM.
Таблица 3. Обзор исследований, в которых изучалось редактирование генов CRISPR/Cas9 с целью регуляции микроокружения в злокачественных клетках GBM.