Успешное секвенирование генома человека [1] способствовало более глубокому пониманию наследственных заболеваний и патогенных процессов, вызывающих хронические и преходящие заболевания. В настоящее время испытывается более 5000 препаратов для генотерапии различных наследственных, хронических и инфекционных заболеваний (https://clinicaltrials.gov/, дата обращения: 30 октября 2023 г.). При разработке кандидата на генотерапию важно продумать эффективный метод доставки, который позволит точно обработать интересующий ген, с достаточной экспрессией в конкретном месте действия и к конкретному месту действия. Также важно поддерживать терапевтический эффект в течение предполагаемого времени и впоследствии разрушать средство доставки, не вызывая никаких неприятных последствий. Из-за потенциальной опасности вызвать серьезные побочные эффекты, такие как онкогенез и даже передача генных модификаций по наследству, процесс разработки продуктов генотерапии (ПГТ) очень строг и занимает больше времени, чем другие терапевтические средства. В дополнительной таблице S1 приведена краткая информация о генных и клеточных продуктах, одобренных к настоящему времени различными регулирующими органами [2-34]. Недавно был опубликован обзор, посвященный разработке некоторых из этих продуктов [35]. Существует два подхода к доставке интересующего гена:
in vivo и ex vivo (рис. 1). Подход
in vivo предполагает доставку генетического материала непосредственно в организм пациента либо в виде голого гена, либо в виде инкапсулированной частицы. С другой стороны, подход
ex vivo предполагает выделение интересующих клеток из организма пациента или нормального донора, их генетическую модификацию, в некоторых случаях расширение, а затем введение пациенту. Таким образом, пациент не имеет прямого контакта с вектором переноса [36]. Селекция, то есть обеспечение преимущественного приживления модифицированных клеток у пациента по сравнению с клетками с естественным дефицитом, может проводиться до или после введения интересующего гена [36]. Недавно был опубликован ряд обзоров, посвященных применению генотерапии в различных областях: использование hematopoietic stem and progenitor cells (HSPCs) для лечения гемопоэтических заболеваний [37,38], генетических заболеваний кожи [39], неврологических расстройств или генетических заболеваний центральной нервной системы [40,41] и ортопедических заболеваний [42], среди прочих.

Figure 1.
Ex vivo delivery of gene of interest. Created with Biorender.com.
2. Cure Approaches of HIV Gene Therapy
Получение лекарства от ВИЧ является сложной задачей из-за наличия латентного вирусного резервуара, который устойчив к существующей терапии. Он транскрипционно неактивен, но значительная его часть способна к репликации. Анти-ретровирусная терапия (АРТ) может относительно плохо всасываться в ткани, в которых обитает латентный вирус, например в ассоциированную с кишечником лимфоидную ткань (GALT) и центральную нервную систему (ЦНС), что может способствовать персистенции вируса в этих местах. Вирусный рецидив наблюдается в течение нескольких недель или месяцев после прекращения ART. Еще одной проблемой для лечения является влияние ВИЧ на иммунную систему: наблюдается слабый гуморальный ответ на ВИЧ с недостаточной выработкой нейтрализующих антител, что происходит только через несколько месяцев после заражения. Кроме того, наблюдается относительная неспособность к восстановлению ВИЧ-специфических CD4+ Т-клеток, что, в свою очередь, приводит к снижению функции CD8+ цитотоксических Т-клеток [43].
Поэтому разумно предположить, что эффективное лечение будет направлено на инактивацию или удаление латентного вируса и восстановление иммунной системы. Ген-модифицированные клетки также должны быть устойчивы к текущей инфекции, а сама терапия не должна вызывать серьезных побочных явлений. Чтобы восстановить или усилить функции иммунной системы, было проведено несколько разработок в области генной инженерии В- и Т-клеток, включая терапию химерными антигенными рецепторами Т (CAR-T). Эти разработки недавно были рассмотрены [43,44]. На рисунке 2 представлен краткий обзор стратегий излечения ВИЧ.
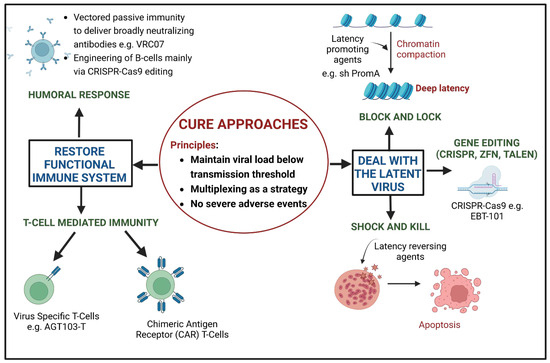
Рисунок 2.
Стратегии лечения ВИЧ. CRISPR-Clustered Regularly Interspaced Short Palindromic Repeats; ZFN-Zinc Finger Nuclease; TALEN-Transcription activator-like effector nucleases. Создано с помощью программы Biorender.
В ходе многосторонней консультации, проведенной Международным обществом по борьбе со СПИДом, были определены минимальные критерии для целевого препарата для лечения ВИЧ. Клиническая эффективность была определена следующим образом: поддержание вирусной нагрузки ниже порога передачи (менее 200 копий РНК ВИЧ/мл), эффективность у 20 % и более человек исследуемой популяции, средняя частота рецидивов менее 10 % в год, продолжительность ремиссии более 2 лет и минимальная вероятность серьезных побочных эффектов, если таковые имеются, т. е. менее 1 % исследуемой популяции. Для возможного излечения также, вероятно, потребуется сочетание различных подходов [45].
Существует четыре стратегии, которые использовались для достижения возможного излечения от ВИЧ. Первый подход - трансплантация стволовых клеток - привел к излечению шести пациентов: пациента из Берлина, пациента из Лондона, пациента из Нью-Йорка, пациента из "Города надежды", пациента из Дюссельдорфа и пациента из Женевы. Этим пациентам была проведена трансплантация гемопоэтических стволовых клеток для лечения злокачественных опухолей. Во всех случаях, кроме женевского пациента, больным пересаживали соответствующие по антигенам лейкоцитов человека (HLA) стволовые клетки от донора, гомозиготного по делеции 32 пар оснований в аллеле CCR5 (CCR5Δ32) [46-48]. Этот подход не может быть распространен на большую популяцию из-за агрессивного характера лечения, стоимости, заболеваемости и смертности, а также отсутствия подходящих не родственных доноров с CCR5Δ32, и поэтому не может быть использован в качестве обобщающего подхода.
Второй подход направлен на удаление всего жизнеспособного латентного вируса из клеточных резервуаров, достижение недетектируемой нагрузки на плазму без необходимости ART [49], что обеспечивает стерилизующее излечение. Эта стратегия называется ‘Shock and Kill’ ("шок и убийство") и широко изучается в испытаниях ранней фазы [50-52]. Хотя в современных формах этого подхода к лечению не используется генотерапия, он был включен в данный обзор, чтобы охватить все существующие подходы к лечению ВИЧ. Метод "Удар и убийство" направлен на активацию вируса в латентном резервуаре с помощью агентов, изменяющих латентность, которые активируют транскрипцию вируса, предотвращают инфицирование новых клеток с помощью одновременной ART и затем уничтожают инфицированные клетки, вызывая апоптоз, лизис, опосредованный CD8+, или посредством гуморального иммунного ответа [53]. Химерные антиген-рецепторные Т-клетки (CAR-T) также могут быть использованы для усиления уничтожения инфицированных клеток [54].
Третья стратегия направлена на уничтожение интегрированного вируса путем редактирования генов с использованием инструментов на основе нуклеаз или сконструированных рекомбинантных ферментов [55]. Инструменты на основе нуклеаз включают CRISPR (кластеризованные регулярно перемежающиеся короткие палиндромные повторы) [56], TALEN (транскрипционно-активаторные эффекторные нуклеазы) [57] и ZFN (нуклеазы с цинковыми пальцами) [58]. С помощью этих нуклеаз можно нацелить CCR5 на усиление устойчивости CD4+ клеток к инфекции [59], а также заглушить CCR5 с помощью коротких интерферирующих или коротких шпилечных РНК (siRNA или shRNA [60]). Редактирование генов также может происходить с помощью инженерных рекомбинантных ферментов, в частности, специфичных для ВИЧ ферментов рекомбиназы длинных терминальных повторов (LTR) - адаптированной сайт-специфической (TRE) рекомбиназы. Это модифицированная форма рекомбиназы Cre, которая нацелена на участок длиной 34 п.н. в 5'LTR (известный как loxLTR), что приводит к удалению интегрированной провирусной ДНК в инфицированных клетках, экспрессирующих этот фермент [55,61].
Четвертая стратегия - это подход "Block and Lock", который направлен на достижение функционального излечения, при котором латентный вирус поддерживается в неактивном состоянии без его уничтожения, а вирусная нагрузка в плазме остается ниже детектируемого уровня [49]. Это достигается путем постоянного глушения или редактирования латентного резервуара с помощью агентов, способствующих латентности, которые предотвращают или "блокируют" транскрипцию вируса и "запирают" его в латентном состоянии путем репрессивных эпигенетических модификаций вирусного промотора [53,62-66].
В большинстве исследований генотерапии ВИЧ используется подход ex vivo. В данном обзоре мы рассмотрим различные этапы генотерапии ex vivo и представим краткую информацию о текущих клинических испытаниях ВИЧ, в которых использовались подходы генотерапии ex vivo или in vivo.
3. Ex Vivo Gene Therapy
Важным фактором, который необходимо учитывать в исследованиях генотерапии ex vivo, является источник клеток, которые будут модифицированы для коррекции конкретного заболевания или генетического нарушения. Эти клетки могут быть аутологичными, полученными от самого пациента, или аллогенными, полученными от подходящего донора. Аутологичные источники выгодны, так как отсутствует опасность заболевания "трансплантат против хозяина"; однако они могут не подойти для пожилых пациентов или при тяжелых заболеваниях (например, ВИЧ, так как клетки могут стать источником новой инфекции). Аллогенные источники стволовых клеток в последнее время вызывают все больший интерес благодаря их способности к самообновлению и дифференцировке в различные линии, хотя существуют и ограничения в их использовании, такие как отторжение, болезнь "трансплантат против хозяина" и длительный иммунодефицит [67]. В доклинических исследованиях генотерапии стволовые клетки могут быть получены из родовых тканей, например, пуповинной крови и плаценты. Стволовые клетки также могут быть получены из эмбриональных тканей, хотя это вызывает этические проблемы, или из индуцированных плюрипотентных стволовых клеток. В клинических исследованиях клетки могут быть получены либо от конкретного пациента, в зависимости от состояния его заболевания, либо от донора, чьи клетки иммунологически совместимы с тканями пациента, либо из других источников клеток, которые имеют низкую вероятность вызвать иммунный ответ, например, клетки плацентарного происхождения из-за отсутствия или низкой экспрессии антигенов HLA I и II классов [68]. Процесс генотерапии ex vivo включает в себя получение интересующих клеток, их модификацию и введение пациенту. Для обеспечения эффективного и преимущественного приживления модифицированных клеток используются различные методы кондиционирования и селекции.
3.1. Sources of Hematopoietic Stem Cells
Гемопоэтические стволовые клетки полезны для генотерапии моногенных расстройств и заболеваний иммунной системы. Гемопоэтические стволовые клетки (HSCs) и гемопоэтические клетки предшественники (HPCs) отвечают за производство взрослых клеток крови и характеризуются специфическими маркерами (рис. 3). Антиген CD34, трансмембранная гликопротеиновая молекула адгезии клеточной поверхности, давно используется в качестве маркера HSCs, а также выполняет другие функции, такие как усиление пролиферации клеток, блокирование дифференцировки, улучшение миграции HSCs и HPCs и содействие адгезии лимфоцитов к сосудистому эндотелию в лимфоидных тканях [69]. Эти клетки обладают способностью дифференцироваться в различные линии функциональных клеток крови и способны к самообновлению, т.е. могут генерировать дочерние HSCs без дифференцировки (рис. 1) [70-72].
![]()
Figure 3.
Hierarchical structure for hematopoietic stem cell development. Ref [71]. NK-natural killer cell; DC-dendritic cell. Created with BioRender.com.
3.1.1. Bone Marrow-Derived Hematopoietic Stem Cells
Обычными источниками HSCs для генотерапии являются костный мозг, пуповина, периферическая кровь, а в последнее время и плацента. В костном мозге остеогенные клетки влияют на баланс гемопоэза. Первичные остеобласты человека необходимы для выживания CD34+ HSCs, полученных из костного мозга, поскольку остеобласты конститутивно экспрессируют гранулоцитарный клеточный стимулирующий фактор (G-CSF) [73]. Аналогичным образом HSCs регулируют секрецию IL-6, макрофагальный воспалительный белок-1α и другие факторы остеобластов, стремясь создать благоприятную среду для гемопоэза [74]. Стромально-производный фактор-1 (SDF-1) и его рецептор C-X-C хемокиновый рецептор 4 (CXCR4) являются важными факторами, определяющими становление костного мозга [75]. Было установлено, что Tie2, рецепторная тирозинкиназа, также незаменима для поддержания HSCs в костном мозге взрослого человека [76]. Антиген CD34 имеет множество сайтов фосфорилирования, из которых два сайта для протеинкиназы С и один сайт для тирозинового фосфорилирования [77].
В статье Panch et al. [78] приводится краткая информация о сборе HSCs из костного мозга, периферической крови и пуповины. Вкратце, забор HSCs из костного мозга - это процедура, которая часто проводится под общей анестезией, при этом из задней или передней части подвздошной кости собирается около 20 мл аспирата костного мозга на килограмм веса, но не более 1,5 л. Перед проведением процедуры у пациента может быть взята кровь для повторного вливания, чтобы заменить кровь, потерянную во время аспирации.
3.1.2. Peripheral Blood-Derived Hematopoietic Stem Cells
Процедура забора HSCs из периферической крови проводится в течение нескольких дней. В ранних схемах мобилизации использовались цитотоксические агенты, такие как циклофосфамид, идарубицин, этопозид, платина и эпирубицин; однако в настоящее время их применение ограничено пациентами, которым проводится трансплантация для лечения злокачественных опухолей [79]. В настоящее время пациентам, перенесшим трансплантацию, для мобилизации CD34+ клеток в периферическую кровь назначают гранулоцитарный клеточно-стимулирующий фактор (G-CSF) в дозе 5-10 мг/кг/сут в течение 5-7 дней с целью достижения целевого количества CD34+ клеток, полученных с помощью лейкафереза, не менее 2 х 106 клеток/кг массы тела [80]. В период введения G-CSF концентрация HSCs в крови увеличивается через 3 дня, достигает пика примерно на 5 или 6 день и начинает снижаться через 7 дней [81]. Доза G-CSF определяется по количеству лейкоцитов в периферической крови, а количество CD34+ в периферической крови является хорошим прогностическим фактором поступления HSCs [82]. Выход также зависит от возраста, пола, основного заболевания и дозы G-CSF. Лечение G-CSF не лишено трудностей: у пациентов наблюдаются побочные эффекты, включая боль в костях, головную боль, усталость, миалгию, а в тяжелых случаях - инфаркт миокарда и ишемию мозга у лиц с высоким риском [80]. Для усиления мобилизующего эффекта G-CSF можно использовать AMD3100 ((Plerixafor), обратимый антагонист CXCR4. CXCR4 - это рецептор для стромально-производного фактора 1 (SDF-1), который выполняет множество функций, в том числе обеспечивает спокойствие, что приводит к длительному поддержанию HSCs [83]. Plerixafor вводится в дозе 240 мкг/кг за 4-6 ч до афереза [78] и, как было установлено, улучшает сбор CD34+ клеток, особенно при использовании в комбинации с G-CSF. Другие средства мобилизации HSCs находятся в стадии разработки [84].
3.1.3. Umbilical Cord-Derived Hematopoietic Stem Cells
Сбор клеток из пуповины включает в себя пункцию вены, отрезанной пуповины и слив крови в стерильный пакет с антикоагулянтом. Обычно в ходе этого процесса собирается от 80 до 160 мл umbilical cord blood (UCB). Выход CD34+ клеток составляет от 2 до 7 х 106/мл пуповинной крови и может зависеть от порядка рождения (первенец > второй > третий и т.д.), веса при рождении [85] и даже от раннего зажима [86]. Такой относительно низкий выход ограничивает возможности их использования.
3.1.4. Placenta-Derived Hematopoietic Stem Cells
В последнее время плацента человека приобрела популярность в качестве источника стволовых клеток, поскольку плацентарные стволовые клетки обладают низкой антигенностью, не имеют этических ограничений и являются плюрипотентными. Плацента человека является первым органом, развивающимся в процессе репродукции, и состоит из двух компонентов: фетального (амнион и хорион) и материнского (децидуа). Развитие плаценты, начиная с момента ее появления, через 6-7 дней после оплодотворения, и до срока, подробно описано [87]. Плацента служит для обеспечения питательными веществами и удаления отходов из развивающегося плода, а также выполняет различные секреторные и иммуномодулирующие функции [88]. Она может быть разделена на следующие четыре области: амниотическая эпителиальная, амниотическая мезенхимная, хорионическая мезенхимная и хорионическая трофобластная [68]. В плаценте имеются различные типы стволовых клеток, способных дифференцироваться в кроветворные и мезенхимальные ткани (адипогенные, хондрогенные, остеогенные, печеночные, панкреатические, миогенные, ангиогенные и нейрогенные), экспрессирующие различные клеточные маркеры, включая OCT4, SOX2 и c-KIT, среди прочих, которые также встречаются в эмбриональных стволовых клетках [88,89]. В плацентарных HSCs отсутствуют или очень слабо выражены антигены HLA I класса (HLA-A, HLA-B, HLA-C) и нет антигенов HLA 2 класса (HLA-DP, HLA-DQ, HLA-DR), что делает их полезными для регенеративной медицины, а также для аутологичной и аллогенной трансплантации. Эти клетки имеют меньшую вероятность иммунного отторжения по сравнению с клетками костного мозга, устойчивы к апоптозу, обладают повышенной клеточной пролиферацией и ранозаживляющими свойствами, а также ингибируют про-фибротические факторы, такие как TGF [68]. Плацентарные HSCs человека имеют фетальное (не материнское) происхождение [90] и являются CD34+- и CD45-dim. Перфузия плаценты человека препаратом AMD3100 (Plerixafor) в концентрации 300 µкг/л приводит к увеличению (более чем в шесть раз) количества HSCs, собранных в perfusate, которые обладают колониеобразующими свойствами и не имеют эндотелиальных маркеров [90]. Мезенхимные стромальные клетки являются важным компонентом гемопоэтической среды костного мозга, и было установлено, что их совместное культивирование с HSCs усиливает пролиферацию HSCs, особенно примитивных CD34+ и CD38- [91,92]. Была проведена трансплантация гемопоэтических стволовых клеток с использованием смеси пуповинной крови и стволовых клеток, полученных из плаценты [93].
Были разработаны различные протоколы для выделения амниотических эпителиальных клеток [94], мезенхимных стромальных клеток [95,96] и гемопоэтических стволовых клеток [97] из плаценты. Одним из основных препятствий, которое приходится преодолевать во всех протоколах, является получение значительного количества клеток с высоким уровнем чистоты желаемой клеточной популяции [98].
.2. Isolation, Purification and Enrichment of Hematopoietic Stem Cells
Для обеспечения преимущественного приживления ген-откорректированных клеток важно, чтобы популяция доставляемых клеток была обогащена клетками с конструкцией и очищена во избежание контаминации белками или другими молекулами, используемыми в процессе культивирования. Для обогащения HSCs используется несколько методов. Наиболее распространенным методом колоночного разделения в настоящее время является технология разделения microbead с помощью магнитно-активированной сортировки клеток (MACS®) от Miltenyi Biotech, Кельн, Германия (https://www.miltenyibiotec.com/, дата обращения: 4 июня 2023 г.). В этой технологии закрытой системы microbead (суперпарамагнитные наночастицы оксида железа) конъюгируются с антителами к CD34 для магнитной маркировки клеток, экспрессирующих CD34+. Стерильная суспензия клеток загружается в сепарационную колонку MACS® (ферромагнитную), которая помещается в магнитное поле сепаратора MACS®. В методе позитивной селекции меченые клетки удерживаются в колонке, в то время как остальные клетки проходят через нее. CD34+ клетки могут быть вымыты из колонки, как только она будет удалена из магнитного поля, создаваемого сепаратором, для последующего использования. Существуют также microbead (микрочастицы) для разделения популяции CD133+ клеток и CD34+ и CD38- клеток. Baldwin и коллеги использовали иммуномагнитные бусины для обогащения CD34+ клеток и затем фракционировали их с помощью флуоресцентно-активированной сортировки клеток (FACS) для обогащения CD34+ и CD38- клеток [99]; Radtke и коллеги, напротив, выделили CD34+, CD90+ и CD45RA- клетки с помощью FACS и обнаружили, что эта группа клеток фенотипически является наиболее подходящей целью для генотерапии HSCs [100], поскольку они способствуют краткосрочному и долгосрочному многостадийному приживлению. Для выделения этих клеток они использовали проточный сортировочный протокол класса GMP (надлежащая производственная практика). Это значительно увеличивает сложность, стоимость и требуемый опыт. В других исследованиях in vitro Kays и коллеги использовали MACS для сортировки клеток, которые, помимо CD34+, также экспрессировали CD105, компонент комплекса рецепторов трансформирующего фактора роста (TGF-beta ), и обнаружили, что эти клетки обогащены ранними HSCs, обладающими высокой способностью к приживлению и репопуляции даже после лентивирусной трансдукции [101]. Laje и коллеги обогатили HSCs, предназначенные для лентивирусной трансдукции, молекулами рецепторов семейства сигнальных молекул активации лимфоцитов (SLAM) и обнаружили, что эти клетки эффективно трансдуцировались и были стабильны по сравнению с не трансдуцированными клетками [102].
Исследования показали, что культивирование HSCs в течение более 48 ч снижает их способность к долгосрочному приживлению [103,104], поэтому рекомендуется культивировать их не более 36 ч, а безопасным сроком считается 24 ч [104]. Исследование Chen и коллег показало, что после культивирования ex vivo с цитокинами (SCF, TPO и Flt3L) возникает митохондриальный окислительный стресс, который приводит к потере стволовости [105] и что адгезионная GPCR G1-позитивная (ADGRG1+) популяция CD34+/CD133+ может обогащать функциональные HSCs в условиях окислительного стресса во время культивирования ex vivo.
Также были предприняты усилия по снижению возможных источников контаминации во время культивирования. Рекомбинантный сывороточный альбумин человека (HSA), получаемый из дрожжей и используемый в качестве компонента сред для культивирования тканей класса GMP, может быть источником загрязнения другими белками, которые не взаимодействуют с альбумином напрямую, или даже пигментами и малыми молекулами. Wilkinson и его коллеги, используя модели мышей in vitro и in vivo, недавно обнаружили, что поливиниловый спирт (PVA) может заменить HSA при культивировании HSCs как мыши, так и человека, поскольку он поддерживает выживание и рост HSCs, сохраняя при этом фенотипические характеристики HSCs. В культуральной среде из PVA наблюдалась более низкая концентрация секретируемых факторов и меньшая экспрессия генов, связанных со старением [106-109], хотя использование PVA для генотерапии человека еще предстоит оценить.
3.3. Modification of Hematopoietic Stem Cells with Genes of Interest
При выборе подходящего вектора для доставки генов необходимо учитывать характеристики трансдуцируемых клеток и характеристики вектора; требуется ли переходная или стабильная экспрессия генной модификации; а также возможные эффекты "off-target", которые могут возникнуть при доставке в ткани. Эти эффекты могут включать иммунные реакции хозяина и иммунные реакции, индуцированные самим вектором. Модификация клеток-мишеней по интересующему гену может быть сопряжена с различными трудностями. Например, адено-ассоциированные вирусные векторы неэффективно трансдуцируют HSCs из-за блокирования входа в ядро, разворачивания и синтеза вторых нитей [110]. Псевдотипирование лентивирусных векторов с оболочкой VSV-G приводит к широкому клеточному тропизму, однако первичные человеческие покоящиеся Т-клетки и CD34+ клетки не могут эффективно трансдуцироваться из-за отсутствия или недостаточной экспрессии рецептора LDLR, через который они попадают в клетку [111]. Активация Т-клеток, с другой стороны, повышает эффективность трансдукции. В случае генотерапии in vivo с использованием вирусных векторов предсуществующий иммунитет к вирусу может привести к снижению количества ген-модифицированных клеток, что, в свою очередь, ограничит скорость репопуляции in vivo. Период между трансдукцией и повторным введением ген-модифицированных клеток также является критическим, особенно для стволовых клеток, которые могут дифференцироваться, что ограничивает их возвращение в целевой участок. Для защиты структуры своих геномов эукариотические клетки имеют защитные механизмы, которые вызывают замалчивание чужеродных транспозируемых элементов или ретровирусов, поэтому существует возможность индукции механизмов сайленсинга, которые могут сделать терапевтический ген неэффективным из-за отсутствия экспрессии [112].
4. HIV Gene Therapy Delivery via Viral Vectors
Наиболее распространенным вирусным вектором, используемым для доставки генов
ex vivo, является лентивирусный вектор благодаря его способности трансдуцировать как делящиеся, так и не делящиеся клетки. Первоначально для доставки генов использовались гамма-ретровирусные векторы, однако их способность интегрироваться вблизи протоонкогенов и вызывать инсерционный мутагенез стала очевидной. С тех пор предпринимались многочисленные попытки сделать вирусные векторы более безопасными и эффективными для доставки генов. Выбор вирусного вектора определяется типом трансдуцируемых клеток, характеристиками вирусного вектора, размером интересующего гена (трансгена) и желаемым эффектом. В таблице 1 ниже приведена сводная информация о полезной нагрузке (размере вставки) для различных вирусных векторов.
Таблица 1. Размер вставки для различных вирусных векторов.
4.1. Gamma Retroviral Vectors (? RV) in HIV Gene Therapy: Complications and Approaches to Enhance Safety
Гамма-ретровирусные векторы были одними из первых вирусных векторов, которые использовались для эффективной генотерапии. Эти векторы трансдуцируют активно делящиеся клетки в зависимости от клеточного цикла и поэтому не трансдуцируют покоящиеся клетки. Изначально ретровирусы были наиболее предпочтительным вектором, поскольку их использование приводило к стабильной интеграции трансгена в геном хозяина. Однако это преимущество было ограничено серией генотоксических событий, которые наблюдались примерно у 10 % пациентов [117] и проявлялись в виде различных форм лейкемии. Ретровирусы, например вирус мышиной лейкемии, преимущественно интегрируются вблизи сильных энхансерных областей [118], сайтов начала транскрипции [119], островов CpG и гиперчувствительных сайтов DNAse-I [120] и могут вызывать инсерционный мутагенез, когда интегрируются вблизи протоонкогенов. Эти опасения по поводу безопасности привели к приостановке клинических испытаний, и, как следствие, были предприняты попытки улучшить профиль безопасности [121]. В настоящее время известно, что в течение жизненного цикла ретровируса преинтеграционный комплекс (PIC) взаимодействует с различными транскрипционными факторами хозяина, в частности с бромодоменом и семейством белков с внешними терминалями (белки BET) [122] и ферментом интегразой, что приводит к интеграции в геном хозяина. Белки BET функционируют путем связывания вирусного PIC с хроматином хозяина, поэтому разработка векторов, не зависящих от BET, может изменить профиль их интеграции [123]. Действительно, несколько групп продемонстрировали эффективность этого подхода [117,124,125] на клеточных линиях и мышиных моделях. Другой подход может заключаться в модификации фермента интегразы, чтобы он не интегрировался вблизи протоонкогенов [125]. Попытки создать само-инактивирующиеся векторы RV оказались менее успешными, чем лентивирусные векторы, поскольку они по-прежнему сохраняют способность к инсерционной активации онкогенов [126,127].
4.2. Lentiviral Vectors for Stable Gene Expression: Challenges and Strategies to Mitigate Them
Лентивирусы - это разновидность ретровирусов, которые, помимо структурных генов env, pol и gag, имеют гены-аксессуары, такие как vpr, vpu, nef и vif, и регуляторные гены, такие как tat и rev. Самым известным лентивирусом является вирус иммунодефицита человека (ВИЧ).
Инженерные лентивирусы считаются подходящими для переноса генов, потому что они могут стабильно трансдуцировать как делящиеся, так и не делящиеся клетки. Это отличие от других ретровирусов может быть связано с тем, что PIC большинства ретровирусов требует разрушения ядерной мембраны (во время митоза), чтобы обеспечить доступ в ядро, в то время как лентивирусные PIC попадают в ядро посредством активного транспорта через нуклеопорины и импортины [128]. PIC представляет собой сборку вирусной кДНК, некоторых вирусных белков из комплекса обратной транскрипции и белков клетки-хозяина [129]. Интеграция вирусной ДНК после обратной транскрипции опосредуется ферментом интегразой и PIC. В одном из исследований было обнаружено, что PIC преимущественно нацеливается на области открытого хроматина вблизи ядерной поры, исключая внутренние области ядра и периферийные области ядерной пластинки. Транскрипционно активные гены на периферии ядра связаны с комплексом ядерной поры (КЯП), что влияет на экспрессию генов ВИЧ-1 [130]. Лентивирусы предпочтительно интегрируются с генами, активно проходящими транскрипцию, и схема интеграции поддерживается транскрипционной программой клетки-мишени [131]. Белок клетки-хозяина, фактор роста эпителия хрусталика (LEDGF/p75), напрямую взаимодействует с вирусной интегразой, и без него интеграза не может переместиться в ядро. Теперь известно, что LEDGF/p75 связывает интегразу с хроматином [132].
4.2.1. Generations of Lentiviral Vectors
Лентивирусные векторы (LV) прошли несколько модификаций с момента их открытия в качестве средств генотерапии (рис. 4). Первое поколение LV состояло из трансгенной конструкции, оболочки и упаковочной конструкции с gag, pol и всеми регуляторными и вспомогательными генами. Замена ВИЧ env на VSV-G env или любую другую подходящую вирусную оболочку (псевдотипирование) позволяет эффективно трансдуцировать широкий спектр клеток, хотя VSV-G плохо трансдуцирует покоящиеся [133] лимфоциты и HSCs. LV второго поколения состоят из трансгенной конструкции, оболочки, экспрессирующей VSV-G, и упаковочной конструкции с gag, pol и регуляторными генами tat и rev. Все вспомогательные гены удалены [134]. LV третьего поколения имеют модификацию вирусного промотора в трансгенной конструкции, где область U3 была изменена путем удаления части последовательности от -418 до -18, оставив только 18 п.н. (400 п.н. удалено), что позволяет создать само-инактивирующиеся (SIN) векторы. Таким образом, 5'LTR состоит из 18 п.н. областей U3, R и U5, а также PolyA tai. Это позволяет вектору нести трансгенную кассету, оставаясь транскрипционно неактивным [135]. Удаленный участок U3 заменяется гетерологичным промотором, обычно промотором цитомегаловируса (CMV) или клеточными промоторами, такими как фактор элонгации 1α (EF1α). Регион 3' LTR, U3 также удален, чтобы предотвратить восстановление с 5'LTR посредством гомологичной рекомбинации во время трансфекции клеток 293T. Векторная конструкция также содержит не-кодирующие домены cPPT (central poly purine tract), который повышает эффективность упаковки РНК в капсид, и WPRE (Woodchunk hepatitis post-transcriptional regulatory element), который улучшает пост-транскрипционную обработку трансгена [134]. Упаковочная конструкция разделяется на конструкцию gag-pol и конструкцию rev, при этом tat удаляется, так как его трансактивирующая петля была удалена из 5'LTR [131,134]. Таким образом, системы третьего поколения собираются из четырех плазмидных конструкций, как показано на рисунке 4 ниже. Наличие трех отдельных упаковочных конструкций снижает вероятность рекомбинации для формирования репликационно-компетентных лентивирусов во время амплификации плазмиды и производства вирусного вектора и уменьшает вероятность возникновения проблем, связанных с интерференцией промоторов [136,137]. В дальнейшем лентивирусные конструкции третьего поколения были усовершенствованы путем модификации плазмиды, несущей трансген, и стали рассматриваться как лентивирусные векторы четвертого поколения. В этой системе, называемой LTR1 или PBS1 (Primer Binding Site1), 5'LTR был удален, а сигналы РНК (PBS-Y-RRE) были размещены ниже по течению от 3'LTR. Таким образом, эти сигналы присутствуют при производстве вектора, но теряются при обратной транскрипции и не копируются вместе с трансдуцированным трансгеном, что еще больше повышает их безопасность [138,139].
![]()
Figure 4.
Advances in lentiviral vector generation. The first-generation construct comprises the transgene construct, a pseudotyped envelope (often VSV-G) and a packaging construct with gag, pol and all regulatory and accessory genes. The second-generation vector are similar to first-generation vectors, except that the accessory genes have been removed. Third-generation vectors are self-inactivating lentiviral vectors with 400 bp deletion in the U3 region. Fourth-generation lentiviral vectors has the 5'LTR removed and the RNA signals (PBS-Y-RRE) placed downstream of the 3'LTR. RRE: Rev responsive element; PM: cell derived or other promoter; cPPT: central poly purine tract; VSV-G: vesicular stomatitis virus type G; WPRE: Woodchunk hepatitis post-transcriptional regulatory element; Y: packaging signal. Ch5': Chimeric 5'LTR; PAS: Primer Activation Signal. 4.2.2. Optimizing Lentiviral Transduction
Эффективная лентивирусная трансдукция клеток человека может быть ограничена факторами рестрикции, вырабатываемыми клетками человека для ограничения лентивирусной инфекции, такими как белок с трипартитным мотивом 5 альфа (TRIM5α), тетерин и каталитический полипептид-подобный 3 (APOBEC3) фермента редактирования мРНК аполипопротеина В [140]. Одним из факторов, который, как было показано, приводит к неэффективной доставке лентивирусных генов в покоящиеся Т-клетки памяти, является фактор рестрикции SAMHD1 (sterile alpha motif and histidine-aspartate (HD) domain-containing protein 1). SAMHD1 - это клеточная дезоксинуклеотидтрифосфогидролаза, которая блокирует обратную транскрипцию [141,142]. Было обнаружено, что ген vpx, кодируемый ВИЧ-2, противодействует способности SAMHD1 ограничивать транскрипцию [143]. Так, в одном из исследований было обнаружено, что vpx увеличивает доставку генов при всех протестированных условиях, но наибольший эффект был достигнут, когда генотерапия была направлена на этапы, предшествующие обратной транскрипции [144].
Оптимизация условий культивирования ex vivo является полезным подходом для повышения скорости переноса генов. Было установлено, что использование таких реагентов, как Polybrene [145], сульфат протамина [146], Retronectin [147], усилители экотропных рецепторов, магнитные бусины типа ускорителя Lenti-X, Vectofusin-1 [148,149], LentiBOOST [150] и Staurosporine [151], улучшают процесс трансдукции. Использование фетальной бычьей сыворотки (FBS) оказалось неудовлетворительным при трансдукции клеток CD34 с помощью лентивирусных векторов, поскольку это приводит к увеличению трансдукции в клетках предшественниках, нок снижению в HSCs. Кроме того, существуют опасения относительно иммунных рисков, связанных с выработкой антител против ксеногенных компонентов [152]. Были разработаны различные бессывороточные среды, которые подходят для трансдукции различных типов стволовых клеток, например, StemSpan Serum-Free Expansion Medium (SFEM) от Stem Cell Technologies, Ванкувер, Британская Колумбия, Канада. Было установлено, что добавление среды для замены нокаутирующей сыворотки (KSR) к среде StemSpan повышает эффективность трансдукции первичных CD34+ клеток и мононуклеарных клеток периферической крови (PBMC) [153].
4.2.3. Lentiviral Vector Silencing
Как и гамма-ретровирусные векторы, хотя и в меньшей степени, лентивирусные векторы подвержены сайленсингу трансгена и изменению эффективности трансгена, что обусловлено взаимодействием трансгена с его непосредственным геномным соседом в геноме хозяина (эффекты хромосомной позиции). Предполагается, что этот эффект вызывается рядом характеристик хозяина и вектора, включая метилирование ДНК и модификации гистонов, в том числе опосредованные группой белков Polycomb [154]. Стратегии, которые могут защитить трансген от сайленсинга, включают использование более сильных энхансерных промоторов, регионов прикрепления матрицы строительных лесов (S/MARS), которые защищают энхансер от метилирования ДНК, и инсуляторов хроматинового домена, которые подавляют репрессивные эффекты положения [155].
4.2.4. Strategies to Reduce Insertional Mutagenesis
Существуют различные попытки снизить вероятность инсерционного мутагенеза. Одна из стратегий заключается в том, чтобы направить интеграцию в "безопасные геномные сайты-убежища", расположенные вдали от протоонкогенов. Schenkwein и др. использовали I-PpoI, димерную 18-20 КДа самонаводящуюся эндонуклеазу из слизневой плесени Physarum polycephalum, чтобы направить интеграцию в высоко консервативный сайт, 28S рибосомальную РНК. Это достигается путем распознавания участка длиной 15 п.н. в этом регионе [156]. Другая стратегия заключается в создании не интегрирующих лентивирусных векторов путем изменения каталитической триады основного домена интегразы (D64, D116 и E152) [157-159]. Хотя риск инсерционного мутагенеза исключен, эти векторы можно использовать только для транзиторной экспрессии генов. Экспрессия генов также ниже, чем в интегрирующих лентивирусных векторах [157]. Модификация LEDGF/p75, функция которого заключается в направлении лентивирусной интеграции, может позволить интеграцию в более безопасные регионы или более случайную интеграцию, что снижает вероятность интеграции вблизи протоонкогенов [160].
4.3. Adeno Virus Associated Vectors (AAVs): Challenges Limiting Their Use
Рекомбинантные адено-ассоциированные вирусы являются векторами выбора для клинических применений, где требуется преходящая экспрессия трансгена (от нескольких месяцев до нескольких лет, в зависимости от оборота инфицированных клеток). Они не содержат вирусной ДНК, а представляют собой наночастицы на основе белка, которые разработаны таким образом, чтобы преодолевать клеточную мембрану и доставлять ДНК в ядро клетки [161]. Эти векторы очень стабильны и могут выдерживать физические или химические нагрузки, возникающие при манипуляциях. Вирусный геном также легко поддается манипуляциям [162] и имеет хороший профиль безопасности. AAV могут нести трансгенные кассеты размером до 4,5 кб [113]. Однако основная проблема AAV заключается в том, что они широко распространены в природе, и поэтому анти-AAV иммунитет очень высок, а распространенность нейтрализующих антител к 12 известным серотипам составляет от 20 до 100 % в некоторых популяциях [163]. Введение этих векторов также может вызывать гуморальные реакции после лечения. В настоящее время применяются различные стратегии для преодоления капсидного иммунитета, фиксации комплемента и сенсибилизации генома AAV [164,165]. Одна из стратегий - инженерия капсида с помощью рационального дизайна, случайных мутаций и перетасовки капсида для предотвращения нейтрализации капсида. Другая стратегия - иммуносупрессия, то есть блокирование классических путей, которые участвуют в активации В-клеток и, следовательно, подавляют гуморальный ответ, хотя гуморальный ответ может быть ограничен в случае генотерапии ex vivo. Чтобы снизить чувствительность генома AAV, сигналы TLR могут быть предотвращены путем удаления динуклеотидов CpG в геноме вектора. Адено-ассоциированные векторы могут использоваться для трансдукции различных клеток, включая мезенхимные стромальные клетки [166], нейрональные клетки [167] и некоторые другие [161], хотя они не подходят для кроветворных клеток [162].
Различные группы изучают возможность использования AAVs для доставки широко нейтрализующих антител в скелетные мышцы, чтобы обеспечить длительный эффект против ВИЧ либо в качестве профилактики, либо лечения, либо и того, и другого. В недавней обзорной статье анализируется их использование при ВИЧ-инфекции, а также существующие проблемы и стратегии, которые могут быть использованы для преодоления препятствий, мешающих их эффективности [168].
4.4. Ex Vivo Cell Selection and Expansion
В зависимости от типа трансдуцируемых клеток, типа вектора, кратности заражения (MOI) и используемой техники трансдукции количество трансдуцированных клеток обычно меньше теоретически ожидаемого. Таким образом, процесс трансдукции не является на 100 процентов эффективным. Однако существует несколько способов максимизировать эффективность трансдукции. В дополнение к примерам, приведенным в разделе 4.2.2, использование высокой MOI приводит к увеличению числа копий вектора (VCN), хотя это повышает риск возникновения аберрантных сплайсинговых событий [169]. Очистка векторных частиц с помощью хроматографии также может повысить эффективность трансдукции [170]. После трансдукции полезно отобрать клетки, несущие трансген, и расширить эти клетки для улучшения их приживления in vivo. Для этого можно использовать маркеры клеточной поверхности [171] или сконструировать вектор для экспрессии гена устойчивости к антибиотикам, что позволит проводить преимущественный отбор клеток с трансгеном при применении соответствующего антибиотика [170].
Целью экспансии трансдуцированных HSCs является увеличение их количества при сохранении "стволовости". Традиционные среды, содержащие сывороточный альбумин и цитокины, обычно поддерживают дифференцировку в зрелые линии, что приводит к потере способности к самообновлению. Для расширения HSCs предпочтительно использовать среду без сыворотки, чтобы ограничить возможность контаминации. В недавней статье Tajer et al. приводится краткое описание факторов, добавляемых в среду для усиления экспансии [172]. Были использованы несколько цитокинов и факторов роста, включая SCF, FLt3-лиганд, TPO (тромбопоэтин), IL-3 и IL-6, хотя IL-3 не включают в некоторые среды, поскольку он стимулирует экспансию предшественников, а не HSCs [104,173]. Другие соединения также оказались полезными. К ним относятся простагландин Е2 ((PGE2), который улучшает приживление HSCs, повышая их способность к закреплению (homing) и самообновлению [174], и Stem Regenin 1 (SR1), антагонист рецепторов ариловых углеводородов [175], который используется для экспансии CD34+ как человека, так и мыши, хотя было установлено, что он также благоприятствует мультипотентным предшественникам, а не стволовым клеткам с длительной репопуляцией. Это контрастирует с UM171, производным pyrimidoindole , который поддерживает экспансию стволовых клеток в большей степени, чем мультипотентных клеток предшественников [176-178]. Поэтому их можно использовать в комбинации для стимулирования экспансии обеих линий. Другие исследования, проведенные на мышиных моделях, показали, что сигнальные пути, регулирующие хоминг и дифференцировку стволовых клеток, можно модулировать. К ним относятся сигнальный путь Notch [179], гены Homeobox [180], Wnt [172] и другие [174]. Избыточная экспрессия Sall4, цинково-пальцевого транскрипционного фактора, приводит к быстрой и эффективной экспансии HSCs (50-кратное увеличение количества CD34+ клеток) in vitro и in vivo в мышиных моделях [181].
5. Administration of Gene-Modified Hematopoietic Stem Cells: Enhancing Preferential Engraftment of Gene-Modified Cells
Первая фаза восстановления кроветворной системы после инфузии HSCs (до 6 месяцев) происходит за счет коммитированных клеток предшественников (краткосрочных HSCs), которые обладают ограниченной способностью к самообновлению [182]. Примерно через 6 месяцев происходит уменьшение количества CD34+ клонов, истощение первой волны клональной реституции и постепенное поглощение реституции долгосрочными HSCs, которые способны к самообновлению и эффект которых сохраняется даже в течение 3 лет после генотерапии [183]. Таким образом, краткосрочные HSCs активны в ранней фазе, в то время как долгосрочные HSCs впадают в состояние покоя в этой фазе и активируются после истощения краткосрочных HSCs.
5.1. Conditioning Regimen for the Clearance of the Hematopoietic Stem Cell Niche
При аутологичной генотерапии заболеваний кроветворной системы целью является замена дефектных клеток на клетки-хозяева с коррекцией конкретного генетического заболевания. При генотерапии ВИЧ цель - заменить клетки, восприимчивые к инфекции, на резистентные или способные бороться с вирусом. Ниши стволовых клеток обеспечивают поддержание стволовых клеток и регулируют их функции; ниши HSCs являются периваскулярными в костном мозге и селезенке [184]. Процесс расчистки ниши для поглощения трансдуцированных HSCs и элиминации нетрансдуцированных клеток, называемый кондиционированием, традиционно осуществляется с помощью химио- и радиотерапии, которая неспецифична для органа-мишени. Кондиционирование проводится с целью истощения гемопоэтических стволовых и клеток предшественников из ниши, снижения вероятности иммунного отторжения в случае аллогенной трансплантации и лечения злокачественной опухоли в случае злокачественных заболеваний [185]. Режимы кондиционирования можно разделить на миелоаблативное кондиционирование (MAC), не миелоаблативное кондиционирование (NMA) и кондиционирование сниженной интенсивности (RIC). Миелоаблативные схемы состоят из алкилирующих агентов с или без тотального облучения тела (TBI) и приводят к панцитопении и истощению кроветворения в течение 1-3 недель, что не позволяет провести аутологичное гематологическое восстановление. Поэтому для выживания необходима поддержка стволовыми клетками [186]. Схемы MAC ассоциируются с токсичностью и, в некоторых случаях, со смертью, особенно если есть проблемы с приживлением. Признаки токсичности включают органную недостаточность, мукозит, миелосупрессию, вторичное злокачественное перерождение, нарушения опорно-двигательного аппарата, а также сердечные, легочные, репродуктивные и эндокринные нарушения. Долгосрочная смертность среди тех, кто прошел через MAC, также выше, чем в общей популяции [187].
В связи с этими нежелательными эффектами были разработаны схемы с более низкой интенсивностью. Более низкая интенсивность означает обратимую миелотоксичность по сравнению с необратимой миелотоксичностью, вызванной MAC. К таким схемам относятся NMA и RIC [186]. Немиелоаблативные схемы вызывают минимальную цитопению и не требуют поддержки стволовыми клетками. С другой стороны, кондиционирование пониженной интенсивности предполагает снижение дозы препаратов MAC не менее чем на 30 % и, хотя оно не приводит к абляции стволовых клеток, тем не менее требует поддержки стволовыми клетками для применения в клинике [186,188]. Подробности этих режимов кондиционирования были рассмотрены [189]. Хотя RIC менее токсична, она оказалась менее эффективной для генотерапии, поскольку приводит к снижению маркировки генов в клетках периферической крови, что связано либо с менее эффективной очисткой ниши, либо с неэффективной индукцией иммунной толерантности к трансгену [190]. При генотерапии доза радиации или химиотерапевтического препарата определяется состоянием заболевания, которое лечится [191], и характеристиками пациента, включая возраст и пол. Балл риска Европейской группы по трансплантации крови и костного мозга (EMBT) - это инструмент, который используется для оценки риска трансплантации для онкологических больных, но может быть распространен и на любого пациента, нуждающегося в трансплантации. Он основан на пяти факторах: возраст пациента, стадия заболевания, промежуток времени от постановки диагноза до трансплантации, тип донора (по HLA-типу) и сочетание пола донора и реципиента [192]. Как правило, при использовании схемы MAC в возрасте старше 30 лет наблюдается повышенная смертность, а в возрасте старше 50 лет она не рекомендуется. Кроме того, риск отторжения выше, если донор и реципиент не одного пола.
5.2. In Vivo Selection for Gene-Corrected Hematopoietic Stem Cells
Чтобы улучшить отбор клеток с трансгеном, в исследованиях in vivo на животных моделях были использованы методы химиоселекции in vivo. Использование генов лекарственной устойчивости для преимущественной селекции in vivo трансдуцированных генов требует, чтобы ген лекарственной устойчивости экспрессировался на высоком уровне в трансдуцированных клетках и не экспрессировался совсем или на низком уровне в не-трансдуцированных HSCs; селективный препарат должен истощать большинство не-трансдуцированных клеток, иметь низкую не гемопоэтическую токсичность и не быть генотоксичным в незлокачественных условиях [193]. Гены, которые использовались для селекции на животных моделях, особенно у мышей, включают ген множественной лекарственной устойчивости (MDR1), дигидрофолат-редуктазы (DHFR), альдегид-дегидрогеназы (ALDH), цитозиндезаминазы (CDD) [194], глутатион-S-трансферазы (GST), метилгуанин-ДНК-метилтрансферазы (MGMT) и гипоксантин-гуанин-фосфорибозилтрансферазы (HPRT) [193,195].
В одном из исследований использовался мутант O6-метилгуанин-ДНК-метилтрансферазы (MGMT), которая является ферментом репарации алкилирования ДНК. Мутант MGMTP140K показал стабильную и эффективную селекцию HSCs у не-человекообразных приматов [196], хотя канцерогенность используемых алкилирующих агентов (например, Carmustine-BCNU) была недостатком [197]. В другом исследовании использовался нокдаун короткой шпилечной РНК (shRNA) гипоксантин-гуанин-фосфорибозилтрансферазы (HPRT) для селекции HSCs при воздействии на них 6-тиогуанина (6 TG) в мышиных моделях. Использование этого метода привлекательно тем, что он позволяет трансдуцированным HSCs само-обновляться, пролиферировать и дифференцироваться, а также используется для очистки ниши и обеспечения преимущественного приживления клеток с трансгеном [195,198]. Длина shRNA, вызывающей лекарственную устойчивость, составляет всего 48 п.н., и количество 6 TG, используемое для химиоселекции, невелико, хотя 6 TG может индуцировать лейкемогенез. Эта группа использовала MOI 1 и достигла эффективности лентивирусной трансдукции 20-30 % после двух последовательных раундов воздействия вируса и без предварительной стимуляции факторами роста, чтобы сохранить "стволовость" [195].
5.3. Recent Developments in Niche Clearance
Одним из последних достижений в улучшении очистки ниши и стимулировании приживления трансдуцированных клеток является использование моноклональных антител, конъюгированных с препаратом, способным очищать нишу. Эти методы позволяют целенаправленно очищать ниши HSCs, тем самым уменьшая побочные эффекты, связанные с не специфичностью режимов кондиционирования, о которых говорилось выше, и обеспечивая преимущественное приживление клеток с трансгеном. Например, для улучшения селекции HSCs в первых исследованиях на мышах использовались конъюгаты CD45-антитело (CD45-ADC), но вскоре стало ясно, что они не специфичны для HSCs и приводят к истощению лимфоцитов, поскольку CD45 также находится на поверхности лимфоцитов и других белых кровяных телец [199,200]. Более специфическое нацеливание на HSCs стало возможным благодаря использованию конъюгатов CD117-антитело (CD117-ADC), что привело к более чем 99%-ному истощению эндогенных ниш HSCs в мышиных моделях [199,201]. Первая группа, сообщившая об эффективности этого метода в 2019 году, конъюгировала CD117 с saporin с помощью стрептавидинового линкера и протестировала его действие на мышах NOD SCID Gamma (NSG) и не-человеческих приматах [199]. Другая группа использовала конъюгат моноклональных антител против человеческого CD117 IgG1, AMG 191, и обнаружила, что он эффективен на не-человеческих приматах и в настоящее время проходит клинические испытания фазы 1/2 [202]. Другая группа конъюгировала CD117+ с amanitin (MGTA-117) и обнаружила его высокую эффективность (он истощал более 95 % HSPC) в мышиных моделях острого миелоидного лейкоза (AML). CD117 высоко экспрессируется в клетках AML, и было обнаружено, что эта схема уменьшает опухолевое бремя у этих мышей [203].
6. Clinical Trials Based on Ex Vivo HIV Gene Therapy
Как уже упоминалось, усилия по генотерапии ВИЧ были направлены либо на то, чтобы заставить иммунную систему более эффективно выполнять свои функции, либо на то, чтобы заглушить или отредактировать интегрированный провирус, сделав его репликацию некомпетентной, а клетки - устойчивыми к инфекции. Было проведено несколько клинических испытаний, направленных на изучение полезности и безопасности продуктов генной и клеточной терапии ВИЧ (дополнительная таблица S2).
6.1. Cell Therapy-Based HIV Clinical Trials
В одном из самых ранних исследований клеточной терапии был создан химерный Т-клеточный рецептор: Т-клетки, модифицированные геном CD4-Zeta. Результаты этого раннего клинического исследования (NCT01013415) показали, что, несмотря на отсутствие различий между группами по вирусным резервуарам, в группе, получавшей ген-модифицированные клетки, наблюдалось снижение бремени ВИЧ по сравнению с исходным уровнем, а также тенденция к уменьшению числа пациентов с рецидивирующей виремией [204]. AGT103-T - препарат, восстанавливающий gag-специфический ответ CD4+ Т-клеток у лиц с хронической ВИЧ-инфекцией. Результаты первой фазы клинических испытаний (NCT03215004) показали многообещающие результаты. Пациентам, включенным в исследование, проводился лейкаферез. После того как клетки были ген-модифицированы и прошли контроль качества, пациенты проходили не-миелоаблативное кондиционирование циклофосфамидом в дозе 1 г/м2 за неделю до инфузии продукта генотерапии. Модифицированные клетки AGT103-T вводились в дозе от 2 до 21 миллиона клеток на килограмм массы тела. Генную маркировку клеток можно было наблюдать даже через 6 месяцев после введения препарата генотерапии. Серьезных побочных явлений зарегистрировано не было [205].
SB-728 - это препарат аутологичных CD4+ Т-клеток с цинково-пальчиковой нуклеазой (ZFN), модифицированных по CCR5. В различных вариантах этого исследования не было выявлено серьезных побочных явлений при применении препарата, даже после повторных доз. Также наблюдалось лучшее приживление, когда для кондиционирования использовался циклофосфамид. Одно из исследований показало, что, несмотря на задержку вирусного рецидива и улучшение реакции CD8+ Т-клеток, сохранявшуюся более 6 месяцев, долгосрочного влияния на латентный резервуар не было [206].
В другом исследовании, NCT03617198, CAR-T-клеточная терапия сочеталась с модификацией ZFN CCR5 в форме двойной терапии, которая обеспечивала устойчивость CD4+ клеток к инфекции и в то же время способность обнаруживать и очищать ВИЧ-инфицированные клетки. Наконец, в исследовании NCT04648046 использовался лентивирусный вектор, кодирующий биспецифические анти-gp120 CAR-молекулы (LVgp120duoCAR-T) для нацеливания на клетки, экспрессирующие gp-120 ВИЧ.
6.2. Clinical Trials Based on Gene Delivery via Retroviral Vectors
В более ранних исследованиях, направленных непосредственно против ВИЧ, для доставки анти-ВИЧ-генов использовались ретровирусные векторы. Сингенные Т-клетки (от идентичных близнецов) использовались в исследовании, в котором бактериальный ген NeoR доставлялся с помощью ретровирусных векторов (NCT00001353). Целью этого исследования было доказать, что сингенные клетки, трансдуцированные геном, действительно могут сохраняться в течение нескольких недель и месяцев за счет деления зрелых клеток, а не деления претимических стволовых клеток [207]. В одном из исследований с участием близнецов (NCT00001535) сингенные CD4+ лимфоциты были получены от серонегативного близнеца и трансдуцированы ретровирусным вектором, несущим антисмысловую TAR или антисмысловую Tat/Rev РНК, трансдоминантный Rev белок или комбинацию обоих. Доклинические исследования показали, что все использованные анти-ВИЧ векторы подавляли ВИЧ, при этом трансдоминантный белок Rev проявлял большее ингибирование [208]. Результаты клинических испытаний не опубликованы. В настоящее время проводится долгосрочное наблюдение за всеми исследованиями с участием близнецов (Gemini Study-NCT04799483). В другом исследовании с использованием ретровирусных векторов (NCT00002221) были получены CD34+ клетки периферической крови ВИЧ-положительных пациентов с неходжкинской лимфомой, которым планировалась аутологичная трансплантация костного мозга, и эти клетки были разделены на три пула. Один пул клеток был трансдуцирован ретровирусным вектором, содержащим две последовательности рибозима "L-TR/Tat-neo", второй пул был трансдуцирован контрольным вектором "LN", а третий пул остался без модифицированных клеток. Затем они были повторно введены пациенту. Результаты этого исследования пока не опубликованы. Помимо риска инсерционного мутагенеза, наблюдаемого при использовании ретровирусных векторов, существует также вероятность того, что успеху этого последнего исследования будет препятствовать низкая доля клеток, несущих терапевтический ген.
RevM10 - доминантно-отрицательный мутант гена Rev ВИЧ-1. Трансдукция этого гена с помощью ретровирусных векторов в CD4+ Т-клетки приводила к подавлению репликации и персистенции ВИЧ даже до 6 месяцев [209]. Результаты исследований RevM10 в гемопоэтических стволовых клетках (NCT00003942) не опубликованы. Ретровирусные векторы также использовались для доставки MazF, Tat-зависимого гена эндорибонуклеазы, в исследовании I фазы для оценки его безопасности, переносимости и иммуногенности. MazF получен из E. coli и избирательно расщепляет ACA-последовательности мРНК, которые часто встречаются в ВИЧ. Это исследование показало, что однократная внутривенная инфузия аутологичных CD4+ Т-клеток, трансдуцированных MazF, вызвала увеличение количества CD4+ и CD8+ клеток, и этот эффект сохранялся в течение как минимум 6 месяцев [210].
Рибозимы - это каталитические молекулы РНК, которые могут нацеливаться на любую последовательность РНК с сайтом расщепления NUX, где N - любой нуклеотид, а X - A, C или U [211]. В доказательном исследовании фазы 1 Rz2, рибозим, направленный на последовательность GUA вблизи инициирующего кодона гена tat, был доставлен с помощью ретровирусных векторов в сингенные мононуклеарные клетки периферической крови (PBMCs), полученные из ген-модифицированных клеток серонегативного близнеца, а затем введен серопозитивному близнецу [211]. В это исследование было включено четыре пациента, что продемонстрировало устойчивость ген-модифицированных клеток как в краткосрочной (24 недели), так и в долгосрочной перспективе (44 месяца), при этом серьезных побочных эффектов в течение этого периода не наблюдалось. В ходе соответствующего испытания 2-й фазы генотерапии с использованием анти-ВИЧ рибозима, трансдуцированного в аутологичные CD34+ клетки с помощью ретровирусных векторов, пациенты получали tat-vpr-специфический анти-ВИЧ рибозим (OZ1) или плацебо. Нежелательных явлений, связанных с OZ1, не было. Хотя статистически значимой разницы в вирусной нагрузке между группой OZ1 и группой плацебо в первичной конечной точке (около 48-й недели) не было, до 40-й недели наблюдались значительные различия, а CD4+ Т-клетки были выше в группе OZ1, чем в группе плацебо до 100-й недели [212,213]. В долгосрочном последующем исследовании NCT01177059 18 из 68 человек, первоначально включенных в исследование, завершили его, и из них у 7 наблюдались серьезные побочные эффекты, включая новообразования различных типов (например, базально-клеточная карцинома, болезнь Ходжкина, саркома Капоши, папиллярный рак щитовидной железы, рак кожи), которые, скорее всего, были вызваны ретровирусным вектором.
6.3. Lentiviral Vector-Based HIV Studies
В исследовании VRX496 (Lexgenleucel-T) аутологичные Т-клетки были модифицированы с помощью лентивирусного вектора на основе ВИЧ, несущего антисмысловой ген, нацеленный на оболочку ВИЧ. Исследование безопасности и переносимости, NCT00295477, показало, что период полураспада приживления в крови составляет 5 недель. У некоторых пациентов клетки, помеченные геном, сохранялись до 5 лет. Это исследование продемонстрировало, что ген-модифицированные клетки могут оказывать генетическое давление на ВИЧ [214].
В другом исследовании, где использовались лентивирусные векторы для доставки анти-ВИЧ генов, сочетались короткая шпилечная РНК (shRNA) против CCR5, которая блокирует проникновение вируса, химерная TRIM5 человека/макаки-резуса, которая нарушает разворачивание вирусного капсида при попадании в цитоплазму, тем самым подавляя ВИЧ-инфекцию, и приманку для ответа на трансактивацию (TAR), которая имитирует вирусную TAR путем связывания вирусного Tat и его секвестирования, тем самым не позволяя ему опосредовать эффективную транскрипцию провирусной ДНК [215]. Результаты этого клинического испытания пока не опубликованы.
В одной группе исследований пациентам, подвергшимся аутологичной трансплантации по поводу лимфомы, вводили CD34+ гемопоэтические стволовые клетки, модифицированные лентивирусной конструкцией, содержащей shRNA tat-rev, приманку TAR и рибозим CCR5 (LV Rhiv7-shI-TAR-CCR5RZ). Первые результаты, полученные у четырех пациентов, показали приживление ген-модифицированных клеток на 11-й день после введения и сохранение вектора даже в течение 24 месяцев, а также селекцию ген-модифицированных клеток после виремии [216]. Результаты отдельных исследований не опубликованы.
Cal-1 - это лентивирусная конструкция с двойным переносом генов против ВИЧ, которая доставляет shRNA, глушащую CCR5 (sh5), и, под другим промотором, кодирующую последовательность для небольшого пептидного ингибитора вирусного слияния, который предотвращает слияние оболочки ВИЧ с клеткой CD4+ хозяина (C46). Несколько исследований Cal-1 были проведены в разных местах (Дополнительная таблица S2). В исследовании NCT01734850 препарат Cal-1 назначали 13 пациентам и оценивали безопасность терапии. Доклинические исследования Cal-1 показали, что терапия эффективна и безопасна [60,217,218]. В ходе клинических испытаний применялось кондиционирование бусульфаном для очищения ниши, чтобы обеспечить приживление ген-модифицированных клеток. Тяжелые и угрожающие жизни нежелательные явления наблюдались в двух группах лечения, прошедших кондиционирование бусульфаном, причем более тяжелые последствия наблюдались при использовании двух доз бусульфана по сравнению с одной дозой. В группе, не подвергавшейся кондиционированию, серьезных нежелательных явлений не наблюдалось. В настоящее время пациенты находятся под наблюдением в рамках долгосрочного исследования (NCT02390297). Токсичность, связанная с кондиционированием, является распространенной проблемой для успешного проведения генотерапии, поэтому целесообразно разработать более безопасные и эффективные методы очистки ниши для успешного и стабильного приживления.
Данные клинические исследования демонстрируют тонкий баланс между адекватной очисткой ниши для достижения достаточного приживления, позволяющей производить ген-модифицированные клетки, и возникающей миелотоксичностью вследствие кондиционирования.
Решение этих проблем необходимо для того, чтобы помочь продвинуться в доклинических исследованиях подходов к лечению ВИЧ, таких как исследования, проведенные в рамках подхода "block and lock" с использованием si/shRNA [53,64,219]. В этой группе доклинических исследований на мышах сообщалось об успешном глушении ВИЧ с помощью si/shRNA, в первую очередь shPromA, которая нацелена на тандемные участки фактора транскрипции NF-κB в промоторе вируса, чтобы вызвать транскрипционное глушение экспрессии нижележащих вирусных генов и репрессивные эпигенетические модификации (рис. 2) [66,220]. В сочетании с вектором Cal-1, содержащим CCR5 shRNA, нацеленная на промотор si/shRNA, PromA, в настоящее время исследуется для разработки комбинированной генотерапии ВИЧ, нацеленной как на CCR5 хозяина, так и на промотор вируса.
7. HIV Gene Therapy Clinical Trials Based on In Vivo Delivery
Исследования, использующие подход in vivo в лечении ВИЧ, в основном находятся на доклинической стадии. Подходы in vivo предполагают введение продукта генотерапии непосредственно пациенту с помощью либо вирусных векторов, таких как аденовирусные векторы, адено-ассоциированные вирусные векторы или не интегрирующие лентивирусные векторы, либо с помощью не вирусных методов, например наночастиц. Методы in vivo не могут обеспечить длительного лечения, поскольку не происходит стабильной интеграции трансгена в генетический материал хозяина, а доставка в конкретные клетки должна быть оптимизирована для снижения вероятности вне-целевого воздействия. Редактирование генов с помощью рекомбиназ или нуклеаз [61], а также механизмы сайленсинга с помощью РНК-интерференции или, возможно, CRISPR-интерференции могут использовать подход in vivo.
Текущие клинические испытания включают исследование с использованием leronlimab- анти-CCR5 гуманизированного антитела IgG4, которое конкурентно ингибирует прикрепление ВИЧ env к CCR5, связываясь с тем же местом прикрепления, что и CCR5 (внеклеточная петля-2 и N-концевые домены). Этот препарат вводился подкожно, и в настоящее время группа работает над использованием синтетического вектора AAV для его доставки. Несколько версий этого исследования - NCT00642707, NCT02175680, NCT02355184, NCT02483078, NCT02990858, NCT03902522, NCT02859961 и NCT05271370 - продемонстрировали безопасность и эффективность препарата, причем пациенты испытывали в основном легкие побочные эффекты, а эффективность наблюдалась при более высоких дозах - 525 мг и 700 мг [221].
CRISPR-Cas9 Technology for HIV Cure
CRISPR и ее система CRISPR-ассоциированная нуклеаза 9 (Cas9) - это система редактирования генов, которая индуцирует двунитевые разрывы в геномных областях при посредничестве направляющей РНК, которые затем восстанавливаются с помощью пути соединения не гомологичных концов. Недавно были опубликованы различные обзорные статьи, описывающие доклинические исследования в области ВИЧ [222,223]. Недавнее клиническое исследование с использованием CRISPR-Cas9 для лечения ВИЧ - NCT03164135, в котором эта технология используется для нокаута гена CCR5 в HSCs пациентов, подвергающихся аллогенной трансплантации стволовых клеток по поводу гематологических злокачественных опухолей. Первые результаты, полученные на пациенте с острым лимфобластным лейкозом, показали ремиссию с полным донорским химеризмом, а донорские клетки с нокаутом CCR5 сохранялись в течение 19 месяцев без побочных явлений генного редактирования. Однако процент лимфоцитов, несущих модификацию, составил всего 5 %, и команда исследователей изучает, как сделать этот процесс более эффективным [224]. Еще один недавний препарат для генотерапии ВИЧ на основе CRISPR-Cas9 - EBT-101 (NCT05144386). Эта генотерапия проводится в виде однократной внутривенной инфузии и доставляется с помощью AAV, которая использует две направляющие РНК, чтобы нацелиться на три места интегрированного провируса. Недавно три пациента были включены в клинические испытания фазы 1, и первые результаты, представленные компанией (Excision Bio Therapeutics, Сан-Франциско, Калифорния, США) на ежегодной встрече Европейского общества генной и клеточной терапии в октябре 2023 года, не выявили ограничивающих дозу токсических эффектов или серьезных нежелательных явлений.
CRISPR-Cas 9 можно использовать для воздействия на ВИЧ-5'LTR, который является промоторной областью, что предотвращает репликацию или активацию латентного вируса; на область CCR5 или CXCR4, что делает клетки устойчивыми к инфекции; или на факторы рестрикции, способствующие репликации ВИЧ, чтобы блокировать их активность [223]. В то время как в настоящее время ни один метод генотерапии на основе CRISPR-Cas9 не одобрен в качестве лекарства от ВИЧ, FDA недавно одобрило первый метод генотерапии на основе клеток CRISPR-Cas9 для лечения серповидно-клеточной болезни, Casgevy (https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapies-treat-patients-sickle-cell-disease, доступ 27 января 2024 г.), что подчеркивает инновационные достижения в генотерапии и потенциал CRISPR-Cas9 в качестве метода лечения ВИЧ.
Conclusions
Длительная или постоянная экспрессия анти-ВИЧ генов и модификация CD4+ и CD34+ клеток с целью придания им устойчивости к инфекции или нарушения жизненного цикла ВИЧ являются важными стратегиями в стремлении достичь излечения от ВИЧ. Хотя появление комбинированной АРТ значительно улучшило результаты лечения и качество жизни людей, живущих с ВИЧ, излечение желательно, особенно для пациентов, у которых развилась резистентность к текущей схеме лечения. Препарат, который обеспечит хотя бы функциональное излечение, скорее всего, должен будет сочетать в себе терапевтические агенты с различными способами действия, чтобы свести к минимуму вероятность развития резистентности, а также быть длительного действия или, в идеале, требовать однократного приема. Поэтому очень важно использовать современные достижения биотехнологии, чтобы усовершенствовать подходы к генотерапии и сделать продукты генотерапии более безопасными, экономичными и долговечными.
 Figure 1. Ex vivo delivery of gene of interest. Created with Biorender.com.
Figure 1. Ex vivo delivery of gene of interest. Created with Biorender.com.
 Рисунок 2. Стратегии лечения ВИЧ. CRISPR-Clustered Regularly Interspaced Short Palindromic Repeats; ZFN-Zinc Finger Nuclease; TALEN-Transcription activator-like effector nucleases. Создано с помощью программы Biorender.
Рисунок 2. Стратегии лечения ВИЧ. CRISPR-Clustered Regularly Interspaced Short Palindromic Repeats; ZFN-Zinc Finger Nuclease; TALEN-Transcription activator-like effector nucleases. Создано с помощью программы Biorender.