Ползователи: 
Х-СЦЕПЛЕННЫЙ ЮВЕНИЛЬНЫЙ РЕТИНОШИЗИС
преклиническая Генотерапия
The Road towards Gene Therapy for X-Linked Juvenile Retinoschisis: A Systematic Review of Preclinical Gene Therapy in Cell-Based and Rodent Models of XLRS:Isa van der Veen,Andrea Heredero Berzal,Celine Koster et al.
 nt. J. Mol. Sci. 2024, 25(2), 1267; https://doi.org/10.3390/ijms25021267
|
X-linked juvenile retinoschisis (XLRS) is an early-onset progressive inherited retinopathy affecting males. It is characterized by abnormalities in the macula, with formation of cystoid retinal cavities, frequently accompanied by splitting of the retinal layers, impaired synaptic transmission of visual signals, and associated loss of visual acuity. XLRS is caused by loss-of-function mutations in the retinoschisin gene located on the X chromosome (RS1, MIM 30083). While proof-of-concept studies for gene augmentation therapy have been promising in in vitro and rodent models, clinical trials in XLRS patients have not been successful thus far. We performed a systematic literature investigation using search strings related to XLRS and gene therapy in in vivo and in vitro models. Three rounds of screening (title/abstract, full text and qualitative) were performed by two independent reviewers until consensus was reached. Characteristics related to study design and intervention were extracted from all studies. Results were divided into studies using (1) viral and (2) non-viral therapies. All in vivo rodent studies that used viral vectors were assessed for quality and risk of bias using the SYRCLE’s risk-of-bias tool. Studies using alternative and non-viral delivery techniques, either in vivo or in vitro, were extracted and reviewed qualitatively, given the diverse and dispersed nature of the information. For in-depth analysis of in vivo studies using viral vectors, outcome data for optical coherence tomography (OCT), immunohistopathology and electroretinography (ERG) were extracted. Meta-analyses were performed on the effect of recombinant adeno-associated viral vector (AAV)-mediated gene augmentation therapies on a- and b-wave amplitude as well as the ratio between b- and a-wave amplitudes (b/a-ratio) extracted from ERG data. Subgroup analyses and meta-regression were performed for model, dose, age at injection, follow-up time point and delivery method. Between-study heterogeneity was assessed with a Chi-square test of homogeneity (I2). We identified 25 studies that target RS1 and met our search string. A total of 19 of these studies reported rodent viral methods in vivo. Six of the 25 studies used non-viral or alternative delivery methods, either in vitro or in vivo. Of these, five studies described non-viral methods and one study described an alternative delivery method. The 19 aforementioned in vivo studies were assessed for risk of bias and quality assessments and showed inconsistency in reporting. This resulted in an unclear risk of bias in most included studies. All 19 studies used AAVs to deliver intact human or murine RS1 in rodent models for XLRS. Meta-analyses of a-wave amplitude, b-wave amplitude, and b/a-ratio showed that, overall, AAV-mediated gene augmentation therapy significantly ameliorated the disease phenotype on these parameters. Subgroup analyses and meta-regression showed significant correlations between b-wave amplitude effect size and dose, although between-study heterogeneity was high. This systematic review reiterates the high potential for gene therapy in XLRS, while highlighting the importance of careful preclinical study design and reporting. The establishment of a systematic approach in these studies is essential to effectively translate this knowledge into novel and improved treatment alternatives.

|
Зрение является основополагающим фактором повседневной деятельности. Потеря или ухудшение зрения влияет на людей во всех аспектах жизни, что приводит к потере независимости и значительному снижению качества жизни [1]. В глазу позвоночных свет преобразуется в электрические сигналы в сетчатке, откуда визуальная информация проецируется в сенсорные области мозга. При многих дегенеративных заболеваниях сетчатки нарушение передачи сигналов непосредственно приводит к потере зрения. Развитие и поддержание клеток сетчатки определяется целым рядом генетических компонентов. Мутации в этих генах могут приводить к наследственным заболеваниям сетчатки (IRDs). Х-сцепленный ювенильный ретиношизис (XLRS, MIM 312700) - относительно распространенное IRDs, распространенность которого оценивается как 1:5000-1:25 000. Впервые это заболевание было описано в 1898 году офтальмологом Josef Haas, который зарегистрировал его у двух молодых братьев [2]. XLRS в основном поражает мальчиков в первом десятилетии жизни, хотя тяжелые случаи заболевания были диагностированы уже в трехмесячном возрасте. Однако обычно диагноз ставится в школьном возрасте [3,4], поскольку тогда умеренная потеря остроты зрения (VA) легко замечается программами визуального скрининга или потому, что дети испытывают трудности с чтением. В связи с Х-сцепленным рецессивным типом наследования было зарегистрировано лишь ограниченное число случаев XLRS у женщин. Тем не менее, гомозиготные женщины демонстрируют фенотип XLRS, а гетерозиготные женщины очень редко могут также проявлять признаки XLRS вследствие инактивации Х-хромосомы [3,5]. Женщины-носители обычно бессимптомны, хотя в редких случаях у них может наблюдаться периферический ретиношизис [6,7].
Тяжесть и прогрессирование заболевания при XLRS сильно варьируют, даже среди членов семьи [4]. У большинства пациентов потеря зрения медленно прогрессирует в первые десятилетия жизни, и до 25 % пациентов становятся слепыми к 60 годам из-за прогрессирующего развития макулярной атрофии, а также дисфункции пигментного эпителия сетчатки (RPE) и макулярных пигментных изменений [4,8]. Примерно у 5-20% пациентов возникают осложнения в виде rhegmatogenou отслоек сетчатки и/или рецидивирующих кровоизлияний в стекловидное тело, часто уже в молодом возрасте [3,4,9]. Другие редкие осложнения включают глаукому и бледность диска зрительного нерва [4].
Наиболее частой клинической находкой у пациентов с XLRS является двусторонний макулярный шизис (schisis), который встречается практически у всех пациентов (рис. 1D). Его можно выявить с помощью фундус-фотографии, но для высоко-детальной визуализации патологических признаков обычно используется оптическая когерентная томография (OCT). При осмотре глазного дна обычно наблюдается спицевидный рисунок микрокистозных изменений, распространяющихся от фовеолы [10] (рис. 1D). Шизис наблюдается как в ядерном, так и в плексиформном слоях сетчатки и может затрагивать внутренний, средний и наружный слои сетчатки [4,11]. Со временем кистоидный шизис может постепенно уменьшаться, оставляя атрофические изменения в макуле, которые можно принять за другие наследственные или не-наследственные заболевания макулы [4]. Примерно у 50 % больных также имеется периферический ретиношизис, и у них повышен риск развития таких осложнений, как отслоение сетчатки и/или кровоизлияние в стекловидное тело [4,9]. Другие морфологические признаки сетчатки включают экссудативную ретинопатию, стекловидные вуали и решетчато-подобные поражения сетчатки [4].
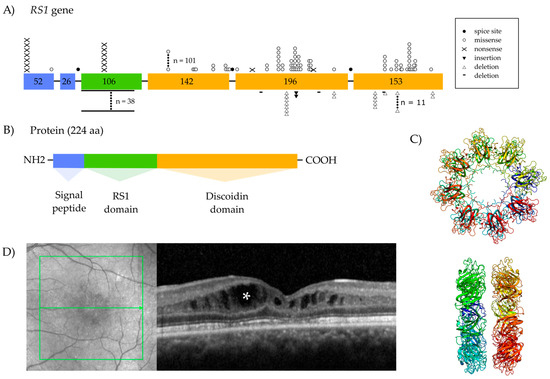 Figure 1. Schematic structure representing the retinoschisin (RS1) gene (A), protein diagram (B), the quaternary structure of the protein (C), and hallmarks of X-linked juvenile retinoschisis (XLRS) (D). (A) (Adapted from Hahn et al. [4]). An overview of RS1 shows the localization and variants within the gene. Colored boxes represent the six exons, and the numbers within the boxes represent their size in nucleotides. The type of variant is presented in the legend, and the frequency and distribution are described within the gene structure. Splice site (n = 38), missense (n = 101), and deletion variants (n = 11) are the three most common variants. (B) Overview of the RS1 protein, featuring the signal peptide domain, the RS1 domain, the discoidin domain and the C-terminal domain. (C) The top and side view of the octamer and double octamer. (D) Fundus photograph of a 35-year old patient with a hemizygous c.428A > T p.(Asp143Val) mutation in the RS1 gene patient with XLRS, and optical coherence tomography image showing macular schisis (asterisk) in this patient with XLRS.
При функциональной оценке амплитуда адаптированной к темноте b-волны на электроретинограмме (ЭРГ) непропорционально снижена, иногда до такой степени, что соотношение между амплитудами b- и a-волн (b/a-ratio) меньше 1, а b-волна не пересекает базовую линию, что приводит к "электронегативной" форме волны [4,12]. Считается, что а-волна на ЭРГ отражает функцию фоторецепторов (PR), в то время как b-волна свидетельствует об активности биполярных клеток ON. Считается, что электроотрицательная ЭРГ означает недостаток распространения синаптического сигнала [13] .
1.2. The Retinoschisin Gene and Its Expression
В 1997 году Sauer и коллеги идентифицировали мутации в retinoschisin (RS1) (OMIM#312700) как причину XLRS [14]. RS1 расположен в хромосомном регионе Xp22.1 и имеет геномный размер 32 421 кб. Ген содержит шесть экзонов и транскрибируется в мРНК длиной 3,1 кб, которая трансформируется в белок из 224-аминокислот [14,15] (рис. 1А). К настоящему времени с XLRS ассоциировано более 200 мутаций RS1, включая точечные мутации, мутации сайтов сплайсинга, делеции и инсерции [4,16]. Наиболее распространены миссенс-мутации, большинство из которых расположены между экзонами 4 и 6 [4,17]. RS1 экспрессируется в основном фоторецепторами и биполярными клетками в зрелой сетчатке [11,18]. RS1 также экспрессируется в пинеалоцитах в шишковидной железе и в низких концентрациях обнаруживается в мозге, легких и щитовидной железе, где роль белка еще не выяснена [19,20].
1.3. Retinoschisin Protein and Function
Активная биологическая конформация белка RS1 представляет собой гомоолигомерный октамер, который секретируется как из фоторецепторов, так и из биполярных клеток [14,21-23]. Каждая субъединица RS1 состоит из четырех отдельных доменов: N-концевой сигнальной последовательности, кодируемой экзонами 1 и 2, уникального домена RS1, кодируемого экзоном 3, дискоидинового домена, кодируемого экзонами 4-6, и С-концевого сегмента (рис. 1В). Дискоидиновый домен опосредует коммуникацию между клетками и тканями [24] и является общим для нескольких хорошо сохраняемых внеклеточных белков клеточной поверхности [25-31]. Считается, что функция дискоидинового домена в RS1 в значительной степени связана с поддержанием архитектуры сетчатки, а также синаптической связи между слоями [11,32].
Localization
Во время развития RS1 (белок и мРНК) экспрессируется во всех нейронах сетчатки, за исключением горизонтальных клеток [33]. У мышей белок впервые обнаруживается примерно на шестой постнатальный день (P6), а взрослый паттерн экспрессии достигается на ст. P12 [18]. В зрелой сетчатке только PRs и биполярные клетки участвуют в синтезе RS1, а затем и в его секреции [18,33,34]. Как следствие, RS1 обнаруживается во всей внутренней и внешней зрелой сетчатке в виде секретируемого белка ([18,35]). У человека, крупного рогатого скота и мыши белок RS1 обнаруживается в высоких концентрациях в слое внутреннего сегмента (IS), особенно в эллипсоидной зоне, прилегающей к наружным сегментам (OS) [18]. Он также присутствует во внутреннем ядерном слое (INL) и в меньшей степени в наружном ядерном слое (ONL) и наружном плексиформном слое [18]. В ганглиозных клетках сетчатки и во inner limiting membrane (ILM) белок RS1 не обнаружен [18].
1.4. Treatment Options
На сегодня нет эффективного лечения XLRS. Лечение этого заболевания исторически было направлено на уменьшение полостей шизиса. Инвазивные методы, такие как витреоретинальная хирургия, применяются только для пациентов с тяжелыми осложнениями, такими как отслойка сетчатки или значительная эпиретинальная мембрана в макуле [36]. Ингибиторы карбоновой ангидразы, такие как dorzolamide, использовались для лечения пациентов с XLRS, уменьшая полости внутриретинальной жидкости шизиса [37,38]. Ингибиторы карбоновой ангидразы действуют путем ингибирования рецепторов карбоновой ангидразы на мембране нейронов сетчатки и RPE. Это приводит к закислению субретинального пространства и, как следствие, к усилению транспорта жидкости через RPE, что способствует склеиванию слоев сетчатки [39]. Эти препараты могут в различной степени уменьшать размеры полостей шизиса при XLRS, но без заметного улучшения VA [38-43].
Несмотря на первоначальную перспективность ингибиторов карбоновой ангидразы в качестве потенциального симптоматического лечения, отсутствие воспроизводимых улучшений состояния VA привело к смещению акцентов в поиске методов лечения XLRS. Главной целью стало устранение основной причины заболевания - мутаций в гене RS1, а также тот факт, что XLRS представляется привлекательной мишенью для генотерапии, поскольку является моногенным заболеванием с четким и относительно однородным клиническим фенотипом [4].
1.4.1. Adeno-Associated Viral Vector-Mediated Gene Augmentation Therapy
Последние достижения в области генно-инженерных технологий позволили разработать методы генотерапии на основе адено-ассоциированных вирусных векторов (AAV). AAV являются популярными транспортными средствами и хорошо зарекомендовавшими себя векторами для доклинической и клинической доставки генов. Это связано с последними достижениями в области изучения капсида AAV, их высокой эффективностью трансдукции, высокой биобезопасностью, пониженной иммуногенностью и длительной и стабильной экспрессией генома [44-46]. Тем не менее, AAV также сталкиваются с некоторыми проблемами, такими как высокая стоимость производства, малая емкость упаковки (менее 4,7 кб) и потенциальные риски, такие как воспаление и атрофия сетчатки в случае глазного использования [44,47]. Несмотря на эти ограничения, AAV были одобрены Управлением по контролю за продуктами и лекарствами (FDA) и Европейским медицинским агентством (EMA) для лечения RPE65-ассоциированного врожденного амавроза Лебера, и в настоящее время используются в клинических испытаниях для лечения широкого спектра наследственных заболеваний сетчатки [48-51]. Различные серотипы AAV обладают различным клеточным тропизмом и способностью к трансдукции, зависящей от их взаимодействия с мембранными рецепторами и клеточными механизмами поглощения и транспортировки [52]. В геноме AAV промотор является важным регуляторным элементом ДНК, который определяет, где и в какой степени экспрессируется трансген [53]. Поэтому выбор промотора и серотипа очень важен для успешного наращивания генов.
Доставка генов для лечения XLRS должна быть направлена на внешнюю сетчатку, в частности на фоторецепторы, а во внутренней сетчатке - на биполярные клетки, поскольку они участвуют в синтезе RS1 в зрелой сетчатке [18,33,34]. Трансдукция RS1 в фоторецепторы Rs1h-дефицитной мышиной модели показала значительное улучшение выработки и секреции RS1, уменьшение количества полостей, улучшение организации сетчатки и функциональное восстановление [54]. В попытке выявить новые потенциальные клеточные мишени трансдукция в Rs1h-дефицитной мышиной модели была распространена на клетки Müller, учитывая их участие в транспортировке RS1, их распределении по сетчатке и сохранению даже на поздних стадиях заболевания [54]. Несмотря на благоприятные результаты с точки зрения производства и секреции RS1 в клетках Müller, этот подход не показал снижения ретиношизиса в данной модели [54]. Это подчеркивает сложную природу RS1 как секретируемого белка во внеклеточном пространстве и указывает на то, что доставка в любой тип клеток сетчатки недостаточна для уменьшения патогенных признаков.
Были проведены обширные исследования, касающиеся безопасности использования AAVs. Тем не менее, несмотря на относительную иммунную привилегированность глаза, в исследованиях in vivo все еще отмечается иммунный ответ на высокие дозы AAV [55,56]. Для преодоления этой проблемы невирусные методы стали потенциально привлекательной альтернативой традиционным вирусным методам доставки.
1.4.2. Non-Viral Gene Augmentation or Gene Editing
Не-вирусные векторы инкапсулируют и переносят ДНК, мРНК, малые интерферирующие РНК (siRNA) и микроРНК (miRNA) [57]. Независимо от интересующей конструкции, не-вирусные векторы защищают их от деградации, облегчая их транспортировку [58]. Эти системы доставки также могут быть использованы для генотерапии с помощью интеграции генов, увеличения генов и Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR)/Cas9, которые вызывают меньше проблем с безопасностью [59]. Кроме того, они позволяют вводить антисмысловые олигонуклеотиды, что представляет все больший интерес для лечения IRDs [57,60]. Не-вирусные методы можно классифицировать как химические, основанные на способности положительно заряженных липидов, пептидов или полимеров вводить отрицательно заряженную ДНК в клетки [61], или физические, использующие температурный или электрический шок для достижения интеграции нуклеиновых кислот [62]. Они стали привлекательными благодаря большей по сравнению с AAV емкости упаковки, возможности производства большого количества не-вирусных частиц, снижающей производственные затраты, простоте модификации и длительной стабильности [63-65]. Эти не-вирусные векторы, по-видимому, обладают меньшей иммунотоксичностью, в отличие от AAV или потенциально родственных вирусных векторов [66]. Несмотря на эти преимущества, невирусные методы имеют ряд ограничений, таких как продолжительность лечения и эффективность трансдукции [67].
XLRS представляется хорошо подходящим для генотерапии благодаря моногенному характеру, относительно раннему началу заболевания, медленно прогрессирующему фенотипу и непролиферативной природе клеток сетчатки [4]. В самом деле, на моделях грызунов были получены существенные результаты при использовании нескольких AAV-опосредованных методов генотерапии, которые будут рассмотрены в данном систематическом обзоре. Однако недавнее клиническое исследование с использованием рекомбинантной генной терапии AAV8-scRS/IRBPhRS (scRS - геном самокомплементарного вектора, содержащий модифицированный промотор retinoschisin человека; IRBP - усилитель интерфоторецепторного ретиноид-связывающего белка) у девяти пациентов не привело к улучшению симптомов у всех, кроме одного (ClinicalTrial.gov: NCT02317887) [68]. Можно ли это объяснить ограниченной трансляционной ценностью использованных моделей или неадекватным (до)клиническим дизайном исследований, еще предстоит выяснить. Цель данного обзора - систематически обобщить и оценить существующие исследования in vivo и in vitro, направленные на борьбу с дефицитом RS1 с помощью вирусного и невирусного дополнения генов или терапии редактирования генов, чтобы улучшить дизайн (до-клинических) исследований. ...
3. Results ...
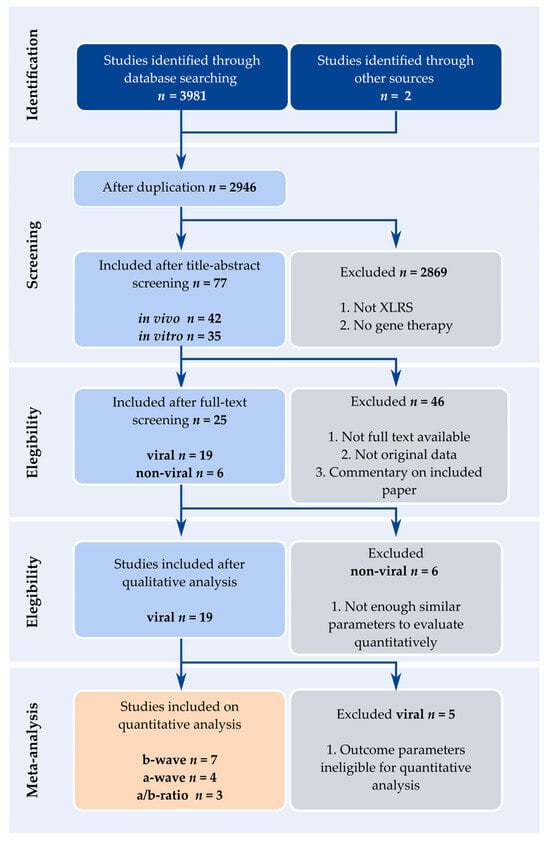 Figure 2. Flowchart outlining the screening and selection process. The selection process was performed through the following stages: identification, screening, eligibility criteria and meta-analysis. Taken together, 3983 studies were identified in the first stage, and after removing duplicates, 2946 studies were included in the screening phase. After title and abstract screening, 77 studies were included. After full-text screening, 25 studies were included, split into 19 studies describing viral methods in in vivo models, and 6 studies describing non-viral and alternative delivery methods in vitro and in vivo. After the second eligibility stage, 19 studies using viral methods were eligible for quantitative analysis. For meta-analysis, seven studies were included for b-wave amplitude, four studies for a-wave amplitude and three studies for the ratio between b- and a-wave amplitudes (b/a-ratio). Four studies were not included in any meta-analysis.
3.1.1. Use of Rodent Models for X-Linked Juvenile Retinoschisis ...
Table 1. The four rodent models for XLRS that were used in the included studies. The rodent models were assigned a name based on the names used in the first publication that described the model. In the case of the rat model, a number was added to distinguish the two. XLRS = X-linked juvenile retinoschisis, RS1 = retinoschisin, Rs1h = homolog of RS1 in rodents, KO = knock-out, bp = base pair, kb = kilobase, IHC = immunohistochemistry, WB = Western blot, INL = inner nuclear layer, ONL = outer nuclear layer, OPL = outer plexiform layer, PR = photoreceptor, IS = inner segments, OS = outer segments, ERG = electroretinography, P = postnatal day, b/a-ratio = ratio between the b- and a-wave amplitudes.
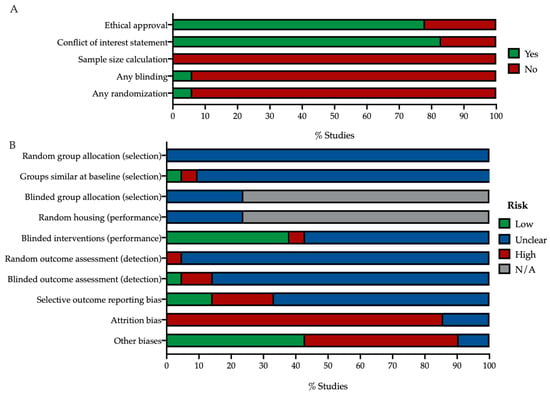 Figure 3. All in vivo studies were assessed on their risk of bias using the SYRCLE tool [69]. (A) The studies were assessed on whether any information was provided about ethical approval, conflicts of interest, calculation of sample sizes, blinding, or randomization. (B) The studies were assessed on possible risk of selection, performance, detection, outcome reporting, attrition and other biases. When the contralateral eye was used as the (internal) control, questions for random housing and allocation concealment were answered with not-applicable (N/A). Most studies received an unclear risk-of-bias score, due to a lack of reporting of essential quality indicators. ...
3.1.3. Main In Vivo Study Characteristics ...
Animal Characteristics ...
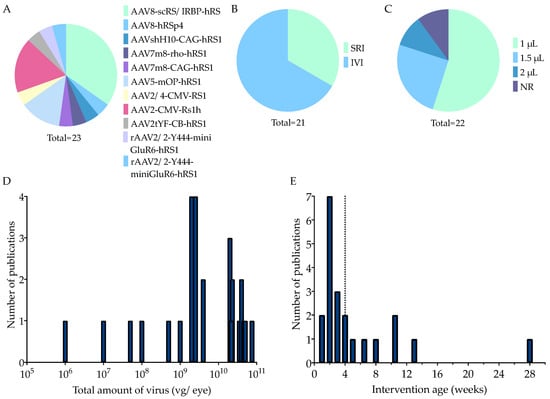 Figure 4. Therapy characteristics of adeno-associated viral vector-mediated (AAV) gene augmentation therapies in included studies. The total number of experimental groups varies per parameter, as some studies tested multiple versions of the same parameter. (A) A spectrum of AAV types was used. The total number of experimental groups was 23. (B) The majority (67%) delivered the treatment by intravitreal injection. (C) Injection volumes ranged from 1 to 2 µL, although 1 µL was most commonly used (55%). (D) A number of publications reported different total doses of virus delivered to the eye (viral genomes/eye), but the majority chose a titer >4 Ч 109 vg/eye. The dotted line indicates the median. (E) The animals were treated at variable ages (5 days–7 months), although most were treated before one month of age (median: three weeks; dotted line). scRS/IRBP = modified RS promoter coupled with an interphotoreceptor retinoid-binding protein enhancer; CMV = cytomegalovirus promoter, hRSp4 = a complex consisting of RS1 promoter, human RS1 cDNA with a truncated first intron, human beta-globin polyadenylation site, and AAV2 inverted terminal repeats; shH10 = AAV subtype derived from AAV6; CAG = promoter element consisting of CMV early enhancer, rabbit beta-globin splice adapter, and the promoter, first intron and exon of CB; CB = chicken beta-actin; RS1 = retinoschisin; hRS1 = human RS1; rho = rhodopsin; mOP = mouse opsin; Rs1h = rodent homolog to RS1; 2tYF = AAV subtype with three tyrosine residues mutated to phenylalanine on the AAV2 capsid surface; rAAV2/2-Y444F = AAV subtype with a single Y mutated to F on the AAV2 capsid surface; mini-mGlu6 = a shortened version of the ON bipolar cell-specific promoter mGlu6; Ple155 = a human-DNA MiniPromoter specific to ON bipolar cells; SRI = subretinal injection; IVI = intravitreal injection; NR = not reported.
Therapy Characteristics
Во всех исследованиях сообщалось об используемом вирусном капсиде, серотипе, промоторе и трансгене (Рисунок 4A). В некоторых исследованиях использовалось несколько векторов, что позволило получить 23 экспериментальные группы, пригодные для нашего анализа. Капсид AAV8 использовался в 10 из 23 (43 %) экспериментальных групп. AAV2 и AAV5 использовались в 17% и 13%, соответственно. Четыре рекомбинантных капсида, полученных из AAV2, были использованы по одному разу. Это, во-первых, AAV2tYF, у которого на поверхности капсида AAV2 три остатка тирозина мутировали в остатки фенилаланина (Y to F) [89]. Во-вторых, AAV7m8, содержащий пептид из десяти аминокислот (7m8), вставленный в последовательность белка AAV2 и трансфицирующий внутреннюю и внешнюю сетчатку [90]. В-третьих, существует AAV2/4, рекомбинантный подтип AAV2, который особенно хорошо трансфицирует фоторецепторы [91]. В-четвертых, использовали rAAV2.2-Y444F, который представляет собой rAAV2 серотипа 2 с единственной мутацией (Y444F) на капсиде [34]. Одна группа использовала AAVshH10, который был получен из библиотеки AAV6 shuffled library и в первую очередь нацелен на клетки Мьллера [92].
В 8 из 23 экспериментальных групп (35 %) использовали вездесущий промотор, который представлял собой либо куриный бета-актин (CB), либо цитомегаловирус (CMV), либо CAG. CAG состоит из раннего энхансера CMV, сплайс-адаптера бета-глобина кролика, а также промотора, первого интрона и экзона CB. Девятнадцать процентов выбрали промотор, специфичный для фоторецепторов, либо мышиный опсин (mOP), либо родопсин (rho). Тридцать пять процентов использовали модифицированный промотор RS1, соединенный с усилителем интерфоторецепторного ретиноид-связывающего белка (scRS/IRBP). Одна экспериментальная группа получала комплекс, названный hRSp4, который состоит из промотора RS1, кДНК RS1 человека с усеченным первым интроном, сайта полиаденилирования бета-глобина человека и инвертированных терминальных повторов AAV2 [82]. Наконец, в одном исследовании было две экспериментальные группы, в которых использовали, соответственно, укороченную версию специфического для биполярных клеток промотора mGluR6 (mini-mGluR6) и специфический для биполярных клеток ON мини-промотор человеческой ДНК Ple155 [34]. Из 20 экспериментальных групп в 15% использовали кДНК мышиного Rs1h, а в 85% - кДНК человеческого RS1.
В 14 из 21 экспериментальной группы (67%) генная добавка вводилась путем интравитреальной инъекции (IVI) (рис. 4В). В остальных использовалась субретинальная инъекция (SRI). Объем инъекции, как субретинальной, так и интравитреальной, составлял от 1 до 2µл (режим: 1 µл) (рис. 4C). Для IVI чаще всего использовалась игла 35 калибра - в 7 из 13 экспериментальных групп, указавших размер иглы (54%) (Дополнительная таблица S1). Для SRI наиболее популярным выбором был 33 калибр (три из семи экспериментальных групп; 42 %). Общее количество вируса варьировалось от 1 x 106 до 7,5 x 1010 векторных геномов на глаз (vg/глаз) (медиана = 4 x 109, мода = 2 [ 1010 vg/глаз) (рис. 4D). Возраст вмешательства был различным (5 дней (д) - 7 м постнатального возраста), но большинство включенных исследований выбрали временные точки до того, как животным исполнился один месяц (медиана = 3 н) (рис. 4E).
В большинстве исследований в качестве контроля использовался либо другой глаз животного (внутренний контроль), либо другие контрольные животные (внешний контроль). В одном исследовании было две экспериментальные группы: одна с внешним контролем, другая - с внутренним [82]. Из 20 экспериментальных групп 85% имели внутренний контроль. Из этих внутренних контролей в двух случаях проводились мнимые инъекции [17,71,84], а в остальных случаях проводилось прямое сравнение с не леченым глазом. В трех группах с внешним контролем контрольные животные получали мнимую инъекцию в один [55] или оба глаза [17]. Другую группу сравнивали с животным без лечения, у которого оба глаза не получали никакого лечения [82]. Как правило, контрольные инъекции состояли из транспортного средства [55,84], фосфатно-буферного солевого раствора (PBS) [71] или нуль-вектора, не содержащего кДНК [17].
В совокупности, предпочтительным методом инъекции был интравитреальный, наиболее часто используемый объем - 1 µл, наиболее распространенный возраст для инъекции - две недели, наиболее часто используемый титр - 4 [ 109 vg/глаз или выше, и наиболее распространенной контрольной группой был внутренний необработанный контроль.
3.1.4. Outcome Parameters and Timepoints
Во всех исследованиях сообщалось хотя бы об одном из следующих параметров исхода после AAV-опосредованной генной заместительной терапии: 3.1.4. Outcome Parameters and Timepoints (n = 14; 74%), OCT (n = 8; 42%), IHC (n = 13; 68%), SLO (n = 1; 5%) и/или поведенческие данные, связанные со зрением (n = 1; 5%). Данные SLO и поведенческие данные были представлены только в одном исследовании, поэтому они не были включены в мета-анализ, а анализировались качественно. Результаты ERG, OCT и IHC были представлены в трех и более исследованиях, поэтому их можно было включить в метаанализ. Эти показатели были представлены в разные сроки наблюдения - от двух недель до пятнадцати месяцев после инъекции (PI) (рис. 5). Сроки и диапазон параметров исхода для OCT составляли 12 недель (2 нед-15 м), для ERG - 2 месяца (4 нед-15 м), а для IHC - 12 недель (1 нед-15 м).
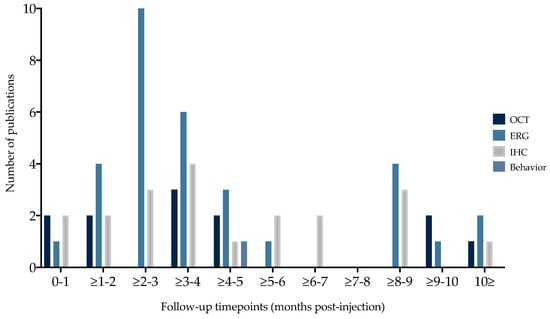 Figure 5. Follow-up time points per outcome parameter selected for in-depth analysis. Outcome parameters were reported at variable timepoints post-injection. Timing mode and range per outcome parameters were, respectively, OCT 12 weeks (2 w–15 m), ERG 2 months (4 w–15 m), and IHC 12 weeks (1 w–15 m). OCT = optical coherence tomography, ERG = electroretinography, IHC = immunohistochemistry. 3.1.5. Vision-Related Behavior
В одной из работ были описаны результаты выполнения поведенческих задач, связанных со зрением, после AAV-опосредованной генной аугментационной терапии [88]. В этом исследовании мыши через четыре месяца после лечения выполняли тест на плавание с визуальным управлением. Мышей помещали в водный лабиринт и оценивали их способность находить платформу. В темноте мыши с дефицитом Rs1h, которых лечили субретинально с помощью AAV2/4-CMV-RS1, находили платформу значительно быстрее, чем контрольные особи без лечения. Интравитреально обработанные мыши не показали значительных результатов по сравнению с контрольными. В условиях освещения не было обнаружено различий между животными дикого типа (WT), нелеченными и леченными [88].
3.1.6. Morphological Read-Outs
Optical Coherence Tomography
В восьми (42 %) из включенных исследований для оценки эффективности лечения использовалась OCT [17,34,54,75,76,85,86,88]. В одной работе были представлены данные OCT после лечения AAV5-mOP-hRS1, и было показано структурное улучшение в глазах, прошедших лечение, через шесть месяцев после начала лечения [77].
На основании данных OCT в исследованиях сообщалось о влиянии генотерапии, опосредованной AAV, на формирование полостей (100%), целостность ламинарного слоя (89%) и толщину сетчатки (50%). Большинство исследований не давали количественной оценки этих параметров, а также демонстрировали только репрезентативные изображения одного животного, что исключает возможность количественного сравнения. Тем не менее, в большинстве исследований сообщалось об уменьшении количества и размера полостей, увеличении или сохранении целостности и ламинированности сетчатки, а также общей толщины сетчатки после лечения с помощью AAV-опосредованной генной аугментации. Эти данные суммированы по экспериментальным группам в Таблице 3. Сроки проведения измерений результатов OCT варьировали от 2 недель до 15 месяцев (медиана = 14 нед). В целом, терапия с использованием AAV-опосредованной генной аугментации уменьшила размер и количество полостей шизиса, улучшила организацию и ламинирование сетчатки, а также увеличила ее толщину.
Таблица 3. Исследования, в которых были представлены данные OCT после адено-ассоциированного вирусного вектора (AAV), опосредованной генной аугментационной терапии в моделях Rs1-дефицитных мышей. Исследования разделены по экспериментальным группам и обозначены как "Год публикации первого автора", затем следует короткий идентификатор для различения нескольких экспериментальных групп. В одном случае OCT изображения были получены через 15 месяцев после инъекции, к этому времени полости у не леченых контрольных мышей уже исчезли. Таким образом, этот параметр неприменим (N/A). 1E6-2.5E9 = титры от 106 до 2. 5 Ч 109; d = дни после инъекции; shH10 = подтип AAV, полученный из AAV6; CAG = промоторный элемент, состоящий из раннего энхансера цитомегаловируса, сплайс-адаптера бета-глобина кролика, а также промотора, первого интрона и экзона куриного бета-актина; rho = родопсин; IVI = интравитреальная инъекция; SRI = субретинальная инъекция; = человеческий ДНК-минипромотор, специфичный для биполярных клеток ON; d = дни; w = недели; m = месяцы; N/A = не применимо; NR = не сообщается.
Immunohistochemistry
В 13 (68%) из включенных исследований были получены результаты IHC после AAV-опосредованной генной аугментационной терапии, из которых 100% подтвердили успешную доставку трансгена путем иммуноокрашивания RS1 [17,34,54,76-88]. Другие оцениваемые результаты были различными и перечислены в Таблице 4 вместе с медианными временными точками результатов. Другие результаты, оцениваемые с помощью IHC, включали целостность ламинарного слоя, наличие полостей, изменение микроглиальных клеток или клеток Müller, а также патологию синапсов. Все они были представлены в одном или двух исследованиях, и поэтому не могут быть подвергнуты метаанализу.
Таблица 4. Список исходов после адено-ассоциированной (AAV)-опосредованной генной терапии, оцененных с помощью иммуногистохимии (IHC). Исследованиям был присвоен идентификатор исследования, отформатированный как First-Author Publication year. Во всех исследованиях, в которых приводились данные ИГХ после AAV-опосредованной генной аугментационной терапии, наблюдалось иммуноокрашивание доставленного трансгена. Ламинирование, количество клеток ОНЛ, изменения в микроглиальных клетках и клетках Мёллера рассматривались в двух работах. ONL = наружный ядерный слой, d = дни после инъекции, w = недели после инъекции, m = месяцы после инъекции.
3.1.7. Electroretinography
В 14 из 19 (74 %) включенных исследований были представлены результаты ERG после AAV-опосредованной генной аугментации [34,54,55,71,77-88]. В 4 из этих 13 исследований была представлена только форма волны ERG репрезентативных животных без количественного определения средней амплитуды a- или b-волны или соотношения b/a [71,79,81,83]. В другом исследовании были представлены данные ERG для кроликов WT без Rs1h-дефицита, но не для пораженных Rs1h-KO мышей, и, следовательно, не был показан эффект лечения [55]. Одно исследование было исключено из мета-анализа, поскольку стандартное отклонение не могло быть получено из представленных данных [34]. Остальные восемь исследований были включены в мета-анализ. Экспериментальные данные по всем группам, включенным в мета-анализ, представлены в Дополнительной таблице S2.
A-Wave Amplitude
В метаанализ амплитуды а-волны были включены четыре исследования, описывающие 13 экспериментальных групп [77,85,87,88]. (Рисунок 6). Входные параметры для каждой экспериментальной группы представлены в Дополнительной таблице S2. Размер групп варьировал от 4 до 29 (медиана n = 24) глаз для групп лечения и от 12 до 38 (медиана n = 29 глаз) для контрольных групп. Контролем служил не леченый глаз во всех экспериментальных группах, кроме двух, где в качестве контроля использовались отдельные не леченые животные [87]. SMD и 95% доверительный интервал (CI) были рассчитаны для каждой экспериментальной группы, а общий размер эффекта был проанализирован с помощью модели случайных эффектов. Тест Хи-квадрат на однородность выявил низкую межстадийную неоднородность (p = 0,19, I2 = 17,7%). В целом, AAV-опосредованная генная терапия привела к статистически значимому умеренному увеличению амплитуды a-волны у Rs1h-дефицитных мышей (0,75 [0,56, 0,94]). Высокий или низкий титр не оказал существенного влияния на общий размер эффекта в подгруппах (0,79 против 0,67, p-value = 0,56). Анализ подгрупп по модели мыши, способу введения, возрасту при инъекции и срокам наблюдения не проводился, так как в этих подгруппах было бы менее трех групп.
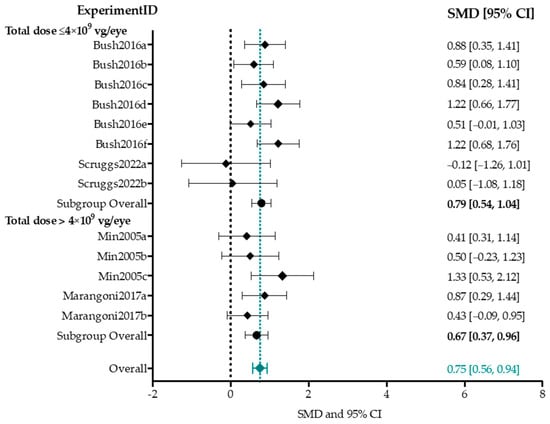 Figure 6. The overall effect size of adeno-associated viral vector (AAV)-mediated gene augmentation therapy on a-wave amplitudes with integrated dosage subgroup analysis. The studies included in this meta-analysis were assigned study IDs according to First Author Publication year, and experimental groups within one publication are distinguished by labeling them a through z. The studies included in this meta-analysis were Bush2016 [85], Scruggs2022 [88], Min2005 [77], and Marangoni2017 [87]. The results are staggered per subgroup (total dose smaller than 4 Ч 109 viral genomes/eye (vg/eye) and larger than 4 Ч 109 vg/eye). The black circles represent the overall subgroup effect size, and the green diamond represents the overall weighted effect size. The black dashed line indicates the null effect. The left side of the null effect line favors the control, whereas the right side of the null effect line favors treatment. The overall effect size (0.75 [0.56, 0.94]) was computed with a random effects model and is represented by a green diamond and dashed line. Included studies were assessed for homogeneity with a Chi-square test and were not found to be highly heterogeneous (I2 = 17.1%). SMD = standardized mean difference, CI = confidence interval.
B-Wave Amplitude
Из 13 исследований, в которых были представлены данные ERG, в 7 исследованиях, описывающих 37 экспериментальных групп, были представлены усредненные амплитуды b-волн у мышей, получавших лечение, и контрольных групп [54,77,78,80,85,87,88]. Различные параметры для каждой экспериментальной группы перечислены в Дополнительной таблице S2. Размер групп варьировал от 5 до 29 глаз (медиана n = 5) для групп лечения и от 5 до 29 глаз (медиана n = 8) для контрольных групп. Контролем служил не леченый глаз во всех экспериментальных группах, кроме двух, где в качестве контроля использовались отдельные нелеченые животные [87]. Включенные исследования были крайне неоднородны; тест на однородность (Хи-квадрат, p-значение менее 0,001) дал статистику I2 76,5%. Из-за высокой гетерогенности данный мета-анализ и последующие анализы подгрупп служат только для ориентировочных целей. В целом, AAV-опосредованное увеличение генов оказало значительное положительное влияние на амплитуду b-волн (1,44 [1,11, 1,77], p-value менее 0,001) (рис. 7).
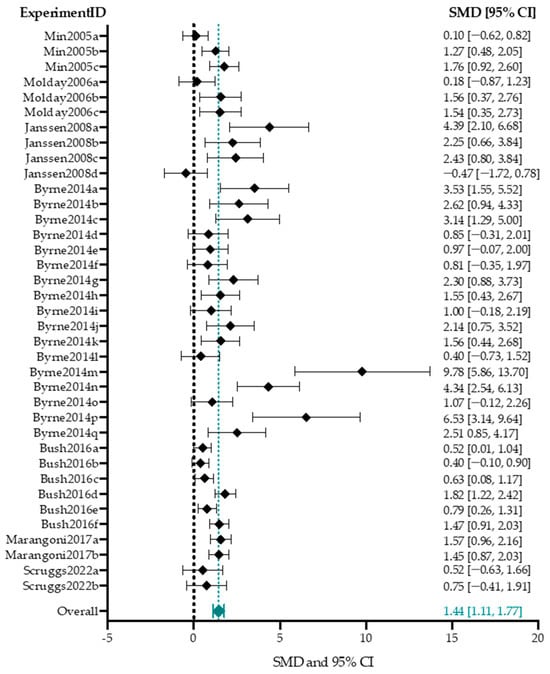 Figure 7. The overall weighted effect size of adeno-associated viral vector (AAV)-mediated gene augmentation therapy on the b-wave amplitude. The studies included in this meta-analysis were assigned study IDs according to First Author Publication year, and experimental groups within one publication are distinguished by labeling them a through z. The studies included in this analysis were Min2005 [77], Molday2006 [78], Janssen2008 [80], Byrne2014 [54], Bush2016 [85], Marangoni2017 [87], and Scruggs2022 [88]. The standardized mean differences (SMDs) with 95% confidence intervals (CI) of each experimental group are displayed in a forest plot. The dashed black line represents no treatment effect. Values left of the null effect line favor control, whereas values right of the null effect line favors treatment. The overall effect size (1.44 [1.11, 1.77]) was computed with a random-effects model and is represented by a green diamond and dashed line. Included studies were assessed for homogeneity with a Chi-square test and were found to be highly heterogeneous (I2 = 76.5%).
Subgroup Analysis b-Wave Amplitude
Чтобы оценить потенциальную связь общего размера эффекта амплитуды b-волны с различными экспериментальными условиями, сравнивали размеры эффектов в нескольких подгруппах. Мы оценивали влияние модели мыши (мышь Rs1h-KO или мышь Rs1h-/y), метода введения (IVI или SRI), низкого (общая доза менее 4 x 10 9 геномов вектора на глаз) или высокого (общая доза более 4 x 10 9 геномов вектора на глаз) титра, возраста при инъекции (до или после трехнедельного возраста) и времени наблюдения (до или после двух месяцев PI) (Рисунок 8). Другие параметры исследования приводили к образованию подгрупп, меньших трех групп, и поэтому не проводились.
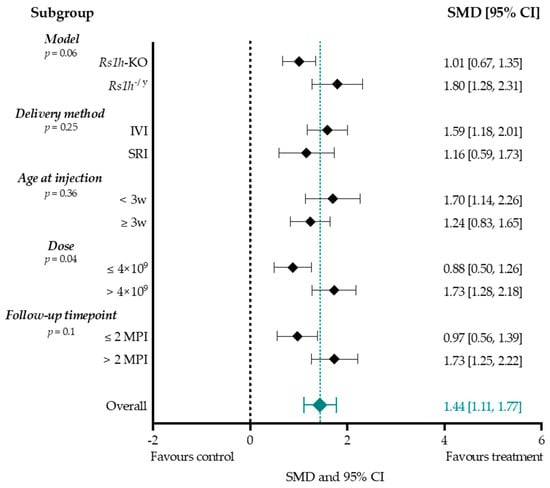 Figure 8. The effect sizes of adeno-associated viral vector (AAV)-mediated gene augmentation therapy on the b-wave amplitude for subgroups mouse model, delivery method, dose, age at injection, and follow-up time point. The black dashed line indicates the null effect. Values left of the null effect line favor the control, whereas values right of the null effect line favor the treatment. The overall effect size (1.44 [1.11, 1.77]) was computed with a random-effects model and is represented by a green diamond and dashed line. The between-study heterogeneity was high (I2 = 76.5%), and therefore these subgroup analyses serve for orientational purposes only. Rs1h = retinoschisin, KO = knock-out, IVI = intravitreal injection, SRI = subretinal injection, M = months of age, MPI = months post-injection, SMD = standardized mean difference, CI = confidence interval.
Между двумя вышеупомянутыми моделями мышей экспериментальные группы Rs1h-/y достигли большего эффекта лечения после AAV-опосредованного увеличения генов по сравнению с Rs1h-KO (1,80 против 1,01). Более того, время последующих измерений показало наибольший размер эффекта через два месяца после PI по сравнению с более ранними сроками (1,73 против 0,97). Инъекции до 3 недель постнатального периода несколько увеличивали размер эффекта (1,70 против 1,24). Титры выше 4 x 109 увеличивали общий размер эффекта в подгруппах (1,73 против 0,88), а корреляция между размером эффекта амплитуды b-волны и дозой была значимой при мета-регрессии (p-value менее 0,05). Метарегрессия не выявила статистически значимой корреляции между величиной эффекта амплитуды b-волны и моделью (p-value = 0,06), возрастом на момент инъекции (p-value = 0,36), сроком наблюдения (p-value = 0,1) или способом доставки (p-value = 0,25).
B/a-Wave Amplitude Ratio
Для определения b/a-отношения были включены три исследования, описывающие десять экспериментов [82,85,87] (рис. 9). Исходные параметры для каждой экспериментальной группы приведены в Дополнительной таблице S2. Размер групп варьировал от 5 до 29 (медиана n = 25 глаз) для групп лечения и от 5 до 38 (медиана n = 34 глаза) для контрольных групп. Неоднородность между исследованиями была очень высокой (Chi-square, I2 = 90,7%).
.
 Figure 9. The overall weighted effect size of AAV-mediated gene augmentation therapy on the ratio between the b- and a-wave amplitudes (b/a-ratio). The studies included in this meta-analysis were assigned study IDs according to First Author Publication year, and experimental groups within one publication are distinguished by labeling them a through z. The studies included in this analysis were Bush2016 [85], Park2009 [82], and Marangoni2017 [87]. The results are staggered per subgroup (total dose smaller than 4 Ч 109 viral genomes/eye (vg/eye) and larger than 4 Ч 109 vg/eye). The black circles represent the overall subgroup effect size, and the green diamond represents the overall weighted effect size. The black dashed line indicates the null effect. Values left of the null effect line favor control, whereas values right of the null effect line favors treatment. The overall effect size (1.08 [0.42, 1.74]) was computed with a random-effects model and is represented by a green diamond and dashed line. The black circles indicate the overall subgroup effect size. A Chi-square test of homogeneity revealed high levels of between-study heterogeneity (I2 = 90.7%). SMD = standardized mean difference, CI = confidence interval.
В целом AAV-опосредованная генотерапия значительно улучшила соотношение b/a в моделях Rs1h-дефицитных мышей (1,08 [0,42, 1,74], p-value менее 0,001). Чтобы оценить влияние дозы вектора (низкая; менее 4 х 10 9 vg/глаз или высокая; более 4 x 10 9 vg/глаз) на эффективность лечения, был проведен анализ подгрупп и мета-регрессия. Высокий титр увеличивал общий размер эффекта в подгруппах, но мета-регрессия не выявила статистически значимой корреляции (1,49 против 0,87, p-value = 0,09). Анализ подгрупп по способу родоразрешения, возрастной группе и сроку наблюдения не проводился, так как в этих подгруппах было менее трех экспериментальных групп...
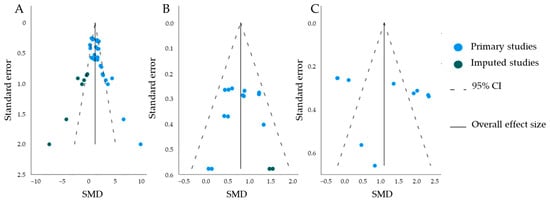 Figure 10. The funnel plots of the meta-analyzed studies. The blue dots indicate standardized mean differences (SMD) of primary studies; the green dots indicate missing studies. The black lines indicate overall effect size, and the dashed lines indicate the 95% confidence intervals (CI). (A) The funnel plot for b-wave amplitude. A trim-and-fill analysis predicted missing studies. (B) The funnel plot for a-wave amplitude. A trim-and-fill analysis predicted missing studies. (C) The funnel plot for the ratio between the b- and a-wave amplitudes (b/a-ratio). Trim-and-fill analysis predicted no missing studies.
3.2.1. Use of Alternative Delivery and Non-Viral Methods for X-Linked Juvenile Retinoschisis
...
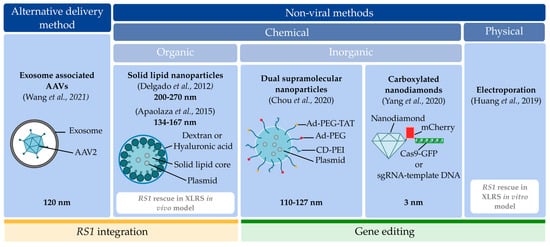 Figure 11. The classification of alternative delivery and non-viral delivery methods. The first classification is alternative delivery and non-viral delivery methods. In the former, the exosome-associated adeno-assiocated viral vectors (AAVs) are classified [93]. Within the non-viral methods category, a second classification can be made: chemical and physical methods. The physical methods contain the electroporation method [58], while the chemical methods can be divided into organic (solid lipid nanoparticles [63,95]) or inorganic (dual supramolecules nanoparticles [96] and carboxylated nanodiamonds [97]) vectors. In each category, a schematic representation of the vectors used for RS1 or gene editing constructs delivery is included to illustrate the building blocks used in each vector. Dual supramolecular nanoparticle and carboxylated nanodiamond representations have been adapted from Chou et al. and Yang et al., respectively [96,97]. Outlined with a yellow line are the studies designed for gene augmentation, whereas those designed for gene editing are marked with a green line. XLRS = X-linked juvenile retinoschisis, RS1 = retinoschisin, ad = adamantane-grafted, PEG = polyethylene glycol, TAT = adenosine-5’-rp-alpha-thio-triphosphate, CD-PEI = carbon dot-polyethylenimine, GFP = green fluorescent protein, sgRNA = single guide RNA.
Обзор характеристик исследований представлен в таблице 5.
Таблица 5. Характеристики исследований альтернативных методов доставки и не-вирусных методов интеграции и редактирования RS1, протестированных in vitro. Были выделены характеристики, касающиеся дизайна исследования, клеточной модели, использованной для оптимизации, состава вектора и промотора. Исследования, в которых использовались различные стратегии, были разделены на отдельные экспериментальные группы. RS1 = ретиношизин, SLN = твердая липидная наночастица, exo-AAV = экзосома-ассоциированный AAV, cNDs = карбоксилированные наноалмазы, CRISPR = Clustered Regularly Interspaced Palindromic Repeats, SMNP = супрамолекулярные наночастицы, C = цитозин, T = тимин, KO = нокаут, KI = knock-in, CEP4 = вектор, включающий промотор CMV и маркер устойчивости к гигромицину, CMV = цитомегаловирус, CAG = комплекс, состоящий из раннего энхансера CMV (C), промотора куриного бета-актина, первого интрона и первого экзона (A) и сплайс-адаптера кроличьего бета-глобина (G); GFP = зеленый флуоресцентный белок, Zsgreen = Zoanthus sp. зеленый, sgRNA = одиночная направляющая РНК, AAV = адено-ассоциированный вирусный вектор, U6 = промотор РНК-полимеразы III типа, pRS1HR-gRNA = плазмида, включающая 950-bp шаблон репарации RS1 и кассету экспрессии gRNA. Figure 11. The classification of alternative delivery and non-viral delivery methods. The first classification is alternative delivery and non-viral delivery methods. In the former, the exosome-associated adeno-assiocated viral vectors (AAVs) are classified [93]. Within the non-viral methods category, a second classification can be made: chemical and physical methods. The physical methods contain the electroporation method [58], while the chemical methods can be divided into organic (solid lipid nanoparticles [63,95]) or inorganic (dual supramolecules nanoparticles [96] and carboxylated nanodiamonds [97]) vectors. In each category, a schematic representation of the vectors used for RS1 or gene editing constructs delivery is included to illustrate the building blocks used in each vector. Dual supramolecular nanoparticle and carboxylated nanodiamond representations have been adapted from Chou et al. and Yang et al., respectively [96,97]. Outlined with a yellow line are the studies designed for gene augmentation, whereas those designed for gene editing are marked with a green line. XLRS = X-linked juvenile retinoschisis, RS1 = retinoschisin, ad = adamantane-grafted, PEG = polyethylene glycol, TAT = adenosine-5’-rp-alpha-thio-triphosphate, CD-PEI = carbon dot-polyethylenimine, GFP = green fluorescent protein, sgRNA = single guide RNA.
Обзор характеристик исследований представлен в таблице 5.
Таблица 5. Характеристики исследований альтернативных методов доставки и не-вирусных методов интеграции и редактирования RS1, протестированных in vitro. Были выделены характеристики, касающиеся дизайна исследования, клеточной модели, использованной для оптимизации, состава вектора и промотора. Исследования, в которых использовались различные стратегии, были разделены на отдельные экспериментальные группы. RS1 = ретиношизин, SLN = твердая липидная наночастица, exo-AAV = экзосома-ассоциированный AAV, cNDs = карбоксилированные наноалмазы, CRISPR = Clustered Regularly Interspaced Palindromic Repeats, SMNP = супрамолекулярные наночастицы, C = цитозин, T = тимин, KO = нокаут, KI = knock-in, CEP4 = вектор, включающий промотор CMV и маркер устойчивости к гигромицину, CMV = цитомегаловирус, CAG = комплекс, состоящий из раннего энхансера CMV (C), промотора куриного бета-актина, первого интрона и первого экзона (A) и сплайс-адаптера кроличьего бета-глобина (G); GFP = зеленый флуоресцентный белок, Zsgreen = Zoanthus sp. зеленый, sgRNA = одиночная направляющая РНК, AAV = адено-ассоциированный вирусный вектор, U6 = промотор РНК-полимеразы III типа, pRS1HR-gRNA = плазмида, включающая 950-bp шаблон репарации RS1 и кассету экспрессии gRNA.
Эти альтернативные и не-вирусные методы доставки использовались для осуществления интеграции RS1 или редактирования RS1. В трех исследованиях использовались стратегии интеграции RS1 [63,93,95], а в трех других - редактирование гена RS1 с помощью CRISPR/Cas9 [58,96,97].
В двух из шести исследований на модели RS1-дефицита изучалось спасение RS1 in vivo с помощью увеличения генов [63] и in vitro с помощью редактирования генов [58] с использованием не-вирусного метода. В остальных четырех исследованиях оценивалось успешное спасение RS1 в моделях без RS1-дефицита [93,95-97]. В частности, в них оценивалось, как альтернативные и не-вирусные методы доставки повышают эффективность трансдукции RS1 в сетчатке глаз, предоставляя доказательства концепции этих методов доставки для воздействия на RS1.
3.2.2. In-Depth Analysis of Exo-Adeno-Associated Viral Vector Delivery and Non-Viral Delivery Methods for Retinoschisin Integration
...
Table 6. Study characteristics of non-viral methods evaluated in rodents. Characteristics regarding the species and strain used, delivery methods, strategy, administration route, follow-up timepoints after injection, persisting GFP expression over time, and controls were extracted. SLN = solid lipid nanoparticle, exo-AAV = exosome-associated adeno-associated viral vector, cND = carboxylated nanodiamond, SMNP = supramolecular nanoparticle, KO = knock-out, C = cytosine, T = thymine, KI = knock-in, GFP = green fluorescent protein, RS1 = retinoschisin, Rs1h = rodent homolog for RS1, IVI = intravitreal injection, SRI = subretinal injection, h = hours, w = weeks, m = months, d = days, NR = not reported.
Non-Viral Chemical Methods
...
3.2.3. In Depth Analysis of Non-Viral Delivery Methods to Perform Gene Editing
...
Non-Viral Physical Method
...
Non-Viral Physical Method
3.2.4. In Vitro Readouts
Table 8. List of readouts performed in in vitro studies using retinoschisin (RS1) editing strategy to evaluate correction efficiency. All studies that edited RS1 evaluated the transfection efficiency and the RS1 editing using the following readouts: % GFP-positive cells, GFP and RS1 visualization, cell viability, PCR and Sanger sequencing. GFP = green fluorescent protein, PCR = polymerase chain reaction, qPCR = quantitative PCR, ddPCR = digital droplet PCR, h = hours, d = days, NR = not reported.
3.2.5. In Vivo Readouts
Таблица 9. Список результатовperformed in in vivo studies using retinoschisin (RS1) integration strategy. The following readouts were used in order to evaluate transfection efficiency and RS1 integration: GFP and RS1 visualization, structural organization, PR loss, presence of schisis, retinal thickness, ONL thickness, mRNA and protein expression levels. GFP = green fluorescent protein, IHC = immunohistochemistry, PR = photoreceptors, ONL = outer nuclear layer, w = weeks, m = months, NR = not reported.
Table 10. List of readouts performed in in vivo studies using retinoschisin (RS1) editing strategy. The following readouts were used in order to evaluate transfection efficiency and RS1 editing: GFP and RS1 visualization, retinal structure, genome editing efficiency, retinal thickness, inner/outer segments (IS/OS) thickness. GFP = green fluorescent protein, IHC = immunohistochemistry, OCT = optical coherence tomography, SLO = scanning laser ophthalmoscopy, H&E = haematoxylin and eosin, PR = photoreceptors, ONL = outer nuclear layer, w = weeks, m = months, NR = not reported.
4. Discussion
В данном систематическом обзоре были систематически рассмотрены и (мета-)проанализированы 19 исследований, в которых проводилась AAV-опосредованная генотерапия на моделях грызунов с Rs1h-дефицитом. Наиболее используемый вектор, AAV8-scRS/IRPB-hRS, был запатентован (US10350306B2) и в настоящее время находится в клиническом испытании (ClinicalTrials.gov: NCT02317887), как и rAAV2tYF-CB-hRS1 (ClinicalTrials.gov: NCT02416622) [68,102,103]. Кроме того, был проведен качественный анализ шести исследований, в которых тестировались новые альтернативные и не-вирусные методы доставки RS1 в качестве доказательства концепции. Хотя клинические испытания этих методов в настоящее время не проводились, экзо-AAV2-ZsGreen был запатентован (CN111500634B).
4.1. The Preferred Practices of In Vivo Study Characteristics
В большинстве проанализированных исследований использовались молодые мыши-самцы, что соответствует клинической значимости. Мы выявили одно исследование, в котором использовались самцы и самки мышей, и ни одно, в котором использовались мыши в возрасте (18-24 месяца). Использовались четыре различные модели животных с Rs1h-дефицитом. Наиболее предпочтительной была модель Rs1h-KO [71], за ней следовала модель Rs1h-/y [70]. В целом эти мыши демонстрировали сходные фенотипы заболевания [104]. Наиболее часто тестируемый вектор, AAV8-scRS/IRPB-hRS, был единственным вектором, оцененным как на крысах, так и на мышах. Однако, поскольку обе модели крыс были разработаны совсем недавно (2022 г.), можно ожидать, что больше векторов получат дальнейшие испытания на моделях крыс.
4.2. In Vivo Study Quality Assessment Reveals Insufficient Self-Reporting
Для оценки качества проанализированных исследований in vivo AAV было проведено несколько тестов и анализов. Инструмент SYRCLE для оценки качества и риска предвзятости выявил неясный риск предвзятости для большинства категорий из-за недостаточной отчетности о применяемых методиках. Как следствие, это затрудняет точную оценку результатов, полученных в этих мета-анализах. Кроме того, различия в качестве исследований могут вносить неоднородность в наши мета-анализы. Для подмножества исследований, включенных в метаанализ амплитуды a- и b-волн, имело место смещение публикаций, что было показано с помощью анализов trim-and-fill и регрессионных тестов Эггера. В частности, воронкообразная диаграмма величины эффекта амплитуды b-волны была очень асимметричной. Часто это связано с занижением отрицательных или статистически незначимых результатов, что искажает результаты общего анализа величины эффекта и, возможно, указывает на возможную причину ограничения трансляционных возможностей.
Различия в контрольных группах могут вносить свой вклад в межстадийную неоднородность. Большинство экспериментальных групп были под внутренним контролем. Большинство контрольных глаз или контрольных групп не подвергались лечению. Однако сама травма (субретинальная) инъекция может оказывать трофическое воздействие на сетчатку [105], поэтому рекомендуется проводить мнимые контрольные инъекции.
4.3. In Vivo Qualitative Analysis Shows Variability in Outcome Parameters
В восьми из проанализированных исследований успешность влияния AAV-опосредованной генной аугментационной терапии на морфологию сетчатки оценивалась с помощью OCT Среди исследований, в которых были представлены данные OCT в большинстве случаев указывались одни и те же параметры (уменьшение полости, толщина сетчатки, целостность ламинирования). Однако из восьми исследований, описывающих 18 экспериментальных групп, представивших данные OCT большинство сообщали об успехе лечения без количественной оценки, демонстрируя лишь визуальное подтверждение уменьшения полостей на репрезентативных изображениях. Это исключает возможность прямого сравнения успешности лечения.
Хотя полости шизиса являются отличительной чертой XLRS, не во всех исследованиях проводился тест на образование полостей. В одном случае, хотя животных лечили в раннем возрасте (P14), успешность лечения оценивали только в возрасте 14 месяцев, когда полости, как правило, уже исчезли у не леченых животных [79]. В других случаях влияние лечения на структуру сетчатки исследовали с помощью IHC. Визуализация in vivo целостности сетчатки и наличия полостей предпочтительнее для выводов о целостности сетчатки по результатам посмертного IHC. В конце концов, OCT изображение неинвазивно и не может привнести повреждение тканей или артефакты с помощью самого метода. Процесс секционирования ткани может внести дополнительные повреждения в и без того хрупкую сетчатку, ложно усугубив дезорганизацию слоев сетчатки. В идеале необходимо проводить и сравнивать обе методики, поскольку каждая из них может дать уникальную информацию. Kjellstrom et al. продемонстрировали необходимость подтверждения доставки трансгена с помощью IHC. У семи инъецированных животных наблюдался большой разброс результатов. Посмертное IHC-окрашивание RS1 показало, что у животных с меньшим количеством или отсутствием спасения присутствие белка RS1 в сетчатке было меньшим или отсутствовало [79]. Таким образом, для правильной интерпретации (неоднозначных) результатов необходимо проверять и сообщать об успешности технического лечения путем подтверждения экспрессии экзогенного RS1.
4.4. Effect-Size Analyses Show a Significant Effect of Adeno-Associated Viral Vector-Mediated Gene Therapy on a- and b-Wave Amplitudes, and b/a-Ratio
Мета-анализ подтвердил эффективность AAV-опосредованной генотерапии на амплитуды b-волн ERG (1,44 [1,11, 1,77]), a-волн (0,75 [0,56, 0,94]) и b/a-отношение (1,08 [0,42, 1,74]). Однако неоднородность между исследованиями, включенных по амплитуде b-волны и соотношению b/a была высокой (I2, соответственно, составил 76,5% и 90,7%). Этого следовало ожидать, поскольку мы включали различные модели животных, векторы генотерапии, возраст вмешательства и сроки наблюдения. Тем не менее, из-за высокой гетерогенности эти анализы и последующие анализы подгрупп предназначены для ориентировочных целей.
4.4.1. Higher Titers Increase Therapy Effect on b-Wave Amplitude
Чтобы понять возможное влияние характеристик исследования на эффективность лечения, было проведено несколько анализов подгрупп. Во всех трех мета-анализах был проведен анализ подгрупп по дозе. Титры выше 4 х 109 vg/глаз положительно влияли на величину эффекта в подгруппах во всех анализах, но метарегрессия показала, что это было статистически значимо только для амплитуды b-волны.
4.4.2. Considerations When Choosing a Delivery Method
При воздействии на наружную сетчатку чаще всего выбирают метод доставки SRI. Вероятно, именно поэтому в первых нескольких исследованиях, посвященных попыткам AAV-опосредованного введения генов в модели XLRS, использовался SRI [71,77,78]. Интересно, что сетчатка Rs1h-дефицитной мыши особенно хорошо подходит для интравитреальной доставки вектора, направленного на внешнюю сетчатку, возможно, из-за дезорганизованного состояния Rs1h-дефицитной сетчатки, что обеспечивает более легкую диффузию по сетчатке [82]. Кроме того, процесс SRI в уже хрупкой сетчатке может вызвать множество осложнений, таких как отслойка сетчатки, кровотечение, воспаление и утечка вектора [77,106]. Таким образом, SRI стала методом выбора в животных моделях XLRS, о чем свидетельствуют 14 из 19 включенных исследований, в которых использовалась SRI. В данном мета-анализе амплитуда b-волны была единственным параметром, по которому можно было провести анализ подгрупп по методу доставки. Хотя введение SRI привело к более высокой величине эффекта в подгруппах, мета-регрессия не выявила значимых различий. Более высокая величина эффекта IVI может быть также объяснена характером метода, поскольку SRI, в отличие от IVI, воздействует локально, а ERG-ответы регистрируются в полном поле.
Тем не менее, неудача IVI в клинических испытаниях на людях потребовала переоценки этого метода доставки, в том числе потому, что IVI, как представляется, в целом безопасна и эффективна у людей [107]. В одном из исследований было проведено прямое сравнение доставки вектора AAV2/4-CMV-hRS1 мышам Rs1h-KO с помощью IVI и SRI, и было установлено, что SRI привела к лучшему спасению по всем измеренным параметрам [88]. На самом деле, IVI-доставка не смогла трансфицировать ONL, тогда как SRI - смогла [88]. Еще одним преимуществом SRI перед IVI является то, что SRI вызывает меньшую иммуногенность, чем IVI, и более эффективно воздействует на PRs - основную клеточную популяцию, представляющую интерес при XLRS [108].
4.4.3. Considerations When Choosing an Intervention Ag
У пациентов с XLRS симптомы часто проявляются в очень раннем возрасте, и на момент обращения за медицинской помощью у них, скорее всего, уже имеется значительная степень патологии [4]. Идеальная терапия должна предотвращать развитие заболевания или излечивать его, когда симптомы уже проявились. Во многих исследованиях наибольшее улучшение в формировании полостей было достигнуто при введении вектора молодым щенкам. Инъекция в возрасте P15 привела к значительному и прогрессивному улучшению скотопической и фотопической функции сетчатки и морфологии для AAV5-mOP-hRS1 [77,80], AAV2/2-CMV-Rs1h [79] и AAV8-scRS/IRBP-hRS [17]. Аналогично, у крыс профилактическое применение AAV8-scRS/IRBP-hRS в возрасте P7 было эффективно для уменьшения образования полостей на OCT[76]. Было показано, что вмешательство в ранние сроки имеет долгосрочный эффект, так как однократная инъекция в возрасте двух недель вектора AAV(2/2)-CMV-Rs1h эффективно снижала фенотипические проявления заболевания до 14 месяцев [79].
Векторы также были протестированы в более поздние сроки и применялись в возрасте одного месяца или позже, когда патология была хорошо развита. Инъекция AAV8-scRS/IRBP-hRS в возрасте P30 предотвратила образование полостей и потерю ламинирования, но не истончение ONL [83]. Введение AAV2/4-CMV-RS1 между P60 и P90 приводило к исчезновению полостей через две недели и функциональному улучшению через 50-60 дней [88]. В двух проанализированных исследованиях непосредственно проверялись и сравнивались несколько временных точек вмешательства. Сравнение инъекций в P14 и P30 показало, что восстановление амплитуды скотопической b-волны в 4 месяца PI было ниже у животных, которым вводили на ст. P30, для всех тестируемых векторов (AAV7m8-rho-hRS1 и AAVshH10-CAG-hRS1) [54]. Аналогичным образом, AAV5-mOP-hRS1 использовали для лечения мышей в возрасте P15, 1, 2 и 7 месяцев, что показало, что эффективность лечения снижается с увеличением возраста вмешательства [80]. Однако введение препарата в возрасте 2 месяцев все еще способно значительно улучшить функцию сетчатки [80]. Таким образом, несмотря на то, что более ранний возраст вмешательства, по-видимому, дает более выраженный эффект, в более старшем возрасте эффект лечения все еще сохраняется.
Важно учитывать, что пик экспрессии генов, доставленных AAV, приходится на 4-6 недель после инъекции [109]. Поскольку пик апоптотических явлений в ONL приходится на P18 [110], а экспрессия экзогенного гена RS1 наблюдалась уже в семь дней PI [17], а белка RS1 - в две недели PI [77], введение препарата на P15 может оказаться слишком поздним для предотвращения гибели клеток в ONL. Кроме того, при выборе временного окна для вмешательства необходимо учитывать видовые различия в развитии заболевания.
4.4.4. Treatment Effect Size Was Increased When Evaluated at Two Months or Later
В целом, эффект лечения не сразу проявлялся на ERG или OCT даже если экзогенный белок присутствовал в сетчатке уже в две недели PI. В двух исследованиях амплитуды ERG не имели существенных различий между леченными и не леченными глазами в течение одного месяца PI при введении препарата в возрасте P15. Через два и три месяца после начала лечения форма волны ERG в обработанных глазах заметно улучшилась, причем улучшение амплитуды достигло пика в три месяца и сохранялось до пяти месяцев после начала лечения [77,78]. Это свидетельствует о задержке влияния лечения на функцию сетчатки. Очевидно, что восстановление выработки белка RS1 не сразу приводит к функциональному эффекту на поверхности клеток. В соответствии с этими данными, величина эффекта положительно сказывалась, когда амплитуды b-волн оценивались через два месяца после начала лечения или позже. Однако улучшение размера и количества полостей было описано уже через две недели после начала эксперимента [88], что указывает на то, что для функционального улучшения может потребоваться исчезновение полостей.
4.5. Discrepancies between Structural and Functional Readouts
Фенотип заболевания при XLRS можно разделить на две категории: структурную и функциональную. Идеальная терапия позволяет устранить образование полостей, защитить целостность ламинирования, предотвратить деградацию ONL и восстановить функцию сетчатки. Мы обнаружили, что улучшение структуры не всегда гарантирует восстановление функции. Введение взрослого вектора в возрасте 13 недель позволило восстановить экспрессию RS1, восстановить форму волны ERG и улучшить скотопическую b-волну к возрасту 6 месяцев, но не привело к улучшению морфологии сетчатки или выживаемости фоторецепторов [71].
4.6. Adeno-Associated Viral Vector Immunogenicity Considerations
Некоторые испытания на безопасность и переносимость были проведены для подгруппы включенных AAV-опосредованных методов лечения генной аугментации. Безопасность и переносимость были проверены для AAV8-hRS/IRBP-hRS1 у мышей Rs1h-KO и кроликов WT [55,111], а также для AAV2tYF-CB-hRS1 у мышей Rs1h-/y [84]. Оба метода лечения хорошо переносились, присутствие вектора ограничивалось инъецированным глазом, и никаких побочных эффектов, кроме незначительного повышения иммунной активации, не наблюдалось. В случае AAV8-hRS/IRBP-hRS1 воспаление стекловидного тела наблюдалось в обработанном глазу кроликов WT через две недели после лечения, его продолжительность была пропорциональна дозе вектора, но оно прошло в течение трех месяцев и не привело к необратимому повреждению тканей [55,111]. Было показано, что капсид AAV8, но не кДНК RS1, которая была доставлена, вызывала такие иммунные реакции у кроликов [55].
Хотя AAV в целом считаются безопасными, некоторые вопросы, связанные с иммуногенностью векторов AAV, остаются нерешенными [65,108,112]. Вероятно, именно поэтому в последние годы предпринимаются усилия по переходу от вирусных векторов к не-вирусным. Не-вирусные векторы просты в производстве и настройке, а также менее ограничены в грузоподъемности [113]. Хотя было доказано, что не-вирусные векторы обладают меньшей иммуногенностью и токсичностью, они обычно также демонстрируют меньшую эффективность трансдукции; как следствие, все еще требуется дальнейшая оптимизация [65,114].
4.7. Alternative Viral and Non-Viral Strategies as Novel Methods to Integrate or Edit Retinoschisin
Неуспех вирусных векторов для облегчения симптомов в клинических испытаниях частично объясняется недостаточной трансдукцией AAV и, как следствие, способностью к транскрипции [93,114-116]. Наш поиск в литературе выявил несколько альтернативных, обычно не-вирусных, методов доставки RS1 или компонентов CRISPR-Cas9, нацеленных на RS1: SLN, двойной SMNP, cNDs, электропорация и экзосома-ассоциированные AAV. Предварительная оптимизация не-вирусных и альтернативных методов доставки проводилась in vitro во всех включенных исследованиях, чтобы снизить затраты, обеспечить прямую оценку желаемого фактора и иметь меньше этических ограничений.
В исследованиях, в которых вводился RS1, оценивалась его интеграция в интересующие клетки. В этих исследованиях использовались такие клеточные модели, как HEK-293T, hiPSC и ARPE-19. Клетки HEK-293T и hiPSC характеризуются быстрой скоростью деления, в отличие от медленно делящихся клеток ARPE-19 [117]. Динамика клеток является ключевым фактором для обеспечения успешной трансдукции, а этот процесс облегчается делением клеток [117]. Напротив, в клетках с медленным делением или полным его отсутствием (таких как PR и клетки RPE) образуется ядерная мембрана, которую труднее пересечь, что препятствует трансдукции [117]. Таким образом, оценка новых не-вирусных методов доставки в различных клеточных линиях с различной динамикой развития клеток является ключевой для оценки всего потенциала желаемого лечения.
Размер и заряд частиц являются важными параметрами для успешной интеграции компонентов RS1 или CRISPR-Cas9 in vivo [58]. Толщина ILM, размер пор и отрицательный заряд напрямую влияют на диффузию наноносителей [46]. Более того, размер пор ILM различается у разных видов, а с возрастом у человека отмечаются значительные изменения в морфологии ILM [118]. Это подчеркивает необходимость углубленной оценки различных составов, конструкций и размеров частиц для наноносителей, чтобы экстраполировать результаты in vivo на клинические испытания.
Для того чтобы оценить успешность интеграции RS1 в ходе оптимизации in vitro, была проведена оценка трансфекционной способности in vitro [63,93,95]. Для этого использовались различные методики: количественное определение % GFP-позитивных клеток, детекция GFP, экспрессия мРНК и белка. Хотя эти исследования были направлены на оценку одного и того же параметра, в них использовались разные показатели. Как следствие, прямое сравнение невозможно. Кроме того, временные точки оценки посттрансдукции в разных исследованиях были разными. Временные точки оценки имеют решающее значение для определения пика эффективности трансдукции и продолжительности устойчивой экспрессии.
В целом, качественная оценка не-вирусных и альтернативных векторов доставки выявила недостаточное освещение применяемых методик, а также высокую вариабельность выбранных результатов. Это перекликается с данными, полученными в ходе анализа увеличения генов, опосредованного AAV in vivo. Если новые не-вирусные и альтернативные методы доставки будут оцениваться по тем же параметрам, что и существующие варианты, можно будет проводить прямые сравнения и точно оценивать эффективность лечения. В этом и заключается важность систематических обзоров и мета-анализов, подобных этому, чтобы извлечь предпочтительные методы и помочь в разработке новых исследований, позволяющих проводить систематические сравнения.
5. Conclusions
В данном систематическом обзоре обобщены и проанализированы имеющиеся на сегодняшний день доклинические данные по генотерапии, направленной на RS1, в моделях грызунов с дефицитом Rs1h на основе клеток. Мета-анализы амплитуд a- и b-волн, а также соотношения b/a на ERG подтвердили эффективность AAV-опосредованной генотерапии у грызунов с Rs1h-дефицитом. К сожалению, оценка качества показала наличие рисков отсева, обнаружения, эффективности, отбора и предвзятости при публикации, что подчеркивает необходимость повышения прозрачности и улучшения отчетности в исследованиях на животных. Неоднородность между исследованиями, а также наличие предубеждений могут привести к переоценке эффективности терапии. Это, в сочетании с видовыми различиями и потенциально не оптимальными методами доставки, может быть причиной того, что эти терапевтические кандидаты еще не достигли успеха в клинических испытаниях. Поэтому мы призываем к разработке стандартизированных подходов и прозрачности в постановке экспериментов, чтобы обеспечить более высокую переносимость и воспроизводимость будущих подходов к генотерапии XLRS. Кроме того, мы обнаружили многообещающие работы по исследованию альтернативных вирусных и не-вирусных подходов к генотерапии, направленной на RS1. Хотя эти направления терапии XLRS, возможно, все еще находятся в зачаточном состоянии, мы ожидаем, что в ближайшие годы количество подобных исследований значительно возрастет. В результате могут появиться новые варианты лечения, а также новые знания о XLRS.
В целом данный систематический обзор генотерапии в моделях XLRS на грызунах и клетках подчеркивает потенциал генотерапии при XLRS и в то же время указывает на необходимость тщательного подхода к дизайну доклинических исследований и их воспроизводимости.
|
 Figure 1. Schematic structure representing the retinoschisin (RS1) gene (A), protein diagram (B), the quaternary structure of the protein (C), and hallmarks of X-linked juvenile retinoschisis (XLRS) (D). (A) (Adapted from Hahn et al. [4]). An overview of RS1 shows the localization and variants within the gene. Colored boxes represent the six exons, and the numbers within the boxes represent their size in nucleotides. The type of variant is presented in the legend, and the frequency and distribution are described within the gene structure. Splice site (n = 38), missense (n = 101), and deletion variants (n = 11) are the three most common variants. (B) Overview of the RS1 protein, featuring the signal peptide domain, the RS1 domain, the discoidin domain and the C-terminal domain. (C) The top and side view of the octamer and double octamer. (D) Fundus photograph of a 35-year old patient with a hemizygous c.428A > T p.(Asp143Val) mutation in the RS1 gene patient with XLRS, and optical coherence tomography image showing macular schisis (asterisk) in this patient with XLRS.
Figure 1. Schematic structure representing the retinoschisin (RS1) gene (A), protein diagram (B), the quaternary structure of the protein (C), and hallmarks of X-linked juvenile retinoschisis (XLRS) (D). (A) (Adapted from Hahn et al. [4]). An overview of RS1 shows the localization and variants within the gene. Colored boxes represent the six exons, and the numbers within the boxes represent their size in nucleotides. The type of variant is presented in the legend, and the frequency and distribution are described within the gene structure. Splice site (n = 38), missense (n = 101), and deletion variants (n = 11) are the three most common variants. (B) Overview of the RS1 protein, featuring the signal peptide domain, the RS1 domain, the discoidin domain and the C-terminal domain. (C) The top and side view of the octamer and double octamer. (D) Fundus photograph of a 35-year old patient with a hemizygous c.428A > T p.(Asp143Val) mutation in the RS1 gene patient with XLRS, and optical coherence tomography image showing macular schisis (asterisk) in this patient with XLRS.
 Figure 2. Flowchart outlining the screening and selection process. The selection process was performed through the following stages: identification, screening, eligibility criteria and meta-analysis. Taken together, 3983 studies were identified in the first stage, and after removing duplicates, 2946 studies were included in the screening phase. After title and abstract screening, 77 studies were included. After full-text screening, 25 studies were included, split into 19 studies describing viral methods in in vivo models, and 6 studies describing non-viral and alternative delivery methods in vitro and in vivo. After the second eligibility stage, 19 studies using viral methods were eligible for quantitative analysis. For meta-analysis, seven studies were included for b-wave amplitude, four studies for a-wave amplitude and three studies for the ratio between b- and a-wave amplitudes (b/a-ratio). Four studies were not included in any meta-analysis.
Figure 2. Flowchart outlining the screening and selection process. The selection process was performed through the following stages: identification, screening, eligibility criteria and meta-analysis. Taken together, 3983 studies were identified in the first stage, and after removing duplicates, 2946 studies were included in the screening phase. After title and abstract screening, 77 studies were included. After full-text screening, 25 studies were included, split into 19 studies describing viral methods in in vivo models, and 6 studies describing non-viral and alternative delivery methods in vitro and in vivo. After the second eligibility stage, 19 studies using viral methods were eligible for quantitative analysis. For meta-analysis, seven studies were included for b-wave amplitude, four studies for a-wave amplitude and three studies for the ratio between b- and a-wave amplitudes (b/a-ratio). Four studies were not included in any meta-analysis.
 Figure 3. All in vivo studies were assessed on their risk of bias using the SYRCLE tool [69]. (A) The studies were assessed on whether any information was provided about ethical approval, conflicts of interest, calculation of sample sizes, blinding, or randomization. (B) The studies were assessed on possible risk of selection, performance, detection, outcome reporting, attrition and other biases. When the contralateral eye was used as the (internal) control, questions for random housing and allocation concealment were answered with not-applicable (N/A). Most studies received an unclear risk-of-bias score, due to a lack of reporting of essential quality indicators. ...
Figure 3. All in vivo studies were assessed on their risk of bias using the SYRCLE tool [69]. (A) The studies were assessed on whether any information was provided about ethical approval, conflicts of interest, calculation of sample sizes, blinding, or randomization. (B) The studies were assessed on possible risk of selection, performance, detection, outcome reporting, attrition and other biases. When the contralateral eye was used as the (internal) control, questions for random housing and allocation concealment were answered with not-applicable (N/A). Most studies received an unclear risk-of-bias score, due to a lack of reporting of essential quality indicators. ...
 Figure 4. Therapy characteristics of adeno-associated viral vector-mediated (AAV) gene augmentation therapies in included studies. The total number of experimental groups varies per parameter, as some studies tested multiple versions of the same parameter. (A) A spectrum of AAV types was used. The total number of experimental groups was 23. (B) The majority (67%) delivered the treatment by intravitreal injection. (C) Injection volumes ranged from 1 to 2 µL, although 1 µL was most commonly used (55%). (D) A number of publications reported different total doses of virus delivered to the eye (viral genomes/eye), but the majority chose a titer >4 Ч 109 vg/eye. The dotted line indicates the median. (E) The animals were treated at variable ages (5 days–7 months), although most were treated before one month of age (median: three weeks; dotted line). scRS/IRBP = modified RS promoter coupled with an interphotoreceptor retinoid-binding protein enhancer; CMV = cytomegalovirus promoter, hRSp4 = a complex consisting of RS1 promoter, human RS1 cDNA with a truncated first intron, human beta-globin polyadenylation site, and AAV2 inverted terminal repeats; shH10 = AAV subtype derived from AAV6; CAG = promoter element consisting of CMV early enhancer, rabbit beta-globin splice adapter, and the promoter, first intron and exon of CB; CB = chicken beta-actin; RS1 = retinoschisin; hRS1 = human RS1; rho = rhodopsin; mOP = mouse opsin; Rs1h = rodent homolog to RS1; 2tYF = AAV subtype with three tyrosine residues mutated to phenylalanine on the AAV2 capsid surface; rAAV2/2-Y444F = AAV subtype with a single Y mutated to F on the AAV2 capsid surface; mini-mGlu6 = a shortened version of the ON bipolar cell-specific promoter mGlu6; Ple155 = a human-DNA MiniPromoter specific to ON bipolar cells; SRI = subretinal injection; IVI = intravitreal injection; NR = not reported.
Figure 4. Therapy characteristics of adeno-associated viral vector-mediated (AAV) gene augmentation therapies in included studies. The total number of experimental groups varies per parameter, as some studies tested multiple versions of the same parameter. (A) A spectrum of AAV types was used. The total number of experimental groups was 23. (B) The majority (67%) delivered the treatment by intravitreal injection. (C) Injection volumes ranged from 1 to 2 µL, although 1 µL was most commonly used (55%). (D) A number of publications reported different total doses of virus delivered to the eye (viral genomes/eye), but the majority chose a titer >4 Ч 109 vg/eye. The dotted line indicates the median. (E) The animals were treated at variable ages (5 days–7 months), although most were treated before one month of age (median: three weeks; dotted line). scRS/IRBP = modified RS promoter coupled with an interphotoreceptor retinoid-binding protein enhancer; CMV = cytomegalovirus promoter, hRSp4 = a complex consisting of RS1 promoter, human RS1 cDNA with a truncated first intron, human beta-globin polyadenylation site, and AAV2 inverted terminal repeats; shH10 = AAV subtype derived from AAV6; CAG = promoter element consisting of CMV early enhancer, rabbit beta-globin splice adapter, and the promoter, first intron and exon of CB; CB = chicken beta-actin; RS1 = retinoschisin; hRS1 = human RS1; rho = rhodopsin; mOP = mouse opsin; Rs1h = rodent homolog to RS1; 2tYF = AAV subtype with three tyrosine residues mutated to phenylalanine on the AAV2 capsid surface; rAAV2/2-Y444F = AAV subtype with a single Y mutated to F on the AAV2 capsid surface; mini-mGlu6 = a shortened version of the ON bipolar cell-specific promoter mGlu6; Ple155 = a human-DNA MiniPromoter specific to ON bipolar cells; SRI = subretinal injection; IVI = intravitreal injection; NR = not reported.
 Figure 5. Follow-up time points per outcome parameter selected for in-depth analysis. Outcome parameters were reported at variable timepoints post-injection. Timing mode and range per outcome parameters were, respectively, OCT 12 weeks (2 w–15 m), ERG 2 months (4 w–15 m), and IHC 12 weeks (1 w–15 m). OCT = optical coherence tomography, ERG = electroretinography, IHC = immunohistochemistry.
Figure 5. Follow-up time points per outcome parameter selected for in-depth analysis. Outcome parameters were reported at variable timepoints post-injection. Timing mode and range per outcome parameters were, respectively, OCT 12 weeks (2 w–15 m), ERG 2 months (4 w–15 m), and IHC 12 weeks (1 w–15 m). OCT = optical coherence tomography, ERG = electroretinography, IHC = immunohistochemistry.  Figure 6. The overall effect size of adeno-associated viral vector (AAV)-mediated gene augmentation therapy on a-wave amplitudes with integrated dosage subgroup analysis. The studies included in this meta-analysis were assigned study IDs according to First Author Publication year, and experimental groups within one publication are distinguished by labeling them a through z. The studies included in this meta-analysis were Bush2016 [85], Scruggs2022 [88], Min2005 [77], and Marangoni2017 [87]. The results are staggered per subgroup (total dose smaller than 4 Ч 109 viral genomes/eye (vg/eye) and larger than 4 Ч 109 vg/eye). The black circles represent the overall subgroup effect size, and the green diamond represents the overall weighted effect size. The black dashed line indicates the null effect. The left side of the null effect line favors the control, whereas the right side of the null effect line favors treatment. The overall effect size (0.75 [0.56, 0.94]) was computed with a random effects model and is represented by a green diamond and dashed line. Included studies were assessed for homogeneity with a Chi-square test and were not found to be highly heterogeneous (I2 = 17.1%). SMD = standardized mean difference, CI = confidence interval.
Figure 6. The overall effect size of adeno-associated viral vector (AAV)-mediated gene augmentation therapy on a-wave amplitudes with integrated dosage subgroup analysis. The studies included in this meta-analysis were assigned study IDs according to First Author Publication year, and experimental groups within one publication are distinguished by labeling them a through z. The studies included in this meta-analysis were Bush2016 [85], Scruggs2022 [88], Min2005 [77], and Marangoni2017 [87]. The results are staggered per subgroup (total dose smaller than 4 Ч 109 viral genomes/eye (vg/eye) and larger than 4 Ч 109 vg/eye). The black circles represent the overall subgroup effect size, and the green diamond represents the overall weighted effect size. The black dashed line indicates the null effect. The left side of the null effect line favors the control, whereas the right side of the null effect line favors treatment. The overall effect size (0.75 [0.56, 0.94]) was computed with a random effects model and is represented by a green diamond and dashed line. Included studies were assessed for homogeneity with a Chi-square test and were not found to be highly heterogeneous (I2 = 17.1%). SMD = standardized mean difference, CI = confidence interval.
 Figure 7. The overall weighted effect size of adeno-associated viral vector (AAV)-mediated gene augmentation therapy on the b-wave amplitude. The studies included in this meta-analysis were assigned study IDs according to First Author Publication year, and experimental groups within one publication are distinguished by labeling them a through z. The studies included in this analysis were Min2005 [77], Molday2006 [78], Janssen2008 [80], Byrne2014 [54], Bush2016 [85], Marangoni2017 [87], and Scruggs2022 [88]. The standardized mean differences (SMDs) with 95% confidence intervals (CI) of each experimental group are displayed in a forest plot. The dashed black line represents no treatment effect. Values left of the null effect line favor control, whereas values right of the null effect line favors treatment. The overall effect size (1.44 [1.11, 1.77]) was computed with a random-effects model and is represented by a green diamond and dashed line. Included studies were assessed for homogeneity with a Chi-square test and were found to be highly heterogeneous (I2 = 76.5%).
Figure 7. The overall weighted effect size of adeno-associated viral vector (AAV)-mediated gene augmentation therapy on the b-wave amplitude. The studies included in this meta-analysis were assigned study IDs according to First Author Publication year, and experimental groups within one publication are distinguished by labeling them a through z. The studies included in this analysis were Min2005 [77], Molday2006 [78], Janssen2008 [80], Byrne2014 [54], Bush2016 [85], Marangoni2017 [87], and Scruggs2022 [88]. The standardized mean differences (SMDs) with 95% confidence intervals (CI) of each experimental group are displayed in a forest plot. The dashed black line represents no treatment effect. Values left of the null effect line favor control, whereas values right of the null effect line favors treatment. The overall effect size (1.44 [1.11, 1.77]) was computed with a random-effects model and is represented by a green diamond and dashed line. Included studies were assessed for homogeneity with a Chi-square test and were found to be highly heterogeneous (I2 = 76.5%).
 Figure 8. The effect sizes of adeno-associated viral vector (AAV)-mediated gene augmentation therapy on the b-wave amplitude for subgroups mouse model, delivery method, dose, age at injection, and follow-up time point. The black dashed line indicates the null effect. Values left of the null effect line favor the control, whereas values right of the null effect line favor the treatment. The overall effect size (1.44 [1.11, 1.77]) was computed with a random-effects model and is represented by a green diamond and dashed line. The between-study heterogeneity was high (I2 = 76.5%), and therefore these subgroup analyses serve for orientational purposes only. Rs1h = retinoschisin, KO = knock-out, IVI = intravitreal injection, SRI = subretinal injection, M = months of age, MPI = months post-injection, SMD = standardized mean difference, CI = confidence interval.
Figure 8. The effect sizes of adeno-associated viral vector (AAV)-mediated gene augmentation therapy on the b-wave amplitude for subgroups mouse model, delivery method, dose, age at injection, and follow-up time point. The black dashed line indicates the null effect. Values left of the null effect line favor the control, whereas values right of the null effect line favor the treatment. The overall effect size (1.44 [1.11, 1.77]) was computed with a random-effects model and is represented by a green diamond and dashed line. The between-study heterogeneity was high (I2 = 76.5%), and therefore these subgroup analyses serve for orientational purposes only. Rs1h = retinoschisin, KO = knock-out, IVI = intravitreal injection, SRI = subretinal injection, M = months of age, MPI = months post-injection, SMD = standardized mean difference, CI = confidence interval.
 Figure 9. The overall weighted effect size of AAV-mediated gene augmentation therapy on the ratio between the b- and a-wave amplitudes (b/a-ratio). The studies included in this meta-analysis were assigned study IDs according to First Author Publication year, and experimental groups within one publication are distinguished by labeling them a through z. The studies included in this analysis were Bush2016 [85], Park2009 [82], and Marangoni2017 [87]. The results are staggered per subgroup (total dose smaller than 4 Ч 109 viral genomes/eye (vg/eye) and larger than 4 Ч 109 vg/eye). The black circles represent the overall subgroup effect size, and the green diamond represents the overall weighted effect size. The black dashed line indicates the null effect. Values left of the null effect line favor control, whereas values right of the null effect line favors treatment. The overall effect size (1.08 [0.42, 1.74]) was computed with a random-effects model and is represented by a green diamond and dashed line. The black circles indicate the overall subgroup effect size. A Chi-square test of homogeneity revealed high levels of between-study heterogeneity (I2 = 90.7%). SMD = standardized mean difference, CI = confidence interval.
Figure 9. The overall weighted effect size of AAV-mediated gene augmentation therapy on the ratio between the b- and a-wave amplitudes (b/a-ratio). The studies included in this meta-analysis were assigned study IDs according to First Author Publication year, and experimental groups within one publication are distinguished by labeling them a through z. The studies included in this analysis were Bush2016 [85], Park2009 [82], and Marangoni2017 [87]. The results are staggered per subgroup (total dose smaller than 4 Ч 109 viral genomes/eye (vg/eye) and larger than 4 Ч 109 vg/eye). The black circles represent the overall subgroup effect size, and the green diamond represents the overall weighted effect size. The black dashed line indicates the null effect. Values left of the null effect line favor control, whereas values right of the null effect line favors treatment. The overall effect size (1.08 [0.42, 1.74]) was computed with a random-effects model and is represented by a green diamond and dashed line. The black circles indicate the overall subgroup effect size. A Chi-square test of homogeneity revealed high levels of between-study heterogeneity (I2 = 90.7%). SMD = standardized mean difference, CI = confidence interval.
 Figure 10. The funnel plots of the meta-analyzed studies. The blue dots indicate standardized mean differences (SMD) of primary studies; the green dots indicate missing studies. The black lines indicate overall effect size, and the dashed lines indicate the 95% confidence intervals (CI). (A) The funnel plot for b-wave amplitude. A trim-and-fill analysis predicted missing studies. (B) The funnel plot for a-wave amplitude. A trim-and-fill analysis predicted missing studies. (C) The funnel plot for the ratio between the b- and a-wave amplitudes (b/a-ratio). Trim-and-fill analysis predicted no missing studies.
Figure 10. The funnel plots of the meta-analyzed studies. The blue dots indicate standardized mean differences (SMD) of primary studies; the green dots indicate missing studies. The black lines indicate overall effect size, and the dashed lines indicate the 95% confidence intervals (CI). (A) The funnel plot for b-wave amplitude. A trim-and-fill analysis predicted missing studies. (B) The funnel plot for a-wave amplitude. A trim-and-fill analysis predicted missing studies. (C) The funnel plot for the ratio between the b- and a-wave amplitudes (b/a-ratio). Trim-and-fill analysis predicted no missing studies.
 Figure 11. The classification of alternative delivery and non-viral delivery methods. The first classification is alternative delivery and non-viral delivery methods. In the former, the exosome-associated adeno-assiocated viral vectors (AAVs) are classified [93]. Within the non-viral methods category, a second classification can be made: chemical and physical methods. The physical methods contain the electroporation method [58], while the chemical methods can be divided into organic (solid lipid nanoparticles [63,95]) or inorganic (dual supramolecules nanoparticles [96] and carboxylated nanodiamonds [97]) vectors. In each category, a schematic representation of the vectors used for RS1 or gene editing constructs delivery is included to illustrate the building blocks used in each vector. Dual supramolecular nanoparticle and carboxylated nanodiamond representations have been adapted from Chou et al. and Yang et al., respectively [96,97]. Outlined with a yellow line are the studies designed for gene augmentation, whereas those designed for gene editing are marked with a green line. XLRS = X-linked juvenile retinoschisis, RS1 = retinoschisin, ad = adamantane-grafted, PEG = polyethylene glycol, TAT = adenosine-5’-rp-alpha-thio-triphosphate, CD-PEI = carbon dot-polyethylenimine, GFP = green fluorescent protein, sgRNA = single guide RNA.
Обзор характеристик исследований представлен в таблице 5.
Таблица 5. Характеристики исследований альтернативных методов доставки и не-вирусных методов интеграции и редактирования RS1, протестированных in vitro. Были выделены характеристики, касающиеся дизайна исследования, клеточной модели, использованной для оптимизации, состава вектора и промотора. Исследования, в которых использовались различные стратегии, были разделены на отдельные экспериментальные группы. RS1 = ретиношизин, SLN = твердая липидная наночастица, exo-AAV = экзосома-ассоциированный AAV, cNDs = карбоксилированные наноалмазы, CRISPR = Clustered Regularly Interspaced Palindromic Repeats, SMNP = супрамолекулярные наночастицы, C = цитозин, T = тимин, KO = нокаут, KI = knock-in, CEP4 = вектор, включающий промотор CMV и маркер устойчивости к гигромицину, CMV = цитомегаловирус, CAG = комплекс, состоящий из раннего энхансера CMV (C), промотора куриного бета-актина, первого интрона и первого экзона (A) и сплайс-адаптера кроличьего бета-глобина (G); GFP = зеленый флуоресцентный белок, Zsgreen = Zoanthus sp. зеленый, sgRNA = одиночная направляющая РНК, AAV = адено-ассоциированный вирусный вектор, U6 = промотор РНК-полимеразы III типа, pRS1HR-gRNA = плазмида, включающая 950-bp шаблон репарации RS1 и кассету экспрессии gRNA.
Figure 11. The classification of alternative delivery and non-viral delivery methods. The first classification is alternative delivery and non-viral delivery methods. In the former, the exosome-associated adeno-assiocated viral vectors (AAVs) are classified [93]. Within the non-viral methods category, a second classification can be made: chemical and physical methods. The physical methods contain the electroporation method [58], while the chemical methods can be divided into organic (solid lipid nanoparticles [63,95]) or inorganic (dual supramolecules nanoparticles [96] and carboxylated nanodiamonds [97]) vectors. In each category, a schematic representation of the vectors used for RS1 or gene editing constructs delivery is included to illustrate the building blocks used in each vector. Dual supramolecular nanoparticle and carboxylated nanodiamond representations have been adapted from Chou et al. and Yang et al., respectively [96,97]. Outlined with a yellow line are the studies designed for gene augmentation, whereas those designed for gene editing are marked with a green line. XLRS = X-linked juvenile retinoschisis, RS1 = retinoschisin, ad = adamantane-grafted, PEG = polyethylene glycol, TAT = adenosine-5’-rp-alpha-thio-triphosphate, CD-PEI = carbon dot-polyethylenimine, GFP = green fluorescent protein, sgRNA = single guide RNA.
Обзор характеристик исследований представлен в таблице 5.
Таблица 5. Характеристики исследований альтернативных методов доставки и не-вирусных методов интеграции и редактирования RS1, протестированных in vitro. Были выделены характеристики, касающиеся дизайна исследования, клеточной модели, использованной для оптимизации, состава вектора и промотора. Исследования, в которых использовались различные стратегии, были разделены на отдельные экспериментальные группы. RS1 = ретиношизин, SLN = твердая липидная наночастица, exo-AAV = экзосома-ассоциированный AAV, cNDs = карбоксилированные наноалмазы, CRISPR = Clustered Regularly Interspaced Palindromic Repeats, SMNP = супрамолекулярные наночастицы, C = цитозин, T = тимин, KO = нокаут, KI = knock-in, CEP4 = вектор, включающий промотор CMV и маркер устойчивости к гигромицину, CMV = цитомегаловирус, CAG = комплекс, состоящий из раннего энхансера CMV (C), промотора куриного бета-актина, первого интрона и первого экзона (A) и сплайс-адаптера кроличьего бета-глобина (G); GFP = зеленый флуоресцентный белок, Zsgreen = Zoanthus sp. зеленый, sgRNA = одиночная направляющая РНК, AAV = адено-ассоциированный вирусный вектор, U6 = промотор РНК-полимеразы III типа, pRS1HR-gRNA = плазмида, включающая 950-bp шаблон репарации RS1 и кассету экспрессии gRNA.