Массовые исследования старения с помощью РНК-секвенирования выявили нарушения важнейших клеточных процессов, таких как транскрипция, трансляция и передача сигналов факторов роста3, при этом и процессы, связанные с функционированием митохондрий, активностью нейронов и повреждением ДНК, нарушаются в стареющем головном мозге2,4. Изменения, происходящие с клетками, зависящими от типа, в процессе старения, остаются неясными при массовом анализе и плохо изучены. Это представляет собой серьезный пробел в знаниях о человеческом мозге, в котором молекулярно различные типы клеток выполняют специфические функции на протяжении всей жизни. Появление одноклеточной геномики позволило проводить анализ как ДНК, так и РНК с высоким разрешением. SCWG и другие методы показали, что соматические мутации накапливаются в нейронах человека в процессе старения и при возрастных заболеваниях, что повышает вероятность того, что такие варианты способствуют нарушению регуляции транскрипции и сопутствующей повышенной восприимчивости к дисфункциям и заболеваниям что сопутствует пожилому возрасту5-10. Секвенирование РНК одиночных клеток и snRNA-seq улучшили понимание состояния клеток мозга11-14 и были использованы для выявления возрастных и связанных с заболеваниями изменений в нескольких органах15, включая человеческий мозг16,17. Несмотря на этот прогресс, наше понимание транскрипционных и геномных изменений, связанных со здоровым старением, которые могут заложить основу для некоторых заболеваний мозга, остается неполным.
Чтобы начать изучать динамику старения человеческого мозга в зависимости от типа клеток, мы создали библиотеки snRNA-seq и scWGS на основе капель свежезамороженной префронтальной коры головного мозга человека (PFC) (рис. 1а) от 19 нейротипичных доноров в возрасте от младенца до столетнего (таблица 1 и дополнительную таблицу 1). В качестве ортогональной проверки наших результатов анализа snRNA-seq мы провели мультиплексную флуоресцентную гибридизацию
in situ с устойчивостью к ошибкам (MERFISH), количественный пространственно-транскриптомный метод с разрешением по одной молекуле, на подгруппе доноров. В экспериментах с использованием snRNA-seq после контроля качества и фильтрации артефактов осталось 367 317 ядер [18], в среднем по 19 332 на донора (дополнительный рис. 1), а уменьшение размерности и иерархическая кластеризация позволили получить 31 кластер (рис. 1b). Мы аннотировали эти кластеры, используя ранее опубликованный набор данных PFC человека
19 в качестве справочного материала (рис. 1с и дополнительная таблица 2), и идентифицировали кластеры возбуждающих нейронов из различных слоев коры, четыре подтипа тормозных нейронов (IN-PV, IN-SST, IN-SV2C и IN-VIP), микроглию, олигодендроциты, клетки-предшественники олигодендроцитов (OPC), астроциты и эндотелиальные клетки. Экспрессия канонических маркерных генов для каждого типа клеток была специфичной для кластера (дополнительный рис. 2). В рамках этих широких классов мы выделили подклассы клеток, которые, несмотря на их сходство, населяли различные кластеры (рис. 1б). В среднем, возбуждающие нейроны экспрессировали более чем в два раза больше генов, чем глиальные и эндотелиальные клетки (рис. 1d).
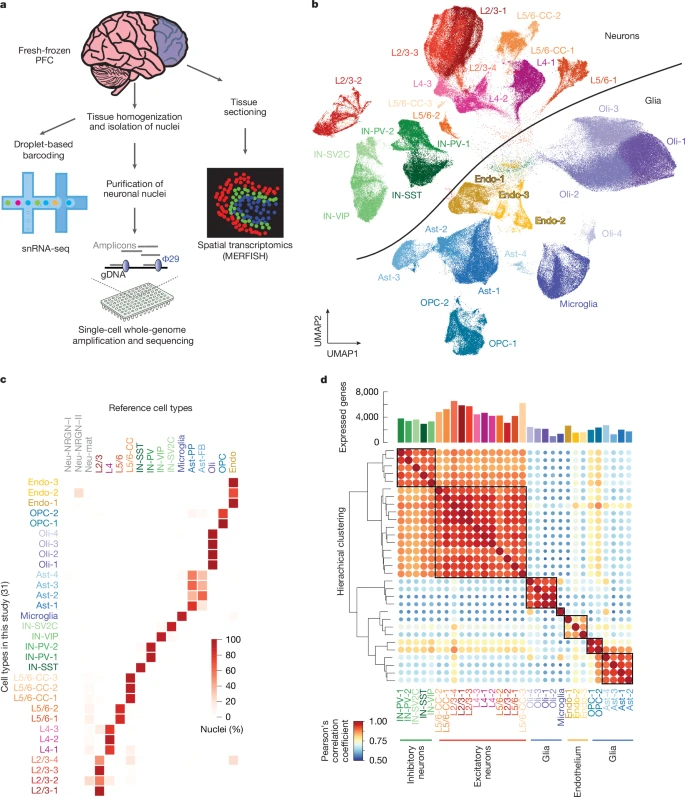 Рис. 1: Схема исследования и характеристика капельного snRNA-seq в PFC человека.
Table 1 Sample information for snRNA-seq and scWGS
Рис. 1: Схема исследования и характеристика капельного snRNA-seq в PFC человека.
Table 1 Sample information for snRNA-seq and scWGS
/div>
Brain cell-type proportions during life
Мы не обнаружили никакой разницы в общем соотношении нейронов к глии или возбуждающих нейронов к тормозящим нейронам. Кроме того, мы не наблюдали потери какого-либо подтипа нейронов при непатологическом старении, а также не наблюдали признаков увеличения реактивной микроглии в мозге пожилых людей (в возрасте более 65 лет) (расширенные данные на рис. 1 и дополнительная таблица 3). Однако мы выявили подкластеры нейронов и астроцитов, которые состояли исключительно или почти исключительно из ядер младенцев-доноров (рис. 2а). В целом, нейронный кластер, специфичный для младенцев, напоминал нейроны L2/3, но при более тщательном изучении были выявлены группы клеток в этом кластере, экспрессирующие маркеры нейронов L4 или L5/6 (расширенные данные, рис. 2), и выявлено, что гены, участвующие в развитии и миграции нейронов (рис. 2b), такие как такие, как
SLIT3 и ROBO1, также были представлены в этой группе (дополнительные таблицы 4 и 5). Анализ данных MERFISH, полученных с помощью платформы Ultra от подгруппы из четырех доноров (0,4-летнего мужчины, 15-летней женщины, 28-летнего мужчины и 57-летнего мужчины), показал, что нейроны младенцев в основном демонстрировали правильную работу, ламинарное позиционирование с нейронами CUX2+ L2/3, нейронами RORB+ L4 и нейронами HS3ST4+ L5/620, демонстрирующими сходное распределение по донорам (рис. 2c, d и расширенные данные рис. 3). HS3ST4 также, по-видимому, маркирует нейроны белого вещества у всех доноров, подобно TLE4, каноническому маркеру L5/621. Эти данные позволяют предположить, что кластер L2/3-2 представляет собой незрелые возбуждающие нейроны, которые населяют различные слои неокортекса младенца. Астроциты, специфичные для младенцев, экспрессировали гены, отвечающие за развитие нервной системы, которые маркируют незрелые астроциты; например,
HES5, ID4, MFGE8 и DCC (ссылки 22-24) (рис. 2b, дополнительные таблицы 4 и 5). Наш повторный анализ опубликованного набора данных snRNA-seq PFC человека, в котором изучалось развитие от плода до взрослого
25, подтвердил паттерны понижающей и повышающей регуляции генов, которые мы наблюдали в нейронах и астроцитах младенцев (Расширенные данные Рис. 4 и дополнительные рис. 3).
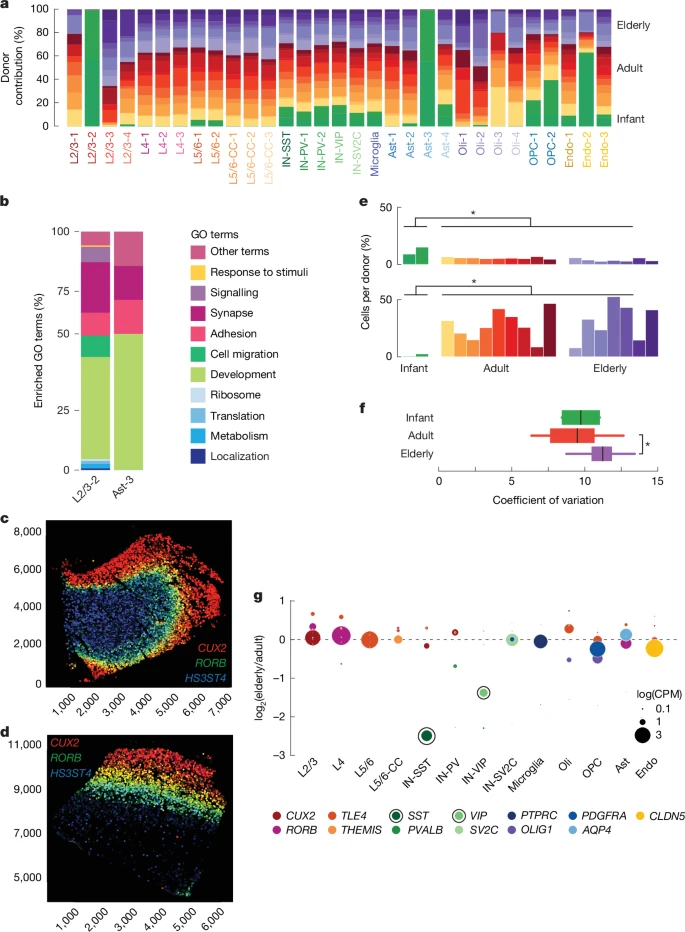 Рис. 2. Изменения в транскрипционном состоянии клеток головного мозга на протяжении всей жизни человека.
Рис. 2. Изменения в транскрипционном состоянии клеток головного мозга на протяжении всей жизни человека.
Количество OPCs уменьшалось с возрастом (P = 1,31 x 10-2, критерий суммы рангов Уилкоксона), будучи самым высоким у младенцев-доноров и снижаясь с течением жизни (рис. 2е), тогда как количество зрелых олигодендроцитов в головном мозге увеличивалось с возрастом (P = 1,31 x 10-2, критерий суммы рангов Уилкоксона при сравнении младенцев с другими донорами), взрослыми и пожилыми). Эти данные свидетельствуют о том, что пул OPCs дифференцируется в зрелые олигодендроциты в течение жизни с неполной заменой; таким образом, способность генерировать новые олигодендроциты у пожилых людей может снижаться.
Повышенная межклеточная вариабельность транскрипции при старении была выявлена в тканях, не относящихся к мозгу26-28, и считается, что это является следствием связанных со старением нарушений в геноме, эпигеноме и транскриптоме. В наших данных мы обнаружили только один тип клеток — нейроны IN-SST — со значительным увеличением коэффициента вариации транскриптома в мозге пожилых людей (рис. 2f; P = 4,30 ? 10-2, критерий суммы рангов Уилкоксона). Мы наблюдали аналогичные тенденции при анализе нашей когорты в трех возрастных группах (15-39, 40-69 и 70 лет и старше; дополнительный рис. 4). Кроме того, экспрессия SST и VIP, которые являются маркерами двух различных классов тормозных нейронов, значительно снижалась с возрастом (кратные изменения составили -2,63 и -1,46; скорректированные значения P < 2,2 x 10-16) в клетках IN-SST и IN-VIP пожилых людей, соответственно (рис. 2g). Потеря этих функционально важных маркерных генов в сочетании с повышенной вариабельностью транскрипции позволяет предположить, что тормозные нейроны претерпевают фундаментальные изменения в процессе старения. В предыдущем отчете описывалось уменьшение количества тормозных нейронов IN-SST и IN-VIP в процессе старения человеческого мозга16. Хотя мы не обнаружили этого феномена (расширенные данные на рис. 1с, г), наши данные согласуются с представлением о том, что в пожилом мозге нарушена передача сигналов торможения.
Housekeeping genes decrease in ageing
Дифференциальный анализ экспрессии по типам клеток, при сравнении 7 пациентов пожилого возраста с 10 пациентами взрослого возраста, выявил 2803 гена, которые значительно изменялись с возрастом (log2 (пожилой/взрослый) более 0,5, скорректированный P < 0,05) (рис. 3а и дополнительная таблица 6). Мы получили аналогичные результаты, когда наша когорта была разделена на три группы или при использовании альтернативного метода линейной модели (расширенные данные на рис. 1). 5 и дополнительную таблицу 7). Повторный анализ опубликованных данных от контрольных доноров в возрасте от 38 до 93 лет
29 и от когорты пожилых доноров
30 подтвердил наши результаты (расширенные данные, рис. 5). В каждом типе клеток при старении снижалось количество генов, а не повышалось (критерий Вилкоксона с ранговым знаком, P = 2,44 х 10
-4), и большинство сниженных генов были идентифицированы в нейронах. Возбуждающие нейроны L2/3 обладали наибольшей активацией генов (201 и 1273 соответственно) из всех типов клеток. В общей сложности 124 гена, которые были снижены при старении, обычно были снижены во многих типах клеток (рис. 3b и дополнительная таблица 8), что отражает увеличение по сравнению со случайной вероятностью (P < 0,001, тест случайной перестановки). Например, белок теплового шока HSPA8, белок цитоскелета TUBA1A и восемь других генов были значительно снижены во всех 13 типах клеток головного мозга в процессе старения. Другие гены, которые обычно снижают свою активность в разных типах клеток, включают другие гены цитоскелета, такие как
TUBB3 (снижены в 12/13 типах клеток),
TUBA4A (10/13) и
TUBB (9/13); гены кальмодулина
CALM2 и
CALM3 (9/13 и 12/13 соответственно); и везикулярный белок VAMP2 (13/13). Напротив, только два транскрипта — антисмысловой транскрипт
UBA6, фермента, модифицирующего убиквитин, и
TMTC1, белка эндоплазматического ретикулума, участвующего в гомеостазе кальция, - обычно активировались во многих типах нейронов и глии.
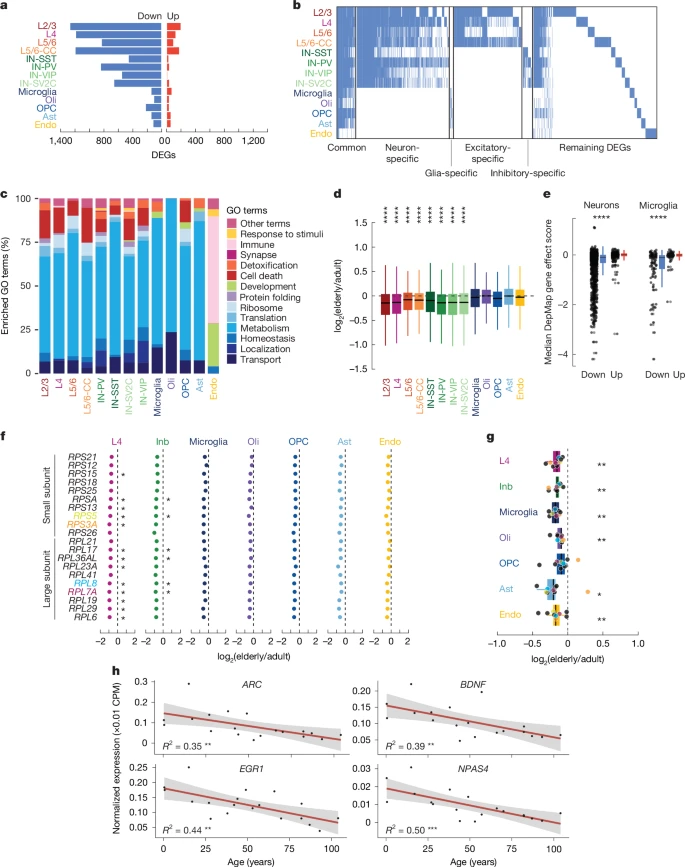 Рис. 3. Общее снижение активности генов в клетках разных типов.
Рис. 3. Общее снижение активности генов в клетках разных типов.
Общей чертой, наблюдаемой у всех типов клеток стареющего мозга, является повсеместное снижение активности генов "домашнего хозяйства". Действительно, анализ генов с пониженной регуляцией с помощью генной онтологии (GO) выявил общие признаки для всех типов клеток, за исключением эндотелиальных клеток (рис. 3в и дополнительная таблица 9). Этот результат был получен при равномерном распределении списков дифференциально экспрессируемых генов по типам клеток (Дополнительная таблица 10). В неэндотелиальных клетках термины, относящиеся к функциям "домашнего хозяйства", таким как трансляция, метаболизм, гомеостаз, рибосомы, внутриклеточная локализация и внутриклеточный транспорт, были значительно обогащены генами с пониженной регуляцией. Чтобы дополнительно и непредвзято оценить изменения экспрессии генов с общими клеточными функциями, мы определили набор генов домашнего хозяйства в нашем наборе данных как те гены, которые стабильно экспрессировались во всех типах клеток головного мозга (средний логарифм (количество на миллион (CPM)) > 0,1 в каждом типе клеток и с различиями менее 0,1 между типами клеток), включая эндотелиальные клетки и микроглию, которые имеют отличное эмбриологическое происхождение от нейронов и других глиальных клеток (Дополнительная таблица 11), и измеряли изменения их экспрессии в процессе старения (дополнительный рис. 5а). Следуя той же логике, мы определили нейрон-специфичные гены как те, которые обнаружены во всех подтипах нейронов, но отсутствуют в клетках, не относящихся к нейронам (Дополнительная таблица 11). Экспрессия этих генов "домашнего хозяйства" снижена у пожилых людей по сравнению со взрослыми нейронами разных подтипов (рис. 3d). Напротив, количество нейрон-специфичных генов в нейронах не уменьшается с возрастом (дополнительный рис. 5б). Таким образом, нейроны теряют экспрессию генов, связанных с общей функцией клеток, но сохраняют клеточную идентичность в стареющем мозге.
База данных DepMap оценивает важность гена на основе показателей выживаемости после нокаута в сотнях линий раковых клеток. Используя DepMap, мы обнаружили, что гены, регуляция которых снижалась с возрастом в нейронах и микроглии, чаще оказывались необходимыми для выживания клеток, чем гены, регуляция которых повышалась (нейроны: P = 7,33 x 10-7; микроглия: P = 9,09 x 10-7, двусторонний t-тест) (рис. 3e и дополнительная таблица 11), предполагая, что гены, которые снижаются при старении, снижают жизнеспособность клеток головного мозга.
RPS3A, RPL26 и RPL15 (все кодирующие рибосомные белки) были значительно снижены в процессе старения в 11 из 13 типов клеток (Дополнительная таблица 8), и 14 других генов рибосомных белков были обычно снижены. Это побудило нас изучить уровень экспрессии всех рибосомальных генов. Мы наблюдали почти повсеместную тенденцию снижения экспрессии генов, кодирующих малые и большие субъединицы рибосом, в процессе старения — гораздо большую, чем можно было бы ожидать случайно (значения P < 3,76 ? 10-6; точный критерий Фишера) (рис. 3f и дополнительный рис. 6). Чтобы подтвердить этот вывод, мы провели эксперименты с морскими рыбками на мозге трех пожилых людей (82 года (мужчины), 82 года (женщины) и 87 лет (мужчины)) и трех взрослых (28 лет (мужчины), 42 года (женщины) и 49 лет (женщины)). Наши результаты показали, что во всех типах клеток экспрессия девяти рибосомальных белков снижалась в мозге пожилых людей, причем во всех клетках, кроме OPCs, наблюдалось значительное снижение (рис. 3g, Расширенные данные рис. 6 и дополнительная таблица 11). Белки, кодируемые ядрами митохондриальной цепи переноса электронов, за исключением генов комплекса II, также демонстрировали согласованную понижающую регуляцию как snRNA-seq, так и MERFISH (расширенные данные рис. 6d, e и дополнительный рис. 7). Анализ нашей когорты snRNA-seq в трех возрастных группах вместо двух показывает, что как рибосомные, так и митохондриальные гены значительно снижаются после 40 лет, причем у доноров в возрасте 40-69 лет экспрессия этих генов аналогична экспрессии у доноров в возрасте 70-104 лет (расширенные данные рис. 7). Эти данные свидетельствуют о том, что нейроны становятся менее метаболически активными в течение жизни. Таким образом, экспрессия ранних генов, которые быстро активируются при стимуляции нейронов31, снижается при старении мозга (рис. 3h).
Mutation patterns reflect transcription
Соматические мутации накапливаются в клетках в течение жизни для многих типов клеток по всему человеческому организму9,32-35, в том числе в постмитотических нейронах головного мозга6,8,9. Частота соматических мутаций в нейронах коррелирует с транскрипцией, измеряемой с помощью bulk RNA-seq в головном мозге5-7,9, что позволяет предположить, что соматические мутации могут влиять на важные программы регуляции генов мозга. Анализ мутационных сигнатур показал, что активность нескольких генов, отвечающих за репарацию ДНК, приводит к возникновению соматических мутаций в нейронах5,7,10. Таким образом, как первичные причины, так и последующие последствия соматических мутаций в одной клетке могут быть изучены с помощью экспрессии генов в одной клетке.
Чтобы связать изменения в нейрональном транскриптоме с изменениями в бремени соматических мутаций в отдельных нейронах, мы провели SCWG с использованием первичной матрично-направленной амплификации (PTA)7,36 на нейронах из той же области мозга и донорах, проанализированных с помощью snRNA-seq (Дополнительная таблица 12). Мы использовали алгоритм SCAN26 для идентификации соматических однонуклеотидных вариантов (sSNV) в данных scWGS по каждому образцу (Дополнительная таблица 13). В соответствии с предыдущими отчетами6,7,9, наш анализ показал, что sSNV накапливаются со скоростью 15,1 на нейрон в год (R2 = 0,87, P = 2,20 x 10-16) (расширенные данные рис. 8а). Общая картина мутаций напоминает известную сигнатуру под названием SBS5 (косинусоидальное сходство 0,96), впервые выявленную в Каталоге соматических мутаций консорциума Cancer (COSMIC), которая накапливается в течение жизни во многих тканях37 (Расширенные данные Рис. 8b,c).
Мы сравнили изменения в экспрессии генов в нейронах с возрастными паттернами соматических мутаций в нейронах, чтобы исследовать взаимосвязи между геномом и транскриптомом при старении. Мы обнаружили, что общий, SBS5-подобный спектр нейронных sSNV состоит из двух различных сигнатур, которые мы назвали A1 и A2 (рис. 4a, Дополнительный рис. 8 и расширенный рис. 8c). Сигнатура A1 напоминала SBS5 (косинусоидальное сходство 0,88) и сильно коррелировала с возрастом донора (R2 = 0,88, P = 3,30 x 10
-50) (рис. 4b), что составляло 12,1 из 15,1 мутаций в год. Уровень сигнатуры A1 также сильно коррелировал с уровнями экспрессии генов в нейронах (рис. 4c и дополнительный рис. 8; критерий хи-квадрат), демонстрируя, что транскрипция в нейронах повышает чувствительность некоторых локусов к определенным типам соматических мутаций. В соответствии с этим, значительное смещение транскрипционных цепей в sSNV, которое, как полагают, является результатом асимметричного повреждения и скорости репарации матричных и нематричных цепей в транскрибируемых локусах
38, наблюдалось в генах со средней и высокой экспрессией, но не в генах, экспрессируемых на низких уровнях (рис. 4d; звездочками отмечены значительные отклонения от нормы). 50:50). Кроме того, сигнатура A1 была обогащена активными состояниями хроматина в мозге человека в местах запуска активной транскрипции (TSS), энхансерах, двухвалентных TSS и слабо репрессированных участках polycomb, но обеднена в местах покоя и слабой транскрипции (рис. 4g и дополнительная таблица 14; критерий хи-квадрат).
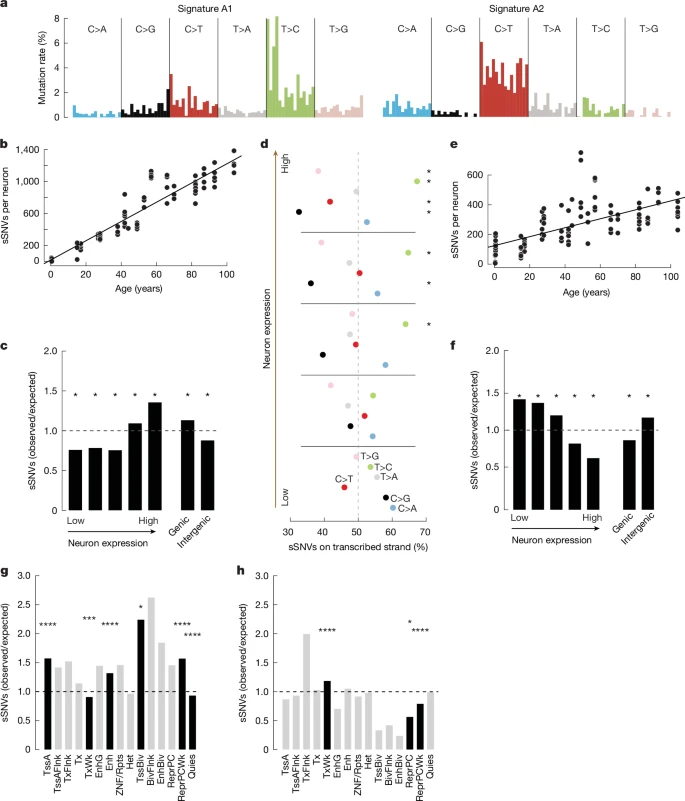 Fig. 4: scWGS reveals sSNV mutational signatures linked to expression.
Fig. 4: scWGS reveals sSNV mutational signatures linked to expression.
На сигнатуру A2 приходилось меньше возрастных мутаций в год (3; R2 = 0,42, P = 6,60 x 10-14), и большинство sSNV в нейронах младенцев были получены из сигнатуры A2 (рис. 4b, e и дополнительная таблица 13). Сигнатура A2 показала высокое сходство с мозаичными мутациями в развитии, выявленными в трех отдельных исследованиях, в которых использовались ортогональные методы для scWGS39-41 (косинусное сходство 0,77, 0,81 и 0,83; расширенные данные на рис. 9а). sSNV, выявленные у наших новорожденных доноров, также были похожи на те, у которых были подтверждены мозаичные изменения в развитии (косинусоидальное сходство 0,82, 0,85 и 0,88, расширенные данные на рис. 9а). Сигнатура A2 сгруппирована с COSMIC сигнатурой SBS30 (косинусоидальное сходство 0,82) (расширенные данные на рис. 8с). Частота характерных мутаций A2 не коррелирует с уровнями экспрессии генов нейронов и увеличивается в межгенных областях (рис. 4f), что согласуется с тенденциями, наблюдаемыми для SBS30 (база данных COSMIC). В соответствии с его обогащением генами, экспрессируемыми на низких уровнях, сигнатура A2 в мозге человека обогащена в состояниях хроматина, обнаруживаемых в местах слабой транскрипции, и обеднена в подавленных и слабо подавляемых участках polycomb (рис. 4h и дополнительная таблица 14; критерий хи-квадрат).
Тем не менее, сигнатура A2 отличается от SBS30 некоторыми ключевыми особенностями. SBS30 содержит почти исключительно варианты C>T, и эти варианты ограничены CpG-динуклеотидами (расширенные данные, рис. 9в). Напротив, сигнатура A2 содержит замены в дополнение к C>T, такие как C>A, которые мы ранее связывали с повышенным окислительным повреждением ДНК при старении, и T>C, которое увеличивается с возрастом7,8. Аналогично подтвержденным клональным мозаичным мутациям, выявленным в ходе других исследований с использованием методов, отличных от non-scWGS39-41, сигнатура A2 демонстрирует вклад SBS1 и SBS5 в дополнение к SBS30 (расширенные данные, рис. 9b). Сигнатура A2 показывает большее количество вариантов CpG>TpG, чем у SBS30,это позволяет предположить, что дезаминирование метилированных цитозинов играет определенную роль в генезе сигнатуры A2, как это происходит в подтвержденных мозаиках (расширенные данные, рис. 9c). Высокая концентрация C>T в CpG-динуклеотидах отличает биологические признаки мутаций от технических в геномике одноклеточных7,42.
Различия, наблюдаемые между сигнатурами A1 и A2 в отношении скорости их накопления в год, их дифференциальной корреляции с экспрессией генов в нейронах, их различной относительной нагрузки в генных и негенных областях и их дифференциальной корреляции с состояниями хроматина мозга, подтверждают предположение о том, что эти сигнатуры представляют собой биологически различные компоненты общего SBS5- подобного спектра мутаций, наблюдаемого в отдельных нейронах человека. Сигнатура A1 является основным источником возрастных SNV в нейронах и коррелирует с экспрессией генов в нейронах, подтверждая, что транскрипция напрямую определяет частоту нейрональных sSNV. Сигнатура A2, по-видимому, более активна в процессе развития и в раннем возрасте, но мутации сигнатуры A2 продолжают накапливаться в процессе старения в транскрипционно неактивных локусах.
Gene length, transcription and mutation in ageing
Соматические мутации возникают в результате повреждения ДНК, которые происходят по-разному. При старении во многих органах происходит снижение регуляции работы длинных генов — эффект, который объясняется естественным повышением вероятности случайного повреждения ДНК, блокирующего транскрипцию. 43-45. Мы обнаружили, что частота sSNV коррелирует с экспрессией нейрональных генов6,7 (рис. 4с), что позволяет предположить связь между транскрипцией и повреждением ДНК. Неизвестно, как длина гена и уровень экспрессии связаны с изменениями транскрипции при старении и коррелируют ли различия в характере соматических мутаций, основанные на размере гена или транскрипции, с возрастными изменениями.
Чтобы исследовать влияние длины гена и уровня экспрессии на изменения транскрипции при старении, мы провели множественный линейный регрессионный анализ. Мы обнаружили, что высокая базовая экспрессия предсказывает снижение экспрессии у пожилых доноров (рис. 5а, Дополнительный рис. 9а и дополнительная таблица 15). Мы подтвердили эту взаимосвязь, используя данные о массовой экспрессии генов в мозге, полученные от консорциума GTEx. Однако более выраженный эффект наблюдался в отношении размера гена. Была выявлена положительная корреляция между длиной гена и экспрессией в нейронах пожилого возраста по сравнению со взрослыми нейронами. Другими словами, более длинные гены с большей вероятностью сохранят или увеличат свою экспрессию во время старения, и, в отличие от других органов, гены с пониженной регуляцией в нейронах, скорее всего, будут короткими. Значительный, но менее выраженный эффект наблюдался также в отношении длины экзона и экспрессии, что позволяет предположить, что этот эффект был обусловлен в основном длиной гена, а не длиной транскрипта. Этот эффект удлинения был сильнее в возбуждающих и тормозящих нейронах (R = 0,59 и 0,57 соответственно), чем в глии (средний R = 0,35), а гены с пониженной регуляцией в нейронах были короче, чем в глии (рис. 5b), что указывает на специфический для типа клеток эффект. Несмотря на то, что наши данные противоречат взаимосвязи, наблюдаемой во многих тканях, они согласуются с данными, полученными из лобной коры мышей
45 и ганглиозных клеток сетчатки, в которых сохраняется длительная экспрессия генов в течение старения
45.
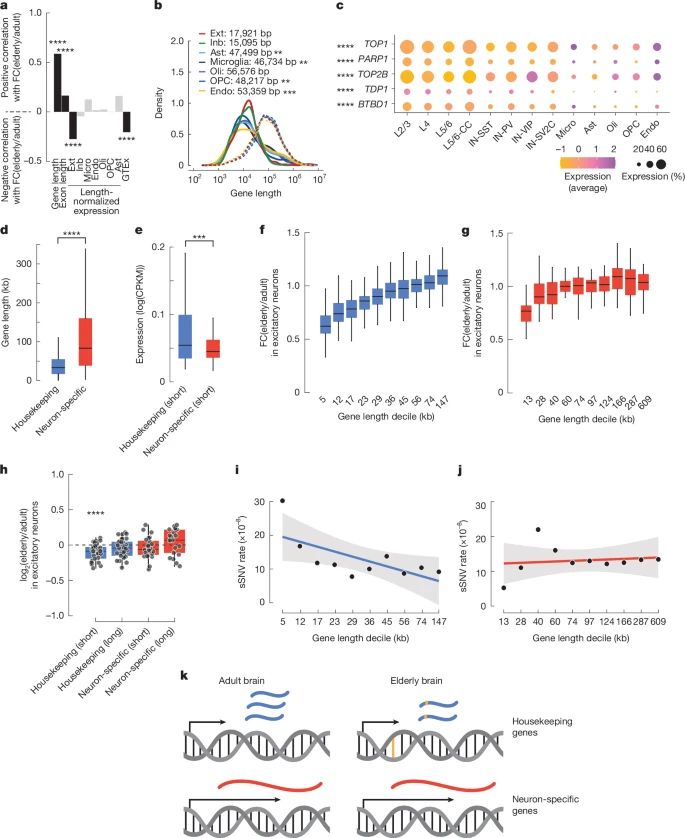 Рис. 5. Снижение регуляции генов при старении связано с размером гена, уровнем экспрессии, типом гена и распространенностью sSNV.
Рис. 5. Снижение регуляции генов при старении связано с размером гена, уровнем экспрессии, типом гена и распространенностью sSNV.
Больший процент нейронов, чем не нейронов, экспрессирует топоизомеразы TOP1 и TOP2B, а также топоизомеразные взаимодействующие элементы PARP1, TDP1 и BTBD1 (P = 8,17 x 10-5; критерий суммы рангов Уилкоксона) (рис. 5в). Нейроны полагаются на активность топоизомеразы, чтобы смягчить напряжение кручения, возникающее при раскручивании нейрональных генов во время транскрипции46, которые, как правило, длиннее, чем широко экспрессируемые гены домашнего хозяйства47 (рис. 5d), что позволяет предположить, что высокая экспрессия топоизомеразы защищает длинные гены в нейронах.
Результаты нашей модели множественной линейной регрессии в целом согласуются с результатами анализа GO, который показал, что гены "домашнего хозяйства" снижаются при старении (рис. 3c), поскольку гены "домашнего хозяйства", как правило, короткие (рис. 5d) и имеют высокую экспрессию48-50 (рис. 5e и дополнительный рис. 9b,c).
Наш объединенный набор одноклеточных геномных и транскриптомных данных позволил нам исследовать взаимосвязь между размером гена, повреждением генома и возрастными изменениями экспрессии на уровне отдельных нейронов. Поскольку длина гена и его функция в головном мозге взаимосвязаны (нейрональные гены, как правило, имеют большую длину), мы отдельно проанализировали взаимосвязь между длиной гена и изменением экспрессии при старении возбуждающих нейронов в специфичных для нейронов генах и генах домашнего хозяйства. Гены домашнего хозяйства показали положительную корреляцию между длиной гена и изменением экспрессии при старении (R2 = 0,50, P = 1,35 x 10-281) (рис. 5f и дополнительный рис. 10), так что самые короткие гены были наиболее подавлены, в то время как самые длинные не показали изменений или слегка увеличились в старых клетках. Этот паттерн напоминал подавление активности коротких генов, наблюдаемое в общем транскриптоме (рис. 5б). Однако между нейронспецифическими генами наблюдалась значительно более слабая взаимосвязь (преобразование Фишера от r к z, P = 2,08 x 10-11) между длиной гена и изменением экспрессии в мозге пожилых людей (R2 = 0,20, P = 1,24 x 10-3) (рис. 5g и дополнительный рис. 11).. Эти выводы были подтверждены анализом ранее опубликованных наборов данных и анализом наших данных с использованием различных группировок или с использованием метода линейной модели (расширенные данные, рис. 10). Анализ MERFISH 33 генов короткого домоводства, 33 генов длинного домоводства, 24 генов, специфичных для коротких нейронов, и 21 гена, специфичных для длинных нейронов, подтвердил снижение активности генов короткого домоводства в образцах от пожилых доноров по сравнению с образцами от взрослых доноров (P = 3,4 x 10-5, критерий суммы рангов Уилкоксона) и не выявил каких-либо существенных изменений в длинных генах ведения хозяйства или нейронспецифичных генах любого размера (рис. 5h).
В пределах классов генов частота sSNV отражала изменения в экспрессии при старении; в генах домашнего хозяйства, частота sSNV снижалась по мере увеличения длины гена (R2 = 0,44, P = 3,52 x 10-2) (рис. 5i и дополнительная таблица 16), тогда как в генах, специфичных для нейронов, не было выявлено значимой взаимосвязи между длиной и частотой SNV генов (R2 = 0,02, P = 0,706) (рис. 5j и дополнительная таблица 16). Эти данные свидетельствуют о том, что существуют различные модели повреждения и репарации ДНК в генах, отвечающих за ведение домашнего хозяйства, и в генах, специфичных для нейронов (рис. 5к). Таким образом, длина гена, его функция и повреждение генома в совокупности влияют на транскриптом стареющего мозга.
Discussion
Здесь мы использовали snRNA-seq, scWGS и пространственную транскриптомику для изучения геномных и транскриптомных изменений в головном мозге в течение жизни. Мы пришли к выводу, что короткие гены домашнего хозяйства с высокой экспрессией демонстрируют высокую скорость накопления sSNV в течение жизни, что коррелирует со снижением экспрессии. К такому выводу нас подводят несколько свидетельств. Во-первых, функции ведения домашнего хозяйства были наиболее часто используемыми терминами GO для обозначения генов с пониженной регуляцией, в частности, доминирующих в нейронах, в то время как специфичные для нейронов гены в целом оставались неизменными при старении без существенных изменений в экспрессии. Во-вторых, гены ведения домашнего хозяйства были короткими и с высокой экспрессией, что согласуется с предыдущей литературой. В-третьих, частота sSNV в нейронах коррелирует с уровнями экспрессии генов в нейронах. Действительно, самые короткие гены домашнего хозяйства, которые показали высокий уровень экспрессии, показали самый высокий уровень sSNV. Наконец, модель множественной линейной регрессии показала, что высокая экспрессия коррелирует с вероятностью снижения регуляции транскрипции при старении, а большая длина гена коррелирует с поддержанием или повышением уровня транскрипции при старении. Взаимосвязь между длиной гена и транскриптомом старения была предметом любопытства в этой области, но до сих пор эта связь варьировала в зависимости от тканей43-45. Наш анализ показывает, что в нейронах длинные гены, связанные с идентичностью клеток, сохраняются при старении, в то время как короткие гены домашнего хозяйства накапливают соматические мутации и уменьшаются в количестве в течение жизни.
Эту взаимосвязь можно объяснить несколькими механизмами. Во-первых, мутации могут непосредственно генерировать преждевременные стоп-кодоны или изменять паттерны сплайсинга РНК, вызывая нонсенс-опосредованный распад мутантных транскриптов. Во-вторых, аберрантные процессы репарации ДНК, участвующие в возникновении соматических мутаций, вызывают локальную эпигенетическую дисрегуляцию51, что влияет на уровни транскриптов. В-третьих, дифференциальная репарация генов, отвечающих за ведение домашнего хозяйства, и генов, специфичных для нейронов, может играть определенную роль в различиях в распространении sSNV. Недавно было показано, что повреждения одноцепочечной ДНК сохраняются в клетках человека в течение длительных периодов времени - вплоть до лет — в отсутствие активной репарации ДНК 52. Частота sSNV может быть высокой в коротких генах с высокой экспрессией, поскольку они демонстрируют преимущественную репарацию ДНК, связанную с транскрипцией53-55, это означает, что повреждения ДНК, возникающие во время транскрипции56, могут быть эффективно преобразованы в постоянные двухцепочечные мутации из-за ошибок репарации. Нейроны могут отличаться от клеток других органов из-за их постмитотической природы или из-за высокой экспрессии генов топоизомеразы, которые защищают длинные гены.
Наша работа также выявила другие изменения в мозге человека в течение здорового образа жизни. В мозге младенца мы выявили популяции незрелых нейронов и астроцитов, а также повышенное соотношение предшественников олигодендроцитов к зрелым олигодендроцитам, что подтверждает предположение о том, что развитие клеток мозга продолжается после рождения. В соответствии с предыдущей работой, scWGS показали, что sSNV с общим спектром, напоминающим Discussion SBS5, увеличиваются в стареющих нейронах. Анализ сигнатур de novo выявил две сигнатуры, A1 и A2, в которых преобладают переходы T>C и C>T, соответственно, которые группируются с известными соматическими мутационными сигнатурами при раке, SBS5 и SBS30, соответственно. Этиология SBS5 неизвестна, но сообщалось, что он действует подобно часовому механизму в головном мозге и других тканях8,9,32,37. Сигнатура A2 несколько напоминает SBS30 и содержит варианты C>A и T>C — типы мутаций, которые связаны с окислительным повреждением ДНК и старением, соответственно. SBS30 был связан со снижением активности базового белка репарации при удалении NTHL1, а наша предыдущая работа связала варианты нейронов C>A с базовым белком репарации при удалении OGG1. Наши данные snRNA-seq показали, что и NTHL1, и OGG1 экспрессируются в нейронах, и что эта экспрессия остается динамичной в процессе старения, но необходимы дальнейшие исследования, чтобы связать эти изменения с сигнатурой A2. Мы отмечаем, что, несмотря на большое сходство между сигнатурой A2 и SBS30, A2 в нейронах отличается от этой сигнатуры опухоли более высокими уровнями C>T в CpG-динуклеотидах. Сигнатура A1 была обогащена кодирующими областями, высоко экспрессируемыми генами и известными открытыми участками хроматина, тогда как A2 демонстрировала противоположную картину, будучи обогащенной некодирующими областями, с наибольшим количеством репрессированных генов и локусами, несущими репрессивные хроматиновые метки.
Поскольку применение scWGS-технологий расширяется и включает в себя другие типы клеток головного мозга, станет возможным дальнейшее изучение взаимосвязи между соматическими мутациями и экспрессией генов в процессе старения. Это расширит понимание исследователями геномного и транскриптомного ландшафта стареющего мозга.
 Рис. 1: Схема исследования и характеристика капельного snRNA-seq в PFC человека.
Table 1 Sample information for snRNA-seq and scWGS
/div>
Рис. 1: Схема исследования и характеристика капельного snRNA-seq в PFC человека.
Table 1 Sample information for snRNA-seq and scWGS
/div>
 Рис. 2. Изменения в транскрипционном состоянии клеток головного мозга на протяжении всей жизни человека.
Рис. 2. Изменения в транскрипционном состоянии клеток головного мозга на протяжении всей жизни человека.
 Рис. 3. Общее снижение активности генов в клетках разных типов.
Рис. 3. Общее снижение активности генов в клетках разных типов.
 Fig. 4: scWGS reveals sSNV mutational signatures linked to expression.
Fig. 4: scWGS reveals sSNV mutational signatures linked to expression.
 Рис. 5. Снижение регуляции генов при старении связано с размером гена, уровнем экспрессии, типом гена и распространенностью sSNV.
Рис. 5. Снижение регуляции генов при старении связано с размером гена, уровнем экспрессии, типом гена и распространенностью sSNV.