Patterned invagination prevents mechanical instability during gastrulation | |
|---|---|
|
Mechanical forces are crucial for driving and shaping tissue morphogenesis during embryonic development1,2,3. However, their relevance for the evolution of development remains poorly understood4. Here we show that an evolutionary novelty of fly embryos—the patterned embryonic invagination known as the cephalic furrow5,6,7—has a mechanical role during Drosophila gastrulation. By integrating in vivo experiments and in silico simulations, we demonstrate that the head–trunk boundary of the embryo is under increased compressive stress due to the concurrent formation of mitotic domains and germ band extension and that the cephalic furrow counteracts these stresses, preventing mechanical instabilities during gastrulation. Then, by comparing the genetic patterning of species with and without the cephalic furrow, we find evidence that changes in the expression of the transcription factor buttonhead are associated with the evolution of the cephalic furrow. These results suggest that the cephalic furrow may have evolved through the genetic stabilization of morphogenesis in response to the mechanical challenges of dipteran gastrulation. Together, our findings uncover empirical evidence for how mechanical forces can influence the evolution of morphogenetic innovations in early development.
|
Морфогенез - это процесс, который формирует эмбриональные ткани с помощью генерируемых клетками механических сил1,2. Эти силы управляют движениями тканей, которые толкают и притягивают соседние участки. Такие физические взаимодействия предоставляют важную информацию эмбриональным клеткам и в конечном итоге формируют морфологию тканей и органов3. Несмотря на важность механических воздействий для эмбриогенеза, их роль в эволюции морфогенеза остается неуловимой4. Чтобы исследовать эволюционное взаимодействие между генетикой и механикой, мы изучили загадочную эпителиальную складку, которая образуется у мух на границе головы и туловища во время гаструляции: головную борозду5,7.
Форма головной борозды находится под строгим генетическим контролем. У дрозофилы она начинается в виде парных боковых углублений, которые инвагинируют, образуя глубокую эпителиальную складку на границе между головой и туловищем 5-7. Её положение вдоль переднезадней оси определяется зиготической экспрессией двух транскрипционных факторов, buttonhead (btd) и even skipped (eve), которые перекрываются на границе головы и туловища несколькими рядами клеток бластодермы8. Эти клетки-инициаторы стимулируют инвагинацию, сокращаясь вдоль апикобазальной оси за счет латерального сокращения миозина9, в то время как механическая связь между клетками обеспечивает распространение морфогенетической волны сворачивания ткани9,10. Образующаяся складка охватывает всю боковую поверхность, что делает головную борозду характерным признаком гаструляции у дрозофилы5,6.
В отличие от других эмбриональных инвагинаций, у головной борозды нет очевидной функции в процессе развития. Несмотря на свою выпуклость и узорчатость, она не приводит к возникновению определенных структур и разворачивается, не оставляя следов5. Было высказано предположение, что инвагинация может служить временным хранилищем11 или якорем для тканей во время гаструляции12,13, но эти гипотезы не были исследованы in vivo или в филогенетическом контексте. Головная борозда является эволюционным новшеством двукрылых мух14, что делает ее идеальной моделью для исследования эволюции паттернов морфогенетических процессов в эмбриональном развитии.
Наша работа объединяет генетику и механику, чтобы раскрыть роль развития и закономерности эволюции головной борозды. Сначала мы покажем, что отсутствие головной борозды увеличивает механическую нестабильность эпителия бластодермы и что основными источниками механического стресса являются образование митотических доменов и расширение зародышевой полосы. Затем мы демонстрируем, что формирование головной борозды поглощает эти сжимающие напряжения и уменьшает нестабильность эпителия на границе головы и туловища. Это позволяет предположить, что головная борозда играет механическую роль во время гаструляции. Затем мы сравнили экспрессию генов "голова–туловище" у разных видов с головной бороздой и без нее. Мы обнаружили, что типичное перекрытие btd–eve, которое требуется для определения клеток-инициаторов у дрозофилы, отсутствует у видов без головной борозды. Это указывает на то, что изменения в экспрессии btd на границе головы и туловища связаны с эволюцией головной борозды. В совокупности эти результаты позволяют предположить, что создание новой области экспрессии генов, возможно, способствовало генетической стабилизации морфогенеза головной борозды и что основным фактором отбора, возможно, была механическая нестабильность во время гаструляции.
Analyses of cephalic furrow mutants Чтобы понять физические последствия нарушения формирования головной борозды у дрозофилы, мы исследовали динамику тканей на границе головы и туловища у известных мутантов головной бороздs: btd, eve и prd8,15. С этой целью мы создали флуоресцентные линии, несущие аллель с потерей функции этих генов, и визуализировали эмбрионы в целом с помощью световой микроскопии с высоким временным разрешением, чтобы выявить различия в событиях развития и охарактеризовать мутантные фенотипы во время гаструляции (рис. 1а).
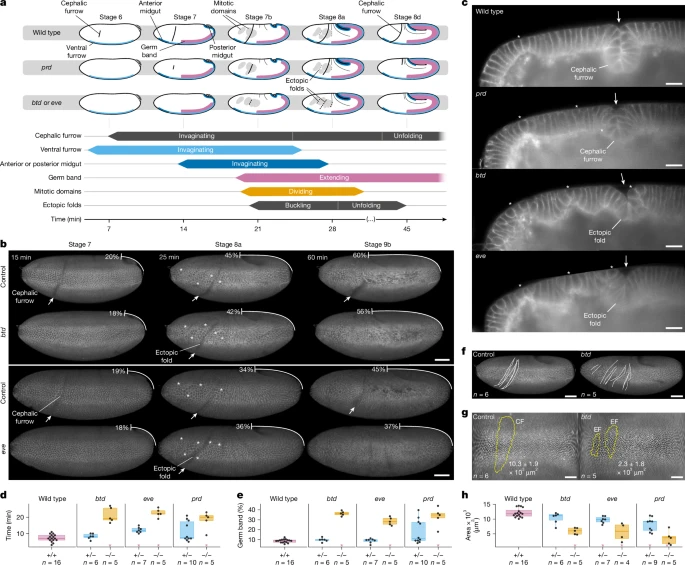 Fig. 1: Formation of ectopic folds in cephalic furrow mutants. Fig. 1: Formation of ectopic folds in cephalic furrow mutants.
Formation of ectopic folds Сначала мы проанализировали поведение клеток-инициаторов в трех мутантных группах. Типичное укорочение инициаторов нарушено у мутантов prd и сильно нарушено у мутантов btd и eve (Расширенные данные, рис. 1, Дополнительное видео 1 и дополнительное примечание 1). Нарушение укорочения клеток-инициаторов связано с выраженным фенотипом у мутантов btd и eve: образованием поздних эпителиальных складок вблизи места канонической головной борозды (рис. 1b,c и расширенные данные рис. 1a). Эти эктопические складки, как они будут называться далее, ранее наблюдались у мутантов btd и eve8,9. Однако механизмы, вызывающие их образование, и их связь с головной бороздой не были исследованы.
Эктопические складки появляются на границе головы и туловища у эмбрионов btd и eve примерно через 20 минут после гаструляции, когда зародышевая полоска удлиняется на 35% от длины яйца (таблица 1, рис. 1a–e и дополнительные видео 2 и 3). Хотя внешне они могут напоминать головную борозду, эктопические складки лишены типичной симметрии и динамики формирования инвагинации дикого типа7. Их расщелина рыхлая и асимметричная, без клиновидных или дугообразных (wedge-shaped или arched-shaped) клеток (рис. 1в и дополнительные видео 4 и 5); они занимают четверть площади и одну пятую глубины головной борозды (таблицы 2 и 3, рис. 1г, н и расширенные данные Рис. 2b,f); а также они быстрее складываются и раскладываются (рис. 1a,b, Расширенные данные фиг. 1a и 2c–e и дополнительное видео 6). Кроме того, эктопическая складчатость более изменчива, чем образование головной борозды, поскольку положение эктопических складок вдоль области голова–туловище отличается у отдельных мутантных эмбрионов (рис. 1f, Расширенные данные Рис. 2a, Дополнительные видео 7 и 8 и дополнительный рис. 1). В совокупности эти различия в морфологии, сроках и расположении позволяют предположить, что эктопические складки и мозговая борозда формируются с помощью различных механизмов.
Таблица 1. Относительные временные различия между событиями развития у мутантов с мозговой бороздой
Таблица 2 Площадь поверхности эктопических складок у мутантов с головной бороздой
Таблица 3 Максимальная глубина эктопических складок у мутантов с головной бороздой
Эктопические складки также могут появляться у гетерозиготных эмбрионов и эмбрионов дикого типа, но с меньшей частотой и меньшими размерами. Хотя более 92% гомозиготных эмбрионов btd и eve имеют одну или более эктопических складок (2,2 ± 0,4 и 1,8 ± 0,6 соответственно; Расширенные данные на рис. 2h и дополнительное видео 8), от 18% до 27% гетерозигот и около 78% эмбрионов дикого типа образуют эктопическую складку спереди или сзади от головной борозды во время гаструляции (таблица 4 и расширенные данные на рис. 2i,j). Площадь этих эктопических складок, однако, значительно меньше, примерно на четверть от площади эктопических складок у эмбрионов btd и eve (таблица 2 и расширенные данные, рис. 2g, k–n). Эти наблюдения свидетельствуют о том, что граница раздела головы и туловища у дрозофилы является областью, склонной к образованию эктопических складок во время гаструляции, и что отсутствие головной борозды увеличивает интенсивность этих эктопических складок.
Таблица 4. Статистика складчатости у мутантов с головными бороздами
Таблица в натуральную величину
Evidence of tissue compression Хотя мы не можем исключить возможность того, что дефекты рисунка могут способствовать образованию эктопических складок, вариабельность эктопических складок позволяет предположить, что, в отличие от головной борозды, эктопические складки не находятся под генетическим контролем и формируются в результате физических взаимодействий в ткани. Наш анализ показывает, что формирование эктопических складок пространственно и во времени совпадает с двумя другими процессами гаструляции: расширением митотических доменов и удлинением зародышевой полосы (рис. 1а, в).
Митотические домены - это группы клеток бластодермы, которые синхронно делятся в течение ядерного цикла14, впервые появляясь на головке эмбриона через 20 мин после гаструляции6. У мутантов btd и eve эктопические складки образуются между митотическими доменами или рядом с ними (рис. 2а). Когда митотические клетки начинают делиться, они теряют свое базальное прикрепление, округляются с апикальной стороны и более чем удваивают свою апикальную площадь во время анафазы (дополнительный рис. 2а). Это апикальное расширение сжимает соседние неделящиеся клетки, которые первыми сворачиваются внутрь (рис. 2b). Митотическое расширение всегда предшествует эктопическому сворачиванию (таблица 1, рис. 2c, d и расширенные данные на рис. 1a). Это позволяет предположить, что образование митотических доменов может вызывать нестабильность в монослойном эпителии, способствуя появлению эктопических складок.
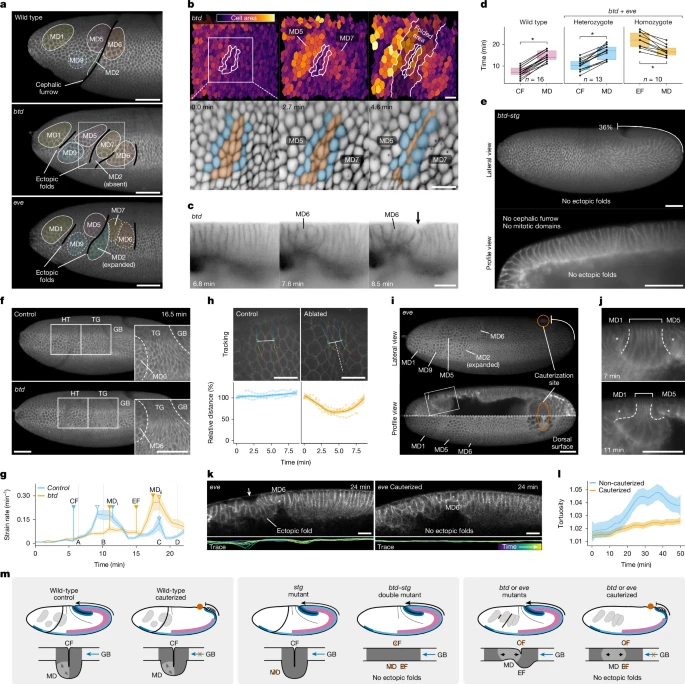 Рис. 2: Роль митотических доменов и зародышевой полосы в эктопическом складывании. Рис. 2: Роль митотических доменов и зародышевой полосы в эктопическом складывании.
Чтобы оценить механические силы, действующие на ткани, мы измерили скорость деформации тканей (strain rate) в областях "голова–туловище" и "туловище–зародыш" с помощью велосиметрии изображения частиц (рис. 2f). На границе головы и туловища у контрольных эмбрионов наблюдается пик скорости деформации, который коррелирует с поздней фазой формирования головной борозды, когда клетки–инициаторы перемещаются в желток (рис. 2g, Дополнительный рис. 2b и дополнительное видео 9). У мутантов с btd это отсутствует. Вместо этого мутанты демонстрируют более высокий пик скорости деформации, который совпадает с максимальным расширением митотических доменов во время телофазы и сворачивания ткани (рис. 2g, Дополнительный рис. 2b и дополнительное видео 9). Это говорит о том, что митотические расширения могут вызывать значительную локальную деформацию тканей.
На границе ствол–зародыш (trunk–germ), клетки между задним митотическим доменом и расширяющейся зародышевой полосой становятся все более анизотропными (рис. 2f). Скорость деформации в этой области со временем неуклонно возрастает (дополнительный рис. 2в), что свидетельствует о том, что ткань подвергается повышенному сжатию. Чтобы проверить эту гипотезу, мы выполнили лазерные надрезы на границе ствол–зародыш у эмбрионов дикого типа. Мы удалили апикальную мембрану нескольких клеток (3-4), сделав надрезы, ориентированные перпендикулярно направлению распространения зародышевой полоски, а затем отследили расстояние между неаблированными клетками с каждой стороны надреза (рис. 2h). У контрольных эмбрионов это расстояние остается постоянным, но у эмбрионов с разрезами оно уменьшается сразу после разреза (рис. 2h). Этот результат позволяет предположить, что ткань, возможно, "сжимается сама по себе", что подтверждает гипотезу о том, что поверхность раздела ствол–зародыш находится под давлением расширяющейся зародышевой полосы.
В совокупности эти анализы позволяют предположить, что образование митотических доменов и расширение зародышевой полосы являются потенциальными источниками сжимающего напряжения, которое может способствовать образованию эктопических складок на границе головы и туловища во время гаструляции.
Mitotic domains and germ band Чтобы проверить роль митотических доменов и удлинения зародышевых полос в механической стабильности бластодермы, мы провели серию экспериментов in vivo.
Сначала мы задались вопросом, требуются ли митотические расширения для формирования эктопических складок. С этой целью мы создали двойную мутантную линию, лишенную как головной борозды, так и митотических доменов, используя аллели с потерей функции btd и string (stg), ортолога фосфатазы cdc25, которая регулирует образование митотических доменов у Drosophila16. Отсутствие митотических доменов у мутантов stg не влияет на формирование головной борозды или другие гаструляционные движения16 (Расширенные данные на рис. 3а,б и дополнительные видеоролики 10 и 11). Однако отсутствие митотических доменов у двойных мутантов btd–stg подавляет образование эктопических складок (рис. 2e, расширенные данные рис. 3c, d и дополнительные видеоролики 12 и 13). Это указывает на то, что митотические расширения необходимы для появления эктопических складок у мутантов с головной бороздой.
Далее мы проверяли, требуется ли расширение зародышевой полосы для образования эктопических складок. Чтобы предотвратить распространение зародышевой полоски, мы прижгли участок заднедорсальной ткани в начале гаструляции, чтобы механически прикрепить его к желточной оболочке (рис. 2i и расширенные данные рис. 3e). Блокирование удлинения зародышевой полоски у эмбрионов дикого типа не предотвращает образование головной борозды (расширенные данные на рис. 3е), поскольку клетки-инициаторы генерируют напряжение в эпителии головы и туловища автономно (дополнительная фиг. 3); инвагинация у прижженных эмбрионов дикого типа примерно на 15% меньше, но разница не была статистически значимой по сравнению с контролем (расширенные данные, рис. 3f). Напротив, когда мы блокируем расширение зародышевой полосы у мутантов btd и eve, эктопические складки на границе головы и туловища не появляются (рис. 2i и дополнительные видеоролики 14-16). Митотические расширения по-прежнему сжимают неделящиеся соседние клетки, но деформация не происходит (рис. 2j). Эпителий прижженных мутантных эмбрионов подвергается меньшей деформации и эктопическому сворачиванию, чем образцы, не подвергшиеся прижиганию (рис. 2k,l и расширенные данные рис. 3g,h). Эти эксперименты показывают, что удлинение зародышевой полоски необходимо для появления эктопических складок у мутантов с головной бороздой.
В целом, мы пришли к выводу, что ни митотические домены, ни зародышевая полоска сами по себе не могут вызвать образование эктопических складок, но когда оба события происходят на одной и той же стадии развития, монослой эпителия эмбриона становится нестабильным и более склонным к прогибанию (рис. 2м).
Физическая модель динамики складывания Чтобы определить относительный вклад митотических доменов и удлинения зародышевых полос в качестве источников механического напряжения на границе головы и туловища, мы создали физическую модель бластодермы и провели моделирование in silico механики ткани в условиях мутантного и дикого типа.
Конструкция и общие свойства WTНаша модель представляет собой монослой эпителия, заключенный в жесткую оболочку (рис. 3а, расширенные данные Рис. 4а и дополнительное примечание 2). Монослой состоит из равноудаленных частиц, соединенных пружинками. Митотические домены - это области с более высокой плотностью частиц, которые имеют тенденцию к расширению; головная борозда - это область с характерной отрицательной кривизной, которая имеет тенденцию к инвагинации; а зародышевая полоса - это статический предел на заднем конце монослоя (рис. 3б). В этой ткани общая энергия на единицу длины (WT) равна сумме составляющих энергии растяжения (Ws) и изгиба (Wb), каждая из которых связана с жесткостью при растяжении ( Ks*) и изгибе ( Kb*). Мы объединили эти два параметра в единый безразмерный показатель жесткости при изгибе (Kb*
) и использовали его в качестве основного параметра в модели и моделировании (рис. 3в).
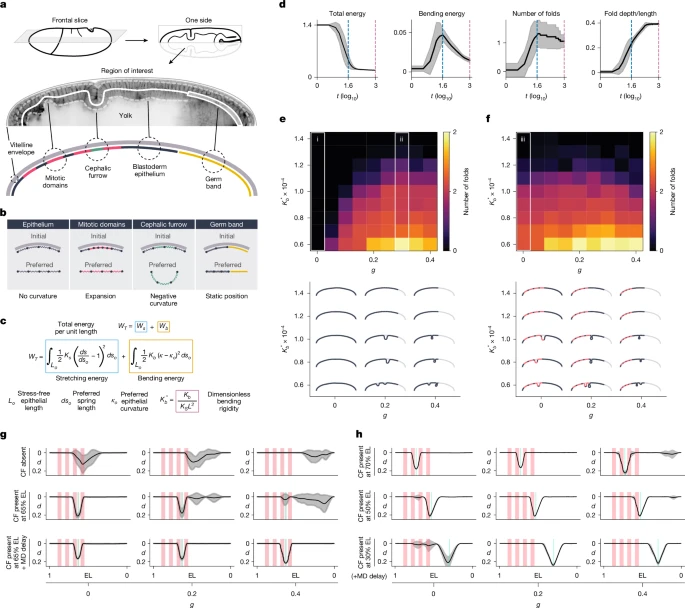 Рис. 3: Модель и моделирование механики сгибания. Рис. 3: Модель и моделирование механики сгибания.
Чтобы охарактеризовать энергетическую динамику системы, мы провели моделирование, используя одно значение жесткости при изгибе и процент растяжения зародышевой полосы. Когда начинает формироваться складка, энергия изгиба увеличивается, высвобождая большое количество энергии растяжения, что уменьшает общую энергию системы (рис. 3d). Увеличение энергии изгиба совпадает с быстрым углублением складки. Как только энергия изгиба достигает пика, складка продолжает постепенно углубляться, но впоследствии количество складок редко меняется (рис. 3d и расширенные данные рис. 4b). Поскольку события сгибания являются стохастическими и происходят на разных итерациях в каждом моделировании, мы использовали пик энергии изгиба в качестве ориентира для стандартизации сравнения между моделированиями.
Ectopic folding in mutant conditions Чтобы получить реалистичные значения безразмерной жесткости
при изгибе, мы выполнили прогонку по пространству параметров в измененных условиях. Мы обнаружили, что количество эктопических складок выше в более мягких условиях (меньшая жесткость при изгибе; рис. 3e, f и расширенные данные рис. 4c,f). В моделировании без митотических доменов мы не наблюдали событий сворачивания без зародышевой полосы (рис. 3е, столбец i). При расширении зародышевой полосы вероятность изгиба увеличивается (рис. 3е, столбец i). 4d) и время складывания уменьшается (расширенные данные, рис. 4e). Изменение параметров показывает четкий переход в фазовом пространстве, при этом вероятность потери устойчивости достигает плато около Kb* 1.2 x 10-4(рис. 3e). В таких жестких условиях зародышевая полоска, даже при ее максимальном растяжении, не может стимулировать образование эктопических складок.
Добавление митотических доменов к моделированию изменило фазовую диаграмму, увеличив вероятность образования складок. Мы обнаружили, что при более низких значениях жесткости при изгибе ( Kb* менее или равно 1.0 x 10-4
) только митотические домены могут вызывать эктопическое сворачивание (рис. 3f, столбец iii). При более низких значениях удлинения зародышевой полоски количество складок выше (Расширенные данные на рис. 3f). 4g) и время сворачивания меньше (расширенные данные на рис. 4h), чем при моделировании без митотических доменов. Эти расчеты показывают, что зародышевая полоска или митотические домены сами по себе могут стимулировать эктопическое сворачивание только в более мягких условиях, но их совместное действие увеличивает механическую нестабильность тканей.
Чтобы определить, где находится реальный эмбрион в этом пространстве параметров, мы определили значение жесткости при изгибе в ходе моделирования, которое повторяет основное понимание наших экспериментальных данных о том, что ни митотические домены, ни зародышевая полоска сами по себе не могут способствовать эктопическому сворачиванию in vivo (рис. 2). В моделировании это соответствует жесткости при изгибе, при которой среднее число сгибов падает ниже 1 только для митотического домена и только для зародышевой полоски (расширенные данные рис. 4c,f). Критерий выполняется, когда Kb* приблизительно 1.0 x 10-4. Чтобы сравнить это значение с прямыми измерениями, мы рассчитали значения Kb* жесткости при изгибе для 3D-культивируемых эпителиальных монослоев17 (Дополнительное примечание 3). После корректировки на различия в толщине эпителия мы рассчитали a Kb* 2.05 x 10-4 для культивируемых монослоев. Это примерно в 2 раза превышает жесткость при изгибе эмбриональной бластодермы, которую мы оценили на основе наших экспериментальных данных, что позволяет предположить, что наше контрольное значение согласуется с существующими измерениями в других тканях. Таким образом, установив и подтвердив этот важный мостик между экспериментами и моделированием, мы использовали эту биологически значимую эталонную жесткость при изгибе для последующих симуляций.
Role of the cephalic furrow Вывод о том, что эктопические складки встречаются реже и уменьшаются в размерах при наличии головной борозды (таблицы 2-4, рис. 1 и расширенные данные на рис. 1). 2) предполагает, что инвагинация может противодействовать механической нестабильности, вызванной митотическими доменами и расширением зародышевой полосы, потенциально поглощая сжимающие напряжения на границе головы и туловища. Чтобы исследовать эту гипотезу о том, что цефалическая борозда является механическим буфером, мы проанализировали, как наличие инвагинации влияет на динамику эктопического складывания при моделировании.
Мы запрограммировали головную борозду в нашей модели, установив внутреннюю отрицательную кривизну ( K0CF) для узкой области бластодермы из частиц–пружин, которая соответствует размеру клеток-инициаторов in vivo (рис. 3а, б). Используя наше эталонное значение жесткости при изгибе Kb* 1.0 x 10-4, мы выполнили проверку параметров для различных K0CF и установили исходную точку, при которой инвагинация формируется устойчивым образом, с минимальной вариабельностью, и фенокопирует головную борозду in vivo ( K0CF более 0.3; Расширенные данные, рис. 4i).
Сначала мы оценили, как K0CF прочность влияет на эктопическое сворачивание. В условиях без зародышевой полосы (g = 0) образование головной борозды уменьшает распространение и частоту эктопических складок на границе головы и туловища (рис. 3g и расширенные данные на рис. 4l). Это уменьшение коррелирует с более высокой
прочностью (расширенные данные, рис. 4j). В условиях, когда зародышевая полоска расширена, эктопическая складчатость увеличивается в задней области и может препятствовать образованию головной борозды, когда K0CF менее или равно 1.0 а g более или равно 0.2 (Расширенные данные, рис. 4j). Таким образом, хотя более высокая сила натяжения более эффективна для предотвращенияэктопического складывания, противоречивые механические воздействия могут ослабить буферный эффект головной борозды.
В приведенных выше моделях головная борозда и митотические домены инициируются на одной и той же итерации. Однако у эмбрионов дикого типа головная борозда образуется за 15 минут до митотических доменов (рис. 1а). Чтобы соответствовать условиям in vivo и проверить, влияет ли их относительное время формирования на эктопическое сворачивание, мы отложили формирование митотических доменов относительно головной борозды при моделировании. В этом состоянии головная борозда очень эффективна в предотвращении эктопической складчатости даже при более низких K0CF
значениях (рис. 3g и расширенные данные рис. 4j, k,l). Эктопическая складчатость происходит только в задней области с расширенной зародышевой полосой (расширенные данные на рис. 4к), аналогично нашим наблюдениям у эмбрионов дикого типа in vivo (таблица 4 и расширенные данные на рис. 4к). 2i–m). Эти результаты показывают, что для предотвращения эктопического сворачивания важнее относительное время, а не сила натяжения.
Наконец, мы проверили, как положение головной борозды влияет на ее способность предотвращать эктопическое сворачивание. При моделировании без зародышевой полосы (g = 0,0) расположение головной борозды более спереди (более 70% длины эмбриона) по-прежнему эффективно предотвращает эктопическое сгибание головки по сравнению с положением дикого типа (65% длины эмбриона), но при расположении ее более сзади (менее 50% длины эмбриона), эктопическое сворачивание вокруг митотических доменов становится более частым (рис. 3h). И наоборот, при расширении зародышевой полоски (g = 0,4) расположение головной борозды более кзади (менее 30% длины эмбриона) предотвращает эктопическую складчатость в задней области, в то время как при расположении ее более кпереди (более 50% длины эмбриона) этого не происходит (рис. 3h). Эти результаты моделирования показывают, что головная борозда наиболее эффективна для предотвращения эктопической складчатости, когда она расположена на расстоянии от 40% до 60% длины эмбриона, в зависимости от процента удлинения зародышевой полоски.
Наша физическая модель обеспечивает теоретическую основу для того, чтобы эпителиальная складка, такая как головная борозда, формируясь до других морфогенетических изменений вокруг середины переднезадней оси, могла поглощать сжимающие напряжения и в значительной степени предотвращать механическую нестабильность эмбриональных тканей во время гаструляции.
Evolution of gene expression Как описано выше, наши анализы показывают, что эффективность головной борозды в предотвращении нестабильности эпителия зависит от положения и времени инвагинации. У дрозофилы этот пространственно–временной контроль определяется генетически комбинаторной экспрессией btd, eve и prd на границе головы и туловища 8,15. Однако конкретные генетические признаки, связанные с эволюцией каскада образования головной борозды, остаются неясными. Чтобы ответить на этот вопрос, мы идентифицировали дополнительные гены, связанные с головной бороздой, и проанализировали их экспрессию у видов двукрылых с головной бороздой и без нее.
Patterning of the cephalic furrow Чтобы идентифицировать гены головной борозды, мы провели скрининг в режиме реального времени (Дополнительное примечание 4) и обнаружили, что факторы транскрипции sloppy paired (slp) играют роль в расположении клеток-инициаторов у дрозофилы (Рис. 5 с расширенными данными, Дополнительное видео 17 и Дополнительное примечание 5). У эмбрионов дикого типа домены экспрессии slp1 и eve разграничивают границу головы и туловища от начала зиготической активации до гаструляции (рис. 4а и расширенные данные рис. 6а). Хотя ранние транскрипты slp1 ограничены передним концом, ранние транскрипты eve изначально распространены повсеместно18, но начинают удаляться с переднего конца в ядерного цикла 11 (расширенные данные на рис. 6а). В 13-м ядерном цикле два гена образуют обширные комплементарные области, соответствующие головным и туловищным участкам эмбриона, причем домены расположены рядом примерно на 70% длины эмбриона (расширенные данные на рис. 6а). Мы впервые обнаружили транскрипты btd и prd на этом интерфейсе (расширенные данные рис. 6а, б). На последующих этапах граница slp1–eve постепенно превращается в узкие примыкающие полосы, которые образуют ряд клеток-инициаторов (рис. 4а и расширенные данные рис. 6а). В совокупности эти данные свидетельствуют о том, что активность slp1 способствует ограничению передней границы экспрессии eve на ранних стадиях зиготической активации, определяя положение клеток-инициаторов вдоль переднезадней оси и, следовательно, место инвагинации головной борозды.
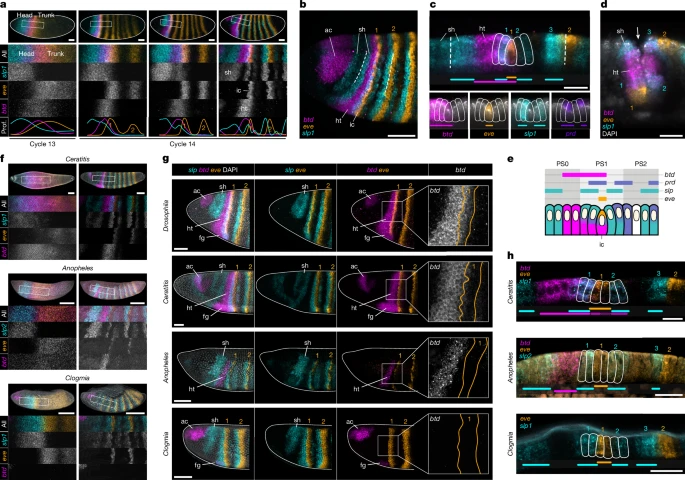 Рис. 4. Генетическая структура границы головы и туловища у Drosophila, Ceratitis, Anopheles и Clogmia. Рис. 4. Генетическая структура границы головы и туловища у Drosophila, Ceratitis, Anopheles и Clogmia.
В начале гаструляции экспрессия btd, eve, slp и prd на границе головы и туловища у дрозофилы формирует уникальный комбинаторный код, который совпадает с различными участками головной борозды (рис. 4b и расширенные данные рис. 6c). Центральный ряд клеток-инициаторов, экспрессирующих eve, окружен соседними клетками, экспрессирующими slp1, при этом экспрессия prd смещена на один ряд клеток относительно внутренних полос slp1 (рис. 4b–d и расширенные данные рис. 6b,c). Более того, клетки, экспрессирующие slp1, также разграничивают внешние края инвагинации (рис. 4d). Это молекулярное расположение нарушено у мутантов, у которых имеются дефекты головной борозды (btd, eve и prd; Расширенные данные на рис. 4d). 7 и дополнительное примечание 6). Это комбинаторное выражение предполагает, что каждый ряд имеет уникальную транскрипционную идентичность, а его нарушение у мутантов указывает на то, что этот специфический молекулярный профиль может быть важен для формирования структуры инвагинации у дрозофилы (рис. 4е).
Innovation at the head–trunk boundary Чтобы выявить различия в генетической структуре головы и туловища, связанные с эволюцией головной борозды, мы сравнили паттерны экспрессии у Drosophila с тремя другими видами двукрылых: один из семейства, о котором известно, что у него есть головная борозда, средиземноморская плодовая мушка Ceratis capitata (Tephritidae)19,20, а два других принадлежат к семейству Ceratis capitata (Tephritidae). к семействам, в которых не наблюдалось головной борозды14, малярийного комара Anopheles stephensi (Culicidae)21,22 и сливной мухи Clogmia albipunctata (Psychodidae)14,23.
Эти три вида демонстрируют ранние соседние домены slp и eve, разграничивающие области головы и туловища по схеме, очень похожей на схему дрозофилы (рис. 4a, f и расширенные данные рис. 8a–c). Более того, поздний паттерн примыкающих полосок slp и eve почти идентичен у четырех видов (рис. 4a, f, g), а экспрессия prd отличается только в Clogmia, где клетки, экспрессирующие prd, не отличаются от полосок slp и eve (расширенные данные, рис. 8d, e). Основное различие, которое мы наблюдали между видами с головной бороздой и без нее, заключается в экспрессии btd. Хотя домен голова–туловище btd перекрывается с полосой eve 1 у Drosophila и Ceratitis, он не перекрывается с eve у Anopheles и полностью отсутствует у Clogmia (рис. 4g, h). Перекрытие btd–eve также отсутствует у Chironomus, другого двукрылого, у которого отсутствует головная борозда14. Эти результаты позволяют предположить, что эволюция головной борозды, возможно, была связана с пространственными изменениями в экспрессии btd и возникновением перекрытия btd–eve на границе головы и туловища.
Discussion Наша работа посвящена изучению роли и эволюции головной борозды. Мы обнаружили, что ткани на границе головы и туловища дрозофилы подвергаются повышенному сжимающему напряжению из–за сопутствующего образования митотических доменов и расширения зародышевой полосы. Без головной борозды эти напряжения нарастают, а направленные наружу силы, возникающие при делении клеток в сжатом монослое эпителия, вызывают механическую нестабильность и деформацию тканей24,25 (Дополнительное примечание 7). Наши результаты свидетельствуют о том, что образование головной борозды нейтрализует эти сжимающие напряжения и предотвращает нестабильность эпителия на границе головы и туловища. Таким образом, мы предполагаем, что головная борозда играет механическую роль во время гаструляции у дрозофилы.
Эта физическая роль интригует и наводит на мысль о том, что головная борозда, возможно, развилась в ответ на механические проблемы гаструляции двукрылых, когда механическая нестабильность действует как избирательное давление. Поскольку это так, мы ожидаем, что механическая нестабильность будет пагубна для эмбриогенеза и приспособленности особей. Хотя механическое сжатие может вызвать высвобождение АТФ26, передачу сигналов кальция 27 и повреждение ДНК 28, а эктопическое сворачивание может потенциально нарушить передачу сигналов ближнего действия и межклеточные взаимодействия, изучение этих эффектов in vivo является сложной задачей. Однако есть свидетельства того, что ингибирование головной борозды с помощью оптогенетики увеличивает частоту искажения срединной вентральной линии 14, что позволяет предположить, что механическая нестабильность может влиять на устойчивость процессов развития.
Распределение признаков головной борозды по филогении двукрылых согласуется с гипотезой о механической нестабильности как избирательном воздействии (рис. 5 и расширенные данные рис. 9). Митотические домены и удлинение зародышевых полос — источники стресса — являются наследственными и развились до появления головной борозды, которая является производным признаком и эволюционной новизной циклоррафановых мух14 (рис. 5а). У видов без головной борозды клеточные деления на границе головы и туловища14 расположены вне плоскости, что является альтернативной стратегией для уменьшения сжимающих напряжений (рис. 5б). Поскольку установление перекрытия btd–eve связано с наличием головной борозды14 (фиг. 4 и 5а), различия в генетическом строении границы между головой и туловищем двукрылых, возможно, способствовали возникновению различных морфогенетических решений в ответ на аналогичное механическое избирательное давление (рис. 5б).
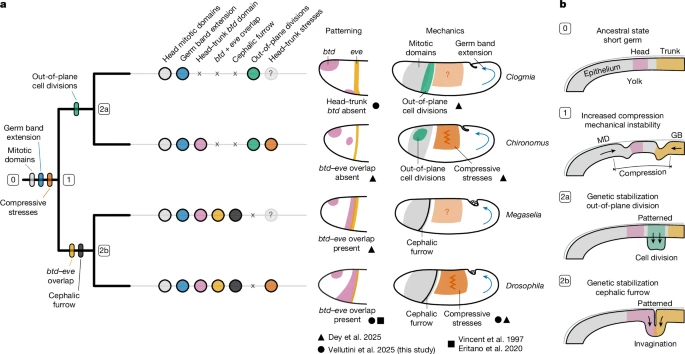 Рис. 5. Взаимодействие генетики и механики в процессе эволюции головной борозды. Рис. 5. Взаимодействие генетики и механики в процессе эволюции головной борозды.
Классические теоретические работы выдвинули гипотезу о том, что физические процессы были существенными движущими силами морфологических инноваций до появления генетических программ29-31. Результаты, описанные здесь и в ссылке 14, предоставляют дополнительные эмпирические доказательства того, что механические силы играют определенную роль в возникновении морфогенетических инноваций и что генетическая стабилизация механических конфликтов может быть более распространенным механизмом, создающим морфогенетическое разнообразие в эмбриональном развитии.
|