FH (Formin Homology) PROTEINS
Формину Гомологичные белки ( Wasserman,1998)
Table 1. FH Protein family members | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
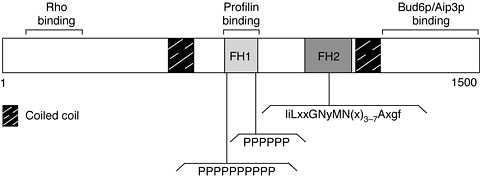 |
Рис. 1. Структура белка FH. FH белок длиной в 1500 , показано положение доменов FH1 и FH2, двух суперскрученных доменов и сайтов связывания для белков Rho, profilin и Bud6p семейств. Два гомополмерных пролина являются характерными для домена FH1. Последовательности, представленные ниже домена FH2 представляют собой наиболее законсервированную часть этого домена. Большими букывами показаны остатки с незначительной или отсутствием изменчивости, которые общи для 90% FH белков. Малыми буквами обозначены последовательности с ограниченной изменчивостью, присутствующие у 50% белков. Позиции, маркированные `x' имеют существенную изменчивость последдовательностей. figure 1. FH protein structure. Scale drawing of a generic FH protein, 1500 amino acids in length, indicating the position of the FH1 and FH2 domains, two coiled-coil domains and the binding sites for proteins of the Rho, profilin and Bud6p families. The two homopolymeric proline sequences are characteristic of the FH1 domain. The sequence listed below the FH2 domain represents the most highly conserved portion of this domain. Upper-case letters indicate residues with little or no sequence variation, with the indicated residue being common to at least 90% of the FH proteins. Lower-case letters indicate limited sequence variation, with the residue indicated being present at a frequency of at least 50%. Positions marked with an `x' have substantial sequence variation |
Все FH белки кроме CAPU содержат одну или более суперскрученные области. Обычно одна coiled-coil область лежит в N-терминальном домене по отношению FH1 и одна или две в С-терминальном домене по отношению к FH2 области. Суперскрученные домны обычны для цитоскелетных белков и обеспечивают для гомотипического и гетеротипического взаимодействия. Фенотипический анализ рецессивных мутаций показывает, что FH гены играют важную роль в цитокинезе у мух, червей и грибов. Drosophila dia аллель с частичной потерей функции обусловливает нарушение цитокинеза во время пролиферации зарордышевых клеток у взрослых самцов ; нулевые мутации летальны и дают высоко полиплоидные клетки. Мутация нематод с материнским летальным эффектом cyk-1 обнаруживает, что борозды дробления намечаются но вскоре регрессируют, давая многоядерные одноклеточные эмбрионы. Schizosaccharomyces pombe клетки, мутантные по cdc12 имеют дикого типа актиновый цитоскелет во время интерфазы, но имеют неправильно локализованные актиновые участки на месте актинового кольца во время митоза. Ген fus1 у S. pombe необходим для слияния спаривающихся отростков у конъюгирующих клеток. Мутации в локусе capu Drosophila нарушают векторизованные микротрубочками направляемые потоки цитоплазмы, но делают это, по-видимому, косвенно нарушая актиновый цитоскелет. Ген почкования дрожжей BNI1 участвует в зависимом от полярности процессе выбора места почкования и цитокинеза.
Дефект в гомологе diaphanous вызывает аутосомно доминантное нарушение слуха. Мутация сплайс-сайта нарушает С-терминальные 52 аминокислоты hDIA1 и обусловливает двухстороннюю глухоту у 78 из 147 взрослых членов косториканской семьи. Очевидно мишенью для hDIA1 действия служат волосковые клетки улитки, в основе которых ряды актиновых филамент.
FH белки располагаются в специфических цитоскелетных структурах
У клеток S. pombe, вступающих в митоз, cdc12 выявляется в виде кольца, совпадающего с кольцом деления клетки. Мушиный и мышиный Dia концентрируется в борозде дробления делящихся клеток(Рис.3).
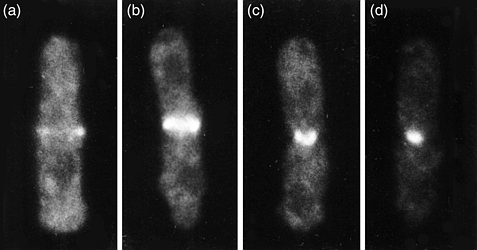 |
Рис. 3. cdc12 локализуется в кольце деления клетки у клеток дикого типа. Schizosaccharomyces pombe клетки : (a) ранний митоз, (b) ранняя анафаза, (c) средняя анафаза и (d) постанафаза. figure 3. cdc12 localizes to the cell-division ring in wild-type cells. Schizosaccharomyces pombe cells were fixed and processed for immunofluorescence using an antibody against cdc12 as described in Ref. 5. (a) early mitosis, (b) early anaphase, (c) midanaphase and (d) postanaphase. Photomicrographs courtesy of F. Chang, Columbia University, USA |
В интерфазе клетки S. pombe, экспрессирующие высокие количества cdc12, выявляются в виде отдельных точек, соответствующих сайту образования актинового кольца. Точки сходного размера и локализации возникают в результате избыточной экспрессии другого компонента актинового кольцаS. pombe , the Myo2 type II myosin heavy chain. Таким образом, комплекс, содержащий cdc12 и Myo2p является маркером плоскости перед сборкой актиновго кольца.
FH белки взаимодействуют непосредственно с профилином
Предполагается, что FH1 домены могут связываться in vivoс профилином, известным регулятором полимеризации актина. Способность профилина связываться с FH белками подтверждена у мух, дрожжей и человека. В Bni1p , взаимодействующая с профилином область картирована в FH1 домене и точнее в области в 50 аминокислот, которая начинается и кончается гомополимерным пролином .
FH белки взаимодействуют с добавочными актин-связывающими белками
Bni1p может связать по крайней мере один цитоскелетный компонент, the Bud6 или Aip3 белок помимо профилина. Bud6p, актин-связывающий белок, необходимый для цитоскелетной полярности у S. cerevisiae, связывается с С-терминальной частью Bni1p,вне домена FH2.
FH белки содержат также Rho-связывающий домен
Как только профилин функционально свяжется с FH белком и актиновым цитоскелетом, то члены Rho подсемейства GTP-связывающих белков связывают FH белки с клеточными путями передачи сигналов. Rho белки, Ras-related GTPases, регулируют адгезивность клеток, подвижность, выбор места почкования и процессы контракции.The Rho субсемейство включает Rho, Rac и Cdc42 белки, из которых Rho и Cdc42 необходимы для цитокинеза. Мышиные и дрожжевые FH белки взаимодействуют преимущественно с активированной или GTP-связанной формой этих членов подсемейства Rho.
В целом Rho белки способны организовать актиновый цитоскелет с помощью мультибелковых комплексов в специфических местах внутри клетки.
Rho-связывающий сайт картирован в has N-терминальной части трех FH белков хотя consensus Rho-связывающего сайта не выявлен (Рис.2).
Предполагается, что FH белки рекрутируются специфическими сайтами с помощью активированных Rho и в свою очередь рекрутируют профилин в этот сайт. Профилин затем регулирует формирование, стабилизацию или функцию контрактильного кольца благодаря его эффекту на полимеризацию актина. Взаимодействующие Rho и FH белки действуют параллельно в направлении локальной организации или активности актин–миозинового контрактильного аппарата.