Kenneth D Irvine
Current Opinion in Genetics & Development 1999, 9 No. 4:434-441.
Abbreviations
A–P—anterior–posterior;
D–V—dorsal–ventral;
Dpp—Decapentaplegic;
Hh—Hedgehog;
L-Fng—Lunatic Fringe;
R-Fng—Radical Fringe.
Serrate-mediated activation of Notch is specifically blocked by the product of the gene fringe in the dorsal compartment of the Drosophila wing imaginal disc.
Development 1997, 124: 2973–2981.
Fringe modulates Notch–ligand interactions.
Nature 1997, 387: 908–912.
Feed-back mechanisms affecting Notch activation at the dorsoventral boundary in the Drosophila wing.
Development 1997, 124: 3241–3251.
fringe, a boundary-specific signaling molecule, mediates interactions between dorsal and ventral cells during Drosophila wing development.
Cell 1994, 79: 595–606.
Radical fringe positions the apical ectodermal ridge at the dorsal-ventral boundary of the vertebrate limb.
Nature 1997, 386: 360–366.
Expression of Radical fringe in limb-bud ectoderm regulates apical ectodermal ridge formation.
Nature 1997, 386: 366–373.
A dominant-negative form of Serrate acts as a general antagonist of Notch activation.
Development 1997, 124: 3427–3437.
Secreted forms of DELTA and SERRATE define antagonists of Notch activation.
Development 1997, 124: 3439–3448.
Complex proteolytic processing acts on Delta, a transmembrane ligand for Notch, during Drosophila development.
Mol Biol Cell 1998, 9: 1709–1723.
Processing of the Notch ligand Delta by the metalloprotease Kuzbanian.
Science 1999, 283: 91–94.
Boundary formation in Drosophila wing: Notch activity attenuated by the POU protein Nubbin.
Science 1998, 281: 409–413.
nubbin encodes a POU-domain protein required for proximal–distal patterning in the Drosophila wing.
Development 1995, 121: 589–599.
Limbs and beyond the Radical Fringe.
Nature 1999, 399: 742–743.
Defects in somite formation in lunatic fringe-deficient mice.
Nature 1998, 394: 374–377.
lunatic fringe is an essential mediator of somite segmentation and patterning.
Nature 1998, 394: 377–381.
All limbs are not the same.
Nature 1998, 395: 230–231.
Dorsal-ventral signaling in the Drosophila eye.
Science 1998, 281: 2031–2034.
Dissection of cis-regulatory elements of the Drosophila gene Serrate.
Dev Genes Evol 1998, 208: 346–351.
A dorsal/ventral boundary established by Notch controls growth and polarity in the Drosophila eye.
Nature 1998, 396: 276–278.
Fringe is essential for mirror symmetry and morphogenesis in the Drosophila eye.
Nature 1998, 396: 272–276.
Positional information along the dorsal-ventral axis of the Drosophila eye: graded expression of the four-jointed gene.
Dev Biol 1996, 173: 428–446.
four-jointed is required for intermediate growth in the proximal-distal axis in Drosophila.
Development 1995, 121: 2767–2777.
white as a reporter gene to detect transcriptional silencers specifying position-specific gene expression during Drosophila melanogaster eye development.
Genetics 1995, 141: 1075–1086.
Dorsoventral patterning in the Drosophila retina by wingless.
Development 1998, 125: 567–577.
Pattern formation in a secondary field: a hierarchy of regulatory genes subdivides the developing Drosophila wing disc into discrete subregions.
Development 1993, 117: 571–584.
Araucan and caupolican, two members of the novel Iroquois complex, encode homeo-proteins that control proneural and vein-forming genes.
Cell 1996, 85: 95–105.
mirror encodes a novel PBX-class homeoprotein that functions in the definition of the dorsal-ventral border in the Drosophila eye.
Genes Dev 1997, 11: 1073–1082.
white+ transgene insertions presenting a dorsal/ventral pattern define a single cluster of homeobox genes that is silenced by the polycomb-group proteins in Drosophila melanogaster.
Genetics 1998, 149: 257–275.
Notch-mediated segmentation and growth control of the Drosophila leg.
Dev Biol 1999, 210: 339–350.
Notch signaling mediates segmentation of the Drosophila leg.
Development 1998, 125: 4617–4626.
The Serrate locus of Drosophila and its role in morphogenesis of the wing imaginal discs: control of cell proliferation.
Development 1994, 120: 535–544.
Temperature-sensitive periods and autonomy of pleiotropic effects of I(1)Nts1, a conditional Notch lethal in Drosophila.
Dev Biol 1978, 62: 432–446.
The pleiotropic function of Delta during postembryonic development of Drosophila melanogaster.
Genetics 1993, 135: 527–539.
Compartment boundaries and the control of Drosophila limb pattern by hedgehog protein.
Nature 1994, 368: 208–214.
Cell interaction between compartments establishes the proximal-distal axis of Drosophila legs.
Nature 1994, 372: 175–179.
Organizing activity of wingless protein in Drosophila.
Cell 1993, 72: 527–540.
Proximal-distal axis formation in the Drosophila leg.
Nature 1997, 388: 139–145.
Generation of multiple antagonistic domains along the proximodistal axis during Drosophila leg development.
Development 1998, 125: 3821–3830.
Proximodistal axis formation in the Drosophila leg: subdivision into proximal and distal domains by Homothorax and Distal-less.
Development 1999, 126: 109–117.
Notch1 is required for the coordinate segmentation of somites.
Development 1995, 121: 1533–1545.
Introduction
В исследованиях на крыльях Drosophila было установлено, что Fringe ингибирует эффективность Notch лиганда Serrate и потенцирует эффективность Notch лиганда Delta [8] [9]. Fringe обычно экспрессируется дорсальными клетками [11], в результате происходит активация Notch вдоль D–V границы крыла. Гомолог Fringe у позвоночных, Radical Fringe (R–Fng), экспрессируется специфически дорсальными клетками в развивающемся зачатке конечности кур и его функция аналогична его роли у Drosophila [12] [13].
Dorsal–ventral limb borders
Имеются указания на то, что существуют механизмы эндогенного процессинга лигандов [15] [16] [17•]которые могут генерировать растворимые формы Delta, способные активировать Notch [17•]. Более того, исследования функции гена nubbin указывают на то, что потенциал ширины полосы активации Notch много шире, чем previously realized [18•]. nubbin кодирует POU доменовый белок, который экспрессируется во всем зачатке крыла [19]. Экспрессия по крайней мере двух Notch target генов вдольD–V границы негативно регулируется nubbin [18•]. Если активность nubbin удалена, то экспрессия этих Notch генов-мишеней genes может обнаруживаться на расстоянии в 10 клеток от D–V границы.
у кур выявляется сходная роль R-Fng [12] [13]; [20•], но у млекопитающих и лягушек роль Fringe генов в развитии конечностей установить пока не удается [21•] [22•] (T Vogt, personal communication). [23].
Specification of dorsal–ventral midline cells in the Drosophila eye
Хотя клетки D–среденей линии не отличаются по морфологии, идентифицированы некоторые гены, экспрессирующиеся преимущественно вдоль D–V средней линии [24•] [25] [26•] [27•] [28] [29] [30] [31]. Эти молекулярные маркеры D–V средней линии регулируются Notch [24•] [26•] [27•]. Используя эти молекулярные маркеры оказалось возможным показать, что активация Notch позиционируется с помощью Fringe [24•] [27•], который обычно экспрессируется спецефически вентральными клетками глаз [24•] [26•] [27•] (Fig. 1b). Notch лиганды Serrate и Delta экспрессируются преимуществено вдоль D–V средней линии [24•] [25] [26•] [27•] и их экспрессия регулируется активностью Notch [24•] [27•], как и в крыльях (Fig. 1b). Более того, Delta и Serrate обладают дорсальной и вентральной специфичностью своей активности, которая связана с Fringe [24•]. Однако экспрессия Fringe и Notch лигандов инвертирована в отношении D–V оси в глазах и крыльях .
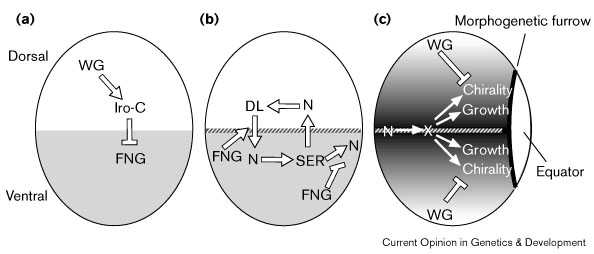 |
Figure 1 Schematic illustrating sequential steps of D–V patterning in the Drosophila eye imaginal disc; dorsal is up and anterior to the left in each panel. (a) Establishment of dorsal and ventral cell fates. Wingless (WG) positively regulates mirror expression in dorsal cells [31], and presumably that of other Iroqouis-complex (Iro-C) genes as well. As WG is also expressed in ventral cells, even at early third instar (not shown), additional factors must also contribute to restricted Iro-C expression. Iro-C genes negatively regulate Fringe (FNG, gray shading) [26•] [27•]. (b) Activation of Notch (N) at the D–V midline (hatched line). Taking into consideration their expression patterns and ability to influence each others' expression when ectopically expressed, Serrate (SER) is hypothesized to signal from ventral cells to dorsal cells, and Delta (DL) from dorsal cells to ventral cells, with FNG playing a key role by modulating their signaling activity [9] [24•]. These regulatory steps need not be direct. (c) Activation of Notch has long-range influences on both eye growth and ommatidial chiralty [24•] [26•] [27•]. This is proposed to occur by induction of a diffusible signaling molecule, X, which spreads from its site of synthesis and becomes distributed in a gradient. Ommatidial chirality is also influenced by WG; the effects of WG are opposite to those induced by Notch activation [62]. |
Самое раннее проявление D–V полярности в крыльях и глазах генерируется с помощью Wingless; однако в крыльях Wingless закладка D–V полярности осуществляется с помощью негативно реглуируемой экспрессии Apterous [32], тогда как в глазах wingless D–V полярность позитивно регулируется экспрессией mirror [31], и возможно другими чоенами комплекса Iroquois (Fig. 1a). Комплекс Iroquois является кластером трех родственных гомеобоксных генов — mirror, araucan and caupolican — которые экспрессируются в виде сходных паттернов во многих ткнях, включая глаза [26•] [33] [34] [35]. Экспрессия комплекса Iroquois комплементарнаfringe в глазах [24•] [26•], и эти гены могут негативно регулировать fringe ([26•] [27•]; H McNeill, personal communication) ограничивая fringe вентральными клетками (Fig. 1a).
Активация Notch вдоль D–V средней линии глаз играет критическую роль в паттернировании и росте глаз [24•] [26•] [27•]. Local activation of Notch exerts a long-range influence on ommatidial chirality and is also necessary and sufficient to promote eye growth (Fig. 1c).
Segmentation of Drosophila appendages[36•] [37•]. Notch сигналы создают мноржественные повторяющиеся границы вдоль proximal–distal оси конечности . Эктопическая активация Notch может вести к индукции структур эктопических суставов [36•] [37•]. Сегментно повторяющаяся потребность в Notch параллельна сегментно повторяющейся экспрессии его лигандов [25] [36•] [37•], и генов, регулируюемых Notch [36•] [37•]. Notch, Serrate, и Delta функционируют одинаково во время сегментации ног и формирования D–V границы, но имеются и отличия в потребности fringe.
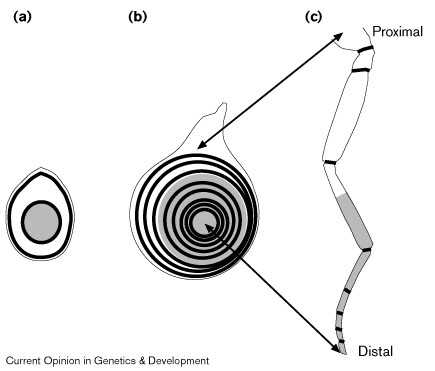 |
Figure 2 Progressive segmentation of the Drosophila leg. (a,b) Schematic of leg imaginal disc at (a) early and (b) late third instar. (c) Schematic of adult leg. During metamorphosis, the leg imaginal disc telescopes out such that the center of the leg disc gives rise to the distal tip of the adult leg and more peripheral regions of the disc give rise to regions that are progressively more proximal to the body. Black rings represent regions of Notch activation, which drive leg segmentation and growth [36•] [37•]; gray shading represents expression of Distal-less. (a) Notch activation is detectable in two rings, one proximal and a second that appears at the edge of the Distal-less domain [37•]. This distal ring may correspond to the most distal ring in mature leg discs [37•]. (b) By the end of third instar, rings of Notch activation exist for most or all segment borders. Although all rings are illustrated here, it is not actually possible to visualize them all in one focal plane as a result of the highly folded nature of the disc epithelium. |
Сегментно повторяющаяся экспрессия Serrate — и возможно fringe и Delta — регулируется с помощью Wingless и Decapentaplegic (Dpp) [36•]. Wingless и Dpp действуют комбинационно создавая proximal–distal ось конечности и обеспечивают ее рост [41] [42] [43]. Они также регулируют экспрессию генов таких как Distal-less, dachshund, и homothorax [44] [45] [46]. Предполагается, что эти гены экспрессирующиеся широкими полосами могут дейстовать комбинационно создавая отдельные кольца экспрессиии fringe, Serrate, и Delta [36•] [37•]. (Fig. 2).
Regulation and function of Lunatic Fringe in vertebrate somitogenesis смотри ЗДЕСЬ
References