Polycomb-group
Модификаторы хроматина
|
The trithorax-group and Polycomb-group chromatin modifiers: implications for disease
Maarten van Lohuizen
Current Opinion in Genetics & Development 1999, 9 No 3:355-361. |
Для понимания экспрессии генов важны эффекты окружающей хроматиновой структуры
[1] [2] [3]. Даже первый уровень вторичной струтуры, закрученной вокруг нуклеосомы ДНК, оказывает выраженное репрессивное влияние на экcпрессию. Эти эффекты должны ослабляться с помощью специфических нуклеосома/хроматин-ремодулирующих белковых комплесов, позволющим генам оставаться активными. Некоторые такие ремодулирующие комплексы очищены и изучены (reviewed in [3] [4] [5]). Функция "транскрипционной памяти" ('transcriptional memory')в основном контролируется на уровне стуруктуры хроматина, с помощью эпигенетических механизмов [6] [7] [8]. В обзоре рассматриваетя такая законсервированная система памяти, обеспечиваемая Polycomb-group (Pc-G) транскрипционных репрессоров и их противников, trithorax-group (trx-G), состоящей из хоматин-ремодулирующих факторов.
Abbreviations
ACF—ATP-utilizing chromatin assembly and remodeling factor;
CHRAC—chromatin assembly complex;
Eed—embryonic ectoderm development;
Esc—Extra sex combs;
E(z)—Enhancer of zeste;
Hox—homeobox;
NURF—nucleosome-remodeling factor;
Pc-G—Polycomb-group;
PREs—Polycomb-responsive elements;
Rb—retinoblastoma;
trx-G—trithorax-group.
| |
Francis, N. J. et al.
Polycomb proteins remain bound to chromatin and DNA during DNA replication in vitro. Cell 137, 110–122 (2009)
Article |
Белки Polycomb repressor complex 1 (PRC1) остаются связанными с хроматином во время репликации ДНК. Эта находка указывает на то, что удерживание хроматином регуляторных белков в ходе репликации ДНК может быть важным механизмом эпигенетического наследования.
Хроматиновая матрица, которая связана с помощью PRC1 core complex (PCC) до репликации ДНК, полностью реплицируется in vitro. Отметим, что известный ингибирующий эффект PCC на ремоделирование хроматина сохраняется после репликации хроматина. Итак, PCC соединяется с и влияет на хроматин в ходе репликации ДНК in vitro.
Используя модифицированный подход иммунопреципитации хроматина Francis et al. установили, что PCC связан как с реплицируемой, так и не реплицируемой ДНК. Дальнейшие эксперименты показали, что PCC не высвобождается с матрицы во время репликации.
Принимая во внимание, что PRC1 может быть связан с репрессивной меткой trimethylated histone H3 Lys27 (H3K27me3), было предположено, что перенос H3K27me3 на дочернюю ДНК во время репликации ДНК может рекрутировать PRC1, если этот комплекс разрушается при прохождении репликационной вилки. Однако, Francis et al. установили, что H3K27me3 не нужен для поддержания ассоциации PCC с хроматином во время репликации ДНК.
Используя иммунопреципитацию хроматина, авт. наблюдали, что компоненты PCC ко-локализуются с bromodeoxyuridine (BrdU, аналог нуклеотида, который инкорпорируется во вновь синтезированню ДНК) на polycomb response elements (PREs) в Drosophila melanogaster S2 клетках, находящихся в S фазе. Интересно, что количество PCC компонента - posterior sex comb (PSC) - который связан с BrdU-меченным PRE, увеличивается после репликации ДНК.
Эти данные подтверждают модель, согласно которой PCC, связанный с ДНК до репликации ДНК, сохраняется на дочерней ДНК матрице, а дополнительный PCC, добавляемый на дочернюю ДНК матрицу после репликации ДНК, завершает восстановление полного количества PCC, необходимого для молчания.
FURTHER READING
Probst, A. V. et al. Epigenetic inheritance during the cell cycle. Nature Rev. Mol. Cell Biol. 10, 192–206 (2009)
A
rticle
|
| JARID2 regulates binding of the Polycomb repressive complex 2 to target genes in ES cells | D. Pasini et al., | Nature Vol. 464,No. 7286, P. 306-310, 2010 |
Белки PcG играют важную роль в контроле экспрессиии генов, существенных для развития, дифференцировки и поддержания клеточных судеб
1,2. Polycomb repressive complex 2 (PRC2), как полагают, регулирует транскрипционную репрессию за счет катализа ди- и три-метилировананных лизина 27 в гистоне Н3 (H3K27me2/3)
2. Неизвестно, как белки PcG рекрутируются на свои мишени промоторы в клетках млекопитающих
3. В работе установлено, что PRC2 образует стабильный комплекс с Jumonji- and ARID-domain-containing белком, JARID2
4. Было установлено, что JARID2 соединяется с боле чем 90% ранее картированных генов мишеней для PcG. Было установлено, что JARID2 достаточен, чтобы рекрутировать белки PcG на гетерологические промоторы и что ингибирование экспрессиии JARID2 ведетк существенной потере связывания PcG и к снижению уровней H3K27me2/3 на генах мишенях. В соответствии с важной ролью белков PcG в раннем развитии
5-8, авт. продемонстрировали, что JARID2 необходим для дифференцировки эмбриональных стволовых клеток мыши. Т.о., эти результаты демонстрируют, что JARID2 важен для соединения белков PcG с генами мишенями.
Stable inheritance of Pc-G repression: different complexes with different functions
Биохимический анализ показал, что повсеместно экспрессирующиеся Pc-G белки как млекопитающих, так и мух формируют большие (~2–5 Md) комплексы [9] [10] [11]. Когда Такие комплексы искусственно targeted с помощью промотор-репортерных конструкций, то наблюдали существенную репрессию — как эписомно расположенных, так и и интегрированных в хромосомы репортерных генов [11] [12] [13] [14]. Это может указывать на неспецифичность функции репрессии , in vivo Pc-G комплексов. Это хорошо иллюстрируется слабыми изменениями паттерна генной экспрессиии специфических Hox генов в ответ на изменения дозы одиночных Pc-G генов у мыши [15] [16] [17]. Как достигается такая специфичность и как Pc-G комплексы взаимодействуют со своими генами-мишенями? Выявлено существование двух отличных Pc-G белковых комплексов в клетках как у Drosophila так и млекопитающих [18] [19] [20]. Фенотипический анализ мутантов Drosophila и мыши указывает на разные функции этих разных комплексов. Комплекс состоящий из Extra sex combs (Esc) и Enhancer of zeste (E[z]) белков необходим на стадии инициации, когда Pc-G репрессия необходима для освобождения от рано действующих репрессоров, таких как Hunchback (Hb). Второй комплекс, содержащий большинство Pc-G белков, таких как Pc, Psc, Ph, постоянно необходим для стабильного поддержания инициированной Pc-G репрессии специфических генов-мишеней( [21]; see Table 1 for an overview of gene names). Автор обозначает эти комплексы как Pc-Gi (инициирующий) и Pc-Gm (поддерживающий). Мышиный гомолог Esc, названный Eed (embryonic ectoderm development), идентифицирован с помощью позиционного клонирования в середине гаструляции у летальных мутантов [22]. Этот тяжелый фенотип хорошо согласуется с ранней инициирующей ролью и контрастирует с менее выраженными фентипически отличными дефектами, обнаруживаемчми у мышей, дефицитных по генам Pc-Gm [15] [16] [17].
Table 1. Обзор Pc-G и trx-G генов*. |
Drosophila gene | Mammalian homologue |
Pc-G initiating (Pc-Gi) dMi-2 | Mi-2 | Centrosomal and chromosomal factor (ccf)? | | Enhancer of zeste (E[z]) | EZH2,Enx1/EZH1,Enx2/ | Extra sex combs (esc) | Eed, hEED | Pc-G maintenance (Pc-Gm) Polycomb (Pc) | M33, HPc | | HPc2, MPc2 | Posterior sex combs (psc) | bmi-1, BMI-1 | | Mel-18, MEL-18 | Polyhomeotic (ph) | HPH1, Mph1/rae28 | | HPH2, Mph2 | †dRING? | Ring/Ring 1a, RING1 | | Ding/Ring 1b, RING2 | Pleiohomeotic (pho)? | hYY-1, mYY-1 | trx-G | | trithorax (trx) | MII IALL-1/HRX | | ALR | brahma (brm) | hbrm/mbrm | | BRG1/mBrg1 | (snr1) | hSNF5,INI1 | |
| *
Больше информации по этим генам содержится в обзорах [15] [16] [17] [26]. Знак вопроса указывает недавние добавления, базирующиеся на наблюдении за генетическими взаимодействиями. У млекопитающих, Pc-Gm (и возможно trx-G гены) удвоены и представлены в виде очень сходных пар (показаны на соседних линиях, напр. RING1 и RING2). †Частичные dRING последовательности выявлены недавно кДНК базе данных Drosophila[71]. |
Важным новым добавлением является идентификация dMi-2 как Hb-взаимодействующего белка [23••]. Генетически dMi-2 мутанты ведут себя очень похоже с E(z) мутантами, указывая тем самым, что действуют в Pc-Gi комплексе. Mi-2 позвоночных очищен как субъединица гистон деацетилазного комплекса, который может действовать на нуклеосомы, деацетилируя гистоновые H3 и H4 amino-terminal хвосты. Это первый комплекс, обладающий как деацетилирующей активностью, так и АТФ-зависимой нуклеосомы ремодулирующей активностью [24•] [25•]. Так как деацетилирование специфических лизинов на N-терминальных концах гистонов H3 и H4 создает репрессивную нуклеосома/хроматин конфигурацию, то это подтверждает механизм, с помощью которого Pc-G комплексы могут действовать, репрессируя транскрипцию [5]. Mi-2 белковые комплексы не содержат других Pc-Gi белков, указывая, что Pc-G взаимодействия могут быть более преходящими по природе, в соответствии с ферментативной модификацией хроматина, потребность в которой временная. Сходным образом, не выявлено стабильно ассоциированной гистон деацетилазной активности для комплексов Pc-Gi или Pc-Gm у мышей. Все это подтверждает спекулятивную модель осуществления Pc-G репрессии (see Fig. 1). Ранние ген-специфические репрессоры, такие как Hb, временно рекрутируют Mi-2 деацетилазный комплекс, совместно с другими белками Pc-Gi для локальной модификации нуклеосом. Прецендентом такого вовлечения является функциональная ассоциация различных гистон деацетилаз с сиквенс-специфическими ДНК связывающими репрессорами (reviewed in [3] [5]). Модифицированный хроматин затем распознается Pc-Gm комплексами еще неизвестным способом для стабильного поддержания репрессивного 'imprint'. 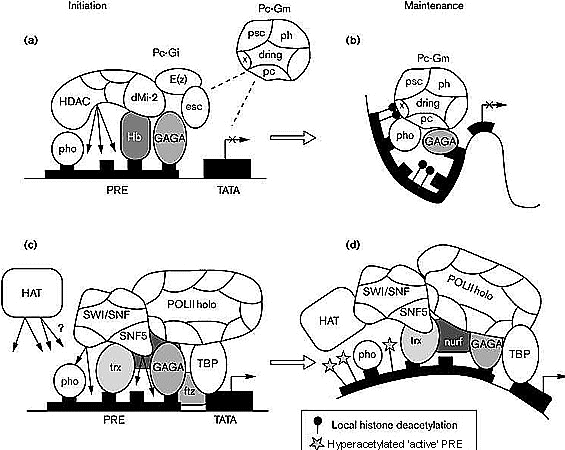 | Рис. 1 Гипотеза о (a,b) Pc-G репрессии и (c,d) trx-G активации. Гены-мишени (такие как Hox гены) могт или быть репрессированы (a) или активированы (b) ранними сиквенс-специфическими ДНК связывающими факторами такими как Hunchback (Hb) и Fushi tarazu (Ftz). Это ведет к вовлечению или dMi-2/гистон деацетилазы (HDAC) и Pc-Gi белковых комплексов к репрессируемым промотор/PRE или в случае активного промотора к Polymerase II holoenzyme (POL II holo) и ассоциированных хромати ремодулирующих комплексов, таких как SWI/SNF and GAGA/NURF. (b) Локальное деацетилирование гистонов вместе с Pc-Gi белками, по-видимому, индуцируют изменения в конформации хроматина, что позволяет Pc-Gm комплексам связываться и стабильно поддерживать репрессию. (c) Напротив, POL II holo энзим м хроматин ремодулирующие комплексы обеспечивают изменения структуры хроматины, вместе с сиквенс-специфическими ДНК связывающими trx-G белками (такими как trx и GAGA) и вообще рекрутируют гистоновые ацетилазы (HAT) для стабилизации индукции (d) гиперацетилированная 'active' PRE. По-видимому, другая, чем у мух и все еще плохо изученная, инициация экспрессии Нох генов у млекопитающих может сопровождаться ранней фазой открытия хроматина ('chromatin-opening' phase) [72]. Это должно обеспечиваться сходными законсервированными и у млекопитающих trx-G белковыми комплексами и ремодулирующими факторами. Сходным образом, Pc-Gi белки и Mi-2/HDAC комплексы могут обеспечивать раннее 'repressed' состояниеHox кластеров, которое поддерживается затем с помощью законсервированных Pc-Gm комплексов млекопитающих тех генов, которые не были активированы. Подобно Hox кластерам генов у млекопитающих также и Pc-Gm гены дуплицируются в ходе эволюции, существенно увеличивая число потенциально возможных комплексов Pc-Gm в соответствии с увеличением числа генов-мишеней[16]. (PRE, Polycomb-responsive element; TATA, TATA box; TBP, TATA-binding protein).
Figure 1 A speculative view of (a,b) Pc- G repression and (c,d) trx-G activation. Target genes (such as Hox genes) can be either repressed (a) or activated (b) by early sequence-specific DNA binding factors such as Hunchback (Hb) and Fushi tarazu (Ftz). This leads to recruitment of either dMi-2/histone deacetylase (HDAC) and Pc-Gi protein complexes to the repressed promoter/PRE or in case of an active promoter, to recruitment of Polymerase II holoenzyme (POL II holo) and associated chromatin remodeling complexes, such as SWI/SNF and GAGA/NURF. (b) Local histone deacetylation together with Pc-Gi proteins is proposed to induce a change in chromatin conformation, allowing Pc-Gm complexes to bind, to stably maintain repression. (c) Vice versa, POL II holo enzyme and chromatin remodeling complexes mediate a change in chromatin structure, assisted by sequence specific DNA binding trx-G proteins (such as trx and GAGA) and perhaps by recruiting histone acetylases (HAT) to stably induce (d) a hyperacetylated 'active' PRE. Although probably different than in flies and still poorly understood, initiation of Hox gene expression in mammals may be accompanied by an early 'chromatin-opening' phase [72]. This could be mediated similarly through conserved mammalian trx-G protein complexes and remodeling factors. Likewise, Pc-Gi proteins and Mi-2/HDAC complexes may be mediating the early 'repressed' state of Hox clusters, which is maintained by conserved mammalian Pc-Gm complexes on those genes that do not get activated. Of interest is that next to the Hox gene clusters also the mammalian Pc-Gm genes have been duplicated in evolution, leading to much greater potential of possible Pc-Gm complexes, in accordance with increased numbers of target genes [16]. (PRE, Polycomb-responsive element; TATA, TATA box; TBP, TATA-binding protein). |
Эта модель может объяснить другое: Pc-G комплексы у Drosophila нуждаются в специфических ДНК элементах (Polycomb-response elements [PREs]) для обеспечения репрессии, факторов, которые детерминируют/способствуют взаимодействию с PREs и которые все еще неизвестны [21] [26]. Идентификация Drosophila pleiohomeotic Pc-G гена как сиквенс-специфического ДНК связывающего белка со значительной гомологией с транскрипционным фактором YY-1 является первым примером [27•]. Изучение некоторых PRE-последовательностей выявило общий мотив, который напоминает YY-1 consensus сайт [28]. Одако этот мотив недостаточен для обеспечения полной репрессивной активности с помощью PRE, следовательно, участвуют дополнительные последовательности/факторы [27•] [28]. Все вместе это указывает на то, что Pc-Gm комплексы могут быть необходимы как для YY-1 сайта, так и для специфически окружающих деацетилированные гистоновые 'imprints', чтобы связываться эффективно( Fig. 1). Интересно, что Pc-G и trx-G комплексы действуют в тесной близи на PREs, исключая простую модель Днк-конкуренции за противоположные активности [29] [30••]. Более того, некоторые trx-G белки, такие как GAGA могут обнаруживаться на репрессированных PREs,указывая, что 'activating' ремодулирующая роль trx-G обязательно регулируется через ассоциацию с дополнительными факторами, такими как SWI/SNF ( [31]; and see below). Итак, гипоацетилирование репрессирует PREs , а гиперацетилирование дерепрессирует PREs.Важные уроки следуют иззаметной стабильности или активного или репрессированного состояния, индуцированных посредством PREs в генах-мишениях у Drosophila [30••]. Наследование ген-транскрипционных паттернов наблюдается не только в последовательных митозах, но даже передаются частично через мейоз в течение нескольких поколений [30••]. Если это стабильное эпигенетическое наследование происходит и у млекопитающих, то это скорее всего будет обнаруживаться в изменениях экспрессии генов при заболеваниях, напоминая хорошо задокументированные эффекты CpG метилирования/импринтинга при болезнях [32] [33].
Pc-G deregulation and disease: connection to cell-cycle regulation and beyondКак уже упоминалось выше потеря Pc-Gi Eed функции ведет к ранней эмбриональной гибели в четырех случаях Pc-Gm нокаута (reviewed in [16] [17]). Тяжесть Pc-Gi потери функции, по-видимому, связана с их инициирующей функцией, но тот факт, что Mi-2/гистон деацетилаза могут быть вовлечены указывает на то, что могут проявиться многие плейотропные эффекты: похоже, что такие энзиматические 'modules' могт быть использованы в репрессии, не связанной с Pc-G. Отметим, что Pc-Gi белки могут также выполнять и структурную роль в регуляции конденсации и сеграции хромосом во время митозов [34] [35]. Эта специальная роль может указывать на общую функцию их с гетерохроматин-ассоциированными белками, которые влияют на мозаичный эффект положения (position effect variegation (PEV)) [8] [36]. PEV представляет собой другую более indiscriminate форму эпигенетического молчания, при которой гетерохроматин распространяет ('spreads') свое влияние на соседние области хромосом[8]. PEV четко отличается от Pc-Gm-обусловленной репрессии, при которой не используется гетерохроматин [37] [38], возможно, что Pc-Gi могут выполнять общую роль 'initiator' в обоих процессах. В соответствие с этим Pc-Gi белки, по-видимому, более 'ancient' в эволюционном плане и хорошо законсервированы у растений и Caenorhabditis elegans, где они играют полноценную и важную роль в поддержании репрессированного состояния в зародышевой линии [39] [40] [41]. Взаимодействие с такой более структурной ролью в сегрегации и поддержании хромосом безусловно должно вносить вклад в нестабильность генома, которая потенциально влият на возникновеие болезней таких как рак.
Безусловно мишениями обоих Pc-Gi и Pc-Gm комплексов являются кластеры Hox генов, что было показано in vivo на Eed гипоморфных мутантных мышах и на разных Pc-Gm нокаутных мышах, а также на мышах с избыточной экспрессией bmi-1 Pc-Gm гена (reviewed in [15] [16] [17]). Эти мутантные мыши обычно обнаруживают характерные дефекты склета, а также дефекты пролиферации и выживания гематопоэтических клеток. Это напоминает некоторые дефекты, ассоциированные с дерегуляцией экспрессии гомоеобоксных ( Hox) генов у человека с врожденными скелетными аномалиями, такими как синполидактилия и различными формами лейкемии у человека [42] [43] [44] [45]. У человека неизвесты мутации с потерей функции Pc-G генов, которые можно было бы связать с фактом, что Pc-G мутации затрагивают множественные ( Hox) гены-мишени, ведущие к гибели. Однако известно, что дергуляция экспрессии Pc-G генов не вносит вклада в заболевания (see below).
Помимо Hox генов, Pc-G комплексы, по-видимому, регулируют множество других генов-мишеней, на это указывает широкий спектр феноипов у мутантных мышей и мух при связывании Pc-Gm комплексов с ~ 100 отдельными сайтами политенных хромосом Drosophila [16] [46]. Биохимический и функциональный анализ общих пролиферативных дефектов в первичных клетках от нокаутных по гену bmi-1 Pc-Gm мышей недавно выясил такую важную мишень. Это локус INK4a, который кодирует опухолевые супрессоры и ингибиторы клеточного цикла p16 и p19Arf, которые обнаруживают избыточную экспрессию в Pc-Gm мутантных клетках [47•]. Напротив, избыточная экспрессия bmi-1 ведет к подавлению p16 и p19Arf, объясняя онкогенный потенциал bmi-1 in vivo, по индукции лимфом у трансгенных мышей [48]. Эта связь интересна, так как p16 и p19Arf действуют как вышестоящие регуляторы ретинобластомна- ( Rb) и p53 тумор-репрессирующего путей и являются главными регуляторами переключения иммортализация/старение (immortalization/senescence checkpoint) у грызунов и в первичных клетках у человека(reviewed in [49]). Эта контрольная точка ('checkpoint')считает количество клеточных делений, ведущих к необратимой остановеке роста после определенного числа пассажей и тем самым избавляет клетки от иммортализации. Эти результаты связывают оногенетическое "поддержание" Pc-G факторов с кнтролем клеточной пролиферации и обеспечивает связь между дифференцирокой и выходом из клеточного цикла. Интересно посмотреть могут ли Pc-Gm комплексы являються частью механизма часов 'clock', который считает клеточные деления. Дополнительным подтверждением потенциальной роли в трнсформации является указание на эффекты избыточной экспрессии других генов Pc-Gm таких как RING, в клеточных линиях грызунов [50]. Помимо таких общих дефектов, потеря индивидуальных Pc-Gm также ведет к уникальным фенотипам у мышей — указывающими на дерегуляцию определенных генов-мишеней индивидуальными Pc-G белками. Это дефекты нейрологические, клеток нервного гребня и гладкомышечных клеток [15] [16]. Наиболее драматическим примером могут служить самцы &#rarr;самки с реверсией пола у M33 мутантных мышей, укзывающим на то, что нарушается SRY пол-детерминирующий путь [51].
Trx-G genes and leukemia
Наиболее сильная взаимосвязь с болезнью получена для некоторых trx-G членов, которые обычно противодействуют репрессии с помощью Pc-G. Человечий гомолог Drosophila trx, названный MLL, ALL-1 или HRX (hereafter named MLL), часто повреждается общераспространенной транслокацией 11q23, обусловливающей как острую лимфобластическую, так и острую миэлоидную лейкемию (reviewed in [43] [52]). Выявлено 30 различных слияний хромосом, в большинстве своем дающих гибридные белки [52], указывающие на то, что MLL ген может содержать специальный фрагильный сайт особенно чувствительный к таким перестройкам. Партнеры по слияюнию неродственны, но в некоторых случаях могут влиять на subtype/lineage лейкемии [52] [53]. Интересно слияние MLL с CBP (CREB-binding protein), который действует как 'integrator' большинства сигнальных путей и содержит внутренне присущую активность по ацетилированию гистонов, которая сохраняется в слитых белках [54] [55]. Предпочтительна модель, которая базируется на том, что укороченный в результате транслокации MLL продукт действует доминантно, взаимодействуя с функцией нормального MLL. MLL, подобно trx, способен взаимодействовать непосредственно со специфическими генами-мишенями, с которыми могут взаимодейстовать и гибридные белки. Первым примером таких потенциальных генов-мишеней,как и ожидалось, являются Hox гены [56].
Напротив, общераспространенная делеция С-концевых частей в транслоцированных MLL может удалять критический для белкового взаимодействия мотив, создавая доминантно-негативную функцию trx. Особый интерес в этом отношении представляет С-терминальный законсервированный домен SET, который связывает SNF5 [57•], единицу высоко законсервированного SWI/SNF хроматин ремодулирующего комплекса; это указывает на то, что нормальная функция MLL может быть связана с рекрутированием SWI/SNF с определенными генами-мишенями. Домен SET domain обнаруживается также в некоторых Pc-Gi и PEV-супрессирующих белках, указывая на то, что они могут также взаимодействовать с SWI/SNF комплексами [8] [36]. Идентифицированы MLL-родственные гены, потенциально увеличивающие disease implications [58]. MLL-дефицитные мыши выявляют — и иные кроме скелетных дефекты, обусловленные отсутствием необходимой эксперессии Hox генов — гематопоэтические дефекты, согласующиеся с ожидаемой ролью MLL как гена trx-G [59] [60]. Критические MLL мишени при лейкемии еще не идентифицированы. Показанные выше взаимодействия и связи Pc-Gm с INK4a в регуляции клеточного цикла могут быть важными to assess whether MLL may similarly converge on INK4a. The SWI/SNF-ремодулирующий комплекс, участвующий в trx-G функционировании, благодаря субъединице SNF2 у Drosophila назван Brahma он был клонирован как trx-G ген [61]. SWI/SNF, был первым идентифицирован у дрожжей как белок, необходимый для эффективной активации транскрипции субнабора генов, следовательно он высоко законсервирован [3] [4] [5] [62]. Субъединица SWI/SNF ISWI также присутствует в трех других хроматин-ремоделирующих комплексах ACF, CHRAC и NURF, что подтвержает взаимодействия с общими партнерами. Кроме того , NURF идентифицирован как комплекс, который может участовать в связывании транскрипционных факторов, таких как GA-repeat binding trx-G белок GAGA, с соединенной с нуклеосомами матрицей ДНК [63]. Все это подтвержадет то, что ДНК связывающие trx-G белки, такие как MLL/trx и GAGA могут вовлекать несколько ремодулирующих комплексов с разыми активностями по отношению к PREs. Очевидно, что они должны действовать в согласии, чтобы поддерживать активную и защищать Pc-G комплексы от сборки в неактивные хроматиновые комплексы. В этом отношении важна ассоцииация SWI/SNF с Polymerase II голоэнзимом [64]. Факт что SWI/SNF/PolII комплексы кроме того вовлекают факторы, подобные CBP, которые обладают гистон ацетилирующей активностью, может быть интересным в отношении способности 'reversing' обусловленного Pc-Gi деацетилирования 'imprint'.
Помимо ассоциации с MLL при лейкемии, гомологи Brahmaмлекопитающих brm и BRG-1 также участвуют в регуляции клеточного цикла. brm и BRG-1 могут связывать 'active' Rb белок, указывая на потенциальную роль в Rb опухоль-супрессирующей активности [65]. Редукция brm экспрессии коррелирует с трансформацией фибробластов грызунов онкогенами ras [66]. Демонстрацией cancer-prone фенотипа с помощью SWI/SNF дерегуляции является идентификация hSNF5 как bona fide опухоль-супрессирующего гена, который часто теряется в высоко злокачественных метастазах rhabdoid опухолей [67•]. Если потеря SNF5 ослабляет функцию SWI/SNF в поддержании генной активности, то это может вести к аберрантной гипер-репрессии генов-мишеней Pc-G белковыми комплексами.
Conclusions and perspectives
Важно верифицировать обнаруживается ли столь заметная стабильность транскрипционных состояний, обнаруживаемая у Drosophila, и у млекопитающих, так как это могло бы представлять новую форму эпигенетического 'imprinting' и неменделевского наследования. Интересны в этом отношении эпигенетическое замалчивание (epigenetic silencing) с помощью CpG-метилирования у позвоночных, а также потребность в гистоновых деацетилазах для стабильной репрессии [68•] [69•]. Обнаружение, что имеются отдельные Pc-G комплексы с отдельными функциями и то, что возможна связь с другими механизмами "памяти" , таким как PEV, могут привести к открытию общих принципов наследования. Если исходить из возможности, что histone-(de)acetylation формы критическая часть Pc-G/trx-G импринтинга ([23••]; V Orlando, personal communication) , то неясно как это может быть определено в выборках fixed patient (tumor). Идентификация in vivo соответствующих генов-мишеней, таких как INK4a локус в регуляции клеточного цикла и опухолей, будет критической. Необходимо установление корреляций дерегуляции Pc-G и trx-G генов с развитием и болезнями. Что эта возможность не исчерпана иллюстрирует корреляция паттерна экспрессии Pc-G в гематопоэтическом развитии [70], и корреляция избыточной экспрессии bmi-1 с high-grade osteosarcoma человека(MW Hentz et al., unpublished data).
|
Сайт создан в системе
uCoz