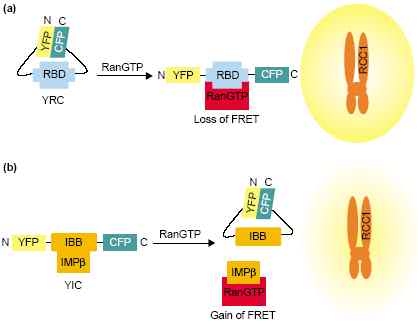
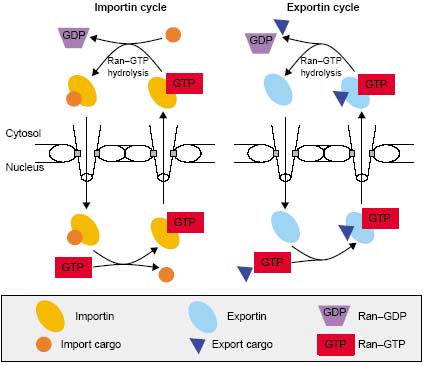
Две групп использовали RNA interference (RNAi) у Caenorhabditis elegans, чтобы разрушить путь Ran [34,35]. Эмбрионы, лишенные Ran, RCC1 или RanGAP образуют биполярные веретена, но обнаруживают неправильное расположение хромосом и неправильное расхождение с хроматином, оказывающимся отсоединённым от микротрубочек веретена [34,35]. Эти результаты важны из-за своего сходства фенотипов, полученных при нарушении как обменов нуклеотидов Ran, так и при путей гидролиза нуклеотидов, в частности эти результаты предсказывают, что нарушение этих двух путей д. давать противоположные результаты. Наиболее заметное различие между результатами эти х двух групп это то, что хотя Bamba et al. [34] и наблюдали сходные фенотипы для деплеции RanGAP и RCC1, но Askjaer et al. [35] обнаруживали только временные нарушения веретена после элиминации RCC1. Всё это подтверждает мнение, что Ran необходима для сборки веретена, и что как нуклеотидный обмен, таки и гидролиз необходимы для собственно прикрепления к веретену in vivo.
Недавние наблюдения также показали, что контроль Ran внутри митотического веретена д.б. чрезвычайно сложным (Рис. 3). Как было предсказано и сегодня подтверждено RCC1 ассоциирует с митотическими хромосомами [36,37]. RanGAP
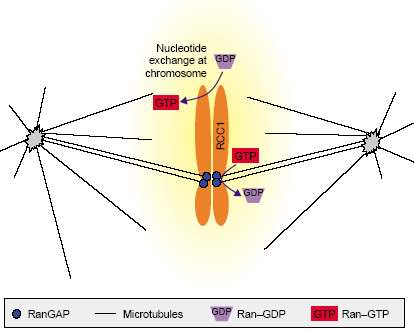
Рис. 3. Organization of Ran regulators in mitosis. Near chromosomes, RCC1 generates Ran-GTP that in turn regulates microtubule dynamics. At kinetochores and on spindles, RanGAP mediates Ran-GTP hydrolysis.
локализуется в веретёнах позвоночных [10,38], растений [11] и мух [36]. Хотя путь Ran довольно хорошо законсервирован у всех видов эукариот, но механизмы RanGAP таргетинга, по-видимому, отличаются между царствами, т.к. RanGAP таргетинг скорее всего обеспечивается с помощью дивергентных последовательностей dyr каталитической области. У позвоночных С-терминальный домен модифицирован с помощью ковалентной конъюгации с малым ubiquitin-родственным белком, называемым SUMO-1, ведущих к его ассоциации как с порами во время интерфазы [2,38], так и с веретеном во время митозов [10]. Напротив. этот домен отсутствует у растений, а отдельный N-терминальный WPP (white prepupal locus) домен обеспечивает ассоциацию растительного RanGAP с растительной nuclear envelope (NE) [39]. При почковании и делении дрожжевые RanGAP белки не обладают ни N-, ни С-терминальными расширениями и отсутствуют доказательства того, что RanGAP целенаправленно находит NPC или веретено у любого организма, который испытывает закрытые митозы.
Имеется существенная концентрация Ran на митотических кинетохорах у C. elegans [34] и RanGAP ассоциирует с кинетохорами митотических клеток млекопитающих[10], указывая тем самым, что кинетохоры являются местами активного гидролиза ГТФ во время митозов. Это важно. Во-первых, управление нуклеотидного гидролиза в этом месте должно менять общую структуру любого распределения Ran-GTP на митотическом веретене и таким образом контролировать высвобождение регуляторов веретена посредством механизма, представленного выше. Во-вторых, потенциал для гидролиза ГТФ на кинетохорах особенно интригующий, учитывая, что прикрепление кинетохор наиболее вероятный затрагиваемый аспект сборки веретена у RNAi-обработанных эмбрионов C. elegans. Это м. указывать на то, что Ran-GTP гидролиз оказывает специфическое и прямое действие в этом месте. Наконец, т.к. механизм ядерного транспорта, кажется очень сходным у разных видов [9], то дивергенция механизмов, используемых для локализации и контроля RanGAP, также как и дивергенция у некоторых членов RanBD белков [40], м. указывать на то, что митотическая роль Ran более текуча в эволюции и адаптируется в соответствии с драматически отличающимися стилями жизни и механизмами делений в клетках грибов, матазоа и растений.
Nuclear envelope assembly
Ran необходима для сборки NE in vitro [41,42], а мембраны NE
не способны ассоциировать с хроматином во время постмитотической сборки ядер у эмбрионов C. elegans, истощенных в отношении Ran или её регуляторов [34,35]. Черви, истощенные по importin-α или importin-β , обнаруживают сходные дефекты в формировании NE [34,35]. Кусочки, покрытые Ran или importin-β рекрутируются мембранами NE в экстрактах яиц Xenopus и формируют структуры, которые напомирнают NEs [42,43]. И нуклеотидные обмены с помощью RCC1 и гидролиз с помощью RanGAP необходимы для сборки NE[44].
В отличие от роли Ran-GTP в процессах, рассмотренных выше, роль Ran в сборке NE, по-видимому, зависит от привлечения importin-β скорее, чем от высвобождения груза от этого рецептора. Cпособность importin-β-покрытых кусочков индуцировать сборку NE теряется благодаря мутациям, которые снижают сродство importin-β к нуклеопоринам или к Ran-GTP, но не благодаря мутациям, которые нарушают взаимодействия с importin-α [43]. В нормальных условиях Ran соединяется с хроматином с низким сродством с помощью гистонов H3 и H4 [8]. Предполагается, что ассоциированная с хроматином Ran-GTP рекрутирует importin-β, который затем соединяется с нуклеопоринами, чтобы начать сборку ядерной оболочки
.
Conclusions
Current models suggest that high levels of Ran–GTP
generated by its chromatin-bound exchange factor serve
to organize numerous processes with respect to the location
of chromosomes. However, we are only beginning to
understand how generation and utilization of Ran–GTP
are spatially directed. Intriguing interspecies differences
could further point the way toward understanding the
evolution of this pathway to conform to the cellular
dynamics and environmental requirements for different
organisms.
Сайт создан в системе
uCoz