Васкулярный эндотелиальный ростовой фактор (VEGF) - основной индуктор ангиогенеза. VEGF продуцируется клетками, находящимися в тесной близи к эндотелиальным клеткам, такими как миокард во время активного ангиогенеза капиляров во время развития и неонатального роста. VEGF осуществляет свои эффекты через рецепторы эндотелиальных клеток, такие как VEGFR-1 VEGFR-2, нейрофилин-1 и нейрофилин-2. Экспрессия VEGF регулируется гипоксией, он индуцирует плейотропные реакции, позволяющие эндотелиальным клетками пролиферировать, мигрировать, собираться в трубки и формировать связанную сеть (морфоген), выживать и усиливать свою проницаемость.
Снижение уровня VEGF обусловливает апоптоз эндотелия, ведущий к обструкции просвета и регрессии сосудов. Витальная функция VEGF зависит от формирования комплекса, содержащего VEGFR-2, β-катенин и белок соединений адхерентного типа VE-кадхерин.
VEGF стимулирует миграцию эндотелиальных клеток путем усиления подвижности и увеличения экспрессии матричных металлопротеиназ и плазминогенных активаторов, матричных молекул (остеопнтин) и матричных рецепторов (αvβ3 интегрина) и коннексина 43 щелевых мостиков.
VEGF обеспечивает выход из сосудов плазменных белков (фибронектин, витронектин, фибрионоген, факторы коагуляции) и активрует экспрессию тканевого фактора (клеточный инициатор коагуляции крови), что ведет к формированию зацепок для мигрирующих эндотелиальных, гладкомышечных и воспалительных клеток. Кроме того VEGF может влиять на ангиогенез путем рекрутирования лейкоцитов (продуцирующих ангиогенные факторы) посредством экспрессии лейкоциты адгезирующих рецепторов.
VEGF играет существенную роль в формировании просветов. VEGF121 и VEGF165 увеличивают, тогда как VEGF189 снижает диаметр просвета.Разные физиологические функции VEGF зависят от определенных уровней VEGF.
Инактивация одиночного VEGF аллеля ведет к связанной с гапло-недостаточностью гибели эмбрионов из-за аномалий развития кровеносных сосудов примерно на 9-й день беременности. Дифференцировка ангиобластов не нарушена, но нарушено образование просветов сосудов, ответвлений и ангиогенез. Инактивация VEGF во время постнатального развития ведет к нарушению постнатальнго развития сосудов и жизнеспособности эндотелия, увеличивает смертнось, задерживает рост и нарушает развитие печени, сердца и почек.
Уровень экспрессии VEGF прогрессивно уменьшается после рождения и минимален в большинстве тканей взрослых, за исключением мест активного ангиогенеза, таких как оварии, матка м кожа (рост волос). Высокие уровни VEGF во взрослых почках связаны с эндотелиалными фенестрациями. Однако экспрессия VEGF реиндуцируется во время патологического ангиогенеза (ишемия миокарда, сетчатки, воспаление. атеросклеротические бляшки и опухоли.
Рецепторы VEGF обнаружены не только в эндотелиальных клетках. VEGF является хемоаттрактантом для макрофагов.
Установлено, что VEGFR2-позитивные клетки из задней мезодермы эмбриoнов птиц, взятые на стадии гаструляции, были способны давать как эндотелиальные, так и гематопоэтические клетки в культуре (Eichman et al., 1997). Эндотелиальная дифференцировка предшественников зависела от присутствия VEGF в культуральной среде. Гематопоэтическая дифференцировка обнаруживалась в отсутствие добавления фактора роста, но ингибировалась добавлением в растворимого внеклеточного домена VEGFR2. Следовательно, дифференцировка эндотелиальных и гематопоэтических клеток зависит от VEGFR2 перепела и регулируется путем связывания с двумя разными лигандами: связывание VEGF запускает эндотелиальную дифференцировку, тогда как гематопоэтическая дифференцировка запускается связыванием с еще неизвестным лигандом. VEGF-C является кандидатом на роль такого лиганда.
VASCULAR ENDOTHELIAL GROWTH FACTOR HOMOLOGUES)
VEGF ГОМОЛОГИ
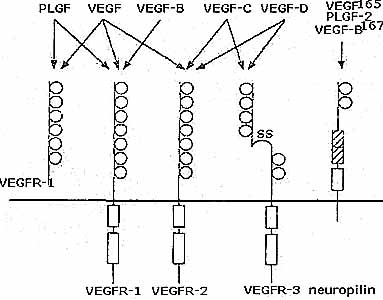
Известно несколько родственных VEGF факторов: placenta-derived growth factor (PIGF), VEGF-B, VEGF-C, c-fos-induced growth gactor (FIGF).
Гомо- и гетеродимеризация их может предопределять их биологическую специфичность.
Placental growth factor (PLGF)
Placental growth factor (PLGF) экспрессируется в плаценте и в меньшей степени в сердце, легких и щитовидной железе. Он связывается только с VEGFR-1 и обеспечивает передачу внутриклеточных сигналов в эндотелиальных клетках и трофобластах. 3 альтернативно транскрибируемые PLGF мРНК идентифицированы у человека, из них PLGF-2 содержит инсерцию в 21 аминокислоту и обладает сродством к компонентам внеклеточного матрикса. PLGF гомодиеры обусловливают пролиферацию и миграцию эндотелия, проницаемость сосудов и ангиогенез возможно блаодаря взаимодействию с VEGF или в результате стимуляции рекрутирования мноцитов. Гипоксия существенно влияет на формирование PLGF/VEGF гетеродимеров. Отсутствие PLGF у трансгенных мышей не ведет к нарушению ангиогенеза во время эмбрионального и постнатального развития. но нрушает ангиогенез во время различных патоголических условий.
VEGF-В
VEGF-В имеет сходную с VEGF эндотелиальную митогенную потенцию, связывается с VEGFR-1 и экспрессируются в первую очередь в развивающемся миокарде и в меньшей степени в развивающихся мышцах, костях, панкреас, надпочечниках и гладкомышеных клетках больших сосудов. Эго экспрессия не регултруется гипоксией. VEGF-В ко-экспрессируется и гетеродимеризуется с VEGF и остается в основном ассоциированным с клетками, возможно передает пространственные сигналы отростающим эндотелиальным клеткам или действует как высвобождаемый пул для индукции регенерации эндотелиальных клеток после повреждения. VEGF-В-дефицитные мыши развиваются нормально, но обладают неуловимыми кардиальными дефектами.
VEGF-С
VEGF-C и FIGF образуют новую субгруппу VEGF-подобных факторов роста, они характеризуются N- и C-терминальными расширениями, фланкирующими домен, гомологичный VEGF. C-терминальный пропептид содержит повторяющиеся мотивы со спайсинг цистеиновыми остатками, типичными для Кольца Бальбиани 3 Белка (BR3R). VEGF-C протеолитически процессирует путем последовательно отщепления С- и N-терминальных пропептидов в результате образуется зрелый VEGF-C, содержащий только домен, гомологичный VEGF. Зрелый VEGF-C подобно VEGF стимулирует проницаемость сосудов, миграцию и пролиферацию капилярных эндотелиальных клеток, хотя нужны более высокие концентрации. Он также ингибирует миграцию PDGF-стимулированных гладкомышечных клеток. У взрослых он обильно экспрессирутеся в сердце, плаценте, легких, почках, мышцах, яичниках и тонком кишечнике.
VEGF-С связывается с VEGFR3 в своей зрелой форме и с VEGFR2 с ни зким сродством в свой форме после неполного процессинга. VEGF-С и VEGFR3 могут первоначально вовлекаться в развитие венозной системы, кроме того они регулируют лимфангиогенез. VEGF-C перепела обнаруживает высокую гомологию с VEGF-C мыши и человека. VEGF-C птиц и человека связывает VEGFR3 и VEGFR2 птиц. Было установлено(Eichmann, et al., 1998) , что VEGF-C, подобно VEGF стимулирует дифференцировку предшественников в эндотелиальные клетки. Следовательно, он может обеспечить эндотелиальную дифференцировку у VEGF-дефицитных перепела, но не способен обеспечить гематопоэтическую дифференцировку.
У эмбрионов перепела VEGF-C мРНК обнаруживается уже на ранних стадиях гаструляции. У эмбрионов мыши VEGF-C обнаруживается со стадии Е7.5 , следовательно, может взаимодествовать с VEGFR2 уже на ранних стадиях дифференцировки эндотелиальных клеток.Экспресия VEGF-C на ранних стадиях развития эмбрионов птиц обнаруживается в основном в структурах, происходящих из эктодермы и мезодермы. В нервной системе ростовой фактор экспрессируется в на дорсальной и вентральной стороне головного мозга, вентрикулярной зоне спинного мозга, пигментированной сетчатке, зрительном нерве и плакодах. Как VEGFR3 и VEGFR2 экспрессируются в перинейральном васкулярном сплетении, соседствующем с клетками, экспрессирующими VEGF-C, что указывает на паракринный способ действия фактора роста. Однако экспрессия на дорсальной стороге головного мозга предшествует формированию интранейрального сосудистого сплетения.
В мезодерме VEGF-C экспресируется некоторыми эндотелиальными клетками, что указывает на возможность механизма аутокринной активации рецепторов с помощью VEGF-C.
У эмбрионов мыши (Е12.5) VEGF-C экспрессируется в мезенхиме, окружающей jugular сосуды, мезентерий и развивающиеся почки. Слабая экспрессия обнаруживается в бранхиальных дугах и межпозвоночных пространствах. Авт. обнаружили сходную экспрессию VEGF-C у эмбрионов птиц, в основном в областях, экспрессирующих VEGFR3, включая бранхиальные дуги, мезокардий и области интестинума. Позднее эти области оказываются богатыми лимфатическими сосудами. У трансгенных мышей с избыточной экспрессией VEGF-C в коже наблюдается гиперплазия лимфатических, но не кровеносных сосудов. Воздействие VEGF-C на хорионалантоисные мембраны эмбрионов птиц вызывает селективную прлиферацию лимфатического эндотелия. Следовательно, VEGF-C играет роль в пролиферации и в дифференцировке лимфатического эндотелия. Однако эндотелиальные клетки, экспрессирующие VEGFR3 и VEGFR2, реагируют на этот лиганд.
VEGF-D
VEGF-D индуцируется c-fos и его уровень наиболее высок в quiescent клетках на обедненной сыворотке. In vivo он экспрессируется в легких, сердце, тонком кишечнике, передней части гипофиза, почках, печени и коже. VEGF-D является лигандом для VEGFR2 и VEGFR3 и митогеном для эндотелиальных клеток.
VEGF изоформы
Ген VEGF человека дает несколько изоформ (VEGF121, VEGF145, VEGF165, VEGF183, VEGF189 и VEGF206. ген VEGF мыши также имеет 4 альтернативно транскрибируемые формы (VEGF115, VEGF120, VEGF, VEGF188. Самая короткая форма VEGF121 свободно диффундирует в окуржающей внеклеточной среде, тогда как длинные изоформы обнаруживают повышенное связывание с богатым гепарином внеклеточным матриксом. VEGF165 может высвобождаться из внеклеточного матрикса
с помощью серин протеиназы плазмина, которая расщепляет его на митогенный С-конец (VEGF111-165 и N-концевой фрагмент (VEGF110 со сниженной способностью связывать рейепторы VEGFR-1, VEGFR-2. VEGF110 и VEGF121 обладают в 100 ораз меньшим митогенным потенциалом для эндотелиальных клеток, чем VEGF165. Разные изоформы отличаются по митогенному потенциалу, хемотактическим свойствам, переносу белка, сигнальной трансдукции, взаимодействию с фактором роста, по характеристикам связывания рецепторов и тканеспецифичности экспрессии.
Были получены мыши, экспрессирующие только VEGF120 изоформу. Часть погибает после рождения сразу, другие примерно на 14-й день из-за сердечной недостаточности. У них не происходит увеличения количества капиляров и коронарных сосудов в сердце. Наступает ишемия миокарда, сходная с ишемической кардиопатией у людей. Интересно, что у этих мышей снижена экспрессия VEGF164-специфического рецептора нейропилина-1. VEGF влияет на формирование гладкомышечных клеток, окружающих коронарные артерии.