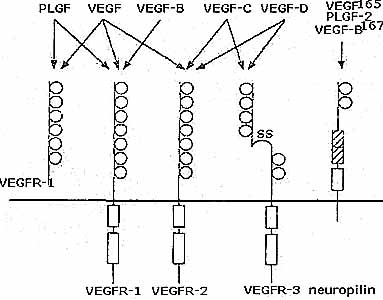
Биологические эффекты VEGF обеспечиваются связыванием с рецепторами семейства тирозин-киназ. VEGFR1 (Flt) связывает VEGF и PLGF; VEGFR2 (FLK1) связывает VEGF, VEGF-C и VEGF-D; a VEGF3 (Flt4) связывает VEGF-C и VEGF-D. Кроме того семафориновые рецепторы нейропилин-1 и нейропилин-2 являются ассоциированными с поверхность рецепторами с низким сродством связывающимися с VEGF-D165 и PIGF-2. Нейропилин-1 ,по-видимому, функционирует как VEGF2 ко-рецептиор, ассистирующий связыванию VEGF165 и потенцирующий его биологический эффект. Рецепторы для VEGF-B и FIGF неизвестны. Формы после протеолитического процессинга обнаруживают повышенную активность в отношении VEGFR3, лишь зрелые формы могут активировать VEGFR2
VEGFR1 и VEGFR2 экспрессируются исключительно в эндотелиальных клетках, а VEGFR2 кроме того в их предшественниках и затем в большинстве капиляров развивающихся органов. VEGFR3 также экспрессируется эндотелиальными клетками ранних эмбрионов, но в основном он ограничен венозным и лимфатическим эндотелием на поздних стадиях развития у эмбрионов как мышей, так и кур. Это подтверждает участие VEGF-C/VEGFR3 в пролиферации лимфатического эндотелия.
Инактивация генов, кодирующих VEGFR1 и VEGFR2 также ведут к недостаточности формирования сосудистой системы и эмбриональной летальности около Е9. Однако фенотипы у мышей разные: VEGFR2/flk-1 гомозиготные нокаутные мыши дают абортивное развитие как эндотелиальных, так гематопоэтических клеток. У VEGFR1/flt-1-дефицитных мышей эндотелиальные и гематопоэтические клетки присутствуют, но не способны давать сосудистые структуры. Фенотип VEGFR2 обусловлен нарушениями ранних ступеней развития, дифференцировки предшественников, общих как эндотелиальным, так и гематопоэтичеаским клеткам.
VEGFR2-позитивные клетки из задней мезодермы эмбринов птиц, взятые на стадии гаструляции, были способны давать как эндотелиальные, так и гематопоэтические клетки в культуре (Eichman et al., 1997). Эндотелиальная дифференцировка предшественников зависела от присутствия VEGF в культуральной среде. Гематопоэтическая дифференцировка обнаруживалась в отсутствие добавления фактора роста, но ингибировалась добавлением в растворимого внеклеточного домена VEGFR2.
Фенотипы мутантов VEGF и VEGFR1 сходны. VEGFR1 является функциональным рецептором для трофобластов, обеспечивая высвобождение нитрик оксида, и для моноцитов/макрофагов, обеспечивая экспрессию тканевого фактора, хемотаксис и трансмиграцию через эндотелиальные клетки. В эндотелиальных клетках он обеспечивает пролиферацию, но не миграцию в ответ на действие VEGF, возможно из-за того, что не активирует МАР киназу. Обнаружена растворимая форма VEGFR1 с неясной функцией. Предполагается, что VEGFR1 отвечает за контактное ингибирование роста эндотелиальных клеток или за сборку эндотелиальных клеток.
VEGFR3 экспрессируется в ранних эмбрионах в кровеносных сосудах, в частности в венах. Постепенно ограничивается местами лимфангиогенеза и становится специфическим маркером лимфатических сосудов. Потеря VEGFR3 не нарушает васкулогенеза и ветвления во время ангиогенеза, но нарушает ремоделирование распространенной эмбриональной васкулатуры, следовательно, эти рецепторы участвуют в развитии сосудистой системы до их участия в лимфангиогенезе.
Сайт создан в системе
uCoz