WT1—more than a transcription factor? Trends in Biochemical Sciences Vol. 23, No. 10, October. 389-393 (1998) | |
|
| |
WT1 in vivo
WT1 and kidney development
WT1 экспрессируется в клетках, предшественниках гломерул почек плодов, стромальных клетках гонад и селезенке и мезотелиальных клетках, выстилающих сердце, диафрагму и перитонеум. Развитие почек зависит от взаимодействий между ureteric эпителием, который происходит из Вольфовых протоков, и окружающей мезенхимы (Рис. 1). Определенная последовательность индуктивных и реципрокных взаимодействий между этими тканями ведет к формировани нефронов (функциональных субъединиц почек). Имеются указания, что инициальное отпочковывание мочеточника зависит от индуктивных сигналов от окружающей метанефрической мезенхимы. Glial-cell-line-derived neurotrophic factor (GDNF) является кандидатом на роль такого сигнала. Это подтверждается паттерном экспрессии фактора роста, который включает метанефрическую бластему, но не развивающуюся почку мочеточника. Gdnf-нокаутные мыши имеют существенные дефекты почек. Когда мочеточник дает веточки, то мезенхима конденсируется вокруг кончиков веточек мочеточника, которые затем подвергаются серии элонгаций и складываний, в результате которых и образуются почечные канальцы и гломерулы. Конденсация метанефрической мезенхимы зависит от сигналов от мочеточника (кандидатами на роль таких сигналов являются WNT-4, BMP-7 и fibroblast growth factors).Сигналы от мезенхимы и мочеточника д.б. дополнены рецепторами в противоположной ткани, чтобы воспринимающая ткань была компетентной.
WT1 and kidney development
WT1 экспрессируется в клетках, предшественниках гломерул почек плодов, стромальных клетках гонад и селезенке и мезотелиальных клетках, выстилающих сердце, диафрагму и перитонеум. Развитие почек зависит от взаимодействий между ureteric эпителием, который происходит из Вольфовых протоков, и окружающей мезенхимы (Рис. 1). Определенная последовательность индуктивных и реципрокных взаимодействий между этими тканями ведет к формировани нефронов (функциональных субъединиц почек). Имеются указания, что инициальное отпочковывание мочеточника зависит от индуктивных сигналов от окружающей метанефрической мезенхимы. Glial-cell-line-derived neurotrophic factor (GDNF) является кандидатом на роль такого сигнала. Это подтверждается паттерном экспрессии фактора роста, который включает метанефрическую бластему, но не развивающуюся почку мочеточника. Gdnf-нокаутные мыши имеют существенные дефекты почек. Когда мочеточник дает веточки, то мезенхима конденсируется вокруг кончиков веточек мочеточника, которые затем подвергаются серии элонгаций и складываний, в результате которых и образуются почечные канальцы и гломерулы. Конденсация метанефрической мезенхимы зависит от сигналов от мочеточника (кандидатами на роль таких сигналов являются WNT-4, BMP-7 и fibroblast growth factors).Сигналы от мезенхимы и мочеточника д.б. дополнены рецепторами в противоположной ткани, чтобы воспринимающая ткань была компетентной.
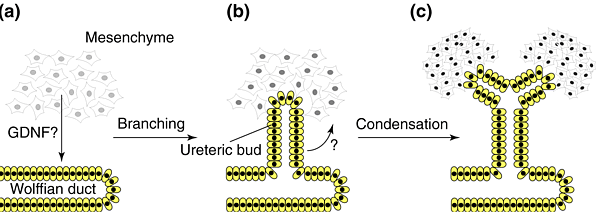 |
| Рис. 1. WT1 and early kidney development. (a) WT1 is expressed in the mesenchyme but not in the ureter. Inductive interactions between these tissues lead to the formation of ureteric buds (b) and subsequent condensation of mesenchymal cells around the tips of the ureter branches (c). The nature of the signals that mediate those reciprocal interactions is not fully understood. A number of candidates, however, exist. wt1 expression levels are indicated by the shading of the nuclei of the mesenchymal cells. Analysis of wt1-recombinant mice demonstrates that WT1 is involved in ureter formation as well as in the response of the mesenchyme to ureter signals. The branching step from (a) to (b) is blocked in wt1-knockout animals. |
Уровни мРНК WT1 низки в неиндуцированной мезенхиме, но отсутствуют в eе реципрокно индуцированной ткани, эпителии мочеточника. Экспрессия WT1 существенно возрастает по мере конденсации мезенхимы. В зрелых нефронах экспрессия WT1 обнаруживается в confined to the podocytes, высоко специализированном слое эпителиальных клеток гломерул. Хотя нормальные мезенхимные клетки присутствуют уже на 11.5 день эмбриональногo развития, уретрический зачаток отсутствует. Затем происходит апоптоз мезенхимы и спустя полдня мезенхимные клетки перестают обнаруживаться. Т.к. WT1 экспрессируется в мезенхиме, но не в мочеточнике, то отсутствие зачатка мочеточника у Wt1-/- эмбрионов указывает на то, что WT1 непосредственно или косвенно отвечает за генерацию сигналов от мезенхимы, которые воспринимаются мочеточником.
WT1 такж, по-видимому, отвечает за компетентность мезенхимы отвечать на сигналы от мочеточника и конденсироваться. Продемонстрирована двойная роль WT1 во время формирования и дифференцировки почек и показано, что WT1 регулирует экспрессию сигнальных и рецепторных молекул на транскрипционном и пост-транскрипционном уровне.
Diseases associated with WT1 mutations
Diseases associated with WT1 mutations
Тumor-suppressor ген играет критическую роль в формировании опухолей Wilms, но мутации WT1 обнаруживаются и при др. заболеваниях у человека. Мутации WT1 вызывают почти все случаи Denys–Drash syndrome, который является редким онтогенетическим нарушением моче-половой системы. Все составляющие синдрома, по-видимому, обусловлены доминантными мутациями в гене WT1. Мутации WT1 обусловливают также случаи Frasier синдрома, редкого заболевания, которое характеризуется мужским pseudo-hermaphroditism и прогрессивной glomerulopathy. Все ассоциированные с Frasier мутации WT1 расположены в интронах; это подчеркивает функциональные отличия между различными сплайс-формами WT1.
| Table 1. Diseases caused by WT1 mutations | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
WT1 мутации обнаруживаются также в редких mesotheliomas. Более того, хромосомные транслокации, которые сливают предполагаемый трансактивационный домен гена Ewing sarcoma (EWS) с частью WT1 выявлены в desmoplastic small-round-cell tumor, рак происходящий из мезотелия. Т.о., хотя WT1 обычно действует как рецессивный ген супрессор-опухолей, он обнаруживает свойства доминантного онкогена, когда слит соспецифическим доменом др. молекулы. Онкогенные свойства в результате слияния белка выявляются различными методами. Наконец, WT1 мутации обнаружены в 4 из 36 острых лейкемий. Изменения были в основном небольшими инсерциями, которые как полагают, дают укороченные WT1 белки.
Большинство тканей, где экспрессируется WT1 и где возникают опухоли как следствие мутаций WT1, подвергаются mesenchyme–epithelial переходам в то время, когда экспрессируется WT1. Напр. , опухоли Wilms, как полагают, возникают из мезенхимных стволовых клеток, которые неспособны дифференцироваться в эпителиальные клетки и впоследствии дают опухоли.
Локус WT1 довольно сложен и наши знания о его регуляции ограничены. В почечных клетках 24 kb of 5'-фланкирующие последовательности недостаточны, чтобы управлять экспрессией WT1. Однако, 620-kb YAC, содержащий ген wt1мыши, фланкированный 240 kb и 300 kb of 5' последовательностями и 3' последовательностями соотв., был способен управлять wt1 экспрессией в почечной 293 линии клеток человека на уровне, сравнимом с таковым для эндогенного гена. Также, 280-kb YAC, содержащий ген WT1 человека, м. частично восстанавливать эмбрионально-летальный wt1-null фенотип.
Два члена семейства paired-box транскрипционных факторов, PAX-8 и PAX-2, а также белок с zinc-finger SP1, позитивно регулируют экспрессию WT1 (Рис. 2). PAX-2 сам по себе негативно регулируется с помощью WT1. Pax-2-нокаутные мыши, которые подобно Wt1-нокаутным мышам, не имели почек и генитальных трактов. Это указывает на то, что оба гена действуют на одном и том же пути. WT1 кроме того осуществляет негативную ауторегуляцию своего собственного промотора. Эта негативная петля обратной связи вносит вклад во временную экспрессию WT1 во многих тканях.
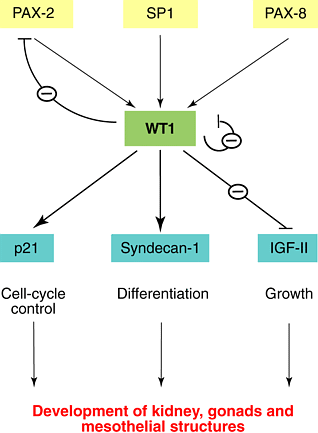 |
| Рис. 2. The WT1 pathway. PAX-2, SP1 and PAX-8 regulate WT1 expression. The genomic region responsible for proper WT1 expression is, however, quite large, and a number of additional transcription factors are likely to control the spatial and temporal expression pattern of WT1. A large number of potential WT1-target genes have been identified, mostly on the basis of transient transfections. In rare instances [e.g. in the case of the gene that encodes the cell-cycle regulator p21, the proteoglycan-encoding and differentiation marker syndecan-1 gene, and the gene that encodes insulin-like-growth-factor II (Igf-II)], the respective endogenous genes have been analysed. Note, however, that the genes depicted are only examples. It is not yet clear which of these genes are physiologically relevant. WT1 can act as a transcriptional repressor as well as an activator. |
WT1? как полагают, регулирует набор нижестоящих генов, которые кодируют, напр., ростовые факторы, рецепторы ростовых факторов и факторы транскрипции. Это гены-мишени, которые м.б. регулированы негативно и позитивно с помощью WT1, они участвуют в различных процессах, таких как пролиферация, дифференцировка и контроль клеточного цикла.
WT1 structure and nucleic acid binding
WT1 structure and nucleic acid binding
WT1 обладает многими свойствами, которые типичны для транскрипционных факторов. Он имеет glutamine/proline-богатый N-конец, активационный и репрессионный домены, nuclear-localization сигналыи 4 Cys2–His2 цинковых пальчика на С-конце. N-терминальные 180 аминокислот WT1 содержат домен само-ассоциации, который функционирует и in vitro и in vivo. WT1 экспрессируется как 52–65-kDa семейство белоков, которое возникает в результате двух альтернативных сайтов инициации трансляции и двух альтернативно сплайсируемых экзонов. Alternative-splice I затрагивает экзон 5, который кодирует 17 аминокислот. Alternative-splice II результат использования альтернативных сплайс-донорских последовательностей между экзонами 9 и 10. Инсерция трех остатков (KTS последовательность) нарушает сплайсинг между цинковыми пальчиками 3 и 4. Эти сплайс-варианты экспрессируются в постоянном соотношении (+KTS: -KTS ~2:1). Следствием альтернативной инициации трансляции как и включение экзона 5 еще не установленоы в точности.
DNA binding
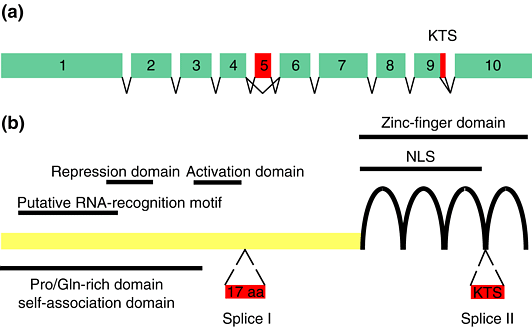 |
| Рис. 3. Structure of the WT1 mRNA (a) and WT1 protein (b). WT1 is encoded by ten exons. Alternative splicing of exon 5 and alternative usage of two different splice-donor sites at the 3' end of exon 9 produce four different splice forms. The inclusion of splice I (exon 5) leads to an insertion of 17 amino acid residues (aa) into the regulatory domain of WT1. The splice-II sequence at the 3' end of exon 9 consists of the tripeptide KTS, which is inserted between zinc fingers III and IV. A Pro/Gln-rich region, which is almost identical to the self-association domain, as well as a repression and an activation domain, are indicated. WT1 seems to harbor multiple nuclear-localization signals (NLS), some of which are located within the zinc-finger region. A predicted RNA-binding motif resides in the N-terminus of the molecule. |
DNA binding
Белок WT1 protein, особенно сплайс-форма с отсутствием KTS инсерции (-KTS форма), соединяется с ДНК. Связывающий мотив использует GCG5CG последовательность, которая обычно обозначается как EGR1 консенсус, т.к. она также соединяется с early growth response 1 (EGR-1) генным продуктом. WT1 кроме того соединяется с неродственным TC мотивом [(TCC)4TCTCC] с равным сродством. WT1 обнаруживает высокое сродство к гетеродуплексной ДНК, которая возникает в результате `bubble fomation' во время репликации или транскрипции, когда dsDNA плавится. Это указывает на то, что WT1 м. ингибировать репликацию ДНК.
RNA binding
RNA binding
Недавно анализ WT1–nucleic-acid взаимодействий предпринят, т.к. WT1 колокализуется со сплайсинг факторами. Во-первых, идентифицированы РНК последовательности, которые являются мишенями для WT1, так, они локализуются в экзоне 2 мРНК insulin-like growth factor 2 и соединяются с помощью цинковых пальчиков WT1-KTS и WT1+KTS изоформ. Кроме того, идентифицированы три неродственных семейства РНК лигандов с помощью метода SELEX (systematic evolution of ligands by exponential enrichment). Все последовательности свяызываются цинковыми пальчиками 2–4 WT1; инсерция KTS трипептида существенно снижает сродство WT1 к РНК мишеням. Необходимо идентифицировать генные транскрипты, которые создают эти последовательности и делают возможной их пост-транскрипционную регуляцию с помощью WT1.
Different splice forms—different functions?
Different splice forms—different functions?
+KTS b -KTS варианты, по-видимому, выполняют разные функции. Во первых, присутствие и -KTS и +KTS форм WT1 законсервировано эволюционно (напр., от мышей и рыбок данио до человека). Это указывает на то, что инсерция KTS последовательностей функционально важна и что -KTS и +KTS варианты выполняют разные функции. Во-вторых, -KTS и +KTS формы WT1 имеют разные, но частично перекрывающиеся, ДНК-связывающее сродство и специфичность. Фактически, -KTS изоформа связывается специфически с определнными консенсусными последовательностями, а +KTS изоформа в целом обнаруживает сниженное сродство к ДНК. Это м. объяснить или регуляцией различных наборов генов-мишеней или тем, что первичная роль -KTS формы является регуляция транскрипции, тогда как +KTS форма вовлекается также в др. клеточные процессы. В-третьих, альтернативно сплайсированные формы WT1 локализуются в различных субъядерных компартментах. В то время как -KTS форма диффузно распределена по всему ядру +KTS форма экспрессируется в виде крапчатого паттерна в ядре. Это указывает на то, что разные сплайс-формы WT1 выполняют свою роль в разных местах ядра и это согласуется с идеей, что две формы WT1 выполняют разные функции.
Подтверждением этому являются мутации в WT1 гене, вызывающие Frasier syndrome. Мутации, ыявляемые при этом синдроме являются интронными и не затрагивают кодирующую область WT1. Следствием этих мутаций является снижение соотношения +KTS: -KTS. Это указывает на то, что изменения в балансе между альтернативно сплайсированными формами WT1 достаточны, чтобы вызвать Frasier syndrome.
Modifications of WT1
Modifications of WT1
мРНК WT1 такж редактируется. В почках взрослых—но не у новорожденных крыс, а также в тестисах человека, тимидиновый остаток в экзоне 6 WT1 (положение 839 у крыс и 1222 у человека) заменяется на цитозиновый остаток. Это ведет к замене Ile→Pro в белке. WT1, который содержит замещенный пролиновый остаток репрессирует транскрипцию с EGR-1 промотора, она на 25–30% менее эффективна, чем у контрольного. Хотя этот эффект не очень драматичен, но отредактированная и не отредактивровання формы WT1 м. вести себя совершенно различно, напр., при процессинге РНК. Редактирование РНК, однако, не столь частый механизм, с помощью которого WT1 меняется во время туморогенеза.
Доказательства пост-трансляционной модификации WT1 показывают, что область цинковых пальчиков WT1 фосфорилируется protein kinase A (PKA)и protein kinase C (PKC) in vitro, а экзогенно экспрессируемый белок WT1 фосфорилируется в COS-7 клетках. Два индуцируемых forskolin сайта фосфорилирования в цинковых пальчиках 2 и 3 (Ser 365 и Ser 393, соотв.) лежат точно внутри PKA консенсусных последовательностей. Фосфорилирование этих остатков редуцирует ДНК-связывающую активность WT1, a коэкспрессия PKA снижает способность WT1 репрессировать транскрипцию с двух различных промоторов.
WT1-associated proteins
WT1-associated proteins
WT1 м. димеризоваться, но связано ли это с др. белками? Идентифицированы некоторые партнеры WT1. Первый является продуктом др. гена супрессирующего опухоли, p53. Два белка влияют на транскрипцию др. др. WT1 усиливает p53-обусловленную активацию транскрипции и снижает его репрессорную функцию. Напротив, присутствие p53 м. изменять WT1 из активатора в репрессор транскрипции. В случае GADD45 (growth arrest and DNA-damage-inducible gene) промотора, p53 прикрепляется к ДНК с помощью WT1 и обеспечивает индукцию транскрипции в ответ на стресс, в отсутствие прямого связывания ДНК. Кроме того, WT1 стабилизирует p53 и противодействует p53-обусловленному апоптозу. В трансформированных аденовирусом клетках, взаимодействие между этими двумя опухоль-супрессирующими белками распространяется на menage a trois, который включает аденовирусный онкопротеин E1B 55K. Этот комплекс располагается в околоядерных цитоплазматических тельцах. Т.о., WT1 и p53 взаимодействуют in vivo. Но неясно, участвует ли это взаимодействие в туморогенезе. При опухолях Wilms, напр., WT1 и p53 мутации исключительно редки.
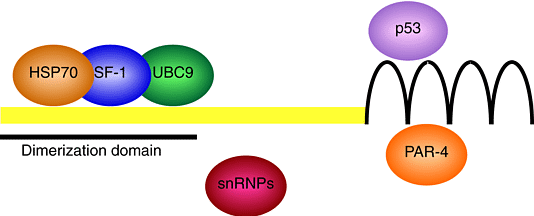 |
| Рис. 4. Proteins that interact with WT1. Yeast two-hybrid and immunoprecipitation experiments have identified a number of WT1-associated proteins. The first two WT1 zinc fingers interact with another tumor-suppressor gene product, p53. The domain that mediates the interaction with PAR-4 is also localized in the zinc-finger region. Interactions between WT1 and the ubiquitin-conjugating enzyme 9 (UBC9), between WT1 and the inducible chaperone HSP70, and between WT1 and the steroidogenic factor 1 (SF-1) are mediated by the N-terminus of WT1. The first 180 amino acids also harbor the dimerization domain of WT1. The domain that interacts with factors that are involved in RNA splicing has not been characterized. Full-length WT1 that contains both alternative splice sequences comprises 449 amino acid residues. |
Lh/ ,беком, который соединяется с WT1 и м. модулировать транскрипционную активность последнего, является PAR-4). Этот репрессор транскрипции содержит домен лейциновых застежек и специфически активируется во время апоптоза клеток простаты. PAR-4 ингибирует функцию активатора транскрипции у WT1, но усиливает у последнего способность репрессировать определенные промоторы. PAR-4, по-видимому, ингибируетрост супрессирующие эффекты WT1.
Физические заимодействия между WT1 и ubiquitin-conjugating enzyme 9 (UBC9) и индуцибельным heat-shock protein 70 (HSP70). Взаимодействие между WT1 и UBC9 нуждается в дальнейшей характеристике. Физическая ассоциация между HSP70 и WT1 происходит в Wilms-tumor и клетках почек эмбринов крыс. Интересно, что HSP70 экспрессия м.б. индуцирована N-терминальным доменом WT1. Колокализация WT1 и HSP70 в клетках развивающихся почек указывает на новую роль этого chaperone во время дифференцировки.
WT1 кроме того действует как коактиватор транскрипции. Во время гонадогенеза у млекопитающих WT1 драматически увеличивает трансактивационную активность orphan nuclear-receptor steroidogenic factor 1 (SF-1). Основой этой синергии является физическое взаимодействие между N-терминальной областью WT1 и SF1. Это происходит только с -KTS формой WT1, но не +KTS вариантом. Ассоциация между SF1 и WT1 является первым примером модуляции транскрипционной активности ядерного рецептора с помощью ткане-специфического кофактора.
Наконец, белок WT1, особенно +KTS сплайс-форма, колокализуется и м. копреципитироваться с антителами против small nuclear ribonucleoprotein particles (snRNPs), а также с coiled-body белком p80 coilin. Взаимодействие между WT1 и snRNPs указывает на то, что WT1 участвует в процессинге пре-мРНК. Факт, что WT1 цинковые пальчики м. связываться с определенными последовательностями РНК, согласуются с этой моделью. Кроме того потенциальный РНК-связывающий мотив должен существовать и на N-конце WT1. Учитывая ограниченный паттерн экспресии WT1, этот белок не может, однако, играть главную роль в сплайсинге, но м. регулировать экспрессию определенных генов пост-транскрипционно, во время развития почек и гонад.