Гены, белки и мутации
β-Катенин
Inactivation of the β-catenin gene by Wnt1-Cre-mediated deletion results in dramatic brain malformation and failure of craniofacial development
Veronique Brault , Robert Moore, Stefanie Kutsch, Makoto Ishibashi , David H. Rowitch ,Andrew P. McMahon, Lukas Sommer , Oreda Boussadia and Rolf Kemler
Development 128, 1253-1264 (2001)
β-catenin был впервые выявлен в комплексе с cell
adhesion molecule (CAM) E-cadherin (Vestweber and Kemler,
1984; Ozawa et al., 1989; Nagafuchi and Takeichi, 1989). Затем было
установлено, что β-catenin непосредствнно
связывается с цитоалазматическим доменом E-cadherin
и с a-catenin, связывающим этот адгезивный
комплекс с актиновым цитоскелетом (Aberle et al.,
1994; Aberle et al., 1996a; Hülsken et al., 1994; Jou et al.,
1995; Rimm et al., 1995). Показано, что E-cadherin/catenin
комплекс является ключевым для полярности
и функции эпителиальных клеток (Aberle et al., 1996b).
Его мутации коррелируют с усилением
инвазивности и метастазирования
опухолевых клеток (Berx et al., 1998). Гомология β-catenin
с Drosophila Armadillo (Arm) указывает на то, что β-catenin
- подобно Arm - является частью пути
передачи сигналов Wingless/Wnt (Wg/Wnt) (McCrea et al., 1991; Butz et al., 1992).
REFERENCES
Aberle, H., Butz, S., Stappert, J., Weissig, H., Kemler, R. and Hoschuetzky, H. (1994). Assembly of the cadherin-catenin complex in vitro with recombinant proteins. J. Cell Sci. 107, 3655-3663.
Aberle, H., Schwartz, H., Hoschuetzky, H. and Kemler, R. (1996a). Single amino acid substitutions in proteins of the armadillo gene family abolish their binding to alpha-catenin. J. Biol. Chem. 271, 1520-1526.
Aberle, H., Schwartz, H. and Kemler, R. (1996b). Cadherin-catenin complex: protein interactions and their implications for cadherin function. J. Cell Biochem. 61, 514-523.
Achatz, G., Nitschke, L. and Lamers, M. C. (1997). Effect of transmembrane and cytoplasmic domains of IgE on the IgE response. Science 276, 409-411.
Bally-Cuif, L., Cholley, B. and Wassef, M. (1995). Involvement of Wnt-1 in the formation of the mes/metencephalic boundary. Mech. Dev. 53, 23-34.
Berx, G., Nollet, F. and van Roy, F. (1998). Dysregulation of the E-cadherin/ catenin complex by irreversible mutations in human carcinomas. Cell Adhes. Commun. 6, 171-184.
Butz, S., Stappert, J., Weissig, H. and Kemler, R. (1992). Plakoglobin and beta-catenin: distinct but closely related. Science 257, 1142-1144.
Cadigan, K. M. and Nusse, R. (1997). Wnt signaling: a common theme in animal development. Genes Dev. 11, 3286-3305.
Carlson, B. M. (1994). Human Embryology and Developmental Biology. St. Louis: Mosby-Year Book
Chai, Y., Bringas P. Jr., Shuler, C., Devaney, E., Grosschedl, R. and Slavkin, H. C. (1998). A mouse mandibular culture model permits the study of neural crest cell migration and tooth development. Int. J. Dev. Biol. 42, 87-94.
Chai, Y., Jian, X., Ito, Y., Bringas, P., Han, J., Rowitch, D. H., Soriano, P., McMahon, A. P. and Sucov, H. M. (2000). Fate of the mammalian cranial neural crest during tooth and mandibular morphogenesis. Development 127, 1671-1679.
Crossley, P. and Martin, G. R. (1995). The mouse Fgf8 gene encodes a family of polypeptides and is expressed in regions that direct outgrowth and patterning in the developing embryo. Development 121, 439-451.
Danielian, P. S., White, R., Lees, J. A. and Parker, M. G. (1992). Identification of a conserved region required for hormone dependent transcriptional activation by steroid hormone receptors. EMBO J. 11, 1025- 1033.
Danielian, P. S. and McMahon, A. P. (1996). Engrailed-1 as a target of the Wnt-1 signalling pathway in vertebrate midbrain development. Nature 383, 332-334.
Danielian, P. S., Muccino, D., Rowitch, D. H., Michael, S. K. and McMahon, A. P. (1998). Modification of gene activity in mouse embryos in utero by a tamoxifen-inducible form of Cre recombinase. Curr. Biol. 8, 1323-1326.
Davidson, D., Graham, E., Sime, C. and Hill, R. (1988). A gene with sequence similarity to Drosophila engrailed is expressed during development of the neural tube and vertebrae in the mouse. Development 104, 305-316.
Davis, C. A. and Joyner, A. L. (1988). Expression patterns of the homeo box-containing genes En-1 and En-2 and the proto-oncogene int-1 diverge during mouse development. Genes Dev. 2, 1736-1744.
Davis, C. A., Holmyard, D. P., Millen, K. J. and Joyner, A. L. (1991). Examining pattern formation in mouse, chicken, and frog embryos with an En-specific antiserum. Development 111, 287-298.
Dickinson, M. E., Krumlauf, R. and McMahon, A. P. (1994). Evidence fora mitogenic effect of Wnt-1 in the developing mammalian central nervous system. Development 120, 1453-1471.
Eastman, Q. and Grosschedl, R. (1999). Regulation of LEF-1/TCF transcription factors by Wnt and other signals. Curr. Opin. Cell Biol. 11, 233-240.
Echelard, Y., Vassileva, G. and McMahon, A. P. (1994). Cis-acting regulatory sequences governing Wnt-1 expression in the developing mouse CNS. Development 120, 13-24.
Etchevers, H. C., Couly, G., Vincent, C. and Le Douarin, N. M. (1999). Anterior cephalic neural crest is required for forebrain viability. Development 126, 3533-3543.
Gendron-Maguire, M., Mallo, M., Zhang, M. and Gridley, T. (1993). Hoxa-2 mutant mice exhibit homeotic transformation of skeletal elements derived from cranial neural crest. Cell 75, 1317-1331.
Gerhardt, H., Wolburg, H. and Redies, C. (2000). N-cadherin mediates pericytic-endothelial interaction during brain angiogenesis in the chicken. Dev. Dyn. 218, 472-479.
Gonzalez, F., Swales, I., Bejsovec, A., Skaer, H. and Martinez-Arias, A. (1991). Secretion and movement of the wingless protein in the epidermis of the Drosophila embryo. Mech. Dev. 35, 43-54.
Grove, E. A., Tole, S., Limon, J., Yip, L.-W. and Ragsdale, C. (1998). The hem of the embryonic cerebral cortex is defined by the expression of multiple Wnt genes and is compromised in Gli3-deficient mice. Development 125, 2315-2325.
Gu, H., Marth, J. D., Orban, P. C., Mossmann, H. and Rajewsky, K. (1994). Deletion of a DNA polymerase beta gene segment in T cells using cell type-specific gene targeting. Science 265, 103-106.
Haegel, H., Larue, L., Ohsugi, M., Fedorov, L., Herrenknecht, K. and Kemler, R. (1995). Lack of β-catenin affects mouse development at gastrulation. Development 121, 3529-3537.
Hagedorn, L., Suter, U. and Sommer, L. (1999). PO and PM22 mark a multipotent neural crest-derived cell type that displays community effects in response to TGF-b family factors. Development 126, 3781-3794.
Heikinheimo, M., Lawshe, A., Shackleford, G. M., Wilson, D. B. and McArthur, C. A. (1994). Fgf-8 expression in the post-gastrulation mouse suggests roles in the development of the face, limbs, and central nervous system. Mech. Dev. 48, 129-138.
Hollyday, M., McMahon, J. A. and McMahon, A. P. (1995). Wnt expression patterns in chick embryo nervous system. Mech. Dev. 52, 9-25.
Huelsken, J., Vogel, R., Brinkmann, V., Erdmann, B., Birchmeier, C. and Birchmeier, W. (2000). Requirement for β-catenin in anterior-posterior axis formation in mice. J. Cell Biol. 148, 567-578.
Hulsken, J., Birchmeier, W. and Behrens, J. (1994). E-cadherin and APC compete for the interaction with β-catenin and the cytoskeleton. J. Cell Biol. 127, 2061-2069.
Ikeya, M., Lee, S. M. K., Johnson, J. E., McMahon, A. P. and Takada, S. (1997). Wnt signalling required for expansion of neural crest and CNS progenitors. Nature 389, 966-970.
Inoue, T., Chisaka, O., Matsunami, H. and Takeichi, M. (1997). Cadherin-6 expression transiently delineates specific rhombomeres, other neural tube subdivisions, and neural crest subpopulations in mouse embryos. Dev. Biol. 183, 183-194.
Jiang, X., Rowitch, D. H., Soriano, P., McMahon, A. P. and Sucov, H. M. (2000). Fate of the mammalian cardiac neural crest. Development 127, 1607- 1616.
Jou, T. S., Stewart, D. B., Stappert, J., Nelson, W. J. and Marrs, J. A. (1995). Genetic and biochemical dissection of protein linkages in the cadherin-catenin complex. Proc. Natl. Acad. Sci. USA 92, 5067-5071.
Jue, S. F., Bradley, R. S., Rudnicki, J. A., Varmus, H. E. and Brown, A. M. (1992). The mouse Wnt-1 gene can act via a paracrine mechanism in transformation of mammary epithelial cells. Mol. Cell Biol. 12, 321- 328.
Kanzler, B., Foreman, R. K. Labosky, P. A. and Mallo, M. (2000). BMP signaling is essential for development of skeletogenic and neurogenic cranial neural crest. Development 127, 1095-1104.
Kimura, Y., Matsunami, H. and Takeichi, M. (1996). Expression of cadherin-11 delineates boundaries, neuromeres, and nuclei in the developing mouse brain. Dev. Dyn. 206, 455-462.
Knecht, A. K., Good, P. J., Dawid, I. B. and Harland, R. M. (1995). Dorsal-ventral patterning and differentiation of noggin-induced neural tissue in the absence of mesoderm. Development 121, 1927-1936.
Le Douarin, N. M. (1982). The Neural Crest. Cambridge, UK: Cambridge University Press. Le Douarin, N. M. (1984). Cell migrations in embryos. Cell 38, 353-366.
Lee, S. M. K., Tole, S., Grove, E. and McMahon, A. P. (2000). A local Wnt-3a signal is required for development of mammalian hippocampus. Development 127, 457-467.
Maden, M., Horton, C., Graham, A., Leonard, L., Pizzey, J., Siegenthaler, G., Lumsden, A. and Eriksson, U. (1992). Domains of cellular retinoic acid-binding protein I (CRABP I) expression in the hindbrain and neural crest of the mouse embryo. Mech. Dev. 37, 13-23.
Mahmood, R., Bresnick, J., Hornbruch, A., Mahony, C., Morton, N., Colquhoun, K., Martin, P., Lumsden, A., Dickson, C. and Mason, I. (1995). A role for FGF-8 in the initiation and maintenance of vertebrate limb bud outgrowth. Curr. Biol. 5, 797-806.
Mallo, M. (1997). Retinoic acid disturbs mouse middle ear development in a stage-specific fashion. Dev. Biol. 184, 175-186.
Mallo, M. and Brandlin, I. (1997). Segmental identity can change independently in the hindbrain and rhombencephalic neural crest. Dev. Dyn. 210, 146-156.
Mastick, G. S., Fan, C. M., Tessier-Lavigne, M., Serbedzija, G. N., McMahon, A. P. and Easter, S. E. (1996). Early deletion of neuromeres in Wnt -/ - mutant mice: Evaluation by morphological and molecular markers. J. Comp. Neurol. 374, 246-258.
McCrea, P. D., Turck, C. W. and Gumbiner, B. M. (1991). A homolog of the armadillo protein in Drosophila (plakoglobin) associated with E-cadherin. Science 254, 1359-1361.
McMahon, A. P. and Bradley, A. (1990). The Wnt-1 (int-1) proto-oncogene is required for development of a large region of the mouse brain. Cell 62, 1073-1085.
McMahon, A. P., Joyner, A., Bradley, A. and McMahon, J. (1992). The midbrain-hindbrain phenotype of Wnt-1-/Wnt-1- mice results from stepwise deletion of engrailed-expressing cells by 9.5 days postcoitum. Cell 69, 581- 595.
Millet, S., Bloch-Gallego, E., Simeone, A. and Alvarado-Mallart, R.-M. (1996). The caudal limit of Otx2 gene expression as a marker of the midbrain/hindbrain boundary: a study using in situ hybridization and chick/quail homotypic grafts. Development 122, 3785-3797.
Miller, J. R., Hocking, A. M., Brown, J. D. and Moon, R. T. (1999). Mechanism and function of signal transduction by the Wnt/β-catenin and Wnt/Ca 2+ pathways. Oncogene 18, 7860-7872.
Mitchell, P. J., Timmons, P. M., Hebert, J. M., Rigby, P. W. J. and Tjian, R. (1991). Transcription factor AP-2 is expressed in neural crest cell lineages during mouse embryogenesis. Genes Dev. 5, 105-119.
Nagafuchi, A. and Takeichi, M. (1989). Transmembrane control of cadherin-mediated cell adhesion: a 94 kDa protein functionally associated with a specific region of the cytoplasmic domain of E-cadherin. Cell. Regul. 1, 37- 55.
Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W. and Roder, J. C. (1993). Derivation of completely cell culture-derived mice from early passage embryonic stem cells. Proc. Natl. Acad. Sci. USA 90, 8424-8428.
Neidhardt, L., Gasca, S., Wertz, K., Obermayr, F., Worpenberg, S., Lehrach, H. and Herrmann, B. G. (2000). Large-scale screen for genes controlling mammalian embryogenesis, using high-throughput gene expression analysis in mouse embryos. Mech. Dev. 98, 77-93.
Nichols, D. H. (1981). Neural crest formation in the head of the mouse embryo as observed using a new histological technique. J. Embryol. Morphol. 64, 105-120.
Noden, D. M. (1978). The control of avian cephalic neural crest cytodifferentiation. II. Neural tissues. Dev. Biol. 67, 313-329.
Ohuchi, H., Yoshioka, H., Tanaka, A., Kawakami, Y., Nohno, T. and Noji, S. (1994). Involvement of androgen-induced growth factor (FGF-8) gene in mouse embryogenesis and morphogenesis. Biochem. Biophys. Res. Comm. 204, 882-888.
Ozawa, M., Baribault, H. and Kemler, R. (1989). The cytoplasmic domain of the cell adhesion uvomorulin associates with three independent proteins structurally related in different species. EMBO J. 8, 1711-1717.
Parr, B. A., Shea, M. J., Vassileva, G. and McMahon, A. P. (1993). Mouse Wnt genes exhibit discrete domains of expression in the early embryonic CNS and limb buds. Development 119, 247-261.
Pfaff, S. L., Mendelsohn, M., Stewart, C. L., Edlund, T. and Jessell, T. M. (1996). Requirement for LIM homeobox gene Isl1 in motor neuron generation reveals a motor neuron-dependent step in interneuron differentiation. Cell 84, 309-320.
Redies, C. (1995). Cadherin expression in the developing vertebrate CNS: from neuromeres to brain nuclei and neural circuits. Exp. Cell Res. 220, 243- 256.
Redies, C. and Takeichi, M. (1996). Cadherins in the developing centralnervous system: an adhesive code for segmental and functional subdivisions. Dev. Biol. 180, 413-423.
Redies, C. (2000). Cadherins in the central nervous system. Prog. Neurobiol. 61, 611-648.
Redies, C., Ast, M., Nakagawa, S., Takeichi, M., Martinez-de-la-Torre, M. and Puelles, L. (2000). Morphologic fate of the diencephalic prosomeres and their subdivisions revealed by mapping cadherin expression. J. Comp. Neurol. 421, 481-514.
Rijli, F. M., Mark, M., Lakkaraju, S., Dierich, A., Dolle, P. and Chambon, P. (1993). A homeotic transformation is generated in the rostral branchial region of the head by disruption of Hoxa-2, which acts as a selector gene. Cell 75, 1333-1349.
Rimm, D. L., Koslov, E. R., Kebriaei, P., Cianci, C. D. and Morrow, J. S. (1995). Alpha 1(E)-catenin is an actin-binding and -bundling protein mediating the attachment of F-actin to the membrane adhesion complex. Proc. Natl. Acad. Sci. USA 92, 8813-8817.
Roelink, H. and Nusse, R. (1991). Expression of two members of the Wnt family during mouse development-restricted temporal and spatial patterns in the developing neural tube. Genes Dev. 5, 381-388.
Salinas, P. C. and Nusse, R. (1992). Regional expression of the Wnt-3 gene in the developing mouse forebrain in relationship to diencephalic neuromeres. Mech. Dev. 39, 151-160.
Schorle, H., Meier, P., Buchert, M., Jaenisch, R. and Mitchell, P. J. (1996). Transcription factor AP-2 essential for cranial closure and craniofacial development. Nature 381, 235-238.
Schwenk, F., Baron, U. and Rajewsky, K. (1995). A Cre-transgenic mouse strain for the ubiquitous deletion of loxP-flanked gene segments including deletion in germ cells. Nucleic Acids Res. 23, 5080-5081.
Serbedzija, G. N., Fraser, S. E. and Bronner-Fraser, M. (1990). Pathways of trunk neural crest migration in the mouse embryo as revealed by vital dye labelling. Development 108, 605-612.
Serbedzija, G. N., Bronner-Fraser, M. and Fraser, S. E. (1992). Vital dye analysis of cranial neural crest cell migration in the mouse embryo. Development 116, 297-307.
Serbedzija, G. N., Dickinson, M. and McMahon, A. P. (1996). Cell death in the CNS of the Wnt-1 mutant mouse. J. Neurobiol. 31, 275-282. Shimamura, K. and Takeichi, M. (1992). Local and transient expression of E-cadherin involved in mouse embryonic brain morphogenesis. Development 116, 1011-1019.
Simeone, A., Acampora, D., Gulisano, M., Stornaiuolo, A. and Boncinelli, E. (1992). Nested expression domains of four homeobox genes in developing rostral brain. Nature 358, 687-690.
Simeone, A., Acampora, D., Mallamaci, A., Stornaiuolo, A., D’Apice, M., Nigro, V. and Boncinelli, E. (1993). A vertebrate gene related to orthodenticle contains a homeodomain of the bicoid class and demarcates anterior neuroectoderm in the gastrulating mouse embryo. EMBO J. 12, 2735-2747.
Sommer, L., Shah, N., Rao, M. and Anderson, D. J. (1995). The cellular function of MASH1 in autonomic neurogenesis. Neuron 15, 1245-1258.
Stemple, D. K. and Anderson, D. J. (1992). Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell 71, 973-985.
Stoner, C. M. and Gudas, L. J. (1989). Mouse cellular retinoic acid binding protein: cloning, complementary DNA sequence, and messenger RNA expression during the retinoic acid-induced differentiation of F9 wild-type and RA-3-10 mutant teratocarcinoma cells. Cancer Res. 49, 1497- 1504.
Swiatek, P. J. and Gridley, T. (1993). Perinatal lethality and defects in hindbrain development in mice homozygous for a targeted mutation of the zinc finger gene Krox20. Genes Dev. 7, 2071-2084.
Takada, S., Stark, K. L., Shea, M. J., Vassileva, G., McMahon, J. A. and McMahon, A. P. (1994). Wnt-3a regulates somite and tailbud formation in the mouse embryo. Genes Dev. 8, 174-189.
Takeichi, M., Uemura, T., Iwai, Y., Uchida, M., Inoue, T., Tanaka, T. and Suzuki, S. C. (1997). Cadherins in brain patterning and neural network formation. Cold Spring Harbor Symposia on Quantitative Biology, Vol. LXII, pp 505-510. Cold Spring Harbor: Cold Spring Harbor Laboratory Press.
Tan, S. S. and Morriss-Kay, G. M. (1985). The development and distribution of the cranial neural crest in rat embryo. Cell Tissue Res. 240, 403-416.
Tan, S. S. and Morriss-Kay, G. M. (1986). Analysis of cranial neural crest cell migration and early fates in postimplantation rat chimaeras. J. Embryol. Exp. Morphol. 98, 21-58.
Tanaka, A., Miyamoto, K., Minamino, N., Takeda, M., Sato, B., Matsuo, H. and Matsumoto, K. (1992). Cloning and characterization of an androgen-induced growth factor essential for the androgen-dependent growth of mouse mammary carcinoma cells. Proc. Natl. Acad. Sci. USA 89, 8928-8932.
Thomas, K. R. and Capecchi, M. R. (1990). Targeted disruption of the murine int-1 proto-oncogene resulting in severe abnormalities in midbrain and cerebellar development. Nature 346, 847-850.
Thomas, K. R., Musci, T. S., Neumann, P. E. and Capecchi, M. R. (1991). Swaying is a mutant allele of the proto-oncogene Wnt-1. Cell 67, 969-976.
Vestweber, D. and Kemler, R. (1984). Some structural and functional aspects of the cell adhesion molecule uvomorulin. Cell Diff. 15, 269-273.
Wilkinson, D. G., Bailes, J. A. and McMahon, A. P. (1987). Expression of the proto-oncogene int-1 is restricted to specific neural cells in the developing mouse embryo. Cell 50, 79-88.
Wurst, W., Auerbach, A. B. and Joyner, A. L. (1994). Multiple developmental defects in Engrailed-1 mutant mice: an early mid-hindbrain deletion and patterning defects in forelimbs and sternum. Development 120, 2065-2075.
Yamaguchi, T. P., Bradley, A., McMahon, A. P. and Jones, S. (1999). A Wnt5a pathway underlies outgrowth of multiple structures in the vertebrate embryo. Development 126, 1211-1223.
Zhang, J., Hagopian-Donaldson, S., Serbedzija, G., Elsemore, J., Plehn-Dujowich, D., McMahon, A. P., Flavell, R. A. and Williams, T. (1996). Neural tube, skeletal and body wall defects in mice lacking transcription factor AP-2. Nature 381, 238-241.
REFERENCES
Aberle, H., Butz, S., Stappert, J., Weissig, H., Kemler, R. and Hoschuetzky, H. (1994). Assembly of the cadherin-catenin complex in vitro with recombinant proteins. J. Cell Sci. 107, 3655-3663.
Aberle, H., Schwartz, H., Hoschuetzky, H. and Kemler, R. (1996a). Single amino acid substitutions in proteins of the armadillo gene family abolish their binding to alpha-catenin. J. Biol. Chem. 271, 1520-1526.
Aberle, H., Schwartz, H. and Kemler, R. (1996b). Cadherin-catenin complex: protein interactions and their implications for cadherin function. J. Cell Biochem. 61, 514-523.
Achatz, G., Nitschke, L. and Lamers, M. C. (1997). Effect of transmembrane and cytoplasmic domains of IgE on the IgE response. Science 276, 409-411.
Bally-Cuif, L., Cholley, B. and Wassef, M. (1995). Involvement of Wnt-1 in the formation of the mes/metencephalic boundary. Mech. Dev. 53, 23-34.
Berx, G., Nollet, F. and van Roy, F. (1998). Dysregulation of the E-cadherin/ catenin complex by irreversible mutations in human carcinomas. Cell Adhes. Commun. 6, 171-184.
Butz, S., Stappert, J., Weissig, H. and Kemler, R. (1992). Plakoglobin and beta-catenin: distinct but closely related. Science 257, 1142-1144.
Cadigan, K. M. and Nusse, R. (1997). Wnt signaling: a common theme in animal development. Genes Dev. 11, 3286-3305.
Carlson, B. M. (1994). Human Embryology and Developmental Biology. St. Louis: Mosby-Year Book
Chai, Y., Bringas P. Jr., Shuler, C., Devaney, E., Grosschedl, R. and Slavkin, H. C. (1998). A mouse mandibular culture model permits the study of neural crest cell migration and tooth development. Int. J. Dev. Biol. 42, 87-94.
Chai, Y., Jian, X., Ito, Y., Bringas, P., Han, J., Rowitch, D. H., Soriano, P., McMahon, A. P. and Sucov, H. M. (2000). Fate of the mammalian cranial neural crest during tooth and mandibular morphogenesis. Development 127, 1671-1679.
Crossley, P. and Martin, G. R. (1995). The mouse Fgf8 gene encodes a family of polypeptides and is expressed in regions that direct outgrowth and patterning in the developing embryo. Development 121, 439-451.
Danielian, P. S., White, R., Lees, J. A. and Parker, M. G. (1992). Identification of a conserved region required for hormone dependent transcriptional activation by steroid hormone receptors. EMBO J. 11, 1025- 1033.
Danielian, P. S. and McMahon, A. P. (1996). Engrailed-1 as a target of the Wnt-1 signalling pathway in vertebrate midbrain development. Nature 383, 332-334.
Danielian, P. S., Muccino, D., Rowitch, D. H., Michael, S. K. and McMahon, A. P. (1998). Modification of gene activity in mouse embryos in utero by a tamoxifen-inducible form of Cre recombinase. Curr. Biol. 8, 1323-1326.
Davidson, D., Graham, E., Sime, C. and Hill, R. (1988). A gene with sequence similarity to Drosophila engrailed is expressed during development of the neural tube and vertebrae in the mouse. Development 104, 305-316.
Davis, C. A. and Joyner, A. L. (1988). Expression patterns of the homeo box-containing genes En-1 and En-2 and the proto-oncogene int-1 diverge during mouse development. Genes Dev. 2, 1736-1744.
Davis, C. A., Holmyard, D. P., Millen, K. J. and Joyner, A. L. (1991). Examining pattern formation in mouse, chicken, and frog embryos with an En-specific antiserum. Development 111, 287-298.
Dickinson, M. E., Krumlauf, R. and McMahon, A. P. (1994). Evidence fora mitogenic effect of Wnt-1 in the developing mammalian central nervous system. Development 120, 1453-1471.
Eastman, Q. and Grosschedl, R. (1999). Regulation of LEF-1/TCF transcription factors by Wnt and other signals. Curr. Opin. Cell Biol. 11, 233-240.
Echelard, Y., Vassileva, G. and McMahon, A. P. (1994). Cis-acting regulatory sequences governing Wnt-1 expression in the developing mouse CNS. Development 120, 13-24.
Etchevers, H. C., Couly, G., Vincent, C. and Le Douarin, N. M. (1999). Anterior cephalic neural crest is required for forebrain viability. Development 126, 3533-3543.
Gendron-Maguire, M., Mallo, M., Zhang, M. and Gridley, T. (1993). Hoxa-2 mutant mice exhibit homeotic transformation of skeletal elements derived from cranial neural crest. Cell 75, 1317-1331.
Gerhardt, H., Wolburg, H. and Redies, C. (2000). N-cadherin mediates pericytic-endothelial interaction during brain angiogenesis in the chicken. Dev. Dyn. 218, 472-479.
Gonzalez, F., Swales, I., Bejsovec, A., Skaer, H. and Martinez-Arias, A. (1991). Secretion and movement of the wingless protein in the epidermis of the Drosophila embryo. Mech. Dev. 35, 43-54.
Grove, E. A., Tole, S., Limon, J., Yip, L.-W. and Ragsdale, C. (1998). The hem of the embryonic cerebral cortex is defined by the expression of multiple Wnt genes and is compromised in Gli3-deficient mice. Development 125, 2315-2325.
Gu, H., Marth, J. D., Orban, P. C., Mossmann, H. and Rajewsky, K. (1994). Deletion of a DNA polymerase beta gene segment in T cells using cell type-specific gene targeting. Science 265, 103-106.
Haegel, H., Larue, L., Ohsugi, M., Fedorov, L., Herrenknecht, K. and Kemler, R. (1995). Lack of β-catenin affects mouse development at gastrulation. Development 121, 3529-3537.
Hagedorn, L., Suter, U. and Sommer, L. (1999). PO and PM22 mark a multipotent neural crest-derived cell type that displays community effects in response to TGF-b family factors. Development 126, 3781-3794.
Heikinheimo, M., Lawshe, A., Shackleford, G. M., Wilson, D. B. and McArthur, C. A. (1994). Fgf-8 expression in the post-gastrulation mouse suggests roles in the development of the face, limbs, and central nervous system. Mech. Dev. 48, 129-138.
Hollyday, M., McMahon, J. A. and McMahon, A. P. (1995). Wnt expression patterns in chick embryo nervous system. Mech. Dev. 52, 9-25.
Huelsken, J., Vogel, R., Brinkmann, V., Erdmann, B., Birchmeier, C. and Birchmeier, W. (2000). Requirement for β-catenin in anterior-posterior axis formation in mice. J. Cell Biol. 148, 567-578.
Hulsken, J., Birchmeier, W. and Behrens, J. (1994). E-cadherin and APC compete for the interaction with β-catenin and the cytoskeleton. J. Cell Biol. 127, 2061-2069.
Ikeya, M., Lee, S. M. K., Johnson, J. E., McMahon, A. P. and Takada, S. (1997). Wnt signalling required for expansion of neural crest and CNS progenitors. Nature 389, 966-970.
Inoue, T., Chisaka, O., Matsunami, H. and Takeichi, M. (1997). Cadherin-6 expression transiently delineates specific rhombomeres, other neural tube subdivisions, and neural crest subpopulations in mouse embryos. Dev. Biol. 183, 183-194.
Jiang, X., Rowitch, D. H., Soriano, P., McMahon, A. P. and Sucov, H. M. (2000). Fate of the mammalian cardiac neural crest. Development 127, 1607- 1616.
Jou, T. S., Stewart, D. B., Stappert, J., Nelson, W. J. and Marrs, J. A. (1995). Genetic and biochemical dissection of protein linkages in the cadherin-catenin complex. Proc. Natl. Acad. Sci. USA 92, 5067-5071.
Jue, S. F., Bradley, R. S., Rudnicki, J. A., Varmus, H. E. and Brown, A. M. (1992). The mouse Wnt-1 gene can act via a paracrine mechanism in transformation of mammary epithelial cells. Mol. Cell Biol. 12, 321- 328.
Kanzler, B., Foreman, R. K. Labosky, P. A. and Mallo, M. (2000). BMP signaling is essential for development of skeletogenic and neurogenic cranial neural crest. Development 127, 1095-1104.
Kimura, Y., Matsunami, H. and Takeichi, M. (1996). Expression of cadherin-11 delineates boundaries, neuromeres, and nuclei in the developing mouse brain. Dev. Dyn. 206, 455-462.
Knecht, A. K., Good, P. J., Dawid, I. B. and Harland, R. M. (1995). Dorsal-ventral patterning and differentiation of noggin-induced neural tissue in the absence of mesoderm. Development 121, 1927-1936.
Le Douarin, N. M. (1982). The Neural Crest. Cambridge, UK: Cambridge University Press. Le Douarin, N. M. (1984). Cell migrations in embryos. Cell 38, 353-366.
Lee, S. M. K., Tole, S., Grove, E. and McMahon, A. P. (2000). A local Wnt-3a signal is required for development of mammalian hippocampus. Development 127, 457-467.
Maden, M., Horton, C., Graham, A., Leonard, L., Pizzey, J., Siegenthaler, G., Lumsden, A. and Eriksson, U. (1992). Domains of cellular retinoic acid-binding protein I (CRABP I) expression in the hindbrain and neural crest of the mouse embryo. Mech. Dev. 37, 13-23.
Mahmood, R., Bresnick, J., Hornbruch, A., Mahony, C., Morton, N., Colquhoun, K., Martin, P., Lumsden, A., Dickson, C. and Mason, I. (1995). A role for FGF-8 in the initiation and maintenance of vertebrate limb bud outgrowth. Curr. Biol. 5, 797-806.
Mallo, M. (1997). Retinoic acid disturbs mouse middle ear development in a stage-specific fashion. Dev. Biol. 184, 175-186.
Mallo, M. and Brandlin, I. (1997). Segmental identity can change independently in the hindbrain and rhombencephalic neural crest. Dev. Dyn. 210, 146-156.
Mastick, G. S., Fan, C. M., Tessier-Lavigne, M., Serbedzija, G. N., McMahon, A. P. and Easter, S. E. (1996). Early deletion of neuromeres in Wnt -/ - mutant mice: Evaluation by morphological and molecular markers. J. Comp. Neurol. 374, 246-258.
McCrea, P. D., Turck, C. W. and Gumbiner, B. M. (1991). A homolog of the armadillo protein in Drosophila (plakoglobin) associated with E-cadherin. Science 254, 1359-1361.
McMahon, A. P. and Bradley, A. (1990). The Wnt-1 (int-1) proto-oncogene is required for development of a large region of the mouse brain. Cell 62, 1073-1085.
McMahon, A. P., Joyner, A., Bradley, A. and McMahon, J. (1992). The midbrain-hindbrain phenotype of Wnt-1-/Wnt-1- mice results from stepwise deletion of engrailed-expressing cells by 9.5 days postcoitum. Cell 69, 581- 595.
Millet, S., Bloch-Gallego, E., Simeone, A. and Alvarado-Mallart, R.-M. (1996). The caudal limit of Otx2 gene expression as a marker of the midbrain/hindbrain boundary: a study using in situ hybridization and chick/quail homotypic grafts. Development 122, 3785-3797.
Miller, J. R., Hocking, A. M., Brown, J. D. and Moon, R. T. (1999). Mechanism and function of signal transduction by the Wnt/β-catenin and Wnt/Ca 2+ pathways. Oncogene 18, 7860-7872.
Mitchell, P. J., Timmons, P. M., Hebert, J. M., Rigby, P. W. J. and Tjian, R. (1991). Transcription factor AP-2 is expressed in neural crest cell lineages during mouse embryogenesis. Genes Dev. 5, 105-119.
Nagafuchi, A. and Takeichi, M. (1989). Transmembrane control of cadherin-mediated cell adhesion: a 94 kDa protein functionally associated with a specific region of the cytoplasmic domain of E-cadherin. Cell. Regul. 1, 37- 55.
Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W. and Roder, J. C. (1993). Derivation of completely cell culture-derived mice from early passage embryonic stem cells. Proc. Natl. Acad. Sci. USA 90, 8424-8428.
Neidhardt, L., Gasca, S., Wertz, K., Obermayr, F., Worpenberg, S., Lehrach, H. and Herrmann, B. G. (2000). Large-scale screen for genes controlling mammalian embryogenesis, using high-throughput gene expression analysis in mouse embryos. Mech. Dev. 98, 77-93.
Nichols, D. H. (1981). Neural crest formation in the head of the mouse embryo as observed using a new histological technique. J. Embryol. Morphol. 64, 105-120.
Noden, D. M. (1978). The control of avian cephalic neural crest cytodifferentiation. II. Neural tissues. Dev. Biol. 67, 313-329.
Ohuchi, H., Yoshioka, H., Tanaka, A., Kawakami, Y., Nohno, T. and Noji, S. (1994). Involvement of androgen-induced growth factor (FGF-8) gene in mouse embryogenesis and morphogenesis. Biochem. Biophys. Res. Comm. 204, 882-888.
Ozawa, M., Baribault, H. and Kemler, R. (1989). The cytoplasmic domain of the cell adhesion uvomorulin associates with three independent proteins structurally related in different species. EMBO J. 8, 1711-1717.
Parr, B. A., Shea, M. J., Vassileva, G. and McMahon, A. P. (1993). Mouse Wnt genes exhibit discrete domains of expression in the early embryonic CNS and limb buds. Development 119, 247-261.
Pfaff, S. L., Mendelsohn, M., Stewart, C. L., Edlund, T. and Jessell, T. M. (1996). Requirement for LIM homeobox gene Isl1 in motor neuron generation reveals a motor neuron-dependent step in interneuron differentiation. Cell 84, 309-320.
Redies, C. (1995). Cadherin expression in the developing vertebrate CNS: from neuromeres to brain nuclei and neural circuits. Exp. Cell Res. 220, 243- 256.
Redies, C. and Takeichi, M. (1996). Cadherins in the developing centralnervous system: an adhesive code for segmental and functional subdivisions. Dev. Biol. 180, 413-423.
Redies, C. (2000). Cadherins in the central nervous system. Prog. Neurobiol. 61, 611-648.
Redies, C., Ast, M., Nakagawa, S., Takeichi, M., Martinez-de-la-Torre, M. and Puelles, L. (2000). Morphologic fate of the diencephalic prosomeres and their subdivisions revealed by mapping cadherin expression. J. Comp. Neurol. 421, 481-514.
Rijli, F. M., Mark, M., Lakkaraju, S., Dierich, A., Dolle, P. and Chambon, P. (1993). A homeotic transformation is generated in the rostral branchial region of the head by disruption of Hoxa-2, which acts as a selector gene. Cell 75, 1333-1349.
Rimm, D. L., Koslov, E. R., Kebriaei, P., Cianci, C. D. and Morrow, J. S. (1995). Alpha 1(E)-catenin is an actin-binding and -bundling protein mediating the attachment of F-actin to the membrane adhesion complex. Proc. Natl. Acad. Sci. USA 92, 8813-8817.
Roelink, H. and Nusse, R. (1991). Expression of two members of the Wnt family during mouse development-restricted temporal and spatial patterns in the developing neural tube. Genes Dev. 5, 381-388.
Salinas, P. C. and Nusse, R. (1992). Regional expression of the Wnt-3 gene in the developing mouse forebrain in relationship to diencephalic neuromeres. Mech. Dev. 39, 151-160.
Schorle, H., Meier, P., Buchert, M., Jaenisch, R. and Mitchell, P. J. (1996). Transcription factor AP-2 essential for cranial closure and craniofacial development. Nature 381, 235-238.
Schwenk, F., Baron, U. and Rajewsky, K. (1995). A Cre-transgenic mouse strain for the ubiquitous deletion of loxP-flanked gene segments including deletion in germ cells. Nucleic Acids Res. 23, 5080-5081.
Serbedzija, G. N., Fraser, S. E. and Bronner-Fraser, M. (1990). Pathways of trunk neural crest migration in the mouse embryo as revealed by vital dye labelling. Development 108, 605-612.
Serbedzija, G. N., Bronner-Fraser, M. and Fraser, S. E. (1992). Vital dye analysis of cranial neural crest cell migration in the mouse embryo. Development 116, 297-307.
Serbedzija, G. N., Dickinson, M. and McMahon, A. P. (1996). Cell death in the CNS of the Wnt-1 mutant mouse. J. Neurobiol. 31, 275-282. Shimamura, K. and Takeichi, M. (1992). Local and transient expression of E-cadherin involved in mouse embryonic brain morphogenesis. Development 116, 1011-1019.
Simeone, A., Acampora, D., Gulisano, M., Stornaiuolo, A. and Boncinelli, E. (1992). Nested expression domains of four homeobox genes in developing rostral brain. Nature 358, 687-690.
Simeone, A., Acampora, D., Mallamaci, A., Stornaiuolo, A., D’Apice, M., Nigro, V. and Boncinelli, E. (1993). A vertebrate gene related to orthodenticle contains a homeodomain of the bicoid class and demarcates anterior neuroectoderm in the gastrulating mouse embryo. EMBO J. 12, 2735-2747.
Sommer, L., Shah, N., Rao, M. and Anderson, D. J. (1995). The cellular function of MASH1 in autonomic neurogenesis. Neuron 15, 1245-1258.
Stemple, D. K. and Anderson, D. J. (1992). Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell 71, 973-985.
Stoner, C. M. and Gudas, L. J. (1989). Mouse cellular retinoic acid binding protein: cloning, complementary DNA sequence, and messenger RNA expression during the retinoic acid-induced differentiation of F9 wild-type and RA-3-10 mutant teratocarcinoma cells. Cancer Res. 49, 1497- 1504.
Swiatek, P. J. and Gridley, T. (1993). Perinatal lethality and defects in hindbrain development in mice homozygous for a targeted mutation of the zinc finger gene Krox20. Genes Dev. 7, 2071-2084.
Takada, S., Stark, K. L., Shea, M. J., Vassileva, G., McMahon, J. A. and McMahon, A. P. (1994). Wnt-3a regulates somite and tailbud formation in the mouse embryo. Genes Dev. 8, 174-189.
Takeichi, M., Uemura, T., Iwai, Y., Uchida, M., Inoue, T., Tanaka, T. and Suzuki, S. C. (1997). Cadherins in brain patterning and neural network formation. Cold Spring Harbor Symposia on Quantitative Biology, Vol. LXII, pp 505-510. Cold Spring Harbor: Cold Spring Harbor Laboratory Press.
Tan, S. S. and Morriss-Kay, G. M. (1985). The development and distribution of the cranial neural crest in rat embryo. Cell Tissue Res. 240, 403-416.
Tan, S. S. and Morriss-Kay, G. M. (1986). Analysis of cranial neural crest cell migration and early fates in postimplantation rat chimaeras. J. Embryol. Exp. Morphol. 98, 21-58.
Tanaka, A., Miyamoto, K., Minamino, N., Takeda, M., Sato, B., Matsuo, H. and Matsumoto, K. (1992). Cloning and characterization of an androgen-induced growth factor essential for the androgen-dependent growth of mouse mammary carcinoma cells. Proc. Natl. Acad. Sci. USA 89, 8928-8932.
Thomas, K. R. and Capecchi, M. R. (1990). Targeted disruption of the murine int-1 proto-oncogene resulting in severe abnormalities in midbrain and cerebellar development. Nature 346, 847-850.
Thomas, K. R., Musci, T. S., Neumann, P. E. and Capecchi, M. R. (1991). Swaying is a mutant allele of the proto-oncogene Wnt-1. Cell 67, 969-976.
Vestweber, D. and Kemler, R. (1984). Some structural and functional aspects of the cell adhesion molecule uvomorulin. Cell Diff. 15, 269-273.
Wilkinson, D. G., Bailes, J. A. and McMahon, A. P. (1987). Expression of the proto-oncogene int-1 is restricted to specific neural cells in the developing mouse embryo. Cell 50, 79-88.
Wurst, W., Auerbach, A. B. and Joyner, A. L. (1994). Multiple developmental defects in Engrailed-1 mutant mice: an early mid-hindbrain deletion and patterning defects in forelimbs and sternum. Development 120, 2065-2075.
Yamaguchi, T. P., Bradley, A., McMahon, A. P. and Jones, S. (1999). A Wnt5a pathway underlies outgrowth of multiple structures in the vertebrate embryo. Development 126, 1211-1223.
Zhang, J., Hagopian-Donaldson, S., Serbedzija, G., Elsemore, J., Plehn-Dujowich, D., McMahon, A. P., Flavell, R. A. and Williams, T. (1996). Neural tube, skeletal and body wall defects in mice lacking transcription factor AP-2. Nature 381, 238-241.
Wnts действуют как сигнальные молекулы и
участвуют во многих онтогенетических
процессах, включая спецификацию судьбы,
полчрность, миграцию и пролиферацию клеток
(Gonzalez et al., 1991; Jue et al., 1992;
Cadigan and Nusse, 1997). После связывания рецепторами
клеточной поверхности Wnts инициируют
внутриклеточный каскад, который
посредством нескольких промежуточных
ступеней ведет к транслокации β-catenin в
ядро. Вместе с транскрипционными факторами
семейства T-cell factor/lymphoid enhancer-binding factor 1
(TCF/LEF1), β-catenin регулирует экспрессию генов
мишеней (reviewed by Eastman and Grosschedl, 1999; Miller et
al., 1999). У позвоночных Wnts экспрессируются в
эмбриональной ЦНС (Parr et al., 1993; Hollyday et
al., 1995). У мышей, начиная с 8.5 days post coitum (dpc),
Wnt1 and Wnt3a экспрессируются вдоль
дорсальной средней линии нервной трубки,
указывая на их роль в в региональной
спецификации нервной трубки (Roelink and Nusse, 1991; Parr et al., 1993).
На 9.5 dpc по крайней мере 7 Wnts
экспрессируются в презумптивном
головном и спинном мозг, включая Wnt1, Wnt3, Wnt3a, Wnt4,
Wnt5a, Wnt7a and Wnt7b (Parr et al., 1993; Salinas and
Nusse,
1992), suggesting multiple and complex patterns of Wnt
signaling.
Wnt1 играет важную роль в формировании передне-заднего паттерна ЦНС (McMahon and Bradley, 1990; Thomas and Capecchi, 1990). Инактивация Wnt1 обусловливает отсутствие развития среднего мозга и ростральной части заднего мозга (McMahon et al., 1992; Mastick et al., 1996; Serbedzija et al., 1996). Wnt1 действует путем поддержания экспрессии транскрипционного фактора engrailed 1 (En1) в каудальной части среднего мозга и ростральной части заднего (Danielian and McMahon, 1996). Отсутствие нарушений в спинном мозге Wnt1 -/ - мутантов и отсутствие нарушений в нервной трубке при нокауте разных генов Wnt, экспрессирующихся в нервной трубке, указывает на вырожденность (redundancy) сигналов Wnt. У двойных мутантов Wnt1 и Wnt3a (Wnt1-3a) выявляется добавочная роль сигналов Wnt в головном и спинном мозге и производных нейрального гребня (Ikeya et al., 1997; S. Lee, M. I. and A. P. M., unpublished). Отсутствие β-catenin вызывает у мышей во время гаструляции отсутствие как развития мезодермы, так и формирования оси (Haegel et al., 1995; Hulsken et al., 2000).
Авт. условно инактивировали ген β-catenin (Catnb – Mouse genome Informatics), используя Cre/loxP рекомбинационную систему bacteriophage P1 (Gu et al., 1994). Мыши с условным (‘floxed’) аллелем β-catenin, который нуждается в экзоне, фланкированном с помощью loxP recombination sequences, скрещивали с трансгенными мышами, экспрессирующими Cre recombinase под контролем Wnt1 регуляторных последовательностей. Делеция гена β-catenin вызывала драматические нарушения головного мозга и черепно-лицевого развития. Отсутствие части среднего мозга и всего мозжечка напоминает нокаут Wnt1 (Wnt1 -/- ), указывая тем самым, что Wnt1 действует через посредство β-catenin , контролируя развитиесреднего-заднего мозга. Черепно-лицевой фенотип не характерен для эмбрионов с отсутствием Wnt1, следовательно, β-catenin участвует в предопределении судьбы клеток нейрального гребня. Показано, что β-catenin м.б. удален из мигрирующих клеток предшественников нейрального гребня. Это вместе с повышенным апоптозом в клетках, мигрирующих в краниальные ганглии и в области прехондрогенных конденсаций подтвержает, что удаление β-catenin нарушает жизнеспособность и/или дифференцировку клеток нейрального гребня.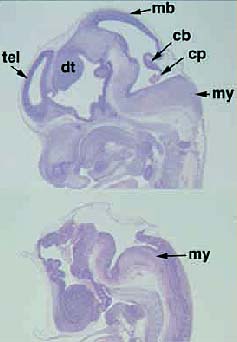
Гены для Wnts, cadherins и catenins широко экспрессируются широко в развивающейся ЦНС, но мРНК накапливаются в виде очень специфических паттернов (Roelink and Nusse, 1991; Shimamura and Takeichi, 1992; Parr et al., 1993; Hollyday et al., 1995; Redies and Takeichi, 1996; Kimura et al., 1996; Grove et al., 1998; Yamaguchi et al., 1999; Lee et al., 2000; Redies, 2000). Wnt1 контролирует формирование регионального паттерна среднего и заднего мозга (McMahon and Bradley, 1990; Thomas and Capecchi, 1990; Thomas et al., 1991; McMahon et al., 1992), и пролиферацию стволовых клеток ЦНС (Dickinson et al., 1994). Классические cadherins, которые комплексуются с катенининами, участвуют в сортировке клеток во время нейрального развития и регионализации ЦНС (Redies, 1995; Redies and Takeichi, 1996; Redies, 2000). У Wnt1 -/ - эмбрионов отсутствует весь средний мозг, мозжечок, происходящий из передней части метэнцефалона (McMahon and Bradley, 1990; Thomas and Capecchi, 1990). Так как у β-catenin мутантов также отсутствует средний мозг и передняя часть заднего мозга, то это указывает на то, что Wnt1 управляет развитием среднего-заджнего моза посредством передачи сигналов β-catenin. Передача сигналов Wnt1 в среднем мозге нужна для поддержания En1-экспрессирующих клеток (McMahon et al., 1992), а экспрессия En1 под контролем Wnt1 регуляторного элемента у Wnt1 -/ - эмбрионов вызывает существенное восстановление морфогенеза среднего и заднего мозга (Danielian and McMahon, 1996). Инактивация функции β-catenin fв среденем мозге также ведет к отсутствию экспрессии En1, это м. служить доказательством того, что сигналы Wnt1/β-catenin контролируют экспрессию En1 в среднем мозге эмбрионов. Некоторые сохранившиеся ткани обнаруживают экспрессию некоторых маркеров среднего и рострального заднего мозга, напр., Fgf8 и Wnt1. Наиболее вероятным объяснением различий фенотипов Wnt1 -/ - и β-catenin мутантов в мозаичной экспрессии Wnt1 (Bally-Cuif et al., 1995) и Cre трансгена в презумптивном среднем мозге. Wnt1 секретируется в соседние клетки, которые не экспрессируют сами Wnt1 или Cre, и следовательно, не будет делетирован ген β-catenin, и сигналы Wnt1 будут передаваться, но возникает очнь тонкий эпителий, неспособный дасть нормальный средний мозг. Кроме того широкая экспрессия Wnt1 в презумптивном среднем мозге кратковременна и возможно не все клетки, экспрессирующие Wnt1, смогут эффективно потерять ген β-catenin. Или Wnt1 сигнал м.б. перенесен до начала функционирования Cre в результате будет осуществляться экспансия нервных предшественников и лишь позднее, с началом активности Cre, будет устраняться Wnt1/β-catenin функция. Гистологический анализ 12.5 dpc β-catenin мутантов покзал кроме того отсутствие хороидного сплетения, границы между metencephalon и myelencephalon. Это указывает на то, что делеция заднего мозга может распространяться больше кзади в r2. Перекрывание Wnt3a и Wnt3 сигналов в r2 вносит вклад в формирование хороидного сплетения и также зависит от функции β-catenin. Мутанты β-catenin обнаруживают строгий фенотип в переднем мозге, отсутствующий у Wnt1 -/ - эмбрионов. Интересно, что в этой области обнаруживается усиление апоптоза. Эта потеря структур переднего мозга обнаруживается также у Wnt1-3a двойных мутантных эмбрионов (Ikeya et al., 1997; S. Lee, M. I. and A. P. M., unpublished), подтверждая тем самым, что β-catenin необходим в развитии переденего мозга для передачи сигналов от Wnt3a и/или других Wnts. Потеря структур переднего мозга м. также быть следствием редукции миграции клеток НГ в эту область (Etchevers et al., 1999). Или фенотип переднего мозга у β-catenin мутантов м.б. обусловлен отсутствием функции β-catenin в кадхерин-опосредованной адгезии. Многие кадхерины дифференциально экспрессируются в развивающейся ЦНС (Redies and Takeichi, 1996; Takeichi et al., 1997; Gerhardt et al., 2000; Redies et al., 2000) и отсутствие β-catenin может нарушать опосредованную кадхеринами адгезию в ЦНС.β-catenin and NCCs
Краниальные клетки НГ вносят свой вклад в экстенсивно формирующиеся черепно-лицевые структуры. Они мигрируют в первую бранхиальную дугу из среднего мозга и передней части заднего мозга примерно на ст. 4-х сомитов (Nichols, 1981; Tan and Morriss-Kay, 1986; Serbedzija et al., 1992; Chai et al., 1998). Эти клетки формируют скелет верхней и нижней челюстей и вносят вклад в тройничный ганглий (Noden, 1978; Le Douarin, 1984; Tan and Morriss-Kay, 1985). Эти структуры, производные клеток краниального НГ отсутствуют у мутантов β-catenin. Ранняя потеря среднего мозга не м. объяснить отсутствие генерируемых клетками НГ скелетных структур, т.к. они разиваются нормально у двойных мутантов Wnt1 -/ - or Wnt1-3a (McMahon and Bradley, 1990; Ikeya et al., 1997). Экспрессия Wnt1 обнаруживается в предшественниках мигрирующих клеток НГ, происходящих из дорсальной ЦНС. При использовании Wnt1 регуляторных последоваельностей для управления экспрессией Cre, β-catenin ген постоянно делетируется в этих клетках и их производных. Отсутствие β-catenin скорее всего нарушает дифференцировку и выживаемость клеток НГ. У β-catenin и Wnt1-3a двойных мутантов обнаруживается дефект формирования краниальных ганглиев и ганглиев дорсальных корешков ( DRGs), это указывает на то, что не только Wnt1, но и Wnt3a, действует через посредство β-catenin-зависимого пути. Дефекты в DRGs менее тяжелые у мутантов β-catenin, возможно из-за того, что Wnt1 и/или Wnt3a успевают передать сигнал прежде потери β-catenin. Кроме того β-catenin мутанты не обнаруживают укорочения ости тела каудальнее передних конечностей, как это имеет место у Wnt3a -/ - и двойных мутантов Wnt1-3a (Takada et al., 1994; Ikeya et al., 1997). Этот менее тяжелый фенотип м. б. обусловлен паракринным действием Wnt сигналов, когда делеция гена β-catenin ограничивает эффект передачи сигналов Wnt клетками, экспрессирующими Wnt1аутокринно. Или краниальные ганглии больше повреждаются у мутантов β-catenin, возможно, благодая влиянию на передачу сигналов от других Wnts, напр., Wnt4 и Wnt3a, т.е. делеция гена β-catenin перекрывает вырожденность (redundancy) Wnts. Массивный апоптоз, выявляемый у β-catenin мутантов в областях, где клетки НГ мигрируют в краниальные ганглии (Fig. 8D), указывает на то, что β-catenin необходим для жизнеспособности мигрирующих клеток НГ. Как усиление клеточной гибели связано с нарушением обеспечиваемой кадхеринами адгезии остается неясным. Анализ скелетных препаратов 18.5 dpc β-catenin мутантных плодов показал, что отсутствуют в основном краниальные кости и хрящи, происходящие из клеток НГ. Отсутствие черепно-лицевых струтур, по-видимому, не является результатом нарушения миграции клеток НГ, т.к. экспрессия некоторых маркеров клеток НГ нормальная. До 9 dpc апоптоз не усиливается в ранних клетках НГ, мигрирующих в бранхиальные дуги и апоптические клетки не обнаруживаются в бранхиальных дугах. Однако, начиная с 10.5 dpc, апоптоз обнаруживается у β-catenin мутантов в проксимальных частях дуг 1 и 2, в положении, где образуются хондрогенные конденсаты. О морфогенезе бранхиальных дуг смотри (Le Douarin, 1982; Carlson, 1994). Конденсации нуждаются в интимных межклеточных контактах, обеспечиваемых молекулами межклеточной адгезии. Следовательно, черепно-лицевые нарушения у β-catenin мутантов скорее всего обусловлены нарушениями кадхерин-обеспечиваемой клеточной адгезии, чем дефектами передачи сигналов Wnt signaling.
Wnt1 играет важную роль в формировании передне-заднего паттерна ЦНС (McMahon and Bradley, 1990; Thomas and Capecchi, 1990). Инактивация Wnt1 обусловливает отсутствие развития среднего мозга и ростральной части заднего мозга (McMahon et al., 1992; Mastick et al., 1996; Serbedzija et al., 1996). Wnt1 действует путем поддержания экспрессии транскрипционного фактора engrailed 1 (En1) в каудальной части среднего мозга и ростральной части заднего (Danielian and McMahon, 1996). Отсутствие нарушений в спинном мозге Wnt1 -/ - мутантов и отсутствие нарушений в нервной трубке при нокауте разных генов Wnt, экспрессирующихся в нервной трубке, указывает на вырожденность (redundancy) сигналов Wnt. У двойных мутантов Wnt1 и Wnt3a (Wnt1-3a) выявляется добавочная роль сигналов Wnt в головном и спинном мозге и производных нейрального гребня (Ikeya et al., 1997; S. Lee, M. I. and A. P. M., unpublished). Отсутствие β-catenin вызывает у мышей во время гаструляции отсутствие как развития мезодермы, так и формирования оси (Haegel et al., 1995; Hulsken et al., 2000).
Авт. условно инактивировали ген β-catenin (Catnb – Mouse genome Informatics), используя Cre/loxP рекомбинационную систему bacteriophage P1 (Gu et al., 1994). Мыши с условным (‘floxed’) аллелем β-catenin, который нуждается в экзоне, фланкированном с помощью loxP recombination sequences, скрещивали с трансгенными мышами, экспрессирующими Cre recombinase под контролем Wnt1 регуляторных последовательностей. Делеция гена β-catenin вызывала драматические нарушения головного мозга и черепно-лицевого развития. Отсутствие части среднего мозга и всего мозжечка напоминает нокаут Wnt1 (Wnt1 -/- ), указывая тем самым, что Wnt1 действует через посредство β-catenin , контролируя развитиесреднего-заднего мозга. Черепно-лицевой фенотип не характерен для эмбрионов с отсутствием Wnt1, следовательно, β-catenin участвует в предопределении судьбы клеток нейрального гребня. Показано, что β-catenin м.б. удален из мигрирующих клеток предшественников нейрального гребня. Это вместе с повышенным апоптозом в клетках, мигрирующих в краниальные ганглии и в области прехондрогенных конденсаций подтвержает, что удаление β-catenin нарушает жизнеспособность и/или дифференцировку клеток нейрального гребня.
β-catenin and brain morphogenesis

Рис. Дефекты ЦНС у β-catenin мутантных эмбрионов. Окраска гематоксилином и эозином сагитальных срезов нормальных и мутантных эмбрионов на ст.12.5 dpc. cb, cerebellum; cp, choroid plexus; di, diencephalon; dt, dorsal thalamus; mb, midbrain;
me, metencephalon; my, myelencephalon; tel, telencephalon.
Гены для Wnts, cadherins и catenins широко экспрессируются широко в развивающейся ЦНС, но мРНК накапливаются в виде очень специфических паттернов (Roelink and Nusse, 1991; Shimamura and Takeichi, 1992; Parr et al., 1993; Hollyday et al., 1995; Redies and Takeichi, 1996; Kimura et al., 1996; Grove et al., 1998; Yamaguchi et al., 1999; Lee et al., 2000; Redies, 2000). Wnt1 контролирует формирование регионального паттерна среднего и заднего мозга (McMahon and Bradley, 1990; Thomas and Capecchi, 1990; Thomas et al., 1991; McMahon et al., 1992), и пролиферацию стволовых клеток ЦНС (Dickinson et al., 1994). Классические cadherins, которые комплексуются с катенининами, участвуют в сортировке клеток во время нейрального развития и регионализации ЦНС (Redies, 1995; Redies and Takeichi, 1996; Redies, 2000). У Wnt1 -/ - эмбрионов отсутствует весь средний мозг, мозжечок, происходящий из передней части метэнцефалона (McMahon and Bradley, 1990; Thomas and Capecchi, 1990). Так как у β-catenin мутантов также отсутствует средний мозг и передняя часть заднего мозга, то это указывает на то, что Wnt1 управляет развитием среднего-заджнего моза посредством передачи сигналов β-catenin. Передача сигналов Wnt1 в среднем мозге нужна для поддержания En1-экспрессирующих клеток (McMahon et al., 1992), а экспрессия En1 под контролем Wnt1 регуляторного элемента у Wnt1 -/ - эмбрионов вызывает существенное восстановление морфогенеза среднего и заднего мозга (Danielian and McMahon, 1996). Инактивация функции β-catenin fв среденем мозге также ведет к отсутствию экспрессии En1, это м. служить доказательством того, что сигналы Wnt1/β-catenin контролируют экспрессию En1 в среднем мозге эмбрионов. Некоторые сохранившиеся ткани обнаруживают экспрессию некоторых маркеров среднего и рострального заднего мозга, напр., Fgf8 и Wnt1. Наиболее вероятным объяснением различий фенотипов Wnt1 -/ - и β-catenin мутантов в мозаичной экспрессии Wnt1 (Bally-Cuif et al., 1995) и Cre трансгена в презумптивном среднем мозге. Wnt1 секретируется в соседние клетки, которые не экспрессируют сами Wnt1 или Cre, и следовательно, не будет делетирован ген β-catenin, и сигналы Wnt1 будут передаваться, но возникает очнь тонкий эпителий, неспособный дасть нормальный средний мозг. Кроме того широкая экспрессия Wnt1 в презумптивном среднем мозге кратковременна и возможно не все клетки, экспрессирующие Wnt1, смогут эффективно потерять ген β-catenin. Или Wnt1 сигнал м.б. перенесен до начала функционирования Cre в результате будет осуществляться экспансия нервных предшественников и лишь позднее, с началом активности Cre, будет устраняться Wnt1/β-catenin функция. Гистологический анализ 12.5 dpc β-catenin мутантов покзал кроме того отсутствие хороидного сплетения, границы между metencephalon и myelencephalon. Это указывает на то, что делеция заднего мозга может распространяться больше кзади в r2. Перекрывание Wnt3a и Wnt3 сигналов в r2 вносит вклад в формирование хороидного сплетения и также зависит от функции β-catenin. Мутанты β-catenin обнаруживают строгий фенотип в переднем мозге, отсутствующий у Wnt1 -/ - эмбрионов. Интересно, что в этой области обнаруживается усиление апоптоза. Эта потеря структур переднего мозга обнаруживается также у Wnt1-3a двойных мутантных эмбрионов (Ikeya et al., 1997; S. Lee, M. I. and A. P. M., unpublished), подтверждая тем самым, что β-catenin необходим в развитии переденего мозга для передачи сигналов от Wnt3a и/или других Wnts. Потеря структур переднего мозга м. также быть следствием редукции миграции клеток НГ в эту область (Etchevers et al., 1999). Или фенотип переднего мозга у β-catenin мутантов м.б. обусловлен отсутствием функции β-catenin в кадхерин-опосредованной адгезии. Многие кадхерины дифференциально экспрессируются в развивающейся ЦНС (Redies and Takeichi, 1996; Takeichi et al., 1997; Gerhardt et al., 2000; Redies et al., 2000) и отсутствие β-catenin может нарушать опосредованную кадхеринами адгезию в ЦНС.
β-catenin and NCCs
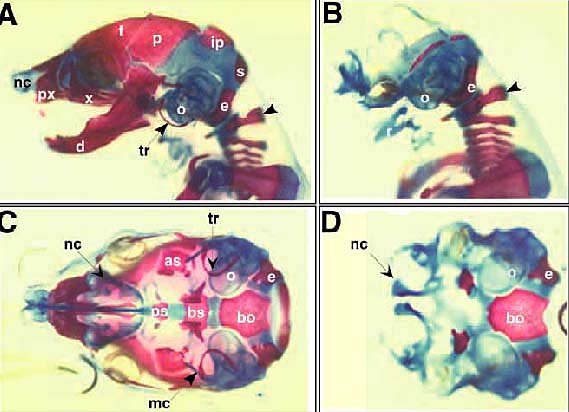
Рис.Черепно-лицевой скелет 18.5 dpc плодов дикого типа (A,C) и b-catenin мутантов (B,D) , окрашенных ализарином красным и голубым;вид сбоку (A,B) и снизу (C,D). Нижняя челюсть, верхняя челюсть и кости нёба удалены у плодов дикого типа (C) для лучшей видимости основания черепа.У мутантов большинство скелетных структур, происходящих из клеток нейрального гребня, отсуствуют за исключением basioccipital (bo) и exoccipital (e) костей, и otic capsule (o). Мaxilla (x), mandible (d) и tympanic ring (t), происходящие из первой бранхиальной дуги полностью отсутствуют. Единственным сохранившимся элементом первой дуги являются остатки vestigial Meckel’s
cartilage (r). as, alisphenoid; b-hy, body of the hyoid bone; bs, basisphenoid; cr, cricoid cartilage; f, frontal bone;
gh-hy, greater horn of the hyoid bone; i, incus; ip, interparietal bone; lh-hy, lesser horn of hyoid
bone; m, malleus; mc, Meckel’s cartilage; nc, nasal capsule; p, parietal bone; px, incisive
(premaxillary) bone; s, supraoccipital bone; sa, stapes; st, styloid process; th, thyroid cartilage; tr,
tympanic ring.
Краниальные клетки НГ вносят свой вклад в экстенсивно формирующиеся черепно-лицевые структуры. Они мигрируют в первую бранхиальную дугу из среднего мозга и передней части заднего мозга примерно на ст. 4-х сомитов (Nichols, 1981; Tan and Morriss-Kay, 1986; Serbedzija et al., 1992; Chai et al., 1998). Эти клетки формируют скелет верхней и нижней челюстей и вносят вклад в тройничный ганглий (Noden, 1978; Le Douarin, 1984; Tan and Morriss-Kay, 1985). Эти структуры, производные клеток краниального НГ отсутствуют у мутантов β-catenin. Ранняя потеря среднего мозга не м. объяснить отсутствие генерируемых клетками НГ скелетных структур, т.к. они разиваются нормально у двойных мутантов Wnt1 -/ - or Wnt1-3a (McMahon and Bradley, 1990; Ikeya et al., 1997). Экспрессия Wnt1 обнаруживается в предшественниках мигрирующих клеток НГ, происходящих из дорсальной ЦНС. При использовании Wnt1 регуляторных последоваельностей для управления экспрессией Cre, β-catenin ген постоянно делетируется в этих клетках и их производных. Отсутствие β-catenin скорее всего нарушает дифференцировку и выживаемость клеток НГ. У β-catenin и Wnt1-3a двойных мутантов обнаруживается дефект формирования краниальных ганглиев и ганглиев дорсальных корешков ( DRGs), это указывает на то, что не только Wnt1, но и Wnt3a, действует через посредство β-catenin-зависимого пути. Дефекты в DRGs менее тяжелые у мутантов β-catenin, возможно из-за того, что Wnt1 и/или Wnt3a успевают передать сигнал прежде потери β-catenin. Кроме того β-catenin мутанты не обнаруживают укорочения ости тела каудальнее передних конечностей, как это имеет место у Wnt3a -/ - и двойных мутантов Wnt1-3a (Takada et al., 1994; Ikeya et al., 1997). Этот менее тяжелый фенотип м. б. обусловлен паракринным действием Wnt сигналов, когда делеция гена β-catenin ограничивает эффект передачи сигналов Wnt клетками, экспрессирующими Wnt1аутокринно. Или краниальные ганглии больше повреждаются у мутантов β-catenin, возможно, благодая влиянию на передачу сигналов от других Wnts, напр., Wnt4 и Wnt3a, т.е. делеция гена β-catenin перекрывает вырожденность (redundancy) Wnts. Массивный апоптоз, выявляемый у β-catenin мутантов в областях, где клетки НГ мигрируют в краниальные ганглии (Fig. 8D), указывает на то, что β-catenin необходим для жизнеспособности мигрирующих клеток НГ. Как усиление клеточной гибели связано с нарушением обеспечиваемой кадхеринами адгезии остается неясным. Анализ скелетных препаратов 18.5 dpc β-catenin мутантных плодов показал, что отсутствуют в основном краниальные кости и хрящи, происходящие из клеток НГ. Отсутствие черепно-лицевых струтур, по-видимому, не является результатом нарушения миграции клеток НГ, т.к. экспрессия некоторых маркеров клеток НГ нормальная. До 9 dpc апоптоз не усиливается в ранних клетках НГ, мигрирующих в бранхиальные дуги и апоптические клетки не обнаруживаются в бранхиальных дугах. Однако, начиная с 10.5 dpc, апоптоз обнаруживается у β-catenin мутантов в проксимальных частях дуг 1 и 2, в положении, где образуются хондрогенные конденсаты. О морфогенезе бранхиальных дуг смотри (Le Douarin, 1982; Carlson, 1994). Конденсации нуждаются в интимных межклеточных контактах, обеспечиваемых молекулами межклеточной адгезии. Следовательно, черепно-лицевые нарушения у β-catenin мутантов скорее всего обусловлены нарушениями кадхерин-обеспечиваемой клеточной адгезии, чем дефектами передачи сигналов Wnt signaling.