ДИНЕИН
Идентифицировано три класса цитоскелетных моторных белков —миозины, кинезины и динеины. Они отвечают за всевозможные движения. Кристаллографические иссдедования моторных доменов миозинов и кинезинов позволяют сдить о механизмах продукции сил. Однако как работает двигательный домен динеина пока неясно. Имеющиеся доказательства указывают на то, что домен связывания с микротрубочками пространственно отделен от АТФазного домена на конце projecting coiled coil. Предполагается, что подобное расположение может обеспечивать аккомодацию множественных копий внешних и функционально сложных двигательных головок на поверхность микротрубочек Richard B. Vallee and Melissa A. Gee (1998).
Динеин участвует в транспорте и организации различных мембнанных органелл, ядерном транспорте, захвате хромосом, организации и ориентации митотического веретена, транспорте микротрубочек и др. Хорошо охарактеризованные формы как аксонемального, так и цитоплазматического динеина обычно имеют две, в некоторых случаях три, большие глобулярные силу-продуцирующие (force-producing) головки и общий молекулярный вес 1.2–2×106. Каждая молекула динеина содержит относительно большое количество субъединиц, соответствующих каждому из 4-х полипептидных классов: тяжелая, промежуточная, легкая промежуточная и легкая цепь. Тяжелые цепи ответственны за активность АТФазы и породукцию силы. Известно не менее 15 генов тяжелых цепей динеина у каждого из изученных организмов. Из-за больших размеров тяжелых цепей определено лишь 12 полноразмерных кодирующих последовательностей. Все они сходны по размеру (~500–530 kDa) и обнаруживают гомологию по все длине в отличие от семейств тяжелых цепей кинезинов и миозинов, для которых идентифицированы многочисленные функциональные и структурные подсемейства.
Организация домена тяжелой цепи динеина
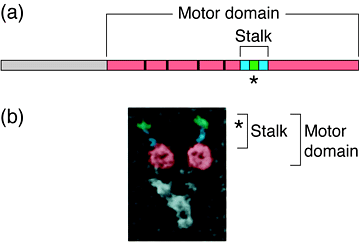 |
Рис. 1. Структурная организация молекулы динеина. (a) Диаграмма тяжелой цепи динеина, показывающая моторный домен, домен ножки и 4 центиральных Р-петлевых элемента (маленькие полоски). (b) Электронномикроскопическая микрофотография голоэнзима динеина, показывающая две силу-продуцирующих головки на вершине. Показаны в цвете головной домен (розовый), предполагаемая суперскрученная область ножки (голубой) и глобулярный конец ножки (зеленый). Звездочка указывает положение домена, связывающего микротрубочки, на кончике ножки. Figure 1. Structural organization of the dynein molecule. (a) Diagram of rat cytoplasmic dynein heavy chain, showing motor domain, stalk domain and four central P-loop elements (small bars). (b) Freeze-etch electron micrograph of cytoplasmic dynein holoenzyme, showing two force-producing heads at the top. Shown in colour are the head domain (pink), the predicted coiled-coil region of the stalk (blue) and the globular stalk tip (green). The asterisk indicates the position of the microtubule-binding domain at the tip of the stalk. (The electron micrograph is reproduced, with permission, from Ref. 9.) |
Организация домена тяжелой цепи динеина
От кинезинов и миозинов динеины отличаются организацией моторного домена, который знaчительно сложнее, чем у других моторных белков. Каждая тяжелая цепь динеина содержит 4 элемента Р-петлеобразных последовательностей, мотивы, которые в целом связаны со связыванием нуклеотидов и гидролизом. Р-петлевые элементы занимают интервалы ~35–40-kDa в центральной трети тяжелой цепи. Воздействие на динеин АТФ и VO4 в присутствии УФЛ расщепляет тяжелую цепь вблизи или в первом N-терминальном P-loop элементе, в результате выходит из строя большая часть АТФазной активности динеина и его способность продуцировать силу. Следовательно, первая Р-петля существенна для функции, но и другие Р-пелеобразные элементы также важны.
Неясно, какая часть тяжелой цепи соответсвует глобулярным головкам, видимым на ЭМ и участвующим в продукции силы. Организация Р-петлевых элементов в центре тяжелой цепи указывает на эволюционное удвоение и редупликацию моторного домена. Однако законсервированные последовательности между регионами тяжелой цепи динеина и с кинезином или миозином незначительны. Масса динеиновых головок варьирует в пределах 320 и 400 kDa. Когда головка состоит только из тяжелой цепи, то от 3/5 до 2/3 полипептида участвует в продукции силы. С-терминальные 2/3 цитоплазматического динеина Dictyostelium discoideum (~380 kDa) выглядят как глобулярная структура с размером, соответствующим головке динеина. Сходный фрагмент тяжелой цепи цитоплазматического динеина представляет собой область минимального размера,необходимую для нормального VO4-опосредованного фоторасщепления. Более мелкие фрагменты, получаемые в результате дальнейших N-terminal или C-terminal делеций не способны к фоторасщеплению. Следовательно, все 2/3 С-конца тяжелой цепи должны быть интактными для нормальной АТФазной активности, ассоциированной с первым Р-петлевым элементом (Рис.1).
Ножки, связывающие с микротрубочкой
Ножки, связывающие с микротрубочкой
Нечувствительные к фоторасщеплению фрагменты колокализуются с микротрубочками при экспрессии в культивируемых клетках млекопитающих. Такое же поведение индуцируется точковой мутацией в первом P-loop элементе и может отражать rigor-like состояние, возникающее в результате потери способности связывать АТФ. Таким образом был идентифицирован сайт связывания микротрубочек в тяжелой цепи. Интересно, что колокализация микротрубочек сохранялась и в отсутствие целой P-loop области, а microtubule-binding активность картировалась в сайте на 340 аминокислотных остатков ниже от 4-ого P-loop элемента.
Самый малый фрагмент связывающий микротрубочки (остатки 3276–3407) фланкирован двумя областями примерно в 100 остатков, которые формируют coiled-coil αспирали. Так как практически отсутствуют доказательства димеризации сайта внутри головки динеина, то предполагается что две спирали взаимодействуют друг с другом, формируя антипараллельную coiled-coil. Домен связывания микротрубочек располагается на дистальном конце такой структуры (Рис.1) длиной примерно в 12–15 nm для coiled-coil, в зависимости от действительной длины спирали, и определен диаметр в 3 nm для глобулярного конца (~125 остатков).
Такая структура имеет заметное сходство с `stalks', ассоциированной с головками динеина (Рис.1). Природа и роль этой структуры неясна, неясно представляют они собой добавочные субъединицы или интегральные компоненты моторного домена динеина. Ясно что они участвуют в связывании микротрубочек, что подтверждается картиной аксонем ресничек и флагелл (Рис.3), в которых тонкие `B-links' сравнимых размеров обнаруживались в связях, которые интерпретируются как связи динеиновых головок с В микротрубочками. ЭМ-анализ рекомбинантной области, связывающей микротрубочки, тяжелой цепи цитоплазматического динеина крыс показал звездчатые лучи из stalk-shaped частиц. Отдельное звено в лучах имет длину сравнимую с ножками, ассоциированными с нативными динеиновыми частицами и каждый луч заканчивается одинаковым глобулярным концом. Полученные данные показывают, что в отличие от кинезина сайт связывания микротрубочек динеина отделен от глобулярной головки и располагается на конце очевидно ригидной палочки.
Консервация длины ножек
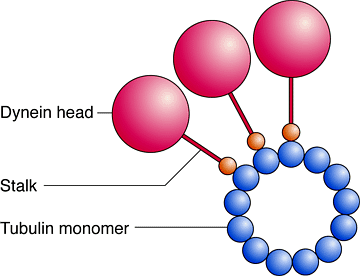 |
Рис. 2. Динеиновые ножки создают пространство для динеиновых головок на поверхности микротрубочек. Вид трехголовой молекулы диненина, связаной с микротрубочкой на конце. Динеиновые головки могут взаимодействовать своими ножками с соседним тубулиновым мономером. Динениновые головки описываются как сферические, яйце-образные и цилиндрические, с диаметром от 13.2 nm до 18 nm для длинной оси яйце-образных головок. Типичный размер 13.5 nm представлен здесь. Длина ножки в 11 nm, согласуется с длиной аксонемальных связей с микротрубочками. Диаметр микротрубочки равен 24 nm. Объем динеиновой головки увеличивается только маргинально , если считать вдоль поверхности three-start тубулиновой мономерной петли Figure 2. Dynein stalks make room for dynein heads on the microtubule surface. Scale drawing of three-headed dynein molecules binding to a microtubule shown end on. Dynein heads can interact through their stalks with adjacent tubulin monomers. Dynein heads have been variously reported as spherical, egg-shaped and cylindrical, with values for the diameter ranging from 13.2 nm to as much as 18 nm for the long axis of an egg-shaped head. A typical value of 13.5 nm is used here. The stalk length is set at 11 nm, which is characteristic of the microtubule-bound value obtained from axonemal images (see Fig 3). The microtubule diameter is set at 24 nm. We note that the dynein head spacing is only marginally increased when calculated along the shallow three-start tubulin monomer helix. |
Консервация длины ножек
Подобно множественным P-loop элементам, ножка является филогенетически и функционально законсервированной структурой динеина. Обнаружено, что все три головки находятся в динеине из флагеллярного наружнго плеча водоросли Chlamydomonas (представляющие α, β и γ тяжелые цепи), в динеинах внутренноего плеча из того же организма, в динеине из цилиарного наружного плеча Tetrahymenaи цитоплазматическом динеине свиней и кур. Область тяжелой цепи цитоплазматического динеина, идентифицируемая как ножка, законсерсирована у всех 12 форм динеина, которые были полностью секвенированы. Хотя консервация первичных последовательностей довольно низкая (33%), и все последовательности, предназначеные формировать парные суперскрученные вторичне структуры, наблюдаемые у крыс.
Прямое сравнение аксонемного и цитоплазматическог динеинов указывает на то, что длина ножки законсерсирована и у этих двух основных функциональных форм динеина. Таким образом, ножка имеет относительно постоянную длину, которая законсервирована у эволюционно удаленных видов.
Role for stalks in dynein packing
Прямое сравнение аксонемного и цитоплазматическог динеинов указывает на то, что длина ножки законсерсирована и у этих двух основных функциональных форм динеина. Таким образом, ножка имеет относительно постоянную длину, которая законсервирована у эволюционно удаленных видов.
Role for stalks in dynein packing
Возможная роль ножки может быть предположена исходя из рассмотрения размеров динеиновых головок относительно тубулиновых субъединиц, с которыми они взаимодействуют. Объем головки обычно порядка 13.5 nm, который значительно больше, чем диаметр тубулинового мономера (расстояние между центрами протофиламент ~5 nm). Различия в размерах способствуют взаимодействию множественных динеинов с поверхностью микротрубочек.
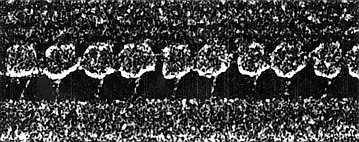 |
Рис. 3. ЭМ микрофотография замороженного сколотого нефиксированного Tetrahymena cilium in rigor (minus ATP). Динеиновые плечи как видно связаны с соседним наружным дублетом микрортрубочек. Головки динеиновых молекул видимые как глобулярные структуры вблизи поверхности А микротрубочки (внизу), сцеплены с помощью ножек с В микротрубочкой (верх). Прямой контакт головки с В микротрубочкой никогда не наблюдался. Figure 3. Freeze-etch electron micrograph of unfixed Tetrahymena cilium in rigor (minus ATP). Dynein arms are seen to link adjacent outer doublet microtubules. The heads of the dynein molecules are observed as globular structures close to the surface of an A microtubule (at the bottom), linked via stalks to a B microtubule (at the top). Direct contact of the head with the B microtubule is never observed. (Reproduced, with permission, from Ref. 14, courtesy of J. Heuser and U. Goodenough.) |
Без ножки головки динеина способны взаимодействовать только с каждым вторым или третьим тубулиновым мономером. Более тесная их упаковка возможна с помощью ножек 15 nm. Фактически ножка длиной 11 nm—the в аксонемальных В-связях (see above)— почти в точности аккомодирует динеиновую головку для каждой тубулиновой субъединицы вдоль three-start левозакрученной тубулиновой мономерной спирали.
Такое расположение имеет очень важное значение для эффективной моторной активности динеина. Для двухголовых и трехголовых молекул динеина скоординированная активность становится возможной только при геометрическом преимуществе, обеспечиваемом ножкой, в результате чего более одной головки контактирует с микротрубочкой. Постоянство длины ножки в ходе эволюции указывает на селективное давление в пользу оптимальной длины. Передача силы через ножку
Такое расположение имеет очень важное значение для эффективной моторной активности динеина. Для двухголовых и трехголовых молекул динеина скоординированная активность становится возможной только при геометрическом преимуществе, обеспечиваемом ножкой, в результате чего более одной головки контактирует с микротрубочкой. Постоянство длины ножки в ходе эволюции указывает на селективное давление в пользу оптимальной длины. Передача силы через ножку
Как энергия, высвобождаемая при гидролизе АТФ в головке динеина, используется для продукции силы в кончике ножки, в месте контакта с микротрубочкой. Имеется два общих механизма, с помощью которых сила может передаваться через ножку (Рис.4). Первый, она должна действать как ригидное плечо рычага, амплифицируя конформационные изменения, возникающие в результате гидролиза АТФ в динеиновой головке. Эта модель предполагает, что моторный домен динеина имеет радикально отличающуюся организацию от других моторных доменов. В случае миозина `регуляторный домен' состоящий из одиночной αспирали plus ассоциированной легкой цепи, служащей плечом рычага. Эта структура явно отличается от динеиновой ножки, которая соответствует области шейки миозина. Другая возможность заключается в том, что ножка является относительно пассивной привязью: конформационные изменения в головке или остальной части молекулы будут обеспечивать натяжение основания ножки, передающееся вдоль микротрубочки
 |
Рис. 4. Модели поведения ножки динеина, слева, функционирующей как плечо рычага и справа, обеспечивающей натяжение передаваемое микротрубочке. См. текст. Figure 4. Models for the behaviour of the dynein stalk shown, at the left, functioning as a lever arm and, at the right, tugging on the microtubule. See text for details. (Modified, with permission, from Ref. 9.) |
Анализ изменений морфологии динеина внутри аксонемы при быстром замораживании и скалывании для ЭМ указывает на то, что имеются относительно large-scale конформационные различия во время цикла образования поперечных мостиков. Однако, так как молекулы динеина расположены с высокой плотностью вдоль длины наружного дуплета, то трудно интерпретировать эти наблюдения в терминах функциональных свойств отдельной молекулы динеина. Наблюдалось согласование АТФ-зависимой формы и позиционных изменений в головке динеина и `feet'. Картина старых аксонем указывает на большие изменения (~12 nm) в положении головок динеина относительно основания. Эти наблюдения согласуются с общим удлиннением и контракцией всей молекулы динеина во время подвижности. Специфическая роль ножек по этому сценарию иная чем связь с микротрубочкой и она неясна, хотя данные согласуются и с пассивной и активной функцией.
Передача сигналов через ножку
Передача сигналов через ножку
Не менее загадочен механизм, с помощью которого конформационные изменения в головке динеина сообщаются сайту связи с микротрубочкой на кончике ножки и наоборот. В отсутствие АТФ динеин связывается с микротрубочкой in a rigor-like state. Добавление АТФ вызывает диссоциацию от микротрубоски. Как событие связывания АТФ может передаваться из головки через ножку(Рис.5) неясно. Разумно предположить, что ость (shaft) сама должна испытывать некую форму конформационных изменений, которые могут передаваться кончику ножки. Однако если стержень (ость) соответствует антипараллельному coiled-coil, то степень конформационной флексибельности, которая возможна без полной потери структуры должна быть крайне ограничена из-за точного регистра, необходимого между аминокислотами в heptad repeat positions. Так как ножка остается морфологически распознаваемой на разных стадиях цикла образования поперечных мостиков, large-scale раскручивание coiled-coil кажется маловероятным. Однако менее выраженные конформационные сообщения всех coiled-coils описаны и участвуют в данном случае. Альтернативно структура ножки может оставаться неизменной в течение всего цикла образования поперечных связей, а информация может передаваться с помощью изменения в ее ориентации относительно поверхности микротрубочки(таких как ротация вокруг длиннной оси ножки).
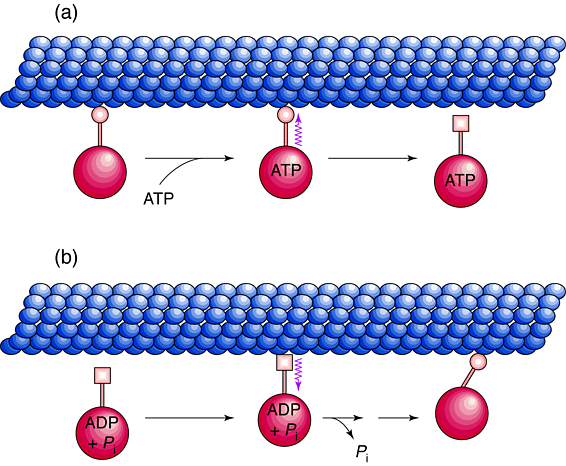 |
Рис. 5. Передача сигналов через ножку. Головка и ножка молекулы динеина взаимодействуют с микротрубочкой на последовательных стадиях цикла образования поперечных мостиков. Некоторые ступени цикла опущены. (a) АТФ-зависимые конформационные изменения в головке динеина должны сигнализировать (jagged стрелка) через ножку о снижении ее сродства к микротрубочке. (b) После гидролиза АТФ в АДФ и Pi, связь с микротрубочкой кончика ножки должна сигнализировать головке пора индуцировать высвобождение продукта и создавать усилие Figure 5. Signal transmission through the stalk. The head and stalk of a dynein molecule are shown interacting with a microtubule at successive stages of the force-producing. Note that some steps in the cross-bridge cycle have been intentionally omitted. (a) ATP-dependent conformational changes within the dynein head must be signalled (jagged arrow) through the stalk to reduce its affinity for the microtubule. (b) Following ATP hydrolysis to ADP and Pi, microtubule binding to the tip of the stalk must be signalled to the head to induce product release and the power stroke. |
После гидролиза АТФ высвобождаемый продукт стимулирует повторное соединение с микротрубочкой. В этом случае повторное соединение должно сигнализировать от кончика ножки к головке через стрежень ножки (рис.5), опять же через изменение или конформации или ориентации ножки. Эти изменения могут представлять собой просто возвращение к ступени, ведущей к диссоциации от микротрубочки. Повторное же соединение с поверхностью микротрубочки должно служить триггером высвобождения продукта и генерации силы путем стабилизации ножки в состояние высокого сродства.
Все вместе указывает на то, что динеин участвует в очень разнообразных механизмах производства силы, в основном в ответ на проблему поверхностной упаковки микротрубочек.