INTEGRINS
ИНТЕГРИНЫ
|
Integrins take partners: cross-talk between integrins and other membrane receptors
Joanna C. Porter , Nancy Hogg
Trends in Cell Biology 1998, 8: No. 10. 390-396
|
Интегрины являются ключевыми эффекторами миграции клеток. Они играют роль в ко-стимулировании Т лимфоцитов и в высоко специфичных взаимодействиях между клетками, ответственными за адаптивную имунную реакцию.1. Интегрины кооперируют также с факторами роста, способствуя пролиферации клеток. Кроме того адгезия необходима клеткам для выхода из клеточного цикла и дифференцировки 2. Наконец, когда слипшиеся тканевые клетки высвобождаются от окружающего их ВКМ (extracellular matrix (ECM)), они теряют сигналы, необходимые для выживания, и подвергаются апоптозу. Интегринам посвящены недавние обзоры 3456.
Литература
[1] Bachmann M. F. et al. (1997) Immunity, 7:549-557.
[2] Boudreau N., Werb Z. and Bissell M. J. (1996) Proc. Natl. Acad. Sci. U. S. A., 93:3509-3513.
[3] Howe A. et al. (1998) Curr. Opin. Cell Biol., 10:220-231.
[4] Giancotti F. (1997) Curr. Opin. Cell Biol., 9:691-700. [5] Bottazzi M. E. and Assoian R. K. (1997) Trends Cell Biol., 7:348-352.
[6] Burridge K., Chrzanowska-Wodnicka M. and Zhong C. (1997) Trends Cell Biol., 7:342-347.
[7] Sundberg C. and Rubin K. (1996) J. Cell Biol., 132:741-752.
[8] Lindberg F. P. et al. (1996) J. Cell Biol., 134:1313-1322.
[9] Wang X-Q. and Frazier W. A. (1998) Mol. Biol. Cell, 9:865-874.
[10] Reinhold M. I. et al. (1995) J. Cell Sci., 108:3419-3425.
[11] Brown E. J. (1997) Trends Cell Biol., 7:289-295. [12] Imhof B. A. et al. (1997) Eur. J. Immunol., 27:3242-3252.
[13] Lindberg F. P. et al. (1996) Science, 274:795-798. [14] Ticchioni M. et al. (1997) J. Immunol., 158:677-684.
[15] Gao A-G. et al. (1996) J. Cell Biol., 135:533-544. [16] Chung J., Gao A-G. and Frazier W. A. (1997) J. Biol. Chem., 272:14740-14746.
[17] Hemler M. E., Mannion B. A. and Berditchevski F. (1996) Biochim. Biophys. Acta, 1287:67-71.
[18] Yáñez-Mó M. et al. (1998) J. Cell Biol., 141:791-804.
[19] Tachibana I. et al. (1997) J. Biol. Chem., 272:29181-29189.
[20] Mannion B. A. et al. (1996) J. Immunol., 157:2039-2047.
[21] Berditchevski F., Bazzoni G. and Hemler M. E. (1995) J. Biol. Chem., 270:17784-17790.
[22] Berditchevski F. et al. (1997) J. Biol. Chem., 272:2595-2598.
[23] Abitorabi M. A. et al. (1997) J. Cell Biol., 139:563-571.
[24] Lebel-Binay S. et al. (1995) J. Immunol., 155:101-110.
[25] Tai X-G. et al. (1996) J. Exp. Med., 184:753-758. [26] Miyamoto S. et al. (1996) J. Cell Biol., 135:1633-1642.
[27] Schneller M., Vuori K. and Ruoshlati E. (1997) EMBO J., 16:5600-5607.
[28] Bartfield N. S. et al. (1993) J. Biol. Chem., 268:17270-17276.
[29] Woodard A. S. et al. (1998) J. Cell Sci., 111:469-478.
[30] Vuori K. and Ruoslahti E. (1994) Science, 266:1576-1578.
[31] Fenczik C. A. et al. (1997) Nature, 390:81-85. [32] Ohta H. et al. (1994) EMBO J., 13:2044-2055. [33] Warren A. P. et al. (1996) Blood, 87:3676-3687. [34] Bohuslav J. et al. (1995) J. Exp. Med., 181:1381-1390.
[35] Okamoto T. et al. (1998) J. Biol. Chem., 273:5419-5422.
[36] Lisanti M. P. et al. (1994) Trends Cell Biol., 4:231-235.
[37] Li S., Couet J. and Lisanti M. P. (1996) J. Biol. Chem., 271:29182-29190.
[38] Wary K. K. et al. (1996) Cell, 87:733-743. [39] Wei Y. et al. (1996) Science, 273:1551-1553. [40] Todd R. F. and Petty H. R. (1997) J. Lab. Clin. Med., 129:492-498.
[41] Petty H. R. and Todd R. F. (1996) Immunol. Today, 17:209-212.
[42] Vetvicka V., Thornton B. P. and Ross G. D. (1996) J. Clin. Invest., 98:50-61.
[43] Todd R. F. (1996) J. Clin. Invest., 98:1-2.
[44] Yebra M. et al. (1996) J. Biol. Chem., 271:29393-29399.
[45] Xue W. et al. (1997) Cancer Res., 57:1682-1689. [46] Conforti G. et al. (1994) Blood, 83:994-1005. [47] Brooks P. C. et al. (1996) Cell, 85:683-693. [48] Nip J. et al. (1995) J. Clin. Invest., 95:2096-2103.
[49] Stetler-Stevenson W. G. (1993) Annu. Rev. Cell Biol., 9:541-573.
[50] Chapman H. A. (1997) Curr. Opin. Cell Biol., 9:714-724. [51] Simon D. I. et al. (1996) Blood, 88:3185-3194. [52] Wong W. S.F. et al. (1996) Immunology, 88:90-97. [53] Sitiri R. G. et al. (1996) J. Clin. Invest., 97:1942-1951.
[54] Dalbey R. E. (1990) Trends Biochem. Sci., 15:253-256. [55] von Heijne G. and Gavel Y. (1988) Eur. J. Biochem., 174:671-678.
[56] Berditchevski F. et al. (1997) J. Biol. Chem., 272:29174-29180.
[57] Kindzelskii A. L. et al. (1997) Biophys. J., 73:1777-1784.
|
Взаимодействуя с молекулами на соседних клетках или ВКМ интегрины также могут формировать cis ассоциации с другими рецепторами на той же самой клетке для образования мультирецепторных комплексов. Эти комплексы рекрутируют сигнальные молекулы в места межклеточной или кллтка-матрикс адгезии, такие как фокальные комплексы или фокальные слипания (focal adhesions). Интегрины кооперируют с другими рецепторами клеточной поверхности и тем самым влияют на различные пути передачи сигналов. Нарпимер, интегрины даже способны использовать рецептор platelet-derived growth factor (PDGF) и его сигнальный путь в отсутствие PDGF 7.
Эти комплексы интегринов и др рецепторов могут формироваться даже в ответ на или независимо от активации и связывания интегринов. Однажды собранные они затем допускают `on the spot' модуляцию интегриновой функции. cis партнер может нарушать конформацию интегрина непосредственно, меняя сродство интегрина к лиганду; образование кластеров с другими рецепторами комплекса может вести косвенно к кластированию ассоциированных интегринов, с увеличением силы интегринами обеспечиваемого связывания лиганда и с увеличением передачи сигналов; или комплекс может представлять собой функциональную упаковку для обеспечения миграции чрез ткань, таких как ассоцииации интегринов с протеазы-содержащими комплексами.
В обзоре обсуждаются cis взаимодействия в которых интегрин ассоциирован физически с другими трансмембранными белками. Классы рецепторов, ассоциирующие физически и функционально с интегринами представлены в табл.1 1. Большинство ассоциаций происходит с участием внеклеточных доменов. Однако пути взаимодействия с мембранными белками caveolin и CD98 все еще недостаточно изучены и могут быть связаны с вовлечением цитоплазматических доменов как интегрина, так и партнеров .
Table 1. Associations between integrins and other cell-surface receptorsa |
Transmembrane receptor |
Associated integrins |
Physical nature of interaction |
Refs |
 |
integrin-associated
protein |
 |
|
αvβ3 |
IgSF-like domain of IAP |
|
|
αIIββ3 |
|
|
|
α2β1 |
|
|
|
(αvβ5) |
Probable association |
|
 |
TM4SF |
 |
At least 21 members including: |
α3β1, α4β1, α6β1, αIIββ3, |
Cation-binding region of a subunit |
|
CD9, CD37, CD53, CD63, |
α4β7 [NOT α6β4, α5β1, |
|
|
CD81, CD82, CD151/PETA, NAG-2 |
α4β7, α2β1, LFA-1 |
|
|
|
(αLβ2) or av] |
|
|
 |
Growth-factor receptors |
 |
IR β-subunit |
αvβ3 |
Unknown |
|
PDGFbR |
αvβ3 |
Unknown |
|
 |
GPI-linked receptors |
 |
uPAR (CD87) |
Mac-1 (αMβ2) |
Lectin carbohydrate linkage |
|
|
LFA-1 (αLβ2) |
Found with uPAR in extracts of monocytes |
|
|
p150,95 (αxβ2) |
FRET on cell surface |
|
|
α5β1 |
Tripartite complex of caveolin, integrin and uPAR |
|
|
α3β1, α5β1, α6β1, |
β1 integrins and uPAR co-immunoprecipitate; FRET on cell surface blocked by NADG |
|
|
αvβ3 |
FRET on cell surface. blocked by NADG |
|
FcγRIIIB (CD16B) |
Mac-1 (αMβ2) |
FRET on cell surface blocked by NADG |
|
|
LFA-1 (aLb2) |
FRET on cell surface |
|
CD14/LPS/LBP |
Mac-1 (αMβ2) |
FRET on cell surface blocked by NADG |
|
CD98 |
β1 integrins |
TM/cytoplasmic domains of CD98 α subunit required |
|
 |
Others |
 |
EMMPRIN/BASIGIN OX47/M6/CD147 |
α3β1, α6β1 |
Unknown, but do not contain TM4SF complexes |
|
|
aAbbreviations: FRET, fluorescence resonance energy transfer; GPI, glycosylphosphatidylinositol; IAP, integrin-associated protein; IgSF, immunoglobulin superfamily; IR, insulin receptor; LPS/LBP, lipopolysaccharide and binding protein complex; NADG, N-acetyl- d-glucosamine; PDGFbR, platelet-derived growth factor β-receptor; TM, transmembrane; TM4SF, transmembrane-4 superfamily; uPAR, urokinase-type plasminogen activator receptor. |
integrin-associated protein
Ассоциированный с интегринами белок (integrin-associated protein (IAP; CD47)) является в 50-kDa одноцепочечным белком, состоящим из внеклеточного immunoglobulin superfamily (IgSF) домена, 5 membrane-spanning последовательностей и короткого цитоплазматического хвоста. IAP выявлен как белок, ассоциирующий с двумя β3 инегринами, повсеместным αvβ3 ( Fig 1a) и ограниченым тромбоцитами αIIbβ3 ( Fig 1b), а также имеющий потенциал ассоциации с αvβ5 8. Недавно было показано, что IAP ассоциирует с α2β1 в гладкомышечных клетках человека 9. Один из четырех сплайс-вариантов IAP экспрессируется в клетках всех типов 10, IAP ,по-видимому, особенно важен для активации и миграции миэлоидных клеток через эндотелиальный и эпителиальный монослой 11. Предполагается, что лейкоцитарный PECAM-1 (CD31) вовлекает IAP–αvβ3 на эндотелии и обусловливает ток Ca 2+ . Этот приток Ca 2+ затем ведет к эндотелиальной ретракции и потере плотных соединений, обеспечивая возможность миграции лейкоцитов. В соответствии с этой моделью имеются доказательства того, что в ответ на присоединение лиганда лейкоцитарный IAP–αVβ3 передает внутриклеточный сигнал, ингибируя α4β1-обусловленную адгезию с эндотелиальным лигандом VCAM-1 и тем самым увеличивая скорость клеточной подвижности 12. Получение IAP-нулевых мышей подтверждает центральную роль этого белка в миграции лейкоцитов и host defence 13. У этих мышей быстро наступает перитонит Escherichia coli благодаря неспособности нейтрофилов мигрировать и активироваться.
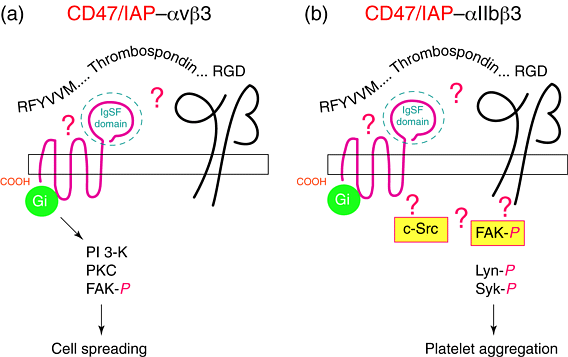 | Рис 1. (a) Модель ассоциации CD47/IAP с αvβ3. Диаграмма интегрин ассоциированного белка (IAP), представленого спиралью, виде 5 раз прошивающей оболочку, с внеклеточным доменом иммуноглобулинового суперсемейства (IgSF) (голубая штриховая линия), который и взаимодействует с интегрином, хотя сайт взаимодействия с интегрином неизвестен 8. IAP оказывает свое влияние на αvβ3 функцию через посредство гетеромерного G-белка, стоящего наверху общего пути расползания клеток, обеспечиваемого фосфоинозитол 3-киназой (PI 3-K), протеин-киназой С (PKC) и тирозин киназой 15. Тромбоспондин (TSP) как показано связывается с IAP и с интегрином через домен связывания клеток (RFYVVM) и RGD мотив, соответственно . (b) Модель ассоциации CD47 с αIIbβ3 иллюстрирующая формирование сигнального комплекса интегрина –IAP–c-Src–FAK когда TSP взаимодействует с IAP и улучшает αIIbβ3-обеспечиваемую аггрегацию тромбоцитов 16. Кроме того,4NIK стимулирует фосфорилирование и ассоциацию FAK, Syk и Lyn 16. Знак вопроса указыват на то. что точная природа взаимодействия неизвестна. . Обозначения: FAK, focal-adhesion kinase. Fig. 1. (a) Model of the association of CD47/IAP with αvβ3. Diagrammatic illustration of integrin-associated protein (IAP) shown as a five-membrane-spanning protein with an extracellular immunoglobulin superfamily (IgSF) domain (blue dotted line), which is thought to interact with the integrin, although the site of integrin contact is unknown8. IAP exerts its effects on αvβ3 function via a heterotrimeric G-protein acting upstream of a common cell-spreading pathway mediated by phosphoinositide 3-kinase (PI 3-K), protein kinase C (PKC) and tyrosine kinases15. Thrombospondin (TSP) is shown binding to IAP and the integrin via the cell-binding domain (RFYVVM) and RGD motif, respectively8. (b) Model of the association of CD47 with αIIbβ3 illustrating the formation of a signalling complex of integrin–IAP–c-Src–FAK when TSP interacts with IAP and enhances αIIbβ3-mediated platelet aggregation16. In addition, 4NIK stimulates the phosphorylation and association of FAK, Syk and Lyn16. Question marks indicate that the precise nature of the interaction is unknown. Abbreviation: FAK, focal-adhesion kinase |
Клетки человека, у которых отсутствует IAP дефицитны по связыванию, обеспечиваемому лигандом αvβ3 8, а трансфекция таких клеток делеционными мутантами и химерными конструкциями IAP показывает, что внеклеточный IgSF домен IAP достаточен для его ассоциации с интегринами и реконституции функции интегрина αv 8. Ко-иммунопреципитация показывает, что в любое время только небольшая часть от всей IAP and β3 интегрина ассоциируют друг с другом 8. IAP играет и свою собственную роль как Т-клеточный ко-митоген, действующий с помощью адгезия-зависимого CD28-независимого пути, по-видимому, независимуют от ассоциацииIAP–интегрин 14. Дополнительная интегрин-независмая функция животрепещущая для всех рецепторов, ассоциирующих с интегринами.
IAP связан с клеточно-связывающим доменом (cell-binding domain (CBD)) тромбоспондина (TS-1) а 4NIK пептид (KRFYVVMKK) из этого домена усиливает αvβ3-обеспечиваемое расползание, но не адгезию в меланомных клетках человека и усиливает α2β1-обеспечиваемый хемотаксис гладкомышечных клеток 9. Этот эффект чуствителен к токсину pertussis, действующему на вышестоящие protein kinase C (PKC) и phosphoinositide 3-kinase (PI 3-K) 915. Помимо детергент-стабильного αIIbβ3, IAP, выделены c-Src и focal-adhesion kinase (FAK) с повышенной фосфориляцией FAK в ответ на стимуляцию тромбоцитами 16. Это указывает на то, что IAP не модулирует активности β1 and β3 интегринов при прямом физическом взаимодействии, но действительно формирует функциональную мембранную единицу , которая передает сигнал посредством гетеротримерных G-белков.
The tetraspans (TM4SF proteins)
Transmembrane-4 superfamily (TM4SF) включает в свой состав по крайней мере 21 белок, обладающие 20–30% гомологией последоватиельностей. Члены TM4SF, так называемые тетраспанс (tetraspans), имеют 4 трансмембраннфх домена с двумя внеклеточными петлями и внутриклетчоными N- и C-концами 17. Подобно IAP, они экспрессируются во всех тестированных клетках, обычно более чем с одним тетраспаном на клетку.Большинство тетраспан–интегриновых ассоциаций выявлено с помощью реципрокной иммунопреципитации, которые показали, что CD9, CD53, CD63, CD81, CD82, CD151/PETA-3 и NAG-2 ассоциировать физически в отдельных комплексах с определенными интегринами 171819.Эти tetraspan–integrin комплексы варьируют в зависимости от типа клетки и один интегрин может ассоциировать более чем с одним тетраспаном( Fig 2) 20. Интегрины, идентифицированные в комплексах с тетраспанами, были α3β1, α4β1, α6β1, α4β7 и αIIbβ3, но не выявлено ассоциаций с тетраспанами α2β1, α5β1, α6β4, αv или the β2 интегринами 17. Лишь небольшая фракция интегринов и тетраспанов (5–10%) способна формировать tetraspan–integrin комплексы 20. Тетраспаны также ассоциируют друг с другом и с другими белками клеточной поверхности, включая CD4, CD8, CD19, CD21 и основного комплекса (MHC) class II 17. Неясен характер состава или стоихиометрии этих кластеров поверхностных молекул, однкао комплексы могут содержать несколько типов тетраспанов. Способность ассоциировать друг с другом и с другими мебранными белками является общим свойстовм всех тетраспанов. В отличие от большинства promiscuous тетраспанов, CD151 ассоциирует с α3β1 в стабильный комплекс, устойчивый к разрушению детергентом (M. Hemler, pers. commun.). Некоторые ассоциации tetraspan–integrin обнаруюиваемы при среднем детергентном лизисе могут быть верифицированы с помощью иммунофлюоресцентной микроскопии отпечатков клеток 21 and cell-surface clusters 20.
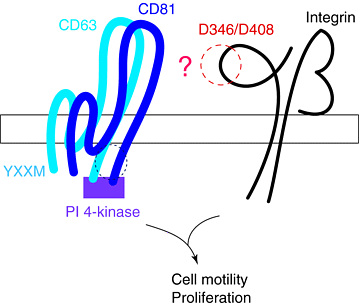 | Рис 2. Комплекс CD63–CD81–интегрин: схематическое изображение теоретического тетраспан–интегринового комплекса, иллюстрирующее предполагаемую роль α4 остатков D346 и D408 в ассоциации с CD81 20. CD63 и CD81 показаны в ассоциации с phosphatidylinositol (PI) 4-kinase, которая обнаружена в CD63–CD81–α3β1 комплексе 22. Показан мотив интеонализации(YXXM) CD63 Figure 2. Complex of CD63–CD81–integrin: diagrammatic illustration of a theoretical tetraspan–integrin complex to illustrate the putative role of α4 residues D346 and D408 in the association with CD8120. CD63 and CD81 are shown in association with phosphatidylinositol (PI) 4-kinase, which has been found in CD63–CD81–α3β1 complexes22. The internalization motif (YXXM) of CD63 is shown. |
Ассоциация интегринов с тетраспанами не завист от субъединицы цитоплазматического хвоста α интегрина, активации интегрина или дивалентных катионов 2021. Однако, как αтак β интегриновые субъединицы отвечают за специфичность этого взаимодействия, а мутации, нарушающие адгезию, во внеклеточной, предпологаемой divalent-cation-binding области α4 субъединицы (D346E и D408E) могут предупреждать ассоциацию α4β1 с CD81 20. Так как эти мутации не являются частью распознаваемого α4β1 лиганд-связывающего сайта, то они могут представлять собой область интегрина , которая осуществляет физический контакт с CD81 и потенциально с другими тетраспанами. Это указывает на то, что ассоциация интегрина с CD81 необходима для адгезии или, напротив, что мутации, которые нарушают адгезию оказывают непрямой эффект на ассоциации integrin–tetraspan, например, нарушая кластрирование интегрина. Хотя точная функция семейства тетраспанов неизвестна, ее члены участуют в контроле подвижности клеток, метастазировании и росте 17. Интегрины также участвуют в этих функциях, поэтому их ассоциации с тетраспанми могут быть очень важными, предполагается, что они затрагивают клеточную адгезию, а β1-integrin-опосредованное связывание клеток может увеличиваться при использовании моноклональных антител (mAbs) против тетраспанов 1718 — однако в других исследованиях те же антитела не обнаруживали подобного эффекта 1720.
Эти вариабельные эффекты mAbs против тетраспанов на адгезивность клеток указывают на то, что ассоциации tetraspan–integrin могут участвовать в контроле более сложных связанных с интегрином событиях, таких как подвижность клеток и метастазирование. Hemler, Berditchevski and colleagues tetraspan–integrin комплексы в уникальных мембранах островков, ассоциированных с ламеллоподиями ведущего края мигрирующих клеток, где происходит рециклинг интегринов 21. В клетках с редуцированным уровнем тетраспанов скорость рециклинга интегринов существенно снижена. Определенные тетраспаны, включая CD63, могут обнаруживатвься внутри клеток в trafficking пузырьках, а CD63 и CD81 вместе с α3β1, связаны физически и функционально с phosphatidylinositol 4-kinase, ферментом ассоциирующим с транспортом этих пузврьков 22. Предложена модель, что по крайней мере некоторые тетраспаны участвуют в выдвижении ламеллоподий и движении клеток путем котроля рециклинга интегринов в ведущем кре клеток. Вместе с этой потенциально важной ролью в рециклинге интегрина тетраспаны могут участвовать также в управлении локализации интегринов на поверхност клеток. Например, CD151, CD9 и CD81 экспрессируются confluent эндотелием исключительно в слипчивых соединениях (adherens junctions), где они физически связаны с α3β1 но не с другими интегринами или молекулами такими как CD31, VE-кадхерин и катенины 18. Сигналы от матрикса строго участвуют в предупреждении анойкиса (anoikis) эндотелиальных клеток, могут сходным образом влиять на межклеточные контакты и возможно, что тетраспаны , путем направления интегринов в слипчивые соединения имеют двойную функцию по предупреждению anoikis и сохраниению интегральности эндотелиального монослоя.
Тетраспаны обнаружены в клеточных микроворсинках, скорее чем на плоскостной поверхности клеток и с помощью физического взаимодействия с интегринами они могут направлять их в микроворсинки, тем самым обеспечивая большую доступность для адгезивных взаимодействий 23. Это может также объяснить важность внеклеточных доменов интегринов в локализации интегринов, так как этот домен должен определять способность интегрина взаимодействовать с уже локализованным партнерными молекулами и релокализоваться. IAP также обнаруживается на высоких уронях в микроворсинках и может играть сходную роль в направлении интегринов. Наконец, два тетраспана , CD9 и CD82, иддентифицированы подобно IAP, как T-cell ко-стимулирующие молекулы 2425, это указывет на то, что клеточная локализация также важна для их функционирования в иммунном.
Growth-factor receptors (GFRs)Адгезивные взаимодействия существенны как для прогрессии клеточного цикла, так и для прллиферативного ответа, инициируемого рецепторами факторов роста(GFRs). Этот функциональный синергизм и локализация некоторых GFRs в фокальных адгезивных комплексах 26 предполагает возможную ассоциацию GFRs с интегринами. Неизвестно все ли GFRs участвуют в прямом физическом контакте с интегринами, но имеются четкие примеры, где они влияют на функцию интегринов. В Фибробластах мышей, крыс и человека 2728 и клетках микроваскулярного эндотелия крыс 29, a 190-kDa белок ассоциирует с αvβ3 , но не с α5β1,в ответ на PDGF, и это независит от влияния лигандов на интегрин. Белок 190-kDa тирозин фосфорилируется в ответ на PDGF,и это может в дальнейшем усиливаться, если αvβ3 взаимодеействует с витронектином 28. Природа 190-kDa белка неясна 27 2829 является ли он рецептором PDGF. Этот синергизм между интегринами и факторами роста оказывает позитивный эффект на αvβ3-опосредованную миграцтию клеток 2729, которая является Arg-Gly-Asp (RGD)-зависимой и может быть блокирована инргибитором тирозин-киназы herbimycin A 29. Эффекты этого рецепторного синергизма на пролиферацию клеток изменчивы (усиливают) 27 (не оказывают эффекта) 29. В другом исследовании, кластирование β1 iинтегринов или взаимодействие с лигандом обусловливают прямое фосфорилтирование рецепторов для PDGF в отсутствие PDGF 7. Инсулиновая стимуляция вызывает αvβ3 копреципитацию с ~5–8% субъединицы рецепторов инсулина (IR) β 27 вместе с небольшим количеством высоко фосфорилированного insulin receptor substrate 1 (IRS-1) 30, цитоплазматического сигнал трансдуцирующего медиатора инсулина. После того как инсулин связывается со своим рецептором, IRS-1 связывается с рядом нижестоящих эффекторных молекул, которые могут быть идентифицированы в тех же самых integrin–IR-β-subunit–IRS-1 комплексах 30. Такие комплексы не обнаружены с другими интегринами или в нестимулированных клетках. Митогенные эффекты инсулина усиливаются при соединении αvβ3 с лигандом только в клетках, которые способны формировать эти комплексы 30. Во всех этих комплексах GFR , по-видимому, используются интегринами для передачи сигналов, модулируемых клеточной адгезивностью. Предполагается, что ассоциация GFR с интегринами дает кластер GFRs, позволяющий более эффективно передавать сигналы или ингибировать раннее дефосфорилирование GFRs, которое innate tyrosine kinase activity.
CD98: the affinity modulatorДругой интересный белок, CD98, по-видимому, непосредственно регулирует сродство β1 интегринов 31. CD98 является α–β гетеромером, рано экспрессируемым при активации Т-клеток. Подобно кавеолину (см ниже), CD98 α субъединица является мембранным белком типа II с N-концом внутри клетки. Антитела mAbs против CD98 индуцируют интегринα3β1-зависимое слияние клеток с помощзью некоторых вирусов 32,а также гомотипическую аггрегацию 33. Установлено, что CD98 α субъединица превращает β1 интегрины в состояние выского сродства 31. Избыточная экспрессия других партнеров интегрина, таких как IAP или тетраспан, CD9 не сопровождается сходным увеличением срдства. По-видимому, это восстановление от супрессии зависит от внутриклеточного взаимодействия между цитоплазматическими последовательностями интегрина и α субъединицы CD98 31. Это может быть первым примером регуляции сродства интегрина с помощью мембранного партнера.
Caveolin
Кавеолы это инвагинации плазменных мембран, участвующие в трансцитозе и присутсвующие в большинстве клеток, за исключением свежих моноцитов и нейтрорфилов и некоторых эндотелиев 34. Они являются специализированными микродоменами со многими функциями, включая концентрацию glycosylphosphatidylinositol (GPI)-сцепленных рецепторов и сигнальных белков. Эти рецепторы и белки рекрутируются кавеолами в результате кластрирования или активации 35. Основной структурный компонент кавеол - кавеолин, белок в 22-kDa. Кавеолин имеет связанные с мембраной последовательности в 30–40 аминокислот, которые пронизывают мембрану один или два раза 3536. 20 аминокислотных остатков N-терминального цитозольного домена, `caveolin scaffolding domain', ассоциируют с ассортиментом сигнальных молекул, таких как Gα субъединица гетеромерных G белков, Ha-Ras и Src-семейство тирозин киназ. Кавеолин взаимодействует преимущественно с инактивной формой этих молекул и пептиды caveolin scaffolding домена конвертируют киназы из активного состояния в неактивное 37. Следовательно, кавеолин играет цетральную роль в оркестрации сигнальных событий в кавеолах.
Кавеолин и кавеолы играют также роль в ECM-опосредованном поощрении пролиферации клеток или терминальной дифференцировки, в зависимости от типа клеток и композиции матрикса. Сигнальные пути, участвующие в этих процессах несовсем понятны, но скорее всего опосредованы интегринами. Установлено, что mAb-опосредованное связывание некоторых β1 интегринов, а также αvβ3, обусловлено вовлечением адпторного белка Shc, ведущего к активации mitogen-activated protein kinase (MAPK) пути 38. Очевидно интегрин-зависимое выживание клеток является результатом одного из двух исходов, зависящих от способности затронутых интегринов активировать Shc. Адгезия, опосредуемая интегринами, которые активируют Shc , способствует вступлению в клеточный цикл и пролиферации клеток, тогда как адгезия, опосредуемая интегринами, которые не активируют Shc обусловливает выход из клеточного цикла и диффернцировку. Способность рекрутировать Shc специфицируется тем же самым ближайшим к мембранам внеклеточным и трансмембранным доменом субъединицы интегрина α , которая взаимодействует с кавеолином 38, вовлекая кавеолин и по-видимому, кавеолы в это взаимодействие integrin–Shc. Возможно, что кавеолин рекрутирует локальный пул неактивных Ha-Ras. Этот пул Ha-Ras затем окажется способным к активации теми интегринами, которые рекрутируются в те же самые кавеолы.
Другое важное взаимодействие интегринов с кавеолином и третьим партнером, urokinase-type plasminogen activator receptor (uPAR/urokinase receptor/CD87; см. ниже) описано недавно. В модельной системе почечных клетках человека, трансфицированных uPAR интегрины β1 обнаружены в ассоциации с кавеолином и uPAR 39. Однако вовлечен только небольшой пул β1 интегринов, формирование этих комплексов переключает специфичность лиганда связывания клеток с интегрин-опосредованного связывания фибронектина на uPAR-опосредованное связывание витронектина(см. ниже).
Mac-1 и основные его партнеры
Несколько иной пример cis взаимодействий - ассоциации интегринов, таких как leukocyte-specific β2 интегрин Mac-1 (CD11b/CD18), с GPI-сцепленными мембранными гликопротеинами. GPI-сцепленные белки не содержат внутриклеточных доменов и могут передавать сигнал через расположенных на мембране партнеров. Примером GPI-сцепленных рецепторов, которые функционируют таким образом, являются uPAR (см. ниже); FcγRIIIB (CD16), которые соединяются с Mac-1 и способствуют зависимому от антител фагоцитозу 40; и с CD14, который связывает бактериальный полисахарид и связывающий белковый комплекс (LPS/LBP) в ассоциации с Mac-1, вызывая продукцию провоспалительных медиаторов 40. FRET микроскопия выявила, что во время хемотаксиса нейтрофилов, uPAR диссоциирует от Mac-1 и поляризует ведущий край мигрирующих клеток, где он ассоциирует с другим β2 интегрином, p150,95 (CD11c/CD18; Fig 3) 41. Значение этого эффекта для миграции миэлоидных клеток пока неизвестно. Эта ассоциация uPAR с β2 интегринами отличается от ассоциации с β1 интегринами тем, что не привлекается кавеолин, который эти клетки не экспрессируют 34.
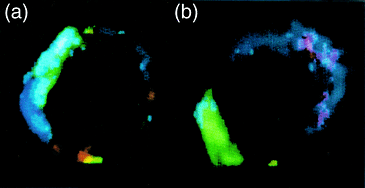 | Рис. 3. Флюоресцентные микрофотографии, показывающие взаимоотношение интегрин–uPAR в нейтрофилах. Когда покоящиеся нейтрофилы начинают мигрировать, взаимосвязь между uPAR и интегрином Mac-1 нарушается. (a) В состоянии покоя, uPAR (blue) и Mac-1 (green) физически взаимодействуют. (b) Когда нейтрофил поляризуется для миграции, то uPAR локализуется в ламелоподиях, где он может ассоциировать теперь со вторым β2 интегрином, p150,95 (red), а Mac-1 оказывается на буксируемом крае 57. Figure 3. Fluorescence micrographs showing the integrin–uPAR relationship in neutrophils. When resting neutrophils start to migrate, the relationship between urokinase-type plasminogen activator receptor (uPAR) and the integrin Mac-1 alters. (a) In the resting state, uPAR (blue) and Mac-1 (green) physically interact. (b) When the neutrophil is polarized for migration, uPAR is localized to the lamellipodia where it may now associate with a second β2 integrin, p150,95 (red), and Mac-1 is at the trailing edge 57. Figure courtesy of H. R. Petty and reproduced from Immunology Today [Vol. 17, no. 5 (1996), cover]. |
Очевидно, что GPI-сцепленные рецепторы формируют цис взаимодействия с Mac-1 путем связывания с лектиновым сайтом субъединицы интегрина α. Установлено, что маннозой, глюкозой и полисахаридами богатый N-acetyl- d-glucosamine (NADG), такой как β-glucan или его производный SZP, взаимдодействует с сайтом связывания N-linked углеводов на Mac-1. Этот сайт является C-терминальнм по отношению к I домену на субъединице α 4243. Когда полисахариды связываются с лектиновым сайтом , то нейтрофил подготавливается к каталитической активности, респираторным щеткам и другим функциям Как FcγRIII так и uPAR активности блокируются малыми сахарами такими как NADG, указывая тем самым, что эти GPI-сцепленные рецепторы также связываются с сайтом распознавания углеводов Mac-1. Кроме того mAb VIM12 отделяют FcγRIII от Mac-1 и могут распознавать эпитопы внутри этого лектиновго сайта 40. Взаимодействие в лектиновом сайте вызывает также фосфорилирование тирозина некоторых цитоплазматических белков и увеличивает экспрессию CBRM1/5 эпитопа активации 42. Этот CBRM1/5 эпитоп расположен внутри Mac-1 I домена, а индукция этого эпитопа полисахаридами указывает на то, что ассоциированные с интегрином молекулы могут в действительности менять конформацию.
Cells on the move: the uPAR connection uPAR уже рассматривался в контексте его ассоциации с β1 интегринами в кавеолах и его ассциации с лектиновым сайтом Mac-1 в миэлоидных клетках. Однако uPAR лучше известен как рецептор клеточной поверхности для serine protease urokinase type plasminogen activator (uPA). При соединении с uPAR, uPA активируется и конвертирует плазминоген в плазмин. Плазмин затем способен деградировать фибрин и другие внеклеточные мембанные белки и действовать как основной перицеллюлярный фибринолитичеакий путь. Вместе с plasminogen activator inhibitor 1 (PAI-1), uPAR и uPA формируют базирующиеся на клеточной мембране упаковки, которые не только регулируют перицеллюлярный протеолиз, но и могут затрагивать интегринами обеспечиваемы функции. Предположение о том, что αvβ3 создает мембранный сайт для активации других протеаз, таких как matrix metalloprotease 2 (MMP-2) 44, представляет другой пример реципрокной регуляции протеазы и интегрина. Комбинрация интегриновой и протеазной активностей может быть критической для миграции клеток через ткани и активируется у многих метастатических опухолевых клеток 4546.
Ряд других исследований выявил различную степень колокализации между uPAR и αvβ5 47, β1 48 and β3 4849 интегринами и также Mac-1. Интересно, что колокализация β1 и β3 интегринов с uPAR, сходна с таковой для uPAR и Mac-1, она может быть снижена с помощью молекулы сахара NADG 48, потдверждая формирование комплекса. Хотя многие интегрины колокализуются с uPAR, имеется довольгно мало примеров действительной физической ассоциации uPAR с интегринами 3948. Однако uPAR коиммунопреципитируется с β1 интегринами. Имеется также ассоциация между uPAR и β2 интегринами Mac-1 и LFA-1 (CD11a/CD18) в моноцитах и uPAR комплексы из uPAR, LFA-1, Mac-1 и четырех тирозин-киназ, fyn, lyn, hck и fgr, но не других моноцитарных GPI-сцепленных белков 34. Коиммунопреципитация β1 интегринов и uPAR снова показывает, что только небольшая пропорция или uPAR или интегрина предназначена для uPAR–integrin комплексов 39.
Очищенный Mac-1 взаимодействует с растворимыми uPAR, и это взаимодействие усиливает активацию интегрина Mn 2+ (Ref. 39), указывая тем самым, что формирование комплекса integrin–uPAR зависит от активности интегрина. В моноцитах человека uPAR является рецептором для витронектина 50, а активация или лигация Mac-1 способствует uPAR-опосредованному связыванию витронектина 5152, которое синергично увеличивает связывание Mac-1 фибрина(огена) 5153. Напротив, растворимые uPAR 39 или связанный uPA с клеточно-поверхностным uPAR ингибирут Mac-1 и α5β1 функцию 51. Не тзвестен функциональный эффект растворимых uPAR на LFA-1 и αv интегрины. PAI-1 связывается с и инактивирует uPA–uPAR комплексы. Это не только ограничивает протеолиз но и освобождет Mac-1 от uPA–uPAR-опосредованной ингибиции. PAI-1 может также полностью блокировать как uPAR- так и αv-опосредованное связывание витронектина, указывая тем самым, что все три рецептора могут связывать витронектин сходным образом. Этот дифференциальный эффект uPAR на функцию интегрина зависит от формы uPAR (растворимой или связанной с клеточной поверхностью) а его лиганд (uPA или витронектин) находится в кажущемся контрасте с гомогенными эффектами спаривания с другим рецептором.
Are there any unifying principles?
Выявлено немного тенденций.
Интегрины могут давать кластеры с другими типами рецепторов и с сигнальными молекулами при формировании функциональных мембранных единиц. Интегрин–протеазные комплексы способствуют миграции, определяя другой тип функциональной упаковки. Лишь небольшорй процент интегринов и cis партнеров участвует в формировании комплексов в каждый момент времени. Интегрины могут быть направлены в микро-домены клеточных мембран с помощью их ассоциации с другими рецепторами. Однако концентрация интегринов в фокальных адгезиях или контактах может давать совместные кластеры с другими типами рецепторов, делая более эффективной передачу сигналов. Несмотря на кажущееся сходство выявляются различия между разными типами интегриновых комплексов. Хотя TM4SF–интегриновые комплексы довольно стабильны (F. Berditchevski, pers. commun.), FRET исследования с uPAR указывают на то, что это не может быть приложимо ко всем интегриновым партнерствам. Некоторые комплексы зависят от состояния активации интегрина, а другие нет.
Можно предположить, что multimembrane-spanning свойства некоторых партнеров (IAP, five-pass; TM4SF, four-pass) могут быть ключевыми в закреплении интегрин– cisпартнерных комплексов в мембранах, благодаря расположению интегринов выше, а сигнальных молекул ниже мембранного бислоя. Это еще до конца не подтверждено для кавеолина и CD98, но, как мембранные белки типа II они могут быть two-pass белками 355455. Идентифицированы и другие integrin–membrane-protein комплексы, например, CD147/EMMPRIN комплексы с α3β1 и α6β1 56, а новый в 150-kDa α5β1-ассоциированный белок имет последовательности, указывающие на 3 трансмембранных прохождения (R. Juliano, pers. commun.).
|


