Retinioid Metabolism: A Balancing Act Nature Genet. V. 31. No 1. P. 7-8 (2002) | |
|
|
Retinoid metabolism Ретиноиды происходят из пищевого витамина А. Их главная функция - передача сигналов в клетках, где они свзывают два класса рецепторов RARs и RXRs, которые относятся к семейству ядерных гормональных рецепторов. Эти рецепторы являются регулируемыми лигандами транскрипционными факторами с важной ролью в эмбриогенезе и взрослой физиологии. Витами А (ретинол) превращается в ретинальдегид и затем в all-trans ретиноевую кислоту с помощью двух этапов окисления (Рис.) All-trans ретиноевая кислота присутствует в эмбриональных и взрослых тканях на высоких уровнях, связываясь эффектинво с RARs, и является основным биологически акивным ретиноидом in vivo. Предполагается, что дальнейшие метаболиты ретиноидов 4-гидрокси-ретиноевая кислота и 4-оксо-ретиноевая кислота являются неактивными продуктами распада all-trans ретиноевой кислты (Рис.). Однако, имеются определенные указания на то, что они выполняют важные биологические функции. 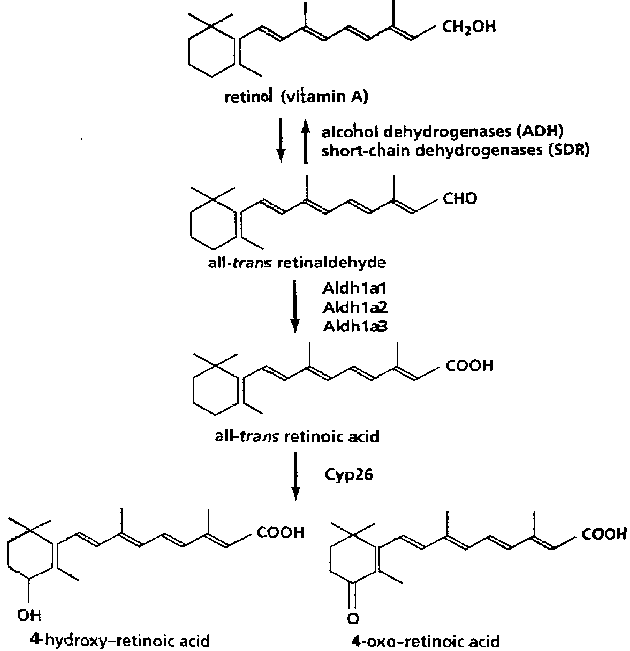
(Рис.1.) | Retinoid roundup. The biosynthetic pathway for generating all-trans retinoic acid invovles two oxidation steps, the first leading to the generation of all-trans retinaldehyde. Thr rate-limiting step in production of all-trans retinoic acid in the embryo is mediated by three related aldehyde dehydrogenases, Aldh1a11, Aldha2 and Aldha3. All-trans retinoic acid is converted to hydroxylated metabolites by Cyp26. These hydroxylated derivatives are metabolized to other polar retinoid metabolites by additional enzymatic pathways. Niederreither et al., show that the impaired retinoid balance resulting from Cyp26 null mutation is rescued on an Aldh1a2 heterozygous background. This finding indicates that the main, if not only, function of Cyp26 is to protect tissue from exess all-trans retinoic acid. Хотя картина остается неполной, многие критические энзимы, участвующие в метаболизме ретиноидов, идентифицированы. Окисление ретинола в ретинальдегид нуждается в активности нескоторых дегидрогенез (Рис.). Вторая ступень окисления до all-trans ретиноевой кислоты - нуждается в действии трех родственных ретинальдегид дегидрогенеаз и эта ступень биосинтеза является скорость-ограничивающей. Имеется высокая корреляция vt'le эмбриональной экспрессией алкоголь дегидрогеназы Aldh1a2 и активностью чувствительного к ретиноиду репортерного гена, а дефицитные по Aldh1a2 эмбрионы мыши имеют аномалии, говорящие о подавлении ретиноидов.
Цитохромный Р450 энзим, Cуp26, существенен для генарации 4-гидрокси-ретиноевой кислоты и 4-оксо-ретиноевой кислоты, а также др. гидроксилированных ретиноидных производных. Изучение Сур26-дефицитных мышей в основном подтвердило вывод о том, что
4-гидрокси-ретиноевая кислота и 4-оксо-ретиноевая кислота являются неактивными продуктами деградации all-trans изомера. Аномлии у этих мышей воспроизводили тератогенез, продуцируемый избытком all-trans ретиноевой кислоты. Однако, возможно, что некоторые из аномалий, обнаруживаемых у Сур26-/- мышей м.б. результатом нехватки Сур26-генерируемых метаболитов, которые играют активную роль in vivo. Более того, all-trans ретиноевая кислота д. оказывать ингибирующее влияние на активность, обеспечиваемую гидроксилированными производными ретиноевой кислоты, этим объясняется, почему аномалии, вызываемые дефицитом Сур26 и избыток all-trans ретиноевой кислоты напоминают др. др. Этот вопрос разрешен до некоторой степени в экспериментах с использованием нокаутных линий с мутациями Aldh1a2 и Сур26.
Retinoids in the balance Niederreither K et al.,( Nature Genet. 31. 2002) полагали, т.к. количество all-trans ретиноевой кислоты снижено у гетерозиготт по Aldh1a2 , то если Cyp26-генерируемые биоактивные метаболиты важны, то фенотип Сур26-/- мышей будет значительно усилен на фоне Aldh1a2+\-. И наоборот, если Сур26 метаболиты являются продуктами деградации и Сур26 просто защищает эмбрионы от избытка all-trans ретиноевой кислоты, то фенотип д.б. ослаблен на Aldh1a2+/- фоне.
Оказалось, что ранний летальный фенотип Сур26-дефицитных мышей фенотипически восстанавливается на Aldh1a2+/- фоне. Наблюдалось полное исчезновение spina bifida и аномалий урогенитального тракта, тогда как др. аномалии восстанавливались лишь частично (нарушения заднего мозга, трансформации позвонков). Самым впечатляющим было то, что такие эмбрионы были жизнеспособными и фертильными. Остальные аномалии имели ослабленную версию. Т.о., получены доказательства того, что главной, если не единственной функцией Сур26 является защита тканей от несоответствующей экспозиции all-trans ретиноевой кислоты.
The Model Morphogen All-trans ретиноевая кислота рассматривается как модель морфогена - сигнальной субстанции, которая локально синтезируется и формирует концентрационный градиент за счет диффузии. Градированные реакции на морфоген обеспечивают формирование паттерна внедифференцировнных эмбриональных тканях, таких как зачаток конечности и ранняя нервная трубка.
Возможно, что в большинстве случаев, данная ткань или униформно экспозируется или защищена от ретиноидов по типу вкл/выкл передачу сигналов. Такое предположение согласуется с униформным распределением in vivo экспрессии Aldh1a2 и Сур26, которое обнаруживается в четко определенных и в основном в неперекрывающихся доменах. Более того, эмбрионы Aldh1a2-/- м.б. частично восстановлены кормлением беременных матерей all-trans ретиноевой кислотой. Такое воздействие должно бы вызывать униформное воздействие ретиноидов в зонах, лишенных энзимов, деградирующих ретиноиды, что было бы несовместимо с потребностью в градированом распределении ретиноевой кислоты, но этого не происходит.
Работа Niederreither K et al., представлила четкие доказаетльства того, что 4-оксо-ретиноевая кислота является в основном продуктом разложения all-trans ретиноевой кислоты. Однако, остается открытым вопрос в отношении др. метаболитов, включая дидегидроретиноиды, обнаруженные у эмбрионов кур и ретро-ретиноиды, класс гидрокилированных ретиноидов, чья биологическая активность, по-видимому, не опосредуется ядерными рецепторами. Наиболее загадочна роль 9-цис ретиноевой кислоты, лиганда высокого сродства для RXR.
|
Сайт создан в системе uCoz