Члены сверхсемейства моторных белков кинезины являются удивительными наномашинами. Большинство кинезинов используют химическую энергию, хранимую в АТФ, чтобы развивать направленные усилия вдоль микротрубочковымх прото-филамент, поддерживая критические клеточные процессы, такие как везикулярный транспорт и сегрегация хромосом (Vale, 2003). Др. члены семейства кинезинов не действуют непосредственно как моторы, а скорее регулируют динамику микротрубочек. Удивительно, некоторые члены семейства кинезинов, такие как димерный "conventional" kinesin 1, движется поступательно вдоль своих белковых треков с помощью координации своих двух моторных доменов по типу hand-over-hand. Kinesin 1 способен осуществлять сотни 8 nm шажков без ухудшения, даже когда удерживается существенным грузом, это гарантирует, что диффузия не устранит мотор и важный груз не будет утерян по пути. Эта поступательность зависит от того, что один моторный домен кинезина остается прикрепленным к микротрубочке всё время. Остается неясным, как в точности поступательные кинезины координирует активности своих двух моторных доменов, так что один домен всегда остается прикрепленным к микротрубочке. В этом номере Cell, Yildiz с сотр. представли элегантное исследование, которое объясняет этот вопрос и открывает некоторые удивительные функции кинезиновых моторов.
Молекулярная архитектура димерного kinesin 1 частично объясняет, как он может осуществлять столь искусное продвижение. Каждый мономер kinesin 1 состоит из основного моторного домена в 350 аминокислот, содержащего ATPase каталитический сайт, а также сайты связывания микротрубочек. Соседним с моторным доменом является шеечный линкер, гибкая область, которая, как было показано, подвергается нуклеотид-зависимому переходу от неупорядоченной к упорядоченной структуре. За линкером следует двухспиральный (coiled-coil) домен димеризации. Т.о.,, kinesin 1 имеет две "ноги" (моторные домены) соединенные др. с др. гибким линкером, который может менять конформацию и который достаточно длинный, чтобы позволить двум моторным доменам, чтобы соединяться с двумя соседними сайтами на микротрубочке на расстоянии в 8 nm. Структура kinesin 1 позволяет ему "путешествовать" вдоль микротубулярной филаменты. Коммуникации между моторными доменами (между головками) , как известно, необходимы для поступательного движения, но как это осуществяляется неизвестно. Большинство теорий постулирует, что коммуникации осуществляются посредством "gating" механизма, где механистически шаг одной головки блокируется до тех пор, пока не будет осуществлен определенный шаг другой головкой (rev. Block, 2007). Такой пропуск д. быть химическим по природе, напр., связывание АТФ блокируется до тех пор, пока головка диссоциирована от микротрубочки (Klumpp et al., 2004; Rosenfeld et al., 2003), или механическим по природе, напр., конформационное изменение одной головки притягивает или отталкивает др. головку от микротрубочки (Hancock and Howard, 1999; Spudich, 2006). Конечног, наиболее вероятно, что действительный механизм коммуникаций между головками использует оба типа выбора, т.к. они не являются взаимо исключающими.
В работе Yildiz et al. (2008) использовали мутантную молекулу kinesin 1 и optical trapping микроскопию, чтобы наблюдать как изменяется длина шеечного линкера и тем самым натяжение между головками, что влияет на gating, а следовательно подвижность кинезаина. Выявлено несколько интересных и неожиданных результатов. В первой серии экспериментов авт. вставляли прогрессивно увеличивающиеся polyproline спирали между линкерной областью и доменом димеризации. Когда головки дикого типа kinesin 1 оказывались связанными с микротрубочкой, то нативные линкеры растягивались с большей или меньшей полнотой. в
Поступательное движение димерного моторного белка kinesin 1 вдоль микротрубочки нуждается в коммуникациях между двумя моторными доменами. Yildiz et al. (2008) показали, что натяжение между моторными доменами не только необходимо для нормального поступательного движения, но и мможет быть достаточным для движения мотора при некоторых условиях.
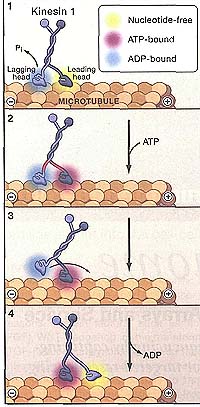 Figure 1. Interhead Tension Is Critical for Kinesin Stepping
Kinesin 1 motility cycle during a processive run along a microtubule protofilament. (1) Release of inorganic phosphate {P) from the lagging motor domain (lagging head) of the dimeric kinesin 1 results in a head that is weakly bound to the microtubule. (2) ATP binding to the leading head results in a conformational change (neck-linker docking) that generates interhead tension across the linker regions (red). (3) This tension promotes the detachment of the lagging motor domain (lagging head) from the microtubule and a biased diffusion-based search (arrow) for the next microtubule-binding site. (4) When the heads have swapped positions on the microtubule, the new leading head binds tightly to the forward microtubule-binding site and releases its bound ADR The lagging head undergoes ATP hydrolysis (step not shown) and releases P, to continue the cycle.
Figure 1. Interhead Tension Is Critical for Kinesin Stepping
Kinesin 1 motility cycle during a processive run along a microtubule protofilament. (1) Release of inorganic phosphate {P) from the lagging motor domain (lagging head) of the dimeric kinesin 1 results in a head that is weakly bound to the microtubule. (2) ATP binding to the leading head results in a conformational change (neck-linker docking) that generates interhead tension across the linker regions (red). (3) This tension promotes the detachment of the lagging motor domain (lagging head) from the microtubule and a biased diffusion-based search (arrow) for the next microtubule-binding site. (4) When the heads have swapped positions on the microtubule, the new leading head binds tightly to the forward microtubule-binding site and releases its bound ADR The lagging head undergoes ATP hydrolysis (step not shown) and releases P, to continue the cycle. Т.о., предполагается, что натяжение между двумя головками д. составлять gating механизм. При увеличении длины линкера, натяжение между головками д. уменьшаться или исчезать. Если только натяжение линкера отвечает за гарантию поступательности, то следует ожидать, что мутантная молекула кинезина с более длинными линкерами бедут больше неспособна путешествовать поступательно. Неожиданно, авт. продолжали наблбюдать поступательное движение вдоль микротрубочки, хотя и более медленное. Это указывает на то, что натяжение линкера необходимо для эффективного движения. Снижение скорости движения может быть обусловлено увеличением количества бесполезных "nonsteps" или количества аномальных шажков, из-за шажков неправильного размера или направления или шажков вдоль разных протофиламент.
Интересно, что подвижность этих хромых kinesin 1 молекул может быть восстановлена путем подталкивания их в правильном направлении. Используя оптическую ловушку, авт. прилагали внешнее натяжение к одиночной молекуле кинезина, подталкивая её вдоль микротрубочки. В таких условиях скорость даже самого длинного мутантного линкера теперь напомината таковую у дикого типа kinesin 1. Это указывает на то, что натяжение между двумя головками является критическим для эффективности поступательного движения (Figure 1). Более того, благодаря геометрии оптической ловушки, прилагаемое внешнее напряжение ощудщается больше отстающей головкой, указывая тем самым, что во время нормального механохимического цикла kinesin 1, отстающая головка стягивается с микротрубочки ведущей головкой.
Др. удивительным результатом у Yildiz et al. стало то, что кинезин предпринимает дискретные шажки в отсутствие АТФ, если подтакивается внешним воздействием. Хотя это, по-видимому, невероятно, учитывая, что кинезин нуждается в гидролизе АТФ, чтобы придать силу для движения, становится ясно. что связывание и гидролиз АТФ служит только для придания направления кинезиновым шажкам—формирование плотного интерфейса мотор-микротрубочка предоставляет большую часть энергии для генерации силы. В отсуствие АТФ внешне прикладываемая нагрузка (the optical trap) может выполнять роль АТФ по направлению движения. Далее, формирование мотор-трек интерфейса всё-ещё происходит в отсутствие АТФ, а внешнее напряжение, генерируемое оптической ловушкой воспроизводит естественное натяжение между головками, развиваемое во время обычного цикла гидролиза АТФ. Т.о., как только автомобиль roll-start, то толчок кинезину вдоль его микротубулярного трека может застаивть мотор действовать.
Работа Yildiz с коллегами представляет четкие и неотразимые доказательства, что натяжение между головками необходимо для нормальной подвижности кинезина. Было также предположено, что конформационные изменения в ведущей головке, по-видимому, запускаtvst с помощью связывания АТФ? увеличивают это нятяжение и вызывают высвобождение оставшейся сзади головки. Отстающая головка также д. играть роль в цикле подвижности, т.к. в обычных условиях, она необходима. чтобы гидролизовать связанный АТФ и высвободить фосфат прежде чем она будет сдернута с микротрубочки. Это делает осмысленным, что ATPase циклы обоих моторных доменов д. удерживаться в корректных относительных фазах, коогда молекула kinesin 1 движется эффективно. Являются ли эти результаты несогласующимися в др. химическими gating теориями? Не обязательно, хотя эти теории д. быть модифицированы, учитывая роль, открытую Yildiz et al. о натяжении между головками для движения мотора. Необходимо установить, почему мутантные молекулы kinesin 1 с удлиннеными линкерами сохраняют поступательрность. Как могут эти мутантные моторы с независимыми, несообщающимися моторными доменами всё ещё осуществляют шажки чаще всего в правильном направлении? Почему их ATPase циклы остаются скоординированными так, что обе головки не отсоединяются от микротрубочки одновременно?
 Figure 1. Interhead Tension Is Critical for Kinesin Stepping
Kinesin 1 motility cycle during a processive run along a microtubule protofilament. (1) Release of inorganic phosphate {P) from the lagging motor domain (lagging head) of the dimeric kinesin 1 results in a head that is weakly bound to the microtubule. (2) ATP binding to the leading head results in a conformational change (neck-linker docking) that generates interhead tension across the linker regions (red). (3) This tension promotes the detachment of the lagging motor domain (lagging head) from the microtubule and a biased diffusion-based search (arrow) for the next microtubule-binding site. (4) When the heads have swapped positions on the microtubule, the new leading head binds tightly to the forward microtubule-binding site and releases its bound ADR The lagging head undergoes ATP hydrolysis (step not shown) and releases P, to continue the cycle.
Figure 1. Interhead Tension Is Critical for Kinesin Stepping
Kinesin 1 motility cycle during a processive run along a microtubule protofilament. (1) Release of inorganic phosphate {P) from the lagging motor domain (lagging head) of the dimeric kinesin 1 results in a head that is weakly bound to the microtubule. (2) ATP binding to the leading head results in a conformational change (neck-linker docking) that generates interhead tension across the linker regions (red). (3) This tension promotes the detachment of the lagging motor domain (lagging head) from the microtubule and a biased diffusion-based search (arrow) for the next microtubule-binding site. (4) When the heads have swapped positions on the microtubule, the new leading head binds tightly to the forward microtubule-binding site and releases its bound ADR The lagging head undergoes ATP hydrolysis (step not shown) and releases P, to continue the cycle.