Активность ЦНС регулируется с помощью возбуждающих и ингибирующих молекул нейротрансмиттеров, обеспечивающих коммуникации между нейронами. Главным ингибирующим нейротрансмиттером в головном мозге человека является γ-aminobutyric acid (GABA), которая соединяется с несколькими рецепторами, включая GABA
A рецепторы. Мутации, затрагивающие GABA
A рецепторы, могут вызывать нейрологические нарушения, такие как эпилепсия. GABA
A рецепторы также имеют сайты связи для многих др. лигандов, некоторые из которых широко используются как терапевтические средства. Соединение лигандов с non-GABA сайтами могут изменять коммуникации между разными сайтами связывания и влиять на конформацию рецепторов способом, который стимулирует или ингибирует их функцию (allosteric modulation). Laverty et al.
1 и Masiulis et al.
2 описали 3D структуру высокого разрешения изоформ GABA
A рецепторов, связанных с разными лигандами, в физиологически подходящих конформациях. Их работа проливает свет на сеть коротких и длинных поперечных связей между разными сайтами связывания рецепторов.
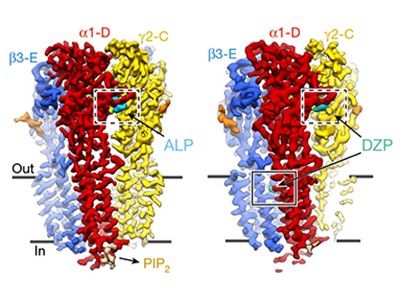 The GABAA receptors are a family of protein complexes that span the cell membrane of neurons. They are composed of five subunits (most often two α, two β and one γ subunit) arranged in a nearly symmetric fashion around a central channel. Each subunit has three domains: the extracellular, transmembrane and intracellular domains. GABA binds to the extracellular part of the receptor, at the interfaces between the α and β subunits. This leads to conformational changes that cause the channel to open and chloride anions to flow through. Benzodiazepines - a group of drugs that includes several widely used sedative and anti-anxiety therapeutics - bind to an extracellular site between the α and γ subunits, whereas the transmembrane part of the receptor harbours binding sites for alcohols, anaesthetics and neurosteroids3-5.
The GABAA receptors are a family of protein complexes that span the cell membrane of neurons. They are composed of five subunits (most often two α, two β and one γ subunit) arranged in a nearly symmetric fashion around a central channel. Each subunit has three domains: the extracellular, transmembrane and intracellular domains. GABA binds to the extracellular part of the receptor, at the interfaces between the α and β subunits. This leads to conformational changes that cause the channel to open and chloride anions to flow through. Benzodiazepines - a group of drugs that includes several widely used sedative and anti-anxiety therapeutics - bind to an extracellular site between the α and γ subunits, whereas the transmembrane part of the receptor harbours binding sites for alcohols, anaesthetics and neurosteroids3-5.
Laverty et al. и Masiulis et al. использовали cryo-electron microscopy (cryo-EM), чтобы исследовать GABA
A изоформу, которая содержит две α1, β3 и одну γ2 субъединицы, расположенные в порядок α1-β3-γ2-α1-β3 (Fig. 1 of ref. 1). Это одна из наиболее распространенных изоформ GABA
A рецепторов в головном мозге человека. Хотя общая архитектура рецепторов была известна, исследования предоставили новую информацию в молекулярных деталях субъединичной архитектуры и места сборки модулятора сайтов связывания и конформационных изменений, инициируемых связыванием лиганда.
 Read the paper: Cryo-EM structure of the human α1β3γ2 GABAA receptor in a lipid bilayer
Read the paper: Cryo-EM structure of the human α1β3γ2 GABAA receptor in a lipid bilayer
Исследование Laverty et al. затронуло три новых методологических аспекта. Во-первых авт. использовали субъединицы полной длины GABA
A, а не укороченные
6,7. Во-вторых, они реконструировали рецепторы в дискоидальных мембранах (nanodiscs) , состоящих из двойного слоя липидных молекул, окруженных каркасными белками, что сходно с их природным клеточно-мембранным окружением (Fig. 1). Это контрастирует с очищенным окружением, которое использовали в предыдущих исследованиях этой группы рецепторов. В-третьих, рецепторы были купированы с синтетическими увеличенными антителами (наз. megabody) с целью ориентации рецептора и расположения во время получения cryo-EM изображений. Используя эту методологию, Laverty et al. установили структуру рецептора, связанного с GABA, а Masiulis et al. получили пять дополнительных структур с разными лигандами или комбинациями лигандов: picrotoxin (агент, блокирующий открытый канал рецептора); picrotoxin и GABA; bicuculline (лекарство, вызывающее симптомы эпилепсии); alprazolam (a benzodiazepine) и GABA; а также diazepam (another benzodiazepine) and GABA.
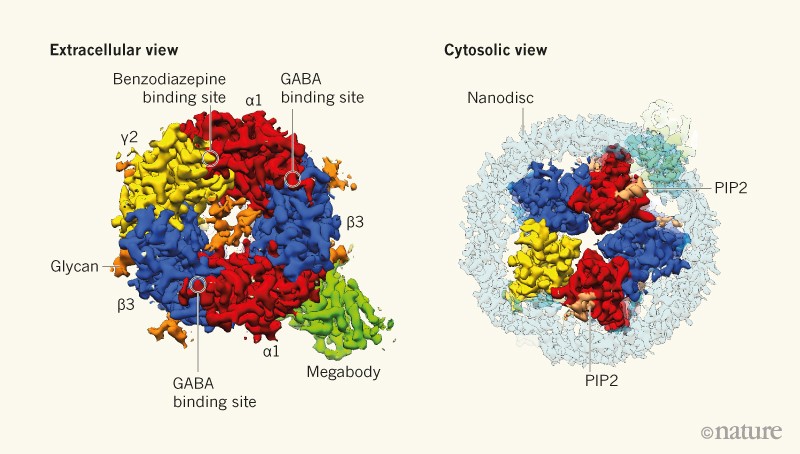 Figure 1 | Structure of a GABAA receptor composed of two α1, two β3 and one γ2 subunits. Laverty et al.1 and Masiulis et al.2 determined the structures of one of the most abundant GABAA-receptor isoforms in the human brain, alone or bound to various ligands, using cryo-electron microscopy. Before imaging, they reconstituted the receptor within a lipid membrane (nanodisc) that mimics the cell membrane of neurons, the receptor's natural environment. The receptor was also coupled to an enlarged antibody (megabody) to enable better orientation during imaging. The extracellular portion of the receptor contains binding sites for γ-aminobutyric acid (GABA), a natural ligand, and for benzodiazepines, which are widely used therapeutic drugs. The structure also indicates the sites of some molecules usually associated with the receptor, such as phosphatidylinositol 4,5-bisphosphate (PIP2) and glycans (sugars attached to the receptor). (Adapted from Fig. 1 of ref. 1.)
Figure 1 | Structure of a GABAA receptor composed of two α1, two β3 and one γ2 subunits. Laverty et al.1 and Masiulis et al.2 determined the structures of one of the most abundant GABAA-receptor isoforms in the human brain, alone or bound to various ligands, using cryo-electron microscopy. Before imaging, they reconstituted the receptor within a lipid membrane (nanodisc) that mimics the cell membrane of neurons, the receptor's natural environment. The receptor was also coupled to an enlarged antibody (megabody) to enable better orientation during imaging. The extracellular portion of the receptor contains binding sites for γ-aminobutyric acid (GABA), a natural ligand, and for benzodiazepines, which are widely used therapeutic drugs. The structure also indicates the sites of some molecules usually associated with the receptor, such as phosphatidylinositol 4,5-bisphosphate (PIP2) and glycans (sugars attached to the receptor). (Adapted from Fig. 1 of ref. 1.)
GABAA рецепторы печально известны своей нуждой в определенном липидном окружении, чтобы подвергаться функциональным конформационным переходам. Недавно два важных исследования6,7 установили впервые гетеротримерную структуру GABAA-рецептора. В обоих исследованиях трансмембранный домен рецептора находился в неестественной конформации, которая могла быть обусловлена замещением естественного окружения мембраны очищенным. Принимая во внимание аллостерическую природу GABAA рецептора любое конформационное отклонение в структуре трансмембранного домена одной или нескольких субъединиц должно влиять на трансмембранные домены др. субъединиц, а также на внеклеточные домены. Следовательно, полученные новые структуры в окружении мембран, могут дать более ясное представление о природе конформаций сайтов связывания рецептора. Laverty et al. продемонстрировали, что их метод реконструкции рецептора сохраняет физиологические удаленные связи между разными лиганд-связывающими сайтами: разные количества данного лиганда, связанные с рецептором, модулирует связывание другого радиоактивно меченного лиганда с отдаленным участком (Fig. 1f and Extended Data Fig. 2d of ref. 1).
Сделанные находки показали, как связывание данного лиганда с сайтом приводит к конформационным и функциональным изменениям GABAA рецептора, включая изменения сайтов связывания с др. лигандами. Напр., одна структура показала, что связывание GABA с обоими сайтами внеклеточного домена вызывает конформационные изменения, которые сжимают и приближают др. к др. эти сайты (Fig. 3 of ref. 1). Др. структура показала, что picrotoxin, соединяющийся с трансмембранным доменом, стабилизирует рецептор в конформации, близкой к структуре канала (Fig. 1 of ref. 2). Однако, третья структура показывает, что если GABA и picrotoxin присутствуют оба, то один из двух GABA-связывающих сайтов закрыт неполностью (Fig. 2 of ref. 2), демонстрируя, что связывание picrotoxin влияет на сайты связывания GABA. Структуры, получаемые, когда присутствуют и GABA и benzodiazepine, показывают, что эти соединения усиливают взаимодействия между в общем-то слабо ассоциированными внеклеточными частями α и γ субъединицами (Figs 5 and 6 of ref. 2). Это может объяснить, как benzodiazepines способствует активности рецептора, когда присутствует GABA.
Исследование также указывает на цитозольные части рецептора. Лишь короткие фрагменты крупных внутриклеточных доменов могут быть определены, даже если видны полной длины субъединицы GABAA. Это находится в резком контрасте с хорошо известными структурами внутриклеточных сегментов полной длины cation-conducting nicotinic acetylcholine- и serotonin-receptor каналов, которые являются членами одного и того же сверхсемейства pentameric neurotransmitter каналов, как и GABAA рецептор8-11. Имеющиеся находки могут быть первыми экспериментальные указания, что внутриклеточные сегменты GABAA и др. анионы проводящих пентамерных каналов могут не иметь определенной вторичной структуры, тогда как внутриклеточные домены катионы проводящих пентамерных каналов структуированы даже, когда экспрессируются в отсутствие внеклеточных и трансмембранных доменов12. Разнообразие длин и аминокислотного состава внутриклеточного домена остается проблемой для структурной и функциональной характеристики GABAA и родственных рецепторов.
Теоретически вовлечение специфических комбинаций субтипов GABAA-рецепторов в определенные нормальные и болезненные процессы дает надежду на определение точных фармакологических вмешательств. Практически, большое количество разных субъединиц GABAA (19 субъединиц), которые постоянно имеют существенно сходные аминокислотные последовательности делает поиск специфичных для субъединиц лекарств утомительным, если возможным. Детальная структурная информация, описанная в этих работах, а также лучшее понимание значительного разнообразия внутриклеточного домена, создаст в будущем солидную платформу для разработки зависимого от структуры лекарства и откроет новые пути разработки лекарств.
 The GABAA receptors are a family of protein complexes that span the cell membrane of neurons. They are composed of five subunits (most often two α, two β and one γ subunit) arranged in a nearly symmetric fashion around a central channel. Each subunit has three domains: the extracellular, transmembrane and intracellular domains. GABA binds to the extracellular part of the receptor, at the interfaces between the α and β subunits. This leads to conformational changes that cause the channel to open and chloride anions to flow through. Benzodiazepines - a group of drugs that includes several widely used sedative and anti-anxiety therapeutics - bind to an extracellular site between the α and γ subunits, whereas the transmembrane part of the receptor harbours binding sites for alcohols, anaesthetics and neurosteroids3-5.
The GABAA receptors are a family of protein complexes that span the cell membrane of neurons. They are composed of five subunits (most often two α, two β and one γ subunit) arranged in a nearly symmetric fashion around a central channel. Each subunit has three domains: the extracellular, transmembrane and intracellular domains. GABA binds to the extracellular part of the receptor, at the interfaces between the α and β subunits. This leads to conformational changes that cause the channel to open and chloride anions to flow through. Benzodiazepines - a group of drugs that includes several widely used sedative and anti-anxiety therapeutics - bind to an extracellular site between the α and γ subunits, whereas the transmembrane part of the receptor harbours binding sites for alcohols, anaesthetics and neurosteroids3-5.  Read the paper: Cryo-EM structure of the human α1β3γ2 GABAA receptor in a lipid bilayer
Read the paper: Cryo-EM structure of the human α1β3γ2 GABAA receptor in a lipid bilayer  Figure 1 | Structure of a GABAA receptor composed of two α1, two β3 and one γ2 subunits. Laverty et al.1 and Masiulis et al.2 determined the structures of one of the most abundant GABAA-receptor isoforms in the human brain, alone or bound to various ligands, using cryo-electron microscopy. Before imaging, they reconstituted the receptor within a lipid membrane (nanodisc) that mimics the cell membrane of neurons, the receptor's natural environment. The receptor was also coupled to an enlarged antibody (megabody) to enable better orientation during imaging. The extracellular portion of the receptor contains binding sites for γ-aminobutyric acid (GABA), a natural ligand, and for benzodiazepines, which are widely used therapeutic drugs. The structure also indicates the sites of some molecules usually associated with the receptor, such as phosphatidylinositol 4,5-bisphosphate (PIP2) and glycans (sugars attached to the receptor). (Adapted from Fig. 1 of ref. 1.)
Figure 1 | Structure of a GABAA receptor composed of two α1, two β3 and one γ2 subunits. Laverty et al.1 and Masiulis et al.2 determined the structures of one of the most abundant GABAA-receptor isoforms in the human brain, alone or bound to various ligands, using cryo-electron microscopy. Before imaging, they reconstituted the receptor within a lipid membrane (nanodisc) that mimics the cell membrane of neurons, the receptor's natural environment. The receptor was also coupled to an enlarged antibody (megabody) to enable better orientation during imaging. The extracellular portion of the receptor contains binding sites for γ-aminobutyric acid (GABA), a natural ligand, and for benzodiazepines, which are widely used therapeutic drugs. The structure also indicates the sites of some molecules usually associated with the receptor, such as phosphatidylinositol 4,5-bisphosphate (PIP2) and glycans (sugars attached to the receptor). (Adapted from Fig. 1 of ref. 1.)