Посещений: 
ГЛИКАНЫ; ГЕПАРАН СУЛЬФАТ
Структура и функция
HS, an Ancient Molecular Recognition and Information Storage Glycosaminoglycan, Equips HS-Proteoglycans with Diverse Matrix and Cell-Interactive Properties Operative in Tissue Development and Tissue Function in Health and Disease Anthony J. Hayes and James Melrose
 Int. J. Mol. Sci. 2023, 24(2), 1148; https://doi.org/10.3390/ijms24021148
|
Heparan sulfate is a ubiquitous, variably sulfated interactive glycosaminoglycan that consists of repeating disaccharides of glucuronic acid and glucosamine that are subject to a number of modifications (acetylation, de-acetylation, epimerization, sulfation). Variable heparan sulfate chain lengths and sequences within the heparan sulfate chains provide structural diversity generating interactive oligosaccharide binding motifs with a diverse range of extracellular ligands and cellular receptors providing instructional cues over cellular behaviour and tissue homeostasis through the regulation of essential physiological processes in development, health, and disease. heparan sulfate and heparan sulfate-PGs are integral components of the specialized glycocalyx surrounding cells. Heparan sulfate is the most heterogeneous glycosaminoglycan, in terms of its sequence and biosynthetic modifications making it a difficult molecule to fully characterize, multiple ligands also make an elucidation of heparan sulfate functional properties complicated. Spatio-temporal presentation of heparan sulfate sulfate groups is an important functional determinant in tissue development and in cellular control of wound healing and extracellular remodelling in pathological tissues. The regulatory properties of heparan sulfate are mediated via interactions with chemokines, chemokine receptors, growth factors and morphogens in cell proliferation, differentiation, development, tissue remodelling, wound healing, immune regulation, inflammation, and tumour development. A greater understanding of these HS interactive processes will improve therapeutic procedures and prognoses. Advances in glycosaminoglycan synthesis and sequencing, computational analytical carbohydrate algorithms and advanced software for the evaluation of molecular docking of heparan sulfate with its molecular partners are now available. These advanced analytic techniques and artificial intelligence offer predictive capability in the elucidation of heparan sulfate conformational effects on heparan sulfate-ligand interactions significantly aiding heparan sulfate therapeutics development.

|
Гепарансульфат (HS) - это древняя молекула гликокаликса, возникшая на ранних этапах эволюции метазоа [1,2]. В течение 500 миллионов лет она приобрела огромное молекулярное разнообразие [3], что позволило ей выполнять функции молекулярного распознавания, хранения и передачи информации, а также развила интерактивные и обучающие свойства, способные модулировать разнообразное клеточное поведение и физиологические процессы [4]. Молекулярное разнообразие HS является свойством его гликокода, т.е. информации, закодированной в структуре его гликозаминогликановых (GAG) цепей, которая способствует высокоспецифичному взаимодействию с широким спектром растворимых и структурных белков. Массивы гликанов на основе клеток и глико-геномное профилирование в настоящее время используются для определения структурных детерминант, действующих в глико-белковых взаимодействиях в живых клетках, чтобы лучше понять разнообразные функциональные свойства, передаваемые HS [5]. Сохранение HS на протяжении тысячелетий служит убедительным доказательством его критической роли во многих важных физиологических жизненных процессах, особенно когда для производства HS требуются значительные генетические инвестиции в ферменты биосинтеза HS. На самом простом структурном уровне HS состоит из повторяющегося дисахарида GlcNAc-GlcA, однако некоторые из этих остатков также подвергаются модификации путем сульфатирования, ацетилирования/деацетилирования в различных положениях вдоль цепи GAG HS и эпимеризации некоторых остатков GlcA в IdoA, что привносит значительный уровень структурной сложности, зарядовой гетерогенности и интерактивной способности (Рисунок 1a-c). HS является самым гетерогенным GAG и, после гепарина, самым высокозаряженным [6]. Как и гепарин, HS содержит переменные области высокого сульфатирования (S-домены), высокого ацетилирования (A-домены), но также имеет менее модифицированные деацетилированные области вдоль цепи HS [6] (рис. 1a). Ацетилированные области в гепарине менее обширны и встречаются в виде отдельных остатков, а не в виде ацетилированных блоков, однако в целом гепарин более обширно модифицирован, чем HS. Встречаются также низкосульфатированные формы HS. Анализ распределения биосинтетических ферментов HS в тканях коррелирует с разнообразием форм HS, обнаруженных в процессе развития и созревания тканей (рис. 2a). Сульфатация других GAG, таких как dermatan sulfate (DS) и keratan sulfate (KS), также неравномерна по цепи GAG, что также связано с интерактивной способностью этих GAG (рис. 2б). Разработка нескольких моноклональных антител (mAbs) к нативному хондроитинсульфату (CS), HS и кератансульфату (KS) с высоким и низким мотивом сульфатации также выявила специфическую локализацию мотивов сульфатации вдоль цепей CS, HS и KS. Специфическая иммунолокализация этих CS-мотивов в ряде тканей показывает, что они играют роль в морфогенезе тканей и связаны с популяциями стволовых клеток-предшественников и развитием тканей, а также с процессами восстановления тканей [7-15]. Сульфатные группы также являются заметными интерактивными характеристиками молекулы HS и располагаются на цепи HS в различных местах (рис. 1b,c). Сборка HS требует скоординированной деятельности более 20 биосинтетических ферментов [16]. Инвестиции клеток в такой сложный генетический биосинтетический механизм с сопутствующими метаболическими энергетическими потребностями показывают функциональную важность, передаваемую HS в основных жизненных процессах. Списки интерактома HS показывают, что HS связывает более 400 биологически активных белков [17]. В мышином исследовании острого заболевания поджелудочной железы было выявлено 786 HS-связывающих белков, что еще больше расширило интерактом HS [18,19,20]. Такие HS-связывающие белки включают разнообразные факторы роста, нейротрофины, цитокины, морфогены, хемокины, структурные белки внеклеточного матрикса (ECM), молекулы клеточной адгезии, протеазы и ингибиторы протеаз [21]. Справочное руководство Essentials of Glycobiology (https://www.ncbi.nlm.nih.gov/books/NBK579918/ accessed on 18 November 2022) является обширным справочным материалом для изучения гликобиологии.
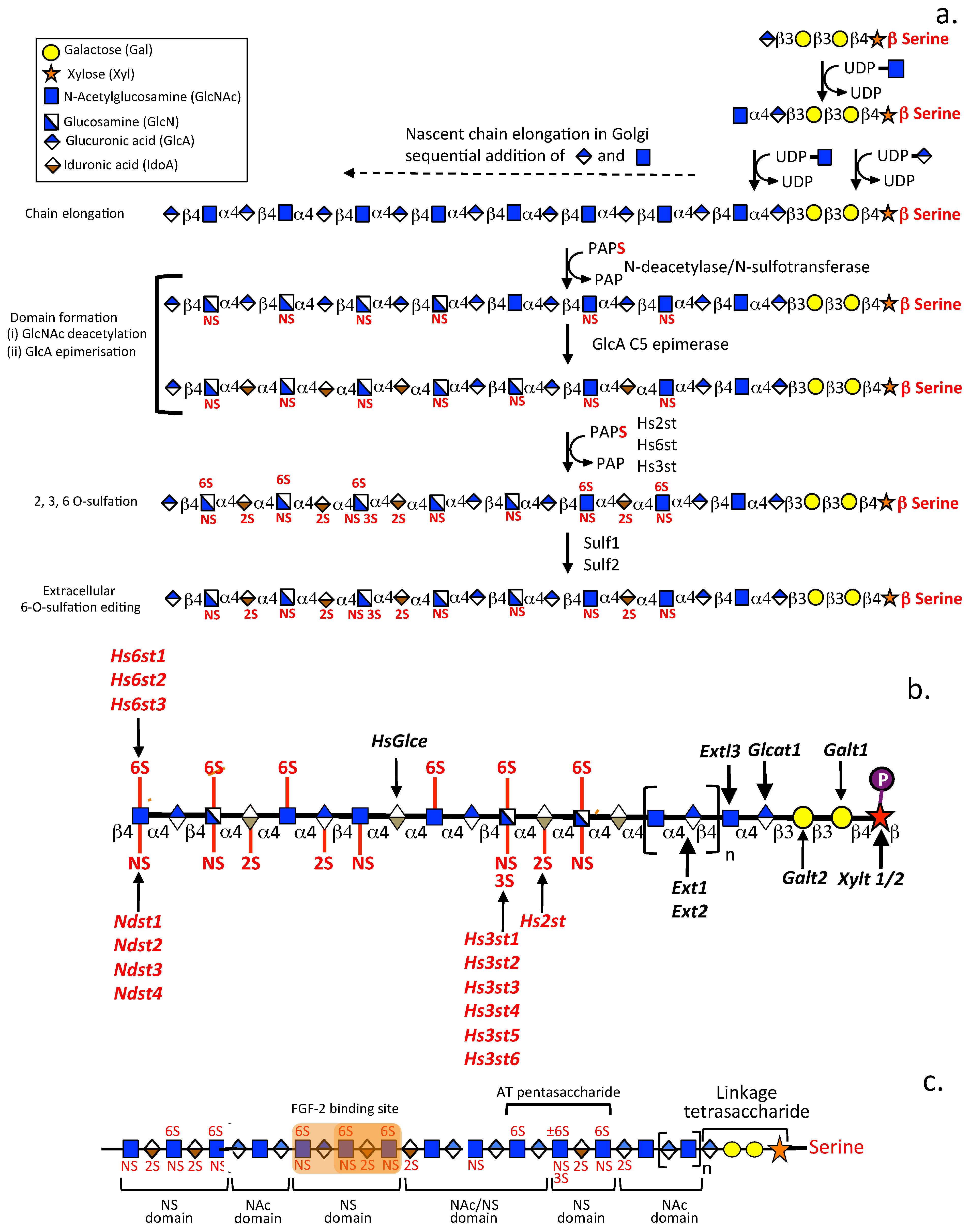 Figure 1. The multiple steps in the biosynthesis of putative heparin and HS chains (a), and the multiple enzymes that sulfate specific regions (b) and identification of specific HS sequences and sulfate presentations that provide FGF-2 and AT binding sites in a putative HS chain (c). Figure reprinted/adapted from Suflita M et al. [22] with the permission of Springer publishers. The GAG symbols used in this figure are those recommended by the symbol nomenclature for glycans (SNFG) discussion group [23].
 Figure 2. Variation in HS sulfation in a number of biological tissues and in GAG side chain structure. (a) Heatmap depicting the expression of twenty GAG biosynthetic enzymes demonstrating transcript expression levels for HS in 37 human tissues based on RNA sequencing (normalized transcripts per million, nTPM). Hierarchical clustering is shown based on the Pearson correlation. Data were obtained using the Genotype-Tissue Expression (GTEx) Program based on The Human Protein Atlas version 21.0 and Ensembl version 103.38. Figure modified from [24]. (b-e) Areas of high and low sulfation regions in putative GAG chains and specific regions in CS chains identified by a range of mAbs to CS sulfation motifs used in the assembly of CS chains. Figure 2a modified from Basu et al. [24] Reproduced under the Creative Commons Attribution CC-BY 4.0. with permission of The American Physiological Society.
Хотя производство специфических структур HS является важным моментом в предоставлении обучающей информации, регулирующей развитие тканей, другой момент заключается в том, что биосинтез HS является стохастическим процессом. Таким образом, хотя были определены отдельные функциональные мотивы HS, биосинтетические реакции HS обладают врожденной способностью производить различные структурные формы HS, которые имеют общие интерактивные свойства благодаря ионным взаимодействиям с участием их отрицательно заряженных сульфатных и карбоксилатных групп. Таким образом, хотя некоторые белок-лигандные взаимодействия могут включать строго определенные структуры HS, другие взаимодействия также происходят без видимого требования к различным сахаридным последовательностям для таких взаимодействий. Это поднимает вопрос о том, насколько существенным является контроль за производством этих специфических сульфатирующих мотивов, когда происходят и более распространенные взаимодействия HS [25]. Сродство и специфичность связывания определяются распределением заряда сульфатных и карбоксилатных групп и тем, как они представлены в плоской ориентации [26]. Сульфатные группы являются громоздкими образованиями, и правильное трехмерное пространственное представление в некоторых случаях может быть важным требованием для эффективного взаимодействия с рецептором. Эпимеризация GlcA в IdoA привносит большую гибкость в основу HS, что может позволить более обширное пространственное исследование сульфатных групп в различных ориентациях с интерактивными партнерами. Однако некоторые взаимодействия HS могут быть неспецифическими и ионными по своей природе. Таким образом, плотность заряда в тканях и высокоспецифичные взаимодействия с участием редких структур HS должны учитываться при контроле развития тканей.
Разнообразие боковых цепей GAG, прикрепленных к основным белкам PG на клеточной поверхности, обуславливает их клеточно-инструктивные и интерактивные свойства в ECM, позволяя взаимодействовать с факторами роста, хемокинами, морфогенами, протеазами и ингибирующими протеазы белками, а также облегчая реакцию клеток на сигналы, доставляемые ECM [24,27]. Сигнальный путь Wnt играет важную роль в развитии эмбриональных тканей и гомеостазе тканей взрослого организма. Белки Wnt - это секретируемые, модифицированные липидами гликопротеины, которые формируют градиенты морфогенов, направляющие клеточное поведение для получения этих эффектов [28]. Однако белки Wnt гидрофобны и плохо растворимы в водной среде, гепарансульфатные протеогликаны (HS-PGs) необходимы для надлежащей активности белков Wnt, поддерживая их растворимость, они также транспортируют белки Wnt, помогая формировать градиенты Wnt в тканях, которые определяют процессы развития [29]. Wnt связывается с доменом LDLR II perlecan, и это действует как средство доставки Wnt в процессе развития тканей [29,30]. HS-PGs также являются компонентами перицеллюлярных и базальных мембран ECM и играют роль в стабилизации синапсов в нейронных тканях, что важно для синаптической пластичности и взаимодействия нейронов в нейронных сетях центральной и периферической нервной системы (ЦНС и ПНС, соответственно) [24,27]. HS-PGs регулируют развитие тканей [31-33] и регулируют физиологические процессы в зрелых тканях [34,35]. Разнообразие структуры боковых цепей GAG в HS-PG придает клеткам и органам специфические функциональные свойства, а временные и пространственные изменения в структуре HS регулируют развитие тканей, опухолевый генез [36] и воспаление [37]. Разработка паттерн-специфических антител к HS [12,38] позволила продемонстрировать клеточное и тканевое распределение HS-PGs во время развития тканей и специфические мотивы сульфатации GAG. Секвенирование следующего поколения и самые современные аналитические инструменты теперь позволяют детально профилировать пространственно-временной характер экспрессии GAG и ферментов биосинтеза GAG в тканях [39,40]. На рисунке 2 тепловая карта, изображающая тканеспецифическую экспрессию генов ферментов биосинтеза HS в 37 тканях человека, полученных из Атласа белков человека [41,42], демонстрирует широкое распространение HS-PGs в этих тканях со специфическими модификациями HS в определенных тканях. На рисунке 2 также показана значительная вариабельность модификаций, происходящих в HS в этих тканях.
По оценкам, гены, кодирующие белки ECM, составляют 1,3-1,5% генома млекопитающих (http://www.pantherdb.org/genes/ accessed 3 December 2022) [43]. Транскриптомная идентификация белков ECM, основанная на вычислительном скрининге более 60 000 полноразмерных кДНК мыши на наличие секретируемых белков с последующим функциональным анализом in vitro, недавно выявила несколько ранее не идентифицированных HS-PG. Семь из них оказались PGs, ассоциированными с базальной мембраной [43]. Исследование сайтов специфического гликозилирования всех известных PGs с помощью масс-спектрометрической (MS) и гликопротеомной методологии также выявило несколько новых CS- и HS-PGs [44]. Из 300-400 генов ECM, которые, по оценкам, присутствуют в геномах млекопитающих, почти треть из них еще не идентифицирована [43]. Таким образом, в будущем ожидается дальнейшее увеличение сложности функциональных PGs. Pikachurin и Eyes shut - два примера HS-PGs, которые были идентифицированы относительно недавно, а характеристика их свойств еще больше иллюстрирует сложность клеточных регуляторных свойств, передаваемых HS-PGs в конкретных тканевых контекстах.
2. The Cell Instructive Properties of GAGs
Как уже говорилось, GAG обладают молекулярным распознаванием и клеточно-инструктивными свойствами, участвующими в развитии тканей, ремоделировании соединительной ткани и восстановлении тканей [45,46]. Гликаны и GAGs играют ключевую роль в функционировании и судьбе нейронных клеток [47]. KS обладает нейрорегуляторными свойствами [7,15,48], KS также обладает клеточно-директивными свойствами в миграции клеток нервного гребня и развитии хорды, нервной трубки и нейронных сетей [49], но обычно ему приписывают несущие свойства как компоненту аггрекана - основного KS-PGs в тканях [50,51]. CS и родственный ему GAG дерматансульфат (DS) также обладают клеточно-инструктивными свойствами [52-55]. Эти GAG дополняют биоразнообразные свойства HS.
2.1. GAG Interactions with Stem Cells
CS и HS GAGs взаимодействуют со стволовыми клетками в их среде ниш, способствуя их выходу из покоящихся рециркулирующих популяций и позволяя им достичь плюрипотентности и приобрести фенотип мигрирующих клеток предшественников, которые могут участвовать в процессах развития и восстановления тканей [52-59]. HS-PG perlecan является важным компонентом ниш стволовых клеток, его HS-цепи способствуют дифференцировке стволовых клеток и миграции линий предшественников стволовых клеток, которые участвуют в развитии ряда тканей [60-63]. В суставном хряще поверхностная зона ткани содержит популяцию стволовых клеток и клеток предшественников, которые стимулируют и поддерживают рост ткани [64-68]. Субпопуляции клеток в этой зоне ассоциированы с уникальными эпитопами мотивов сульфатации CS [69] и новыми внеклеточными сульфатазами, Sulf-1 и Sulf-2 [70], которые могут служить для регулирования их статуса дифференцировки через взаимодействие с матричными факторами роста (например, TGF-β), поддерживая тем самым рост расположенной рядом ткани [71].
Высоко сульфатированная гликоформа HS необходима для перехода мезенхимных эмбриональных стволовых клеток (mESCs) в специфическое терминально дифференцированное состояние, которое направляет их развитие в определенную клеточную линию [72,73]. При достижении плюрипотентности mESCs сначала синтезируют низкосульфатную гликоформу HS, которая управляет процессом дифференцировки [59,74], а затем в этом процессе участвует высокосульфатная HS [70,71]. В этом процессе участвуют N-сульфотрансферазы на ранних стадиях и 6-O и 3-O-сульфотрансферазы на более поздних, в результате чего образуются мотивы сульфатации HS, которые тонко регулируют переход к определенной клеточной линии [74]. HS-PGs регулируют стволовые клетки в нишах в развивающихся тканях, связывая факторы роста и поддерживая жизнеспособность стволовых клеток [60-63,75].
2.2. CS Sulfation Motifs Expressed by Stem Cells
Мотивы сульфатации CS 3B3[-], 7D4 и 4C3 экспрессируются стволовыми клетками-предшественниками, участвующими в развитии суставного хряща, и являются маркерами морфогенеза ткани [60-63]. Цепи HS перлекана играют важную роль в секвестрации факторов роста в нишах стволовых клеток, регулируя таким образом пролиферацию и жизнеспособность стволовых клеток и достижение плюрипотентности, т.е. образование мигрирующих популяций стволовых клеток, которые стимулируют развитие тканей и способствуют их восстановлению [30,76,77]. Перлекан является гибридным CS/HS-PG во многих тканях, а в фетальных тканях человека было показано, что он несет мотив сульфатации CS 7D4, который также был обнаружен в тканях, подвергающихся морфогенетической трансформации [78].
2.3. The Distribution of Sulfate Groups along GAG Chains Is Not Uniform
Многочисленные исследования продемонстрировали неравномерное распределение сульфатных групп вдоль цепей GAG, как показано на рисунке 1. Сульфатные группы также неравномерно распределены по всем GAG, кроме НА, который является единственным несульфатированным GAG (рис. 2). Разработка ряда mAbs к специфическим сульфатным мотивам CS облегчила картирование этих мотивов вдоль цепей CS и DS [13,79-81]. Картирование доменов CS/DS GAG также позволило структурно охарактеризовать PGs [81-83]. Исследование HS Interactome выявило большое количество интерактивных лигандов HS [17]. В тканях происходит широкий спектр модификаций HS (рис. 2a). Характер сульфатации CS и HS изменяется при раке (рис. 3a) и объясняется мутациями в ферментах, модифицирующих HS и CS, при ряде заболеваний опорно-двигательного аппарата (рис. 3b).
 Figure 3. Variation in the sulfation patterns of CS and HS in cancer (a) and mutations in HS sulfation enzymes associated with several musculoskeletal disorders (b). Data modified from Basu et al. [24] Reproduced under the Creative Commons Attribution CC-BY 4.0. with permission of The American Physiological Society. 2.4. The Glyco-Code of HS and the Enigmatic 3-O Sulfated HS Sulfation Motif
HS имеет линейную спиралевидную форму с уникальными небольшими "перегибами", где D-глюкуроновая кислота эпимеризуется в L-идуроновую кислоту благодаря большей гибкости гликозидных связей вокруг остатков IdoA, что обеспечивает фокальные области в цепи HS, которые могут принимать более компактную конформацию, содержащую мотивы сульфатации 3-O [84]. Сульфатирование 3-O в цепях HS в целом встречается редко, однако в тканях присутствует множество изоформ HS3ST с различной субстратной специфичностью, что делает эту функциональную структурную модификацию HS загадочной. HS является хранилищем самых разнообразных "кодов сульфатации" среди всех GAG [84]. Это дает HS возможность избирательно распознавать и взаимодействовать с определенными белками [85-87]. Разнообразие белков, с которыми может взаимодействовать HS, отражено в белках, перечисленных в базах данных HS и GAG Interactome. Код сульфатации HS не биосинтезируется классическим образом, а возникает в результате действия контролируемой тканевым контекстом пространственно-временной экспрессии суперсемейства N- или O-сульфотрансфераз [88,89]. Семь изоформ 3-O-сульфотрансфераз (HS3ST-1, -2, -3A, -3B, 4, -5 и -6) вводят мотивы сульфатирования 3-O в цепи HS на заключительном этапе биосинтеза HS и, как правило, редко встречаются в большинстве тканей [90]. Однако это не всегда так, поскольку HS фолликулярной жидкости человека содержит большое количество 3-O-сульфатирующих мотивов [91]. Фолликулярная жидкость играет важную роль в оплодотворении яйцеклетки и ее питании в раннем эмбриональном развитии. Семь изоформ H3ST демонстрируют значительные различия в субстратной специфичности. HS3ST-1 преимущественно генерирует АТ-связывающую последовательность HS, тогда как HS3ST-3B генерирует мотивы связывания для гликопротеина D HSV-1 [90]. Другие изоформы HS3ST демонстрируют совпадение в генерации АТ или гликопротеина D-связывающих мотивов, однако были выявлены четкие различия в специфичности между семью изоформами HS3ST [92-94]. Был идентифицирован ряд белков, которые преимущественно связываются с 3-O-сульфатными мотивами в HS, включая AT [95], FGFR [96], гликопротеин D [97], циклофилин B [98], нейропилин-1 [99], HC II [62,63], гликопротеин tau [87] и гликопротеин шипа SARS-CoV-2 [68]. Последовательности сульфатации HS, фланкирующие область сульфатации 3-O, обеспечивают специфичность для этих интерактивных последовательностей 3-O HS. Таким образом, мотивы 3-O, 2-O и 6-O сульфатации в HS оснащают его разнообразной динамической системой распознавания для точной идентификации биологически активных молекул клеточного регулирования с помощью " кода сульфации" [100,101]. Это отражается в ко-рецепторных функциях HS-PGs на поверхности клеток [68] и разнообразных ролях HS-PGs в стабилизации и функциональных свойствах глазных тканей [102] и нейронной активности в ЦНС/ПНС [103]. Взаимодействие HS-PG с гликопротеинами прикрепления к поверхности нервных клеток обеспечивает синаптическую стабилизацию [104-106] и сигнальные свойства нейронных сетей [106]. Специфический вклад синаптических HS-PG нейрексина в стабилизацию и функционирование нейронов [104]. also show the important tissue organizational functional properties that HS-PGs convey to specific tissues [24,44].
3. Analysis of Glycan Structure and Function
Огромное структурное разнообразие замещения гликанов в белках создает значительные технические проблемы, которые затрудняют выяснение конкретных функциональных ролей этих разнообразных гликозилированных паттернов [112]. Справочное руководство Essentials of Glycobiology является чрезвычайно полезным справочным источником, помогающим в решении любых технических вопросов (https://www.ncbi.nlm.nih.gov/books/NBK579918/ accessed 8 November 2022). Значительные достижения в области количественной транскриптомики, протеомики и редактирования генов на основе нуклеаз открыли новые возможности для анализа функциональной роли гликозилирования путем направленного воздействия на экспрессию биосинтетических ферментов, ответственных за эти модификации белков. Кроме того, разработка передового программного обеспечения для in silico анализа взаимодействий гликан-белок улучшает наше понимание функциональных сложностей гликопротеома [113]. Гликановые микрочипы также оказались чрезвычайно полезными инструментами в расшифровке гликан-белковых взаимодействий [114-116]. Методы искусственного интеллекта (ИИ) также в настоящее время используются в исследованиях структуры-функции гликанов и в разработке лекарств и хорошо подходят для анализа больших массивов данных [117-120]. Для помощи в таких исследованиях существует ряд баз данных и инструментов по гликомике [118-122]. MatrixDB - особенно полезная база данных, хорошо снабженная текущей информацией и услугами по гликомике [118,119]. Киотская энциклопедия генов и геномов (KEGG) [123-125] охватывает биоинформатику и анализ данных в области геномики, метагеномики, метаболомики и омических исследований, связанных с молекулярным моделированием, имитационной системной биологией и трансляционными исследованиями в области дизайна лекарств и разработки приложений. KEGG предоставляет графические инструменты Java для просмотра геномов и сравнения геномных карт, а также вычислительного анализа последовательности и графических данных. KEGG обновляется ежедневно и доступна на сайте GLYCAN (http://www.genome.jp/kegg/glycan/ accessed 9 November 2022). База данных углеводных структур также была добавлена к KEGG [126]. Она включает информацию о путях, связанных с гликанами, и карту составных структур, иллюстрирующую вариации углеводных структур в организмах.
Ресурс Gene Ontology (GO), предоставляемый Gene Ontology Consortium, является самым обширным в мире источником информации о функции генов и продуктов генов (http://geneontology.org accessed 18 November 2022) [127,128].
3.1. Advanced Analytical Techniques for the Examination of GAG Structure and Function and the Identification of Their Molecular Targets
3.1.1. Neutron Scattering GAG Analysis
HS динамически связывают многие сигнальные белки, такие как факторы роста, хемокины и цитокины, и регулируют их активность. На эти взаимодействия с белками влияют геометрия, гибкость и жесткость цепей HS и конформации их присоединенных сульфатных групп. Понимание этих динамических взаимодействий на молекулярном уровне обеспечивает фундаментальное понимание этих клеточных взаимодействий HS и является информативным для разработки соединений, которые могут модулировать эти взаимодействия. Рассеяние нейтронов является мощным методом для изучения сверхбыстрых молекулярных взаимодействий биологических макромолекул, таких как GAG, а мотивы сульфатации являются важными интерактивными детерминантами, влияющими на такие взаимодействия. Нейтронная спектроскопия позволяет оценить динамические взаимодействия, опосредованные GAG, на уровне от пикосекунд (пс) до наносекунд (нс) [129] и нашла применение в оценке взаимодействия папаиноподобной протеазы SARS-CoV-2 с перспективными терапевтическими антивирусными агентами [130].
3.1.2. Electron Detachment Dissociation Analysis of GAGs
Масс-спектрометрия (MS) и тандемная масс-спектрометрия являются полезными методами структурного анализа GAG, которые широко используются. Для фрагментации GAG были разработаны методы диссоциации, вызванной столкновениями (CID), которые приводят к гликозидным расщеплениям, но не дают широкого спектра структурно информативных данных о кольцевых структурах GAG. Поэтому были разработаны методы диссоциации с переносом заряда (CTD) и диссоциации с отщеплением электронов (EDD) для фрагментации GAG таким образом, чтобы облегчить анализ газофазных ионов GAG для получения более полной структурной информации [131]. CTD может использоваться с масс-спектрометрами с ионной ловушкой для изучения структурных деталей сайтов модификации HS, т.к. EDD и CTD дают более полную структурную информацию, чем CID [132].
3.1.3. Ion Mobility Mass Spectrometry Methods for Analysis of HS Structure and Sulphation
Тандемная масс-спектрометрия с использованием диссоциации, вызванной столкновениями, или фрагментацией на основе электронов является хорошо зарекомендовавшим себя методом анализа GAG, но страдает от неполного охвата аналитических фрагментов GAG, которые они генерируют. Спектрометрия ионной подвижности и ионная спектроскопия с IR и UV фотофрагментацией обеспечивают большую гибкость и больший охват молекулярной структуры [133]. Полный охват всех структурных видов важен, так как вариабельные сульфатированные виды ОН являются основными регуляторами биологических процессов. Например, 3-О-сульфатированный HS/heparin обладает важнейшей антикоагулянтной активностью, однако терапевтическое применение сдерживается отсутствием достаточно дискриминационных инструментов для полной расшифровки структурно-функциональных связей HS. Использование синтетических 3-O-сульфатированных стандартов, комплексное профилирование дисахаридов HS и клеточная инженерия позволили устранить этот недостаток, продемонстрировав ранее не оцененные различия в профилях 3-O-сульфатирования в клинических гепаринах и HS3ST, вызванные структурными различиями в HS клеточной поверхности [134]. Это облегчило корреляцию функциональных различий в антикоагулянтной активности и побочных эффектов тромбоцитопении, вызванных PF4, в терапевтических гепаринах. Клетки, экспрессирующие изофермент HS3ST4, генерируют HS с мощной антикоагулянтной активностью, но слабым связыванием PF4, это позволяет понять структуру-функцию 3-O-сульфата в новом поколении адаптированных гепаринов на основе клеток [134]. Выяснение биоразнообразия HS/heparin основы является важной задачей. Криогенная инфракрасная спектроскопия отобранных по массе ионов позволяет различать изомерные тетрасахариды HS, отличающиеся только конфигурацией строительных блоков гексуроновой кислоты [135]. Инфракрасный спектральный анализ высокого разрешения систематического набора синтетических стереоизомеров HS выявил их характерные спектральные особенности, продемонстрировав потенциал метода для секвенирования HS и структурно родственных биомолекул [135].
3.1.4. X-ray Crystallography
Лейкоцитарный общий антиген-связанный (LAR) белок является тирозинфосфатазой рецептора типа IIa (RPTP), который играет роль в передаче сигнала и регуляции аксонального роста и регенерации. HS и CS регулируют сигнализацию LAR, но приводят к разным результатам регуляции. Рентгеновская кристаллография дает важное представление о взаимодействии RPTP типа IIa с CS и HS. Более глубокое понимание таких взаимодействий может помочь в разработке новых терапевтических соединений для регулирования восстановления нервов [136].
3.1.5. In Silico Molecular Docking Simulations
Разработка современного компьютерного программного обеспечения облегчила молекулярное моделирование стыковочных взаимодействий между GAGами и белковыми интерактивными структурами. Это было использовано для изучения взаимодействия между белком Spike SARS-CoV-2 и HS клеточной поверхности на клетках потенциального хозяина для лучшего понимания инфекционного процесса COVID-19 [137]. Подобные взаимодействия между круговым (Robo) рецептором Slit [138], HS и белками нервных проводников Slit также были оценены с помощью молекулярного докинга [139]. Трансмембранные рецепторы Robo взаимодействуют с белками наведения нервов Slit для регуляции роста аксонов во время нейронального развития, взаимодействия Robo-Slit модулируются HS. Исследования молекулярного докинга олигосахаридов гепарина с гепарин-связывающим доменом Hep-II фибронектина продемонстрировали важность конформации сульфатных групп в этом интерактивном процессе [140]. Участки связывания heparin/HS на интегрине αvβ3 также были картированы с помощью методологии молекулярного докинга [141]. Молекулярное моделирование взаимодействия HS с факторами роста предоставило бесценную информацию о том, как оптимизировать активность клеточных факторов роста [142].
3.1.6. Application of Artificial Intelligence (AI) in GAG Analysis
Методология ИИ была успешно применена к анализу структуры GAG [143]. Алгоритмы машинного обучения способны выполнять высокопроизводительный анализ распознавания образов на огромных массивах данных по гликомике, извлекая значимую информацию из сложных или зашумленных данных как для описательных, так и для прогностических целей и предлагая значительную диагностическую, прогностическую и терапевтическую ценность [144]. ИИ и глубокое машинное обучение были применены для анализа больших наборов гликомических данных при разработке лекарств [145-148]. Эта методология также использовалась для анализа моделей гликозилирования и стереоселективности углеводов [149,150] и для прогнозирования вклада атомистического окружения в селективность гликанов. ИИ показывает значительные перспективы в анализе баз данных гликомиксов и предлагает значительный потенциал в улучшении нашего понимания взаимодействий лигандов гликанов, которые могут иметь терапевтическое применение [144]. Все большее количество гликомических данных генерируется с помощью передовых технологий гликоанализа. В настоящее время доступно множество баз данных по гликомике и инструментов для манипулирования гликомикой. ИИ предоставляет мощный аналитический инструмент для анализа больших массивов данных [151]. Появляются методы ИИ, интегрированные с программным обеспечением для прогнозирования в подходы гликоинформатики, которые обеспечивают дальнейшее улучшение анализа гликомики [117].
3.1.7. Analysis of GAG 3D Structure
Огромное структурное разнообразие GAG и PGs затрудняет анализ GAG с помощью стандартных методологий. Передовое вычислительное программное обеспечение, применяемое в молекулярном моделировании, динамическом моделировании докинга и измерении кинетики связывания, оказывается полезным для анализа трехмерных взаимодействий GAG с их предполагаемыми молекулярными мишенями [121]. Значительные успехи были достигнуты в интеграции данных, полученных учеными-вычислителями и гликобиологами, для улучшения нашего понимания значительных сложностей познавательного мира гликанов и их клеточных взаимодействий [121]. GAG представляют собой сложные конформационно разнообразные молекулы. GAG-DB - это курируемая база данных трехмерных характеристик CS, DS, HS, HA и KS и их олигосахаридов в комплексе с белками [122]. В ней представлены данные рентгеновской дифрактометрии, спектроскопии NMR растворов и данные рассеяния, связанные с молекулярным моделированием. Эта база данных разработана с использованием навигационных инструментов для запроса базы данных, сопряженных с идентификаторами Protein Data Bank (PDB), UniProtKB и GlyTouCan (универсальный репозиторий гликанов). GAG-DB предоставляет подробную информацию о GAGs и белковых интерактивных лигандах с помощью нескольких приложений открытого доступа и находится в свободном доступе [121], как и интерфейсное приложение GAG Builder [122]. GLYCAM-Web GAG Builder, (www.glycam.org/gag accessed 18 November 2022) - это дополнительный веб-инструмент, разработанный для неспециалистов для быстрого и простого прогнозирования трехмерных структурных моделей GAG [152]. Пользователю предоставляются файлы визуализации координат, в которых встречные ионы и вода могут быть добавлены по желанию. Heparin/HS, CS, DS, KS, и HA все они проанализированы в отношении паттерна сульфатирования в случае изменения содержания.
3.1.8. Advanced High Precision Quantum Cellular Imaging Methodology for the Identification and Quantitation of Single Molecule Contributions to Cellular Phenotypes
Значительные успехи в визуализации клеток на субнанометровом уровне для анализа отдельных молекул с использованием методов квантовой визуализации [153] обеспечили важные достижения в оценке клеточных изменений в процессах заболеваний и роли конкретных белков [154,155]. Окрашивание пептидов отдельных молекул полупроводниковыми нанозондами с квантовыми точками [156,157] позволило изучить специфический вклад отдельных молекул в клеточные фенотипы [155,158,159]. Квантовые точки - это флуоресцентные наночастицы с узкополосным, настраиваемым по размеру и длительным профилем излучения [160], которые оказались полезными для молекулярной визуализации в медицине рака [161]. Эта методология также была применена для визуализации живых клеток и может быть автоматизирована [162,163]. Таким образом, она может оказаться полезной для пространственно-временной оценки модификаций HS [164], происходящих во время морфогенеза и восстановления тканей [165,166]. Нанозонды на основе квантовых точек, разработанные для AT и FGF-2, были использованы для картирования распределения на поверхности клеток редкого мотива сульфатации 3-O HS [167]. Интеграция глубокого машинного обучения и беспристрастных автоматизированных процедур скрининга высокого содержания в роботизированных клеточных культурах с высокой пропускной способностью была применена для идентификации сложных сигнатур заболеваний [168]. Высокая точность, обеспечиваемая вышеупомянутыми методологиями, может помочь расшифровать молекулярные сложности, связанные с пространственно-временными и конформационными модификациями HS, которые, как известно, происходят в процессе морфогенеза тканей и ремоделирования ECM при заболеваниях [169]. Расшифровка сложных гликозилированных сигнатур ECM будет иметь неоценимое значение для открытия новых терапевтических средств и биомаркеров в диагностике и лечении заболеваний [151,170-172]. Были определены интерактивные последовательности HS с Wnt, липопротеиновой липазой, AT, FGF-2 и FGFR (рис. 4). В структурно-функциональном вычислительном исследовании было изучено, как редкое представление сульфатирования O-3 HS способствует специфичности связывания белка [173].
3.1.9. GAGome Biomarkers of Disease
Хотя GAGs и играют определенную роль в нормальной физиологии и при заболеваниях, понимание биологических функций конкретных структур GAGs затруднено из-за их большой структурной гетерогенности. Профили GAG мочи и плазмы (GAGomes) [174], тем не менее, оказались полезными в качестве биомаркеров метаболизма опухоли для раннего выявления рака [175].
3.1.10. Transcriptomics and Its Application in the Analysis of Glycoproteomics
Гликозилирование является чрезвычайно разнообразной посттрансляционной эукариотической клеточно-опосредованной модификацией, которая происходит в белках и включает сложные метаболические и гликозилирующие пути, которые обеспечивают протеомное усиление биоразнообразия PGs [113]. Появляются подходы in silico с возможностью прогнозирования при анализе результатов клеточного гликозилирования, которые революционизируют карты гликозилирования и генетические подходы, направленные на модификацию функциональных свойств гликопротеинов [112,176,177]. Транскриптомика, генетический скрининг и инженерия паттернов гликозилирования на одноклеточном уровне значительно продвигают миметику гликанов и разработку терапевтических гликопротеомных модуляторов клеточного поведения, которые применяются для лечения заболеваний человека [178-181]. Одноклеточная транскриптомика и обеспечиваемая ею повышенная точность революционизируют анализ вариаций в структуре HS-PGs и их вклада в пространственно-временные процессы развития. Транскриптомный анализ тканей яичников также показал, что биосинтез HS/heparin и CS/DS GAG происходит по двум путям, причем биосинтез HS- и CS-PGs регулируется по-разному. Уровни HS-PGs и CS-PGs значительно повышаются при фолликулогенезе. Овариальные GAGs способствуют гонадотропин-индуцированному развитию фолликулов у мыши, действуя через стимуляцию ангиогенеза, что согласуется с ролью, отведенной perlecan в развитии ряда этих тканей [182,183]. Транскриптомика также использовалась для изучения пространственно-временного разнообразия и регуляции биосинтеза GAG в нормальных гомеостатических тканях и в тканях, подверженных процессам заболевания [24].
3.1.11. Antibodies That Detect HS Sulfation Motifs
Антитела к сульфатирующим мотивам HS и KS использовались для определения топографического распределения этих соединений в тканях, подвергающихся морфогенезу [13,184,185], связанных с поведением клеток [186, 187] и взаимосвязи структуры и функции [188-191], а также биоактивность HS и CS в нормальных и патологических тканях [192-200] и модификации HS и CS, происходящие в тканях [13,24,201-204]. Гликановые микрочипы предоставляют важную информацию, определяющую специфичность этих антител. Были разработаны методы с использованием микрочипов GAG и вычислительного моделирования для анализа взаимодействий GAG и белков [205].
3.1.12. Genome-Wide Analysis of Highly Specific CRISPR/Cas9 Gene Editing Sites in Musculoskeletal Disease and GAG and PG Systems
Технология кластеризованных регулярно перемежающихся коротких палиндромных повторов (CRISPR) с использованием РНК-направляемой нуклеазы Cas9 быстро заняла доминирующее положение в области геномной инженерии как уникальный и мощный инструмент редактирования генов. Технология редактирования генов CRISPR/Cas9 все чаще используется для вмешательства в биосинтез GAG в модельных системах, чтобы лучше понять роль GAG в конкретных заболеваниях опорно-двигательного аппарата. CRISPR/Cas9 использовалась для создания стабильных клеточных линий хондроцитов с дефицитом аггрекана [206] и применялась в исследованиях мукополисахаридоза I для изучения влияния GAG на костно-мышечные ткани при этом заболевании [207]. CRISPR/Cas9, несомненно, найдет более широкое применение в исследованиях, направленных на понимание того, как GAG функционируют в костно-мышечных тканях в состоянии здоровья и болезни. Транскриптомика широко применяется для изучения пространственно-временных изменений GAG в больных тканях, для идентификации новых HS-PGs в базальной мембране и для оценки того, как профили PGs влияют на архитектуру ткани при болезни [208,209].
 Figure 4. Identification of specific ligand interactive glyco-sequences in HS. The structures shown are those proposed by Gao et al. [188] (a) Cummings [210] (b,c) and Gomes et al. [211]; Wang et al. [212] (d). The orange highlighted area in HS in (d) depicts FGF-2 and FGF-R binding sites however flanking structures also contribute to specificity in a functional tetra or pentasaccharide arrangement as determined by NMR spectroscopy [213]. 4. HS-Proteoglycans
4.1. HS-PGs Are Broadly Distributed ECM, Cell Surface, Intracellular, and Nuclear Components (Table 1)
HS-PGs являются многофункциональными молекулами клеточной регуляции, которые широко распространены в тканях и встречаются в виде PGs клеточной, внутриклеточных мембран и ECM (Таблица 1). Они локализованы вокруг ниш мезенхимных стволовых клеток и играют роль в дифференцировке стволовых клеток и производстве определенных линий клеток предшественников, играющих роль в развитии тканей, ремоделировании ECM и восстановлении тканей [60-63]. Оценка категорий биологических процессов GO (Gene Ontology) и путей KEGG (Kyoto Encyclopedia of Genes and Genomes), обогащенных членами интерактома heparin/HS, демонстрирует разнообразные интерактивные свойства и биологические процессы, в которые вовлечены HS-PG [17,214].
Table 1. Extracellular, Cell membrane, Intracellular and Nuclear HS-Proteoglycans. 4.2. Betaglycan
Бетагликан - многофункциональный трансмембранный HS/CS ко-рецептор суперсемейства TGF-β с массой 250-280 кДа [239,260], он образует функциональный гомодимер на поверхности клетки, который содержит сайты связывания inhibin, FGF-2, Wnt и TGF-β [240,261-268]. Цепи HS бетагликана связывают FGF-2, но не являются обязательными для связывания лигандов TGF-β Wnt также связывает специфические HS-последовательности независимо от TGF-β связывающей активности бетагликана [269]. HS ингибирует сигнализацию Wnt, а CS способствует сигнализации Wnt [269,270]. N- и O-связанные олигосахариды бетагликана также влияют на лиганд-связывающую активность бетагликана, модулируя его опосредованные факторами роста, сосудистые и миграционные свойства раковых клеток [271] и взаимодействие с ингибином А и В [272]. Фрагменты бетагликана, высвобождаемые с поверхности клеток plasmin и MMPs , действуют как циркулирующие антагонисты активности бетагликана в клетках. В мозге человека наблюдалась совместная локализация субъединиц белков ингибина/активина и бетагликана [273,274]. FGF-2, переносимый бетагликаном, стимулирует пролиферацию и дифференцировку нейронов [275]. TGF-β усиливает взрослый нейрогенез в субвентрикулярной зоне и обладает противовоспалительными свойствами во взрослом мозге [276,277]. Активин и ингибин регулируют секрецию фолликулостимулирующего гормона (FSH), влияя на дифференцировку, пролиферацию и клеточные функции многих типов клеток [278]. Рецепторы активина высоко экспрессируются клетками нейронов, и их уровень повышается после травмы мозга, гипоксического/ишемического повреждения, механического раздражения или химического повреждения [279]. FGF-2 является нейрогенным и обладает нейропротекторными антиапоптотическими свойствами, связанными с стимулированием вызванного поражением мозга повышения активности активина А [279-281].
4.3. CD47
CD47 - это HS/CS гибридный трансмембранный PG многофункциональный рецептор гематопоэтических клеток. Замена HS на CD47 ингибирует передачу сигналов рецептора Т-клеток тромбоспондином-1 (TSP-1). CD47 является рецептором для TSP-1 и регулирует клеточную миграцию, пролиферацию и выживание сосудистых клеток при врожденной и адаптивной иммунной регуляции [282,283]. TSP-1 действует через CD47 для ингибирования сигнализации оксида азота (NO) в сосудистой системе и поддерживает артериальное давление, ограничивая активацию эндотелиальной синтазы оксида азота (eNOS) и эндотелий-зависимую вазорелаксацию [284]. CD47 является лигандом для SIRPα (сигнальный регуляторный белок α), с тирозиновыми мотивами активации или CD172a [285-287]. Он был назван контрольным пунктом врожденного иммунитета, посылающим макрофагам сигнал "не ешь меня" [288], позволяющий опухолевым клеткам избежать обнаружения и уничтожения. Блокирование взаимодействия CD47-SIRP с помощью гуманизированных антител к CD47 (Hu5F9-G4) дало многообещающие доклинические результаты при ряде злокачественных опухолей человека, включая детские опухоли мозга: медуллобластому, атипичные тератоидные рабдоидные опухоли, примитивную нейроэктодермальную опухоль, детскую глиобластому и диффузную intrinsic pontine глиому [289]. Целенаправленное воздействуя на иммунологический контрольный пункт CD47-SIRP, можно затормозить развитие глиобластомы и повысить активность фагоцитарных, дендритных и Т-лимфоцитов, способствующих уничтожению опухолевых клеток в рамках врожденного и адаптивного иммунитета [290-293]. Целенаправленные взаимодействия на TSP-1:CD47 является многообещающим антитромботическим подходом. Инженерный циклический пептид CD47 TAX2 (CEVSQLLKGDAC) селективно ингибирует взаимодействие TSP-1:CD47, снижая агрегацию тромбоцитов и взаимодействие тромбоцитов с коллагеном в условиях артериального сдвига и не ассоциируясь с повышенным риском кровотечения. TAX2 является инновационным антитромботическим препаратом и новым антагонистом взаимодействия TSP-1:CD47 [294].
4.4. Neuropilin
Нейропилин-1 (NRP-1) - это многодоменовый мембранный белок клеточной поверхности, играющий роль в ангиогенезе и развитии нейронов [295]. NRP-1 содержит цитоплазматический домен PDZ с ограниченной способностью передавать сигналы через клеточную мембрану и полагается на сотрудничество с другими клеточными рецепторами для регулирования клеточной сигнализации [296,297]. NRP-1 сбрасывается с поверхности клеток в виде растворимой изоформы, которая взаимодействует с другими мембранными рецепторами, их лигандами и HS. NRP-1 связывает высоко сульфатированные и полностью де-сульфатированные участки гепарина, но отдает предпочтение 3-O сульфатированным HS [99] или химически модифицированным гепаринам, содержащим одну или две сульфатные группы, например, он лучше связывает гепарин с одной 6-O сульфатной группой, чем гепарин с любыми двумя N-сульфатными, 6-O сульфатными и 2-O сульфатными группами [298]. Домен b1, домены a1 и линкерная область L2 NRP-1 вносят свой вклад во взаимодействие с гепарином и HS [295]. Преимущественное связывание NRP-1 с протяженными сульфатированными гликановыми структурами указывает на то, что он потенциально может связывать большие сегменты цепей HS.
4.5. Neurexins
Форма и свойства синапсов являются функцией его молекулярной организации [299-302]. Нейрексины - это семейство пре-синаптических HS-PG, которые взаимодействуют с несколькими пост-синаптическими молекулами адгезии в синаптической щели. Изоформы нейрексинов существуют в виде PGs с белками ядра разного размера, содержащими одну цепь HS. Последовательность GAG в этой цепи HS может различаться между типами нейронных клеток, что придает специфичность взаимодействию нейрексина с молекулами клеточной адгезии [104,303]. Также было идентифицировано несколько альтернативно сплайсированных изоформ основных белков нейрексина. Они содержат домены laminin, neurexin, sex-hormone-binding (LNS), в некоторых случаях перемежающиеся с повторяющимися доменами EGF. Изоформы основного белка нейрексинов содержат шесть доменов LNS, в то время как нейрексины содержат один домен LNS и не содержат доменов EGF. Нейрексины являются трансмембранными HS-PG на клеточной поверхности, которые присоединяются к пресинаптической клеточной мембране через PDZ-домены.
Пре-синаптические нейрексины и белковые тирозинфосфатазы типа IIa (RPTPs) взаимодействуют с рядом постсинаптических лигандов в функциональной синаптической организации. Leucine-rich-repeat transmembrane neuronal proteins (LRRTMs) первоначально взаимодействуют с доменами основного белка нейрексина, однако именно взаимодействие HS боковой цепи нейрексина с LRRTMs является критическим для индукции пре-синаптической дифференцировки и синаптогенеза [303]. Взаимодействие нейрексин-нейролигин также опосредует развитие и функционирование синапсов, неправильные взаимодействия между ними встречаются при аутизме и шизофрении [106]. Цепь HS нейрексинов связывает постсинаптические нейролигины и LRRTMs, которые дополняют взаимодействия, опосредованные основным белком нейрексина [303]. Изменения в тонкой структуре этих цепей HS помогают в тонкой настройке синаптической функции в процессе развития мозга [304]. Динамика синаптической организации контролирует различные взаимодействия с транссинаптическими сигнальными молекулами. Альтернативно сплайсированные формы нейрексинов играют центральную роль в этом динамическом коде [305]. Пре-синаптические нейрексины регулируют синаптические взаимодействия посредством дифференциального связывания с рядом постсинаптических лигандов, модулируя входные/выходные сигналы, генерируемые в синаптической щели. Нейролигины - основные постсинаптические молекулы адгезии, взаимодействующие с нейрексинами, которые встречаются в очень разнообразных альтернативно сплайсированных формах, обеспечивающих большой спектр синаптических регуляторных сигналов [304]. Мутации в генах, кодирующих нейрексины и их лиганды, наблюдались при таких нейропсихических расстройствах, как шизофрения, аутизм, эпилепсия и синдром Туретта, что свидетельствует о центральной роли нейрексинов в контроле синаптической пластичности [306-316]. HS-PGs играют важную роль в развитии болезни Альцгеймера [317].
4.6. Pikachurin
Пикачурин, (AGRINL и EGF-подобный, фибронектин типа-III и ламинин G-подобный домен-содержащий белок), кодируется у человека геном EGFLAM. Пикачурин - это 110 кДа дистрогликан (DG) -интерактивный белок, играющий роль в координации точных ассоциаций между ленточным синапсом фоторецептора и биполярными дендритами [109]. Для связывания пикачурина с DG требуется гликозилирование DG и наличие двухвалентных катионов. Неправильное взаимодействие между пикачурином и DG было отмечено при мышечных дистрофиях, часто связанных с аномалиями глаз [318,319]. Сообщалось, что пикачурин может быть замещен HS и CS, хотя точные точки присоединения к основному белку еще не опубликованы [44]. Основной белок пикачурина содержит множество повторов фибронектина III типа, модули EGF и LamG, которые известны как белковые интерактивные домены [320].
4.7. Eyes Shut
Eyes shut (Eys) кодирует предсказанный модульный PG ретинальной базовой мембраны в 250-350 кДа, тесно связанный с агрином и перлеканом и играющий роль в организации фоторецепторов и в ремоделировании ECM в развивающемся эпителии сетчатки [111]. Как агрин и перлекан, Eys содержит несколько модулей EGF и LamG и центральный серин-треонином-богатый модуль, содержащий несколько предполагаемых мест прикрепления GAG. Были проведены сложные иммунолокализации Eys, демонстрирующие его пространственно-временную локализацию и очевидную роль в развитии эпителия сетчатки насекомых. Eys секретируется фоторецепторными клетками у дрозофилы, однако у медоносной пчелы Eys не секретируется фоторецепторными клетками, что свидетельствует об изменении его роли в развитии глаза [110]. Нормальное развитие и функционирование зрительных фоторецепторов необходимо для здоровья глаз млекопитающих и остроты зрения. Мутации в генах, кодирующих белки, участвующие в развитии и функционировании фоторецепторов, приводят к целому ряду наследственных дистрофий сетчатки [321]. Мутации в гене EYS являются распространенной причиной аутосомно-рецессивного пигментного ретинита (arRP) в китайской и японской субпопуляциях [322], однако роль EYS PG у человека до конца не определена [110,323]. В фоторецепторных клетках EYS может быть вовлечен в стабилизацию цилиарной аксонемы как в палочках, так и в колбочках, однако наличие нескольких изоформ EYS позволяет предположить, что еще могут быть раскрыты дополнительные роли.
Рисунок 5 и Рисунок 6 представлены в данном обзоре, чтобы показать разнообразие структуры HS-PG, а также проиллюстрировать функциональные элементы, общие для всех членов HS-PG. Существует множество прекрасных обзоров по всем аспектам биологии HS-протеогликанов, и заинтересованному читателю рекомендуется ознакомиться со следующими исследованиями [29,30,53,76,77,80,228,230,231,324,325-334]. Наше обсуждение HS-PGs будет сосредоточено в основном на более поздних членах семейства HS-PGs, а именно на нейрексинах, eyes-shut и пикачурине, а не на пересказе информации о других членах этого семейства PG, которые уже широко доступны.
 Figure 5. Cell surface and intracellular HS-proteoglycans. (a) the glycophospatidyl choline anchored cell surface glypican family, (b) the syndecan family, (c) cell surface neuropilin-1, (d) betaglycan, (e) CD47, (f) the synapse stabilising neurexins, (g) CD44, (h) serglycin, (i) testican. Neuropilin occurs as a proteoglycan containing a single HS or a single CS chain this is why the CS chain is bracketed to make this point. Testican (i) is a part time HS-PG and also contains CS chains. Mast cell serglycin is exclusively substituted with heparin however serglycin produced by other cell types can also contain CS chains.
 Figure 6. Extracellular HS-proteoglycans and their core protein domain organisations and GAG attachment sites. (a) perlecan, (b) agrin, (c) type XVIII collagen, (d) Eyes-shut (e) Pikachurin.
5. Function Defining Properties of HS-PGs and CS-PGs in Neural Tissues
Цереброгликан (GPC-2) - это регулируемый в процессе развития GPI-якорный интегральный мембранный HS-PG, обнаруженный исключительно в развивающейся нервной системе [335,336]. Характер экспрессии цереброгликана и других глипиканов в процессе развития указывает на их инструктивную роль в регуляции роста нейронов и аксонального направления во время формирования нейронных сетей [337]. Члены семейства глипиканов HS-PG играют интерактивную роль с белками нейрональной ориентации нетрином и рецепторами синаптической щели и кругового обхода для координации эмбрионального развития нейронной сети [338-342]. Специализированная форма хордального аггрекана, член PG лектикана CS-KS, содержащий эпитоп гликана натурального киллера человека-1 (HNK-1), также играет инструктивную направляющую роль в клетках предшественниках нервного гребня во время этих процессов развития [49]. Формирование нервных тканей и нейронных сетей - это высоко скоординированный процесс, в котором важную роль играют CS-PGs и HS-PGs, обеспечивающие точное достижение отдельными нейронами намеченных целей в нейронных сетях во время развития тканей [49]. CS-PGs и HS-PGs также играют роль в пролиферации нейронов, дифференциации [343], развитии синапсов и определении специфичности [106,334,344], определяя функцию тканей во взрослых нейронных тканях в состоянии здоровья и болезни [15,47,54,345-348].
5.1. The Synapse and Perineuronal Nets (PNNs) Are Highly Sophisticated Sensory Glycocalyx-like Structures of Functional Significance in Neural Homeostasis and Neurodegenerative Pathophysiology
Нервные ткани совершенно не похожи на любые другие ткани человеческого организма. В нейронном ECM преобладают GAG и отсутствуют фибриллярные коллагеновые и эластические сети, которые являются важными стабилизирующими структурами в соединительных тканях. Нейрональные PGs играют роль как в стабилизации тканей, так и в обеспечении обучающих сигналов для популяций нейрональных клеток в специализированных структурах ниш и ионных микросредах, которые обеспечивают жизнеспособность и оптимальную клеточную активность. CS-PGs и HS-PGs обладают важными функциональными свойствами в этих тканях, и координация их интерактивных свойств является важной особенностью функции и гомеостаза нервной ткани [348]. Таким образом, хотя HS-PGs обладают важными внутренними обучающими свойствами, полученными в исследованиях in vitro, они не действуют изолированно in vivo, а возникают в среде, содержащей огромное количество влиятельных модулирующих веществ в опосредованном клетками взаимодействии этих стимулирующих факторов. Плейотропная природа HS в значительной степени наделяет HS-PGs свойствами, необходимыми для успешной работы в такой смешанной среде [6,30,77,349].
5.2. Roles for HSPGs in the Neuronal Synapse and PNNs
HS-PGs и CS-PGs играют скоординированную клеточно-инструктивную роль в синапсах нейронов и в PNNs, регулируя гомеостаз и ремоделирование тканей в состоянии здоровья и болезни. PNNs - это конденсированные формы ECM головного мозга, которые окружают сому и проксимальные дендриты подмножеств нейронов, обволакивая и защищая синаптические терминалы [350]. PNNs - удивительно динамичные структуры, претерпевающие изменения, которые влияют на процессы познания и памяти [351]. Экспериментальное разрушение PNNs у взрослых животных реактивирует пластичность критических периодов и при определенных условиях может действительно улучшить память. Во время так называемых "критических периодов" нервная система особенно чувствительна к стимулам окружающей среды, что представляет собой важный аспект процессов обучения и памяти [352]. Во время этого критического периода нейронные цепи подвергаются динамическому ремоделированию, однако, если по какой-то причине соответствующий стимул не будет получен во время этого "критического периода", то возможность научиться потенциально новому навыку может не появиться. HS-PGs и CS-PGs имеют установленную клеточно-инструктивную роль в координации аксональной миграции в сложных условиях во время формирования эмбриональной нейронной сети [49].
Хотя HS-PGs ассоциированы с PNNs, они, однако, не считаются неотъемлемыми функциональными компонентами PNN каркаса, который состоит в основном из CS-PGs. Тем не менее, признано, что сульфатированные CS-PGs PNN играют важную клеточно-инструктивную роль, что является общей чертой HS-PGs [103,351]. Нейроны в PNN также синтезируют HS-PG на поверхности клеток, через которые могут быть получены инструктивные сигналы от ECM для клеток. Такие сигналы ECM играют инструктивную направляющую роль в отношении правильных функциональных свойств нейронов, и нарушения в таких взаимодействиях могут способствовать развитию неврологических расстройств [353]. Протеомный анализ нейронных тканей при шизофрении и болезни Алцгеймера продемонстрировал множество белков, участвующих в таких нарушениях нормальной синаптической активности [354].
Нейрексины (Nrxn 1, 2, 3) - это высоко интерактивные специализированные HS-PG, которые стабилизируют синапсы посредством обширного ряда интерактивных лигандов, играющих критическую роль в правильной нейронной функции [355,356]. С эволюционной точки зрения, HS - это молекулы гликокаликса, которые развивались под давлением строгого эволюционного отбора, чтобы стать молекулами со свойствами молекулярного распознавания, хранения и передачи информации для регулирования клеточного поведения. Таким образом, в настоящее время синапс можно рассматривать как высокоспециализированный гликокаликс, в котором боковые цепи HS нейрексинов выполняют аналогичные регуляторные функции. Дисфункциональная активность нейрексинов была выявлена при ряде психических расстройств, включая шизофрению, аутизм, умственную отсталость и аддиктивные расстройства [357]. Изменчивые паттерны сульфатирования HS нейрексинов способствуют их разнообразному взаимодействию в синапсе с широким спектром лигандов в состоянии здоровья и болезни [103,358]. Синапс содержит очень разнообразный спектр интерактивных лигандов HS, которые важны для нейронной активности и передачи сообщений в нейронных сетях [106,344].
В последнее время внимание также было сосредоточено на роли PNNs в контроле пластичности нейронов и синапсов в состоянии здоровья и болезни [359,360], теперь ясно, что PNNs также играют важную роль в когнитивных процессах обучения и модуляции памяти. Нарушения в PNNs наблюдались при болезни Алцгеймера [361-364] и при повышенных уровнях патологического tau при нейродегенеративных заболеваниях [365]. HS-PGs также играют роль в отложении патологических белковых агрегатов в тканях мозга [317]. При болезни Алцгеймера происходит значительная потеря PNNs пропорционально уровню отложения амилоидных бляшек и гиперфосфорилирования tau. Эта потеря PNNs, по-видимому, опосредуется глиальными клетками [366] и дисрегуляцией астроцитов и астроцитарно-нейрональной коммуникации [367,368]. HS-PGs опосредуют некоторые эффекты астроцитов на синаптическую функцию и участвуют в реакции на повреждение мозга, опосредованной астроцитами [369]. PNNs, рецепторы на поверхности клеток нейронов и интерактивные молекулы в ECM играют роль в патофизиологии ряда психических расстройств, включая шизофрению, аутизм и аффективные расстройства, болезнь Алцгеймера и эпилепсию [359,360,370,371]. Такие взаимодействия могут потенциально влиять на пре- и пост-синаптические окончания нейронов [353,354,358]. Активация глиальных клеток и астроцитов при нейродегенеративных заболеваниях также может влиять на перекрестное взаимодействие с популяциями нейронных клеток, которые могут модулировать синаптические функции и пластичность, что приводит к синаптической дисфункции. Более того, потеря PNNs при болезни Алцгеймера и защиты, которую они обычно обеспечивают, может подвергать популяции нейрональных клеток воздействию токсичных компонентов, генерируемых нейровоспалительными процессами в ходе патогенеза неврологических заболеваний, способствуя митохондриальной дисфункции и апоптозу нейронов [362,372].
Глипикан HS-PG, имеющий GPI-якорь, играет важную роль в развитии и функционировании синапсов и вместе с альтернативно сплайсированными членами семейства нейрексина HS-PG образует синапс-организующие белковые комплексы, а также служит лигандом для лейцин-богатых повторяющихся трансмембранных нейрональных белков (LRRTMs) и членов семейства лейкоцитарных общих антигенов, связанных с рецепторным протеином тирозинфосфатазы (RPTP) [351,371]. Нейронный RPTP-δ действует как рецептор PG, связывая HS-PGs и CS-PGs, которые передают клеточные сигналы. CS-PGs обычно передают ингибирующие сигналы, которые регулируют пролиферацию и рост нейронов из глиотических рубцов, препятствуя функциональному восстановлению тканей мозга после травматического повреждения, тогда как HS-PGs передают сигналы, способствующие пролиферации, миграции и росту нейронов [49,103]. Таким образом, коллективное взаимодействие HS-PGs и CS-PGs регулирует развитие тканей, гомеостаз, ремоделирование тканей и процессы восстановления в здоровье и болезни [366,373,374].
5.3. Cell Regulatory Roles of Dually Modified HS/CS PG Co-Receptors
Двойные модифицированные PG-ко-рецепторы HS/CS на клеточной поверхности являются многофункциональными, они модулируют сигналы Wnt, ShH, TGF-β и FGF в процессе развития и болезни. Неправильные сигнальные ответы клеток на секретируемые факторы роста связаны с развитием ряда заболеваний [269,270,375,376]. Двойная модификация ко-рецепторов с помощью HS/CS способствует одновременному связыванию факторов роста из различных семейств факторов роста, модулируя многочисленные регуляторные процессы. HS и CS во многих случаях способствуют противоположным процессам клеточной регуляции и могут представлять собой молекулярный переключатель "включено-выключено". Например, HS ингибирует сигнализацию Wnt через бетагликан и CD47-опосредованные взаимодействия, в то время как CS способствует передаче сигналов Wnt. CS и HS также оказывают противоположное влияние на пролиферацию, миграцию и рост нейронов через RPTP-δ взаимодействия, при этом CS обеспечивает ингибирующие сигналы. Ко-рецепторы гибридных PGs CS/HS на поверхности клеток включают членов семейства синдеканов, бетагликан и рецептор TSP-1 CD47.
Значительная часть NRP1 представляет собой PG, модифицированный либо HS, либо CS на одном консервативном остатке Ser в основном белке. Также часто встречаются формы NRP-1 без GAG. Состав GAG-цепей NRP1 различается между эндотелиальными клетками и гладкомышечными клетками, однако одна GAG-цепь не может содержать одновременно HS и CS, поэтому эндогенный NRP1 существует как HS-PG или CS-PG, но не как гибридный PG. Остаток Ser, который заменен на GAG, расположен между b1b2 и MAM доменами NRP1 и является консервативным у позвоночных. NRP2, гомолог NRP1 у млекопитающих, не имеет этого консервативного остатка Ser [250]. Семафориновые рецепторы NRP-1 и 2 класса III взаимодействуют с семафорином и VEGFA в аксональном направлении при эмбриональном формировании нейронной сети. Во взрослых тканях NRP-1, 2 являются про-ангиогенными, стабилизируя взаимодействие VEGF/VEGFR, что способствует развитию и восстановлению тканей, росту, миграции и инвазии опухолей [250]. Два комплемент-связывающих гомологических домена NRP (a1 и a2) необходимы для связывания с Sema 3 и Plexin A во время аксональной ориентации. Домены гомологии доменов b1 и b2 фактора коагуляции V/VIII NRP опосредуют связывание VEGF. NRP-1 связывает высоко сульфатированные и полностью де-сульфатированные олигосахаридные участки гепарина, но отдает предпочтение 3-O сульфатированным HS [99]. Гомодимер бетагликана клеточной поверхности содержит сайты связывания ингибина, FGF-2, Wnt и TGF-β [240,261-268] и ко-локализован с субъединицами белка ингибина/активина в мозге [273,274]. CD47 - еще один гибридный ко-рецептор CS/HS нейронов, связанный с нейродегенеративными заболеваниями. Лиганды CD47 включают SIRPα, TSP-1 и интегрины. Они регулируют клеточную адгезию, пролиферацию, апоптоз, миграцию клеток, гомеостаз и иммунную функцию в нервных тканях. Взаимодействие CD47-SIRPα модулирует активацию Т-клеток врожденного иммунитета. [285-287]. TSP-1 действует через CD47, ингибируя сосудистую NO сигнализацию, регулирующую кровяное давление путем ограничения активации eNOS и эндотелиальной клеточно-зависимой вазорелаксации. Взаимодействие CD47 с SIRPα регулирует врожденное самораспознавание [282]. Взаимодействие CD47 с TSP-1 регулирует ремоделирование сосудов в стрессовых условиях, таких как травма мозга и неврологические заболевания [377,378]. CD47 защищает синапсы от избыточного ремоделирования, опосредованного микроглией, во время развития тканей и травм [379] и играет нейропротекторную роль в нейровоспалительных процессах, происходящих при патологическом ремоделировании тканей при нейродегенеративных заболеваниях, которые снижают когнитивные процессы и память [380,381].
В учебниках perlecan часто описывают как HS-PG, имея в виду сосудистый perlecan, вырабатываемый эндотелиальными клетками, который представляет собой монозамещенный HS-PG. Однако многие типы клеток (хондроциты, клетки IVD, менисковые клетки, гладкомышечные клетки) производят перлекан, в котором по крайней мере одна из цепей HS заменена на CS, таким образом, перлекан во многих тканях присутствует как HS/CS гибридный PG. Лишь немногие исследования изучали влияние этой замены HS на CS на функциональную биологию перлекана. В одном исследовании было показано, что CS-цепь перлекана регулирует фибриллогенез коллагена [382]. Другое исследование показало, что CS регулирует высвобождение FGF-2, секвестрированного цепями HS, причем высвобождение HS происходит только после удаления CS бактериальными хондроитиназами, однако физиологический фермент, ответственный за это, на данный момент не известен [383]. Открытие гиалуронидазы-4 в качестве CS-гидролазы является ферментом млекопитающих, способным удалять CS из перлекана [384]. Ферменты редактирования HS - гепараназа, Sulf-1 и 2 - также удаляют 6-O сульфатированный HS из HS-PGs [385,386], и это регулирует ангиогенный ответ эндотелиальных клеток на действие FGF-2 и VEGF [387]. Взаимодействие между цепями HS и CS в синдекане также участвует в улучшении связывания и переноса midkine и pleiotropin с их когнитивными рецепторами [388]. Таким образом, двойная модификация перлекана с помощью HS и CS может еще больше улучшить его способность связывать факторы роста.
5.4. The Roles of LamG and EGF-like Core Protein Motifs in HS-Proteoglycans
Agrin, laminin, perlecan, neurexin и pikachurin взаимодействуют с α-DG через свои домены LamG [109,389-391]. Домены LamG также характерны для агрина, перлекана и основных белков коллагена XVIII. Пикачурин необходим для поддержания ленточных синапсов фоторецепторов, которые взаимодействуют с дендритными отростками биполярных нейронов [109]. Eys, HS-PG базальной мембраны, также взаимодействует с матригликаном и фосфорилировани-DG через свои LamG домены для стабилизации фоторецепторной базальной мембраны [392]. Drosophila Eys содержит 4 N-концевых LamG домена, гомологи Eys человека и Eys рыбок данио содержат 5 LamG доменов. EGF, кальций-связывающий EGF (cb EGF) и EGF-подобные домены также являются важными компонентами основного белка Eys и других HS-PG. Eys дрозофилы содержит 10 EGF и 4 cbEGF мотивов, гомолог Eys человека имеет 18 EGF, 3 EGF-подобных и 7 cbEGF доменов, Dys рыбок данио имеет 20 EGF, 1 EGF-подобный и 18 cbEGF доменов. EGF-подобные домены ранее были идентифицированы в глобулярных доменах членов семейства CS-PG lectican и показано, что они способствуют клеточной пролиферации и миграции в некоторых видах рака [393-395], однако конкретная роль EGF-подобных доменов в HS-PG не установлена, и неизвестно, вносят ли они вклад в клеточную пролиферацию и миграцию, стимулируемую HS-PG.
α-Nrxn-1, 2, 3 на поверхности пре-синаптических клеток необходимы для нейротрансмиссии и связаны с нарушениями нейрального развития, такими как аутизм или шизофрения. Разнообразные интерактивные партнеры α-Nrxn зависят от альтернативного сплайсинга, а также neuroligins (Nlgn) и αDG [356]. Транссинаптический комплекс с Nlgn1 вносит вклад в функцию α-Nrxn. Взаимодействие α-Nrxn с αDG, нейрексофилинами (Nxph1) и Nlgn2, лигандами происходит именно в тормозных синапсах, однако эти взаимодействия не до конца изучены [356,396]. Эпитопы связывания αDG и Nxph1 на Nrxn1 показывают, что связывание является взаимоисключающим. Необычный цистеиновый мостик и сложные гликаны в Nxph1 обеспечивают связывание со вторым LamG-доменом связывания ламинина/нейрексина/сполового-гормона (LNS2) Nrxn1α, эта связь не мешает связыванию Nlgn на LNS6 [397-400]. αDG, напротив, взаимодействует с LNS2 и LNS6 в основном через LARGE (like-acetylglucosaminyltransferase) генерируемые гликаны. Связывание αDG на LNS2 предотвращает взаимодействие Nlgn на LNS6 за счет стерических препятствий. Экспрессия αDG, Nxph1 и альтернативно сплайсированного Nrxn1 может предотвращать или облегчать формирование различных транссинаптических комплексов Nrxn-Nlgn, способствуя разнообразным синаптическим взаимосвязям [401,402].
α-DG является высоко гликозилированным рецепторным компонентом базальной мембраны matriglycan, нового внеклеточного гликопротеина [403]. Множество гликозилтрансфераз играют ключевую роль в функционально определяющих модификациях α-DG [404-406]. Функциональная структура O-маннозы использует фосфо-рибитоловые фосфотрисахаридные мостики для соединения с 30 дисахаридами из α-DG, которые связывают белки ECM [407]. Когда эта связь нарушается из-за мутаций в генах этих гликотрансфераз, возникают множественные формы врожденной мышечной дистрофии [408]. О-манноза-рибитол является новым компонентом фосфотрисахаридной связи с ксилозой в α-DG (рис. 7). Цитидилтрансфераза CDP-рибитол ISPD (изопреноидсинтазный домен) генерирует восстановленный сахарный нуклеотид, необходимый для вставки рибитола в эту фосфодиэфирную связь [406]. Последовательные ферменты TMEM5 (UDP-ксилозилтрансфераза), B4GAT1 (глюкуронилтрансфераза) и LARGE (двухфункциональная гликозилтрансфераза) модифицируют это фосфодиэфирное соединение рибитола для создания функционального рецептора α-DG, взаимодействующего с LamG-мотивами белков ECM.
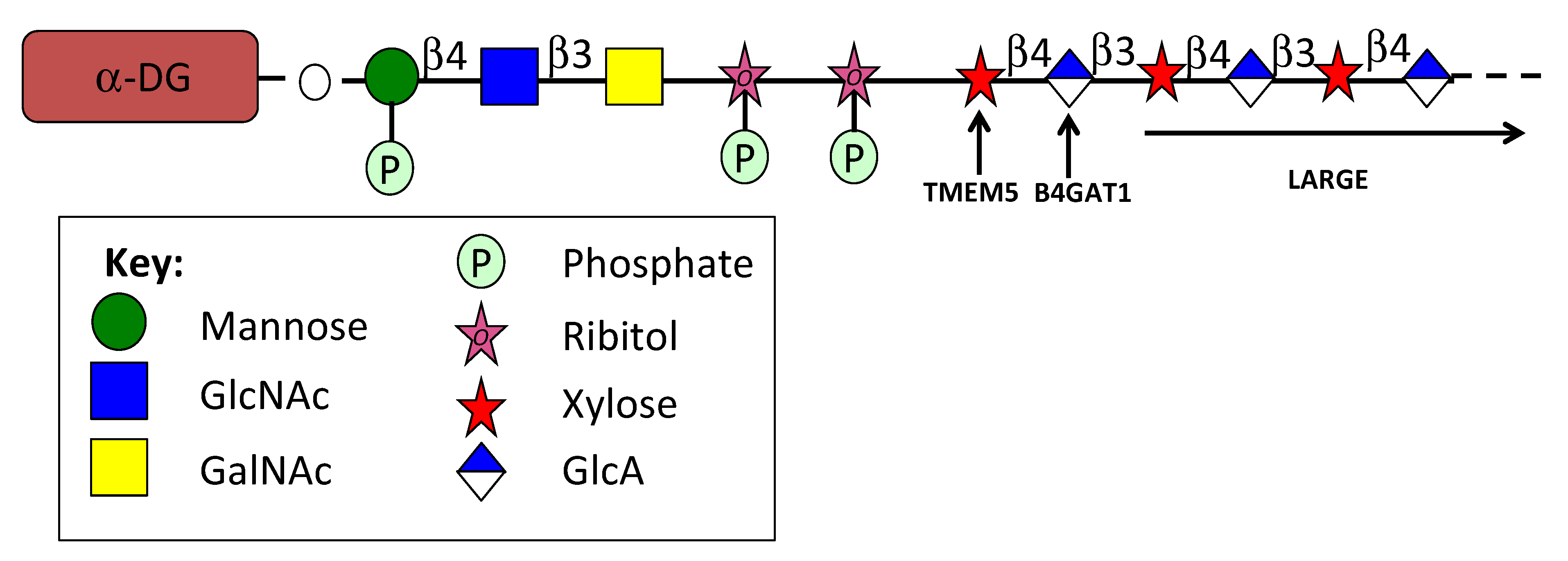 Figure 7. The α-DG LamG binding receptor and its constituent glycan components assembled from a GalNAc-β3-GlcNAc β4 Mannose M3 trisaccharide link module with sequential attachment of a number of glycan components by glycosyl transferases including TMEM5, B4GAT1, and the LARGE xylosyl and glucuronyl transferase complex to form a functional receptor. Phosphorylated ribitol is an unusual component in this assembly process. Figure re-drawn from data provided in [407,409]. 6. Concluding Remarks
В данном обзоре освещены сложности HS и его дифференциальной обработки в различных биологических тканях в состоянии здоровья и болезни. Использование четко определенных синтетических 3-O-сульфатированных стандартов, комплексное профилирование дисахаридов HS и клеточная инженерия позволили выявить ранее не оцененные различия в профилях 3-O-сульфатирования клинических гепаринов и структурные вариации HS клеточной поверхности, генерируемые HS3ST. Наличие этих стандартов значительно повысило точность идентификации этих видов HS. Сульфатация GAG HS является важной функциональной детерминантой, которая придает различные регуляторные свойства HS-PGs. Свойства переноса заряда, передаваемые сульфатными группами, украшающими HS GAG, представляют собой механизм клеточной сигнализации и коммуникации между клетками и ECM, который регулирует клеточное поведение. Сульфатированные гликаны и гликолипиды регулируют рост и дифференциацию клеток, синтез и организацию ECM и процессы механосенсорной сигнализации, которые модулируют гомеостаз тканей, процессы восстановления и ремоделирования, происходящие при здоровье и болезни. Трансдукция внутренних биомеханических сил в клеточном микроокружении регулирует клеточное поведение, включая стволовые клетки в их нишах, посредством участия клеточно-ассоциированных и перицеллюлярных HS-PGs. HS является очень универсальным GAG, что отражается в его широком тканевом распространении. HS наполнен информацией, которая облегчает его разнообразные роли в молекулярном распознавании и передаче информации клеткам, таким образом опосредуя клеточный контроль над развитием тканей и восстановлением ран, а также многие другие важные физиологические процессы. Известно, что HS взаимодействует с более чем 400 белками, перечисленными в интерактоме HS. Однако модель активно воспаленной мышиной поджелудочной железы позволила еще больше расширить общее число известных белков, связывающих HS, по крайней мере, до 786, что объясняет широкое разнообразие лигандных взаимодействий и клеточного поведения, в которых участвует HS. Информация о HS и его взаимодействиях в здоровье и болезни неуклонно растет, а миметические пептиды, основанные на некоторых из этих взаимодействий, оцениваются в нескольких потенциальных терапиях для контроля воспаления и содействия регенерации тканей или в качестве противоопухолевых агентов. Продолжается идентификация HS-PGs и определение их функциональных свойств, и этот класс PGs будет продолжать развиваться с идентификацией новых членов. Хорошо проведенные систематические фундаментальные исследования HS и его разнообразных молекулярных и клеточных взаимодействий сделают клиническое применение еще на один шаг ближе. Перлекан содержится в нише стволовых клеток и способствует дифференцировке MSC в определенные линии клеток-предшественников.
Идентификация специфических HS-PGs, вовлеченных в управление спецификацией линии hMSC, вероятно, предоставит новые маркеры, которые позволят лучше отбирать hMSC и расширять их для использования в терапевтических целях. Недавние исследования, раскрывающие роль HS-PGs в стабилизации синапсов, активности фототрансдуктивной сети нейронов, сборке и функционировании нервно-мышечного соединения, указывают на разнообразие нейрорегуляторных процессов, в которых участвуют HS-PGs. Более глубокое понимание структуры и функции HS иллюстрирует потенциал молекулярных взаимодействий HS в разработке более эффективных терапевтических подходов к лечению конкретных процессов заболеваний. Были разработаны сложные аналитические процедуры для анализа взаимосвязей структуры и функции HS не только в нормальных тканях, но и в больных тканях, а также для разработки миметиков HS. Эта область дизайна лекарств вступила в захватывающую эру с доступными в настоящее время передовыми аналитическими методами и, несомненно, приведет к значительному улучшению терапевтических препаратов HS и их применению в восстановительной биологии.
|






