Reelin - это гликопротеин, имеющий решающее значение для формирования и развития нейронных цепей, синаптогенеза и синаптической пластичности у взрослых, играющий важную роль в центральной нервной системе (ЦНС) и сетчатке глаза в связи с физиологическими и патологическими состояниями [1-3]. Низкий уровень Reelin может привести к синаптической дисфункции и нейродегенерации [1]. Болезнь Альцгеймера (AD) и другие деменции вносят значительный вклад в глобальную инвалидность, поскольку в 2019 году число лет жизни с поправкой на инвалидность, связанных с деменцией, возросло до более чем 25 миллионов [4]. Стандартизированные по возрасту показатели DALY изменились в пределах стандартизированных по возрасту регионов DALY, резко увеличившись в регионах с высоким и средним социально-демографическим индексом (SDI) [5]. Увеличение DALY на 176%, произошедшее в период с 1990 по 2021 год, подчеркивает необходимость совершенствования инструментов профилактики и ухода за людьми старше 65 лет, таких как диагностика, терапия и политические вмешательства, особенно направленные на борьбу с нейродегенеративными заболеваниями [6].
Появляющиеся данные связывают Рилин с AD, нейродегенеративным заболеванием, характеризующимся отложением бета-амилоидных бляшек (amyloid-β или Aβ) и tau-клубков в головном мозге [7]. В нескольких исследованиях на людях описаны измененные уровни Рилина при AD: примечательно, что N-концевой фрагмент рилина массой 180 кДа значительно повышен в спинномозговой жидкости (ликворе) пациентов с AD по сравнению с пациентами с умеренными когнитивными нарушениями (MCI) или здоровой контрольной группой [8]. Это повышает вероятность того, что мониторинг содержания рилина и продуктов его расщепления в ликворе или крови может помочь идентифицировать особей, у которых состояние прогрессирует от MCI до AD [9].
Что касается зрительной системы, то у мышей, у которых отсутствует Рилин, нарушается слоистость сетчатки в процессе развития [10]. У мышей с дефицитом Рилина в сетчатке обнаруживается значительная активация глии, связанная с признаками нейровоспаления, и, в частности, реактивные клетки Мюллера синтезируют и высвобождают нейротрофические факторы, такие как NGF и IL33, для компенсации нейротрофии и сохранения целостности сетчатки [11]. В других исследованиях сообщается о некотором изменении уровней рилина у людей с AD, что указывает на повышенные уровни N-концевого фрагмента рилина массой 180 кДа в ликворе пациентов с AD по сравнению с пациентами с MCI или здоровым контролем [8]. Это открытие позволяет предположить, что мониторинг содержания рилина и продуктов его расщепления в ликворе или матриксе крови может помочь в выявлении индивидуумов, прогрессирующих от MCI к AD [9].
Одной из предполагаемых связей между возрастной макулярной дегенерацией (AMD) и AD является аномальное накопление белка и явное отложение Aβ [12]. Исследования показали, что амилоидный каскад может играть определенную роль в развитии ВМД, хотя эта гипотеза требует дальнейшего подтверждения [13]. Образование старческих токсичных бляшек, состоящих из агрегатов Aβ и нейрофибриллярных клубков, образованных tau-белком, представляет собой типичный признак нейродегенерации [14]. В этом контексте внутриклеточная концентрация кальция и условия ионной силы представляют собой две важные движущие силы образования фибрилл и последующего начала прогрессирования нейродегенерации [15,16]. В физиологических условиях с высоким содержанием кальция S100A9 самопроизвольно образует фибриллы, что свидетельствует об уникальном механизме агрегации, имеющем потенциальное значение для развития нейровоспаления, связанного с болезнью Альцгеймера, что было обнаружено с помощью атомно-силовой микроскопии [15]. Кроме того, амилоидные фибриллы α-синуклеина проявляют выраженный полиморфизм в зависимости от концентрации белка и ионной силы, что подчеркивает, насколько незначительные переменные окружающей среды могут оказывать глубокое влияние на структуры фибрилл, имеющие отношение к нейродегенеративным патологиям [16]. Эти патологические скопления, наряду с потерей синапсов и нейронов, связаны с признаками нейровоспаления, в которое могут вносить свой вклад реактивные клетки Мюллера и активированная микроглия, высвобождая множество провоспалительных цитокинов [17].
На сосудистом уровне AMD и AD связаны с нарушением гематоэнцефалического барьера или барьера кровь–сетчатка, что способствует сосудистой дисфункции, тканевой гипоксии и нейродегенерации [18]. В основном наблюдаются изменения в липидном обмене, в частности в аполипопротеине Е (ApoE), особенно в отношении аллеля ApoE4, хорошо известного генетического фактора риска возникновения и/или прогрессирования AD, а также AMD [19].
В последние годы Рилину уделяется все больше внимания в связи с его потенциальной ролью в патогенезе AD [20]. Снижение уровня рилина может привести к недостаточной модуляции синаптической пластичности, что приводит к когнитивной дисфункции [8]. Ингибирование передачи сигналов Reelin может быть одной из причин неспособности мозга поддерживать связь между нейронами, что также может проявляться в сетчатке [21].
В этом обзоре мы провели критический анализ литературы за последние 10 лет, чтобы осветить основные функциональные аспекты гликопротеина Рилина в контексте оси мозг–глаз и оси мозг–кишечник–глаз, учитывая структуру микробиома, которая недавно привлекла междисциплинарное внимание в области мозга, кишечника и глаз. Обширный литературный обзор статей, опубликованных в период с 2015 по 2025 год, был проведен на основе стандартной процедуры (PubMed; (https://pubmed.ncbi.nlm.nih.gov/; 19 июня 2025 г.), Embase; (https://www.embase.com /; 19 июня 2025) и Google Scholar; (https://scholar.google.com/; 19 июня 2025)). ..
2. Reelin: Structure, Function, and Homeostasis
Рилин - это секретируемый гликопротеин массой 440 кДа (386 кДа с 18 предполагаемыми N-сцепленными сайтами гликозилирования), экспрессируемый c большого участка генома, расположенного на хромосоме 7 человека [22]. Эта сериновая протеаза кодируется геном RELN (450 т.п.н., охватывающим 65 экзонов) как крупный секретируемый белок внеклеточного матрикса в пределах его физиологического окружения [22]. Этот гликопротеин состоит из сигнального пептида, области, подобной F-spondin, уникальной области с эпитопом для антитела CR-50, и восьми тандемных повторов [2,23]. Повторы Reelin имеют длину около 350-390 аминокислот и содержат домен центрального эпидермального фактора роста (EGF), окруженный двумя гомологичными субповторами [24]. Анализ рецептор-связывающего фрагмента Reelin и мутационный анализ показывают, что механизм распознавания аналогичен механизму распознавания эндоцитарных рецепторов [25].
У человеческого и мышиного Рилина идентичность последовательностей белков и генов составляет соответственно 87,2% и 94,2%, что делает возможным изучение механизма его действия на экспериментальных моделях [26]. Рилин в основном синтезируется нейронами в различных областях головного мозга, включая кору головного мозга и гиппокамп, и играет ключевую роль, связываясь с рецептором аполипопротеина Е 2 (ApoER2) и рецептором липопротеинов очень низкой плотности (VLDLR), которые относятся к семейству рецепторов липопротеинов низкой плотности (LDLR). [27]. В клетках, несущих VLDR, Рилин модулирует синаптическую пластичность, плотность дендритных корешков и нейрональные связи, обеспечивая правильные когнитивные функции [28]. Точнее, связывание ApoER2/VLDLR с рилином активирует внутриклеточные тирозинкиназы семейства Src (SFK), в частности Fyn и Src, фосфорилирующие адапторный белок Dab1 по специфическим остаткам тирозина [29]. Связывание с Рилин–рецептором активирует сигнальный белок Disabled-1 (Dab1), который, в свою очередь, активирует нижележащие сигнальные пути [30]. Что касается клеточного сигнала, поступающего после связывания Reelin–ApoE2/VLDLR, то активация Erk1/2 приводит к усилению фосфорилирования p90-RSK и индукции немедленной экспрессии гена, что связано со многими факторами роста [31]. Поскольку активация Erk1/2 не опосредована каноническим путем передачи сигнала, весьма вероятно, что неканонический путь также может быть активирован Reelin во время развития мозга [31]. При связывании Рилина могут наблюдаться различные биологические функции, зависящие от локализации ткани и нейрональных и ненейронных клеток, включая фосфорилирование NF-κB, фосфатидилинозитол-3-киназы (PI3K, через нижестоящие эффекторы Akt и GSK-3β), AKT и JAK/STAT [21,32]. С другой стороны, связывание Reelin–ApoER2 позволяет избирательно активировать сигнал NF-κB, который, в свою очередь, регулирует эндотелиальный гомеостаз [21]. Физиологический Рилин в изобилии содержится в крови, являясь основой гомеостаза мозга, сердца, печени, кишечника и глаз, но он также может действовать как провоспалительный и протромботический фактор, играя важную роль при воспалительных и аутоиммунных заболеваниях (рассеянный склероз, болезнь Альцгеймера, артрит, атеросклероз) и регуляция/нарушение регуляции раковых клеток [21,33].
Что касается его активности, мишенями для Reelin также являются интегрины и белок-предшественник амилоида (APP), который, в свою очередь, активирует центральный фрагмент Reelin и взаимодействует с интегрином α3β1, способствуя росту нейритов [34]. Аберрантная обработка приложений была связана со снижением активности AD мозга [35]. На клеточном уровне патологические уровни Reelin могут способствовать привлечению воспалительных клеток и стимулировать воспаление за счет увеличения сосудистой сети, а также экспрессии белков адгезии лейкоцитов к эндотелию на эндотелиальных клетках посредством активации ядерного фактора каппа–усилителя легких цепей активированных В-клеток (NF-κB) и экспрессия белка адгезии сосудистых клеток 1 (VCAM-1), молекулы межклеточной адгезии 1 (ICAM-1) и молекул адгезии Е-селектина [21,36,37]. Истощение запасов Рилина уменьшает поступление циркулирующих лейкоцитов в различные ткани из-за снижения адгезивных свойств сосудистого эндотелия и уменьшения экстравазации лейкоцитов, хотя прямого воздействия Рилина на лейкоциты не сообщалось [21]. Экспрессия Reelin после повреждения предполагает важную роль в регуляции перемещения стволовых клеток в нейрональных и ненейронных тканях после повреждения, а также его роль в нормальном органогенезе [38].
Каноническая передача сигналов Reelin также, по-видимому, активна в гомеостазе кишечника и ободочной кишки, что также указывает на потенциальное влияние Reelin на патофизиологию некоторых опасных для жизни хронических и воспалительных синдромов, таких как болезнь Крона [21]. Из-за постоянного процесса самообновления кишечника в эпителиальных клетках кишечника и миофибробластах (колоноцитах, бокаловидных клетках, энтероэндокринных клетках) может нарушаться баланс между пролиферацией, дифференцировкой и апоптозом клеток, что, скорее всего, связано с экспрессией ApoER2, VLDLR и Disabled-1 (Dab1) и модуляцией местного иммунного ответа, пара- и воспалительные процессы [39].
3. Reelin as Biological Marker
Обнаружение или визуализация белка Reelin может быть достигнуто в экстрактах головного мозга и сетчатки, а также в биологических жидкостях с помощью полуколичественных и количественных методов исследования (вестерн-блот, иммуногистология–цитохимия, проточная цитометрия, ELISA; [40]). Многие коммерческие наборы для ELISA были нацелены на обнаружения у людей и мышей, в основном для обнаружения ликвора, плазмы и лизата тканей [41]. Рилин может оказаться потенциальным биомаркером нейродегенеративных заболеваний благодаря минимально инвазивному сбору образцов (крови или ликвора) в сочетании с высокочувствительными иммунологическими анализами. До сих пор было мало доказательств использования определения Reelin в качестве прогностического и/или диагностического биомаркера нейродегенеративных заболеваний. При анализе биологических жидкостей и биоптатов тканей, полученных при нейрональных и ненейронных нарушениях, потенциальный вклад Рилина в качестве биологического маркера стал очевиден [42]. Путь RELN-APOER2-DAB1 является ключевым в патогенезе AD, где p-Tau нарушает передачу сигналов APOER2-DAB1, вызывая ухудшение нейродегенерации [42]. Недавно было высказано предположение, что модификации пути Reelin, обусловленные биохимическими, генетическими и эпигенетическими влияниями, могут быть полезны для лучшего понимания прогрессирования AD и позволяют воздействовать на сигналы Reelin с возможностью частичного противодействия нейродегенеративному процессу [42]. Еще одной особенностью Рилина является его прямое взаимодействие с некоторыми гормонами. Примечательно, что Рилин взаимодействует с гормонами щитовидной железы Т3 и Т4, которые необходимы для правильного развития мозга; их дефицит во время беременности может вызвать серьезные повреждения головного мозга (кретинизм) и неврологический дефицит с психическими проявлениями (шизофрения и аутизм). Повреждения, вызванные снижением экспрессии Рилина в развивающемся мозге, в основном связаны с корой головного мозга и гиппокампом. Новые протеомные платформы оказались полезными для количественного определения уровней Reelin в нейрональных и вненейронных жидкостях, что позволяет предположить возможность оценки уровня Reelin в глазных жидкостях, собранных во время рутинных офтальмологических процедур, таких как хирургия катаракты [43].
3.1. Reelin Involvement in Neurodegeneration
Роль Рилина при AD вызвала интерес с точки зрения того, может ли модулирование его активности помочь ему действовать в качестве нейропротектора для поврежденных нейронов [44]. Нарушение передачи сигналов Reelin недавно было признано патологическим механизмом при AD поскольку путь Reelin–ApoER2/VLDLR регулирует фосфорилирование tau и метаболизм β-амилоида при AD [1,20]. Снижение уровня рилина или нарушение передачи сигналов Рилина были связаны с тяжелым отложением tau-гиперфосфорилирования, что приводит к образованию нейрофибриллярных клубков [20]. Общий обзор роли рилина и маркеров воспаления в основном нейродегенеративном процессе в нейронах показан на рисунке 1.
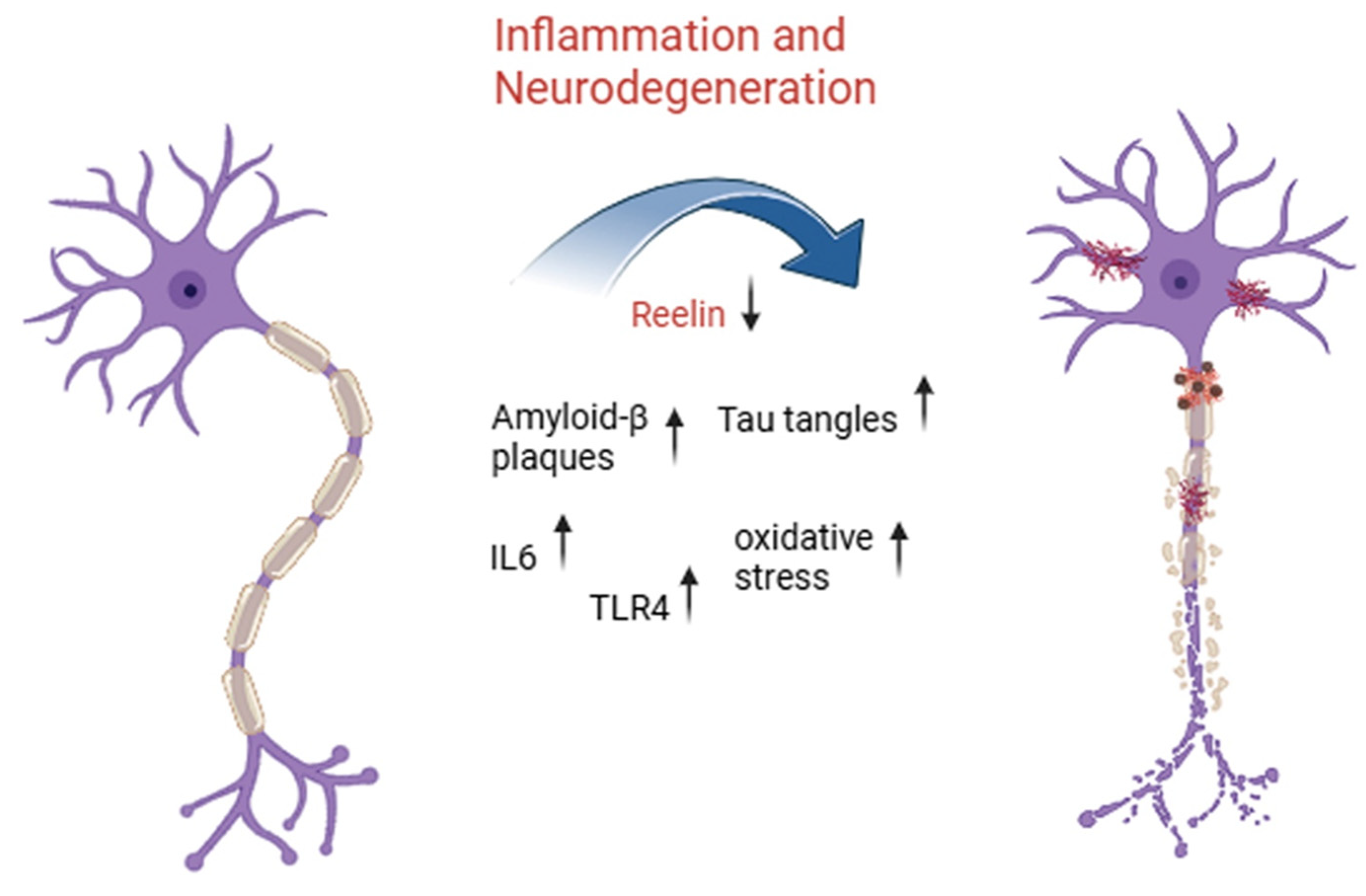
Figure 1. Inflammatory signaling and Reelin downregulation drive neurodegeneration in aging-related disorders. This illustration highlights the progressive transformation of a healthy neuron (left) into a degenerating one (right) due to chronic inflammatory activation and molecular dysregulation. Central to this process is a reduction in expression of Reelin, a key extracellular matrix protein involved in synaptic plasticity and neuronal integrity. As Reelin levels drop, inflammatory mediators such as interleukin-6 (IL-6) and toll-like receptor 4 (TLR4) become upregulated, promoting a cascade of detrimental events including increased oxidative stress, accumulation of amyloid-Я plaques, and formation of neurofibrillary tangles composed of hyperphosphorylated tau protein. Together, these pathological features contribute to the breakdown of neuronal structure and function, ultimately leading to neurodegeneration, a hallmark of aging-related neurodegenerative diseases such as Alzheimer’s disease.
Кроме того, защитные эффекты Reelin были ослаблены в присутствии ApoE4 (установленного генетического фактора риска развития AD), который модулирует взаимодействия между Reelin и ApoER2 [20]. ApoER2 и VLDLR, несомненно, играют важную роль в нейропротекции Рилина и могут представлять собой терапевтические мишени [45]. У носителей ApoE4 снижение передачи сигналов Reelin, связанное с нарушением функций митохондрий, коррелирует с более быстрой потерей синаптических связей и снижением когнитивных способностей [22]. Напротив, подход к усилению передачи сигналов Reelin или просто повышению уровня Reelin показал потенциальные результаты предотвращения прогрессирования AD и противодействия tau-патологии путем защиты синаптической целостности [22]. Путь Reelin–ApoER2-DAB1 существенно влияет на стабильность цитоскелета, синаптическую пластичность, долговременное усиление и некоторые иммунологические сигналы [46]. Дисфункция Reelin приводит к чрезмерной активации этих киназ и гиперфосфорилированию tau-белка, это, следовательно, способствует сборке tau-белка в нейрофибриллярные клубки, а Reelin модулирует киназы, участвующие в фосфорилировании tau, включая гликогенсинтазную киназу 3 бета (GSK-3β) и циклинзависимую киназу 5 (CDK5) [47]. Одновременно ApoER2 связывается с амилоидным APP и предшественником Aβ, и мутации в пути Reelin–ApoER2 могут способствовать амилоидогенному процессингу APP путем сверхэкспрессии β-секретазной и γ-секретазной активности, что приводит к увеличению количества амилоидных β-пептидов [42]. Эти пептиды образуют агрегаты и бляшки, что характерно для патологии AD Кроме того, зависимое от фосфорилирования связывание и последующая деградация модифицированных Reelin изоформ ApoE с помощью LRP8 влияет на динамику взаимодействия, и, в частности, ApoE4 конкурирует с Reelin за этот рецептор, ограничивая сигналы Reelin, что приводит к усилению таупатии и амилоидогенеза [48].
Согласно противоречивой точке зрения, взаимодействие Рилина с рецепторами является важнейшим нейропротекторным механизмом, и нарушение этого взаимодействия может непосредственно способствовать патофизиологическому каскаду развития AD кульминацией которого являются токсические эффекты Aβ и tau [1]. Снижение уровня Рилина в ликворе может свидетельствовать о ранней синаптической дисфункции, в то время как быстрое повышение уровня Рилина может замедлить нейродегенеративные процессы в головном мозге, обеспечивая компенсаторную реакцию на нейродегенеративный процесс [42].
3.2. Reelin in Anterior and Posterior Eye Segments
Вне нервной системы Рилин присутствует в кровотоке и различных органах/тканях, включая глаза, где он играет важную роль в поддержании зрительных функций [21]. Рилин физиологически экспрессируется во время ретиногенеза, но повышается после травмы глаза [49]. На глазном уровне два недавних исследования показали, что Рилин может устранять некоторые нарушения зрения, которые наблюдались в слоях сетчатки у группы пациентов с AD [50].
Сетчатка имеет много общего с мозгом по структуре и функциям. Рилин участвует в дифференцировке и созревании нейронов сетчатки, включая ганглиозные клетки [51]. В частности, было показано, что белок Рилин регулирует образование синапсов в областях мозга, связанных со зрением, при этом измененные уровни рилина потенциально влияют на синаптическую пластичность сетчатки. Рилин играет важнейшую роль в поддержании структурной и функциональной целостности сетчатки [52]. Он экспрессируется в клетках пигментного эпителия сетчатки (RPE), фоторецепторах и других слоях сетчатки, где регулирует клеточную адгезию, динамику внеклеточного матрикса (ECM) и синаптическую стабильность [53]. Reelin способствует правильному расположению фоторецепторов и клеток RPE, обеспечивая эффективную фототрансдукцию и удаление отходов. Его присутствие в микроокружении сетчатки также связано с противовоспалительными свойствами и защитой от окислительного стресса - двумя важнейшими факторами здоровья сетчатки [40]. У людей с AD часто наблюдаются дисфункции сетчатки, такие как нарушение реакции на зрительные стимулы и изменения в ганглиях сетчатки, которые могут быть связаны со снижением скорости реакции [54]. Снижение уровня рилина в головном мозге коррелирует со структурными и функциональными изменениями в сетчатке [21]. Как показано на рисунке 2, нарушение регуляции экспрессии рилина и маркеров воспаления может вызвать AMD в сетчатке.
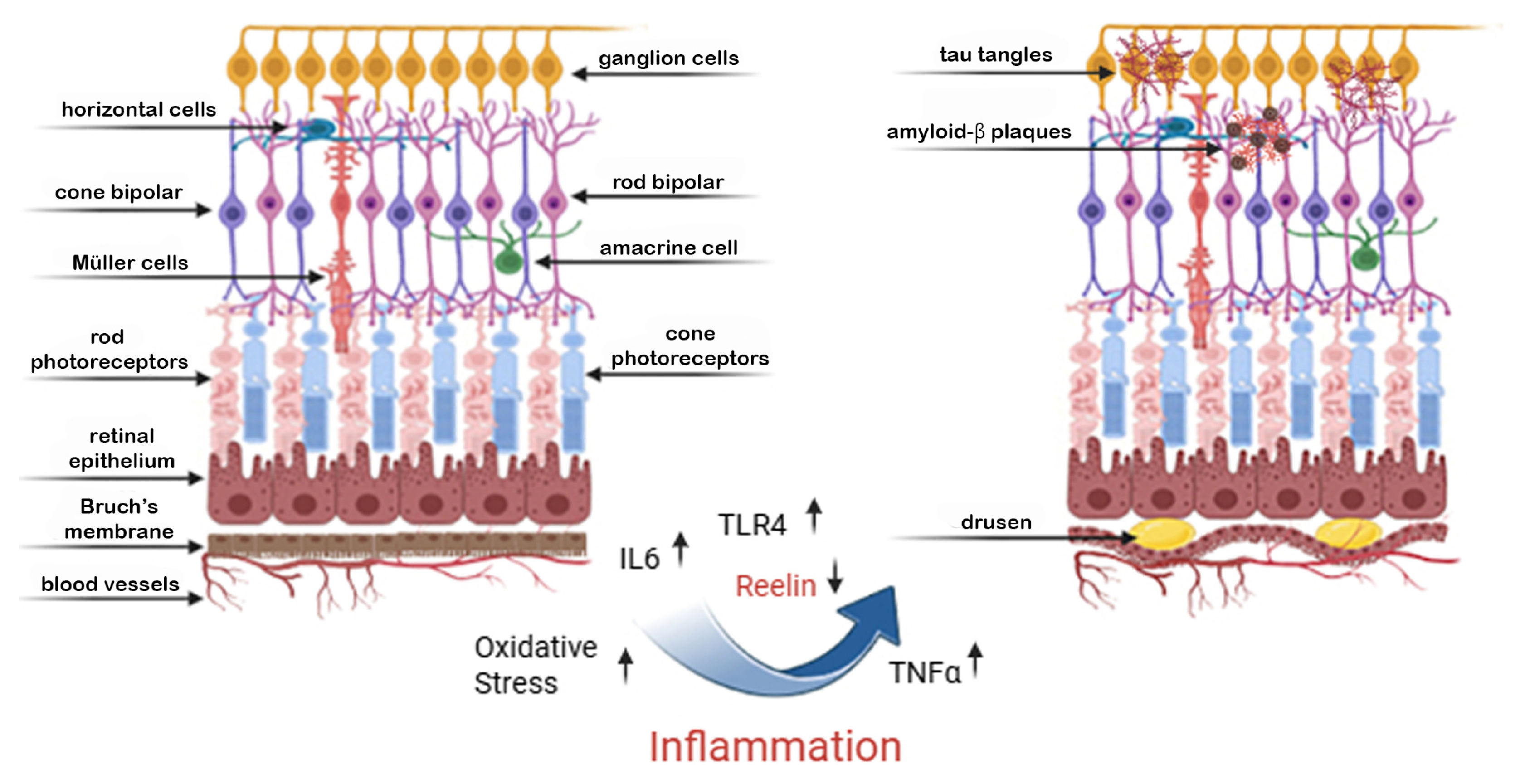 Рисунок 2. Дегенерация сетчатки, вызванная воспалением: общий путь развития с нейродегенерацией. На этом рисунке показаны структурные и молекулярные изменения в сетчатке, связанные с хроническим воспалением, которые аналогичны механизмам, наблюдаемым при церебральной нейродегенерации. Слева показана здоровая сетчатка с организованными слоями сетчатки, включающими фоторецепторы, клетки Мюллера, биполярные клетки и ганглиозные клетки. Справа хроническое воспаление, характеризующееся повышенным уровнем IL—6, TNF-α и TLR4 сигналов, приводит к усилению окислительного стресса и снижению регуляции Рилина, важнейшего белка внеклеточного матрикса, участвующего в стабильности нейронов. Эти молекулярные изменения способствуют накоплению ?-амилоидных бляшек и тау-клубков не только в головном мозге, но и в нейронах сетчатки, особенно затрагивая ганглиозные и биполярные клетки. Со временем эти патологические процессы способствуют образованию друзообразных отложений под пигментным эпителием сетчатки и истончению сетчатки, что является признаком дегенеративных заболеваний сетчатки, таких как возрастная макулярная дегенерация (AMD). Это приводит к прогрессирующей потере зрения на поздних стадиях, что отражает общую воспалительно–нейродегенеративную связь между сетчаткой и головным мозгом.
Рисунок 2. Дегенерация сетчатки, вызванная воспалением: общий путь развития с нейродегенерацией. На этом рисунке показаны структурные и молекулярные изменения в сетчатке, связанные с хроническим воспалением, которые аналогичны механизмам, наблюдаемым при церебральной нейродегенерации. Слева показана здоровая сетчатка с организованными слоями сетчатки, включающими фоторецепторы, клетки Мюллера, биполярные клетки и ганглиозные клетки. Справа хроническое воспаление, характеризующееся повышенным уровнем IL—6, TNF-α и TLR4 сигналов, приводит к усилению окислительного стресса и снижению регуляции Рилина, важнейшего белка внеклеточного матрикса, участвующего в стабильности нейронов. Эти молекулярные изменения способствуют накоплению ?-амилоидных бляшек и тау-клубков не только в головном мозге, но и в нейронах сетчатки, особенно затрагивая ганглиозные и биполярные клетки. Со временем эти патологические процессы способствуют образованию друзообразных отложений под пигментным эпителием сетчатки и истончению сетчатки, что является признаком дегенеративных заболеваний сетчатки, таких как возрастная макулярная дегенерация (AMD). Это приводит к прогрессирующей потере зрения на поздних стадиях, что отражает общую воспалительно–нейродегенеративную связь между сетчаткой и головным мозгом.
Дисфункция сетчатки может отражать потенциальные патологические явления, происходящие в головном мозге, включая снижение синаптической пластичности или нарушение передачи сигналов нейронами [3]. Рилин также может модулировать нейровоспаление, которое играет ключевую роль при AD и это событие может повлиять на сетчатку, ускоряя повреждение нейронов и ухудшение зрения [8].
Исследования показывают, что нарушение регуляции липидного обмена может способствовать развитию AMD несколькими путями [8,55]. AMD характеризуется разрушением RPE, накоплением друз (богатых липидами отложений) и хроническим воспалением в макуле [56]. Снижение уровня рилина может ослабить гомеостаз ECM, что приводит к структурным повреждениям в RPE и мембране Бруха, нарушению обмена ECM и накоплению неправильно свернутых белков в друзах [57]. Изменения уровня Reelin в сетчатке глаза при AD могут открыть новые перспективы для ранней диагностики и отслеживания прогрессирования заболевания при AD и/или старческом слабоумии [21]. Снижение уровня Reelin в сетчатке глаза в экспериментах было связано с тяжестью AD [1,58].
Как указывалось выше, комплекс RELN-APOER2-DAB1 вызывает многие патологические состояния [42]. Недавняя связь между аллелями ApoE и патологией сетчатки указывает на важность распознавания функции рецепторов ApoE в нормальной и пораженной сетчатке [59]. Человеческий промотор Reelin чувствителен к метилированию, и в случае гиперметилирования ДНК-метилтрансферазой 1 (Dnmt1) экспрессия Reelin подавляется (негативная регуляция) [60-62]. Рилин также может подавлять провоспалительные процессы, в частности, снижая экспрессию IL-6 и TNF-α [8]. При AMD снижение активности Reelin связано с обострением иммунного ответа, модуляцией клеточных реакций на окислительное повреждение и нарушением способности сетчатки справляться с окислительным стрессом и липидным обменом, что способствует образованию друз и потере фоторецепторов (повреждение RPE) [8,56,63].
Недавно глазные жидкости были предложены в качестве хорошей матрицы для диагностики нейродегенеративных расстройств в качестве минимально инвазивной альтернативы ликвору, учитывая их более доступный и надежный диагностический путь как при взятии проб, так и при анализе биомаркеров [64]. В частности, анализ водянистой влаги и стекловидного тела, а также слезной жидкости в сочетании с прямой визуализацией сетчатки может быть многообещающим, неинвазивным или минимально инвазивным подходом для начала использования Рилина в качестве раннего биомаркера AMD или AD (40,65). Изменения в уровне слезной пленки могут отражать системные изменения или изменения в головном мозге, обеспечивая связь между нервной и зрительной системами [66]. Поскольку глазная жидкость находится под влиянием местной микросреды и представляет собой резервуар для высвобождения тканевых медиаторов, определение уровня рилина в водянистой жидкости и стекловидном теле может коррелировать с изменениями в ликворе тканей при AD предлагая альтернативный метод раннего выявления биомаркеров [67,68]. Эта концепция подтверждается тем фактом, что сетчатка является частью ЦНС и имеет общие нейропатологические особенности с нейродегенерирующим мозгом [21,69].
Недавние исследования были проведены с целью изучения взаимодействий Рилина с другими важными молекулами, такими как интегрины и матриксные металлопротеиназы, для поиска лекарственных мишеней [33]. Роль Рилина в поддержании синаптической стабильности, его взаимодействие с факторами риска AMD и его присутствие в биологических жидкостях делают его привлекательным кандидатом в качестве потенциального раннего биомаркера [21,40]. Эти методы могут повысить точность диагностики, облегчить своевременное вмешательство и обеспечить непрерывное отслеживание заболеваний.
3.3. Reelin and GUT Axis
“Кишечная ось” означает связь между кишечником и другими органами, осуществляемую в двунаправленном режиме и при взаимодействии различных факторов (нервов, воротной вены, кишечного эпителиального барьера) с участием кишечной микробиоты [70]. Высокая экспрессия рецепторных путей Reelin (белков ApoER2, VLDLr и Dab1) была обнаружена как в экспериментальных моделях кишечника, так и при заболеваниях человека [37]. Экспрессия транскрипта Reelin наблюдалась в основном в фибробластах, в то время как транскрипты, специфичные для Dab1, ApoER2, VLDLr и интегринов α3 и β1, были обнаружены в энтероцитах, криптах и кишечных фибробластах [57]. Рилин был выделен из фибробластов кишечника и эпителиального слоя ворсинок (α-гладкомышечный актин (α-SMA), экспрессируемый миофибробластами) [71]. Присутствие белков VLDLR и Dab1 было подтверждено как в клетках крипт, так и в ворсинках, с заметным избытком в энтероцитах, в то время как белок ApoER2 был идентифицирован в верхней половине ворсинок и отсутствовал в структурах крипт [57] в нервной системе кишечника из-за аналогичных процессов пролиферации, дифференцировки и апоптоза вдоль крипт– оси ворсинок [57]. Хотя точные механизмы, управляющие миграцией клеток между криптами и ворсинками, до конца не выяснены, предполагается, что они включают синергетическое взаимодействие адгезии клетка–клетка, адгезии клетка–матрикс и изменений в цитоскелете. Эмпирические исследования показали, что Рилин также может влиять на миграцию клеток вдоль оси крипта–ворсинка, поскольку его содержание в области крипт выше, чем в ворсинках [57]. Это изменение потенциально может быть объяснено высвобождением рилина на базальной мембране с последующей его диффузией в эпителиальный слой для выполнения своих функций [57]. В совокупности эти исследования дают убедительный аргумент в пользу участия Рилина в миграции от крипт в ворсинки. Мыши Reeler демонстрируют повышенные показатели воспаления по сравнению с мышами дикого типа, что позволяет предположить, что мутация повышает их уязвимость к DSS-индуцированному колиту [72].
В недавней работе Carvajal и соавторов были представлены доказательства того, что дистальный отдел толстой кишки мыши усиливает выработку Reelin в ответ на dextran sodium sulfate (DSS)-colitis посредством ДНК-метилтрансферазы 1 (DNMT1)-зависимого гипометилирования промоторной области гена и что Reelin оказывает защитное действие против колита [73]. Микробиота кишечника, сложная экосистема, влияющая на пищеварение, иммунный ответ и обмен веществ, связана со здоровьем и благополучием, включая отсутствие дегенеративных заболеваний [74], в то время как воспаление может вызывать патологии кишечника, как показано на рисунке 3.
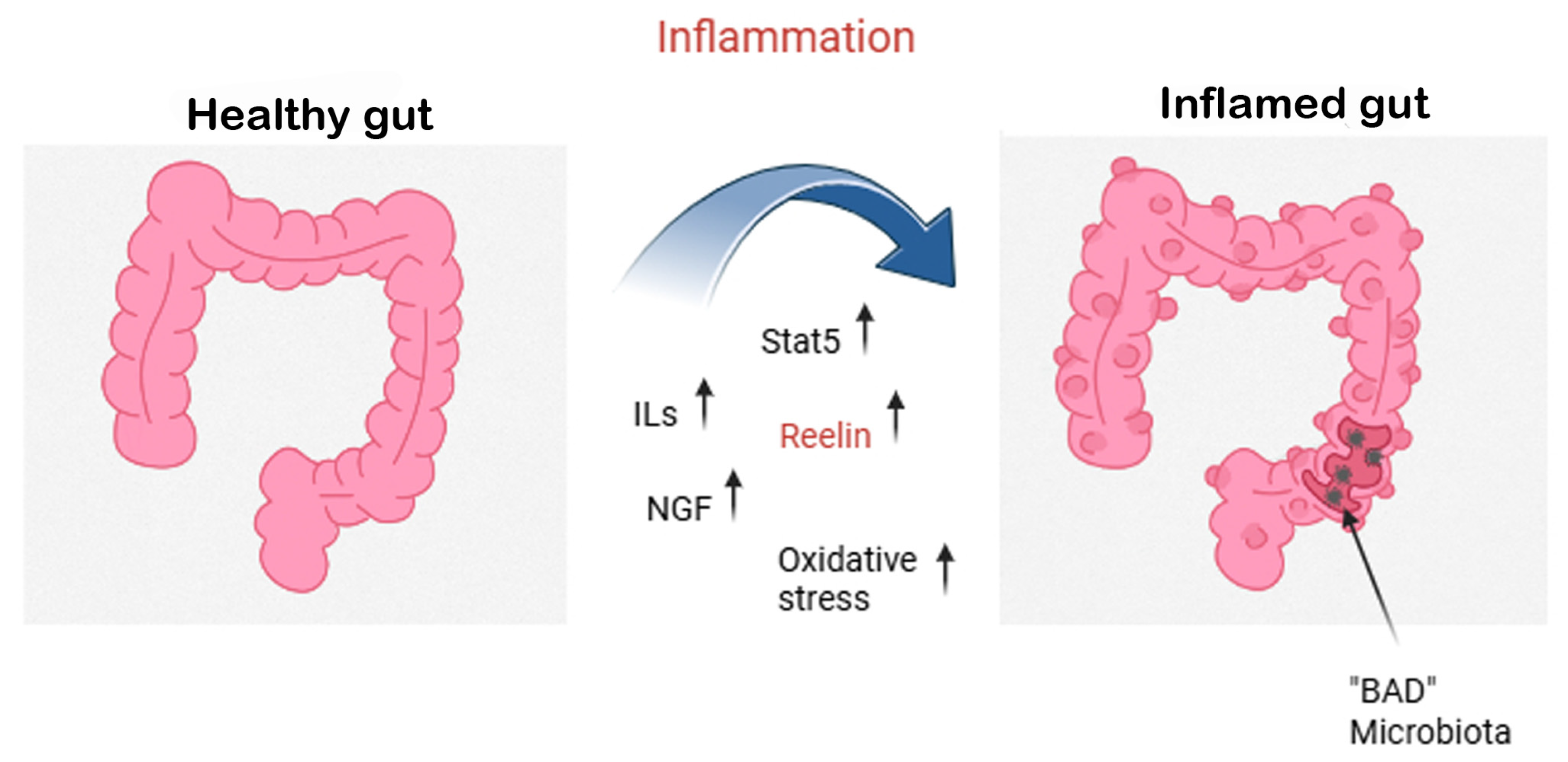 Рисунок 3. Воспаление кишечника и нейропротекторная роль Рилина и NGF. Этот рисунок объясняет переход от здорового кишечника (слева) к воспаленному кишечнику (справа), вызванный дисбактериозом и чрезмерными воспалительными реакциями. Во время воспаления кишечника повышается уровень провоспалительных цитокинов (интерлейкинов, ILs) и окислительного стресса, что приводит к повреждению эпителия и потере полезной (“хорошей”) микробиоты. В свою очередь, это допускает колонизацию патогенной (“плохой”) микробиотой, увековечивая воспалительный процесс. Активируются молекулярные медиаторы, такие как преобразователь сигнала и активатор транскрипции 5 (STAT5), в то время как экспрессия Рилина, гликопротеина с известными нейропротекторными функциями, повышается. Одновременно фактор роста нервов (NGF) и остаточный Рилин действуют как компенсаторные сигналы, помогая смягчить воспаление и защитить целостность нейронов и эпителия кишечника.
Рисунок 3. Воспаление кишечника и нейропротекторная роль Рилина и NGF. Этот рисунок объясняет переход от здорового кишечника (слева) к воспаленному кишечнику (справа), вызванный дисбактериозом и чрезмерными воспалительными реакциями. Во время воспаления кишечника повышается уровень провоспалительных цитокинов (интерлейкинов, ILs) и окислительного стресса, что приводит к повреждению эпителия и потере полезной (“хорошей”) микробиоты. В свою очередь, это допускает колонизацию патогенной (“плохой”) микробиотой, увековечивая воспалительный процесс. Активируются молекулярные медиаторы, такие как преобразователь сигнала и активатор транскрипции 5 (STAT5), в то время как экспрессия Рилина, гликопротеина с известными нейропротекторными функциями, повышается. Одновременно фактор роста нервов (NGF) и остаточный Рилин действуют как компенсаторные сигналы, помогая смягчить воспаление и защитить целостность нейронов и эпителия кишечника.
Эти механизмы отражают те, что наблюдаются в сетчатке и головном мозге, где подавление регуляции липидного обмена, воспаление и окислительный стресс способствуют нейродегенеративным изменениям. Наличие общих молекулярных структур в этих органах подтверждает существование оси мозг–глаза–кишечник, по которой нейровоспалительные и нейропротекторные сигналы взаимосвязаны во всех системах. Понимание этой взаимосвязи может открыть новые возможности для лечения хронических заболеваний, охватывающих множество органов, включая нейродегенеративные заболевания, заболевания сетчатки и желудочно-кишечного тракта.
4. Reelin in the Psycho–Neuro–Endocrine–Immunology Circuit and Gut–Brain–Eye Axis
Дисциплина психонейро–эндокринной иммунологии (PNEI), также известная как психонейроиммунология или PNI, изучает взаимодействия между нервной, эндокринной и иммунной системами и механизмы действия, участвующие в регулировании баланса PNEI у человека [75]. Исследования возможной связи между этими четырьмя системами начались в первые десятилетия прошлого века с новаторской работы нескольких ученых, которые положили начало интересу к химической связи между мозгом и железами внутренней секреции. Объединяя различные междисциплинарные результаты, PNEI стремится продемонстрировать, что человеческие системы работают не поодиночке, а в единой сети, что приводит нас к выводу о том, что психика - это измерение, возникающее из биологического измерения, влияющее на эндокринную, иммунологическую и зрительную системы, и обладающее собственной автономией, позволяющей ему воздействовать на мозг, модифицируя его, когда в эндокринной или иммунологической системе происходят, казалось бы, некоррелированные изменения [76].
На сегодняшний день PNEI - это инновационный междисциплинарный подход, оказавший заметное влияние на прецизионную медицину, который может представлять собой сдвиг парадигмы от строго биомедицинского взгляда на здоровье и болезни к междисциплинарному подходу. В последнее десятилетие наша группа расширила свой интерес к оси PNEI и зрительной системе (PNEI-V), в основном основываясь на результатах исследования NGF и уровня кортизола [77,78]. Для углубленного изучения этой темы мы выдвинули гипотезу о решающей роли PNEI-V при витреоретинальных заболеваниях, предположив наличие некоторой сети для восстановления. Медиаторы, оказывающие плейотропное действие на функцию нейронов и когнитивные процессы, такие как Рилин, NGF, BDNF, холин, источники микробиоты и другие, а также комбинированные ингибиторы цитиколина, мемантина и ацетилхолинэстеразы (AChEIs) у пациентов с AD свидетельствуют о благотворном влиянии такого образа мышления [79].
5. Preclinical Studies and Their Potential Therapeutic Implications
Несмотря на то, что ни один из методов лечения, непосредственно нацеленных на Рилин, еще не применялся в клинической практике, в ходе доклинических исследований было разработано несколько многообещающих стратегий [37]. Моноклональное антитело CR50 продемонстрировало эффективность при лечении мышей с аутоиммунными и воспалительными заболеваниями. При применении при экспериментальном аутоиммунном энцефаломиелите CR50 избирательно подавляет действие Reelin, регулирует активацию эндотелия и предотвращает инфильтрацию лейкоцитов, не влияя на синаптическую пластичность или токсичность для ЦНС в целом [37]. В результате того, что CR50 нарушает олигомеризацию Reelin, Dab1 не может взаимодействовать с Reelin, и нисходящая передача сигналов в эндотелиальных клетках не активируется [27]. Напротив, повышение уровня Reelin оказалось многообещающим методом лечения на мышиных моделях болезни Альцгеймера. Этого можно достичь либо путем защиты нейронов от гиперфосфорилирования tau и токсичности, вызванной Aβ42, in vitro, либо путем сверхэкспрессии Reelin у животных с избыточной экспрессией APP, что задерживает образование бляшек Aβ и поддерживает память [1]. Кроме того, Рилин ингибирует агрегацию α-синуклеина и способствует выживанию дофаминергических нейронов в моделях болезни Паркинсона за счет усиления регуляции лизосомального LAMP1, особенно в условиях обогащения. In vitro CR-50 устраняет эти эффекты [80].
В целом, анти-рилиновая терапия и терапия, повышающая уровень Рилина, демонстрируют четкую механическую эффективность в различных моделях нейродегенеративных заболеваний, а также новые клинические профили безопасности in vivo [37]. Однако, перенос на заболевания человека по-прежнему затруднен. Будущие исследования должны быть сосредоточены на (i) обеспечении долгосрочной безопасности для ЦНС, (ii) оптимизации дозировки и доставки для системной модуляции Reelin и (iii) начале ранней фазы испытаний на людях для оценки биомаркеров защиты эндотелия и нейронов. Рилин получает все большее признание за его участие в лечении нейродегенеративных заболеваний, особенно при AD [21]. Однако его независимая диагностическая ценность ограничена противоречивыми результатами различных исследований и отсутствием специфичности. Из-за посттрансляционных изменений и периферической экспрессии уровни рилина в крови кажутся менее информативными [27]. Стратегии терапевтического модулирования Reelin показывают, что использование моноклональных антител для периферического истощения Reelin может уменьшить нейровоспаление, не влияя на функцию центральной нервной системы [37], в то время как улучшение передачи сигналов Reelin продемонстрировало нейропротекторные эффекты в моделях AD и может уменьшить tau-патологию, о чем свидетельствует защитный вариант RELN у человека, устойчивого к AD в известном случае [22]. Однако имеющиеся данные в основном доклинические, и стандартизированных клинических анализов Reelin не существует. Для подтверждения его диагностического и терапевтического применения необходимы длительные исследования на людях, стандартизация протоколов измерений и комбинация Reelin с установленными биомаркерами.
6. Conclusions and Future Perspectives
Сетчатка все чаще признается зеркалом нейродегенерации головного мозга, имеющим общее эмбриологическое происхождение и молекулярные характеристики [81]. AD и AMD также имеют много общего в патологии, такой как накопление β-амилоида и tau-белка, воспаление и сосудистые изменения. Эти сходства подразумевают, что изменения сетчатки при AMD могут отражать или даже предшествовать их возникновению в головном мозге [82]. Однако остается неясным, является ли AMD ранним признаком AD (или наоборот), и необходимы дальнейшие продолжительные исследования, чтобы выяснить эту взаимосвязь. Рилин играет центральную роль как в развитии нервной системы, так и в дегенеративных процессах. Этот крупный белок внеклеточного матрикса необходим для миграции нейронов, синаптической пластичности и выживания, и его нарушение регуляции хорошо задокументировано при AD (совместная локализация с Aβ-бляшками и tau-клубками) [57].
В наше время, характеризующееся дискуссиями о Xamamine, Citicoline и микробиоте с точки зрения их полезного применения при потере нейронов при AD и DS, мы в первую очередь подчеркиваем потенциальное использование Рилина в качестве биомаркера для мониторинга ранних и текущих воспалительных процессов (потери нейронов) [8].
С терапевтической точки зрения модулирование передачи сигналов Reelin изучается в качестве новой противовоспалительной стратегии. Это позволяет предположить способ уменьшения хронического нейровоспаления при таких заболеваниях, как AD, рассеянный склероз, атеросклероз или артрит, путем воздействия на сосудистую систему, где действует Reelin [21]. Изменения в передаче сигналов Reelin, связанные с гиперфосфорилированием tau и отложением Aβ, могут свидетельствовать о том, что Reelin является суррогатным маркером, полезным для выявления состояний от MCI до AD (дифференциальной диагностики). Как системные факторы контролируют экспрессию, секрецию и протеолиз Reelin, остается в значительной степени неизвестным. Выяснение этих регуляторных механизмов важно, поскольку воздействие Рилина за пределами мозга и его взаимодействие с такими факторами риска, как гипертония, гиперлипидемия или изменения микробиома кишечника, могут оказывать глубокое влияние на нейродегенеративные процессы [50].
В проспективных исследованиях необходимо измерять уровень Reelin в крови и ликворе наряду с установленными биомаркерами (Aβ, tau), чтобы оценить его чувствительность, специфичность и дополнительную ценность. Также важно учитывать периферические факторы (возраст, пол, диета, воспаление), поскольку уровень рилина в плазме крови после достижения зрелого возраста практически не меняется.
Понимание того, как ферменты, например дезинтегрин и металлопротеиназа с тромбоспондиновыми мотивами (ADAMTS) или металлопротеиназы (MMPs), и сигнальные пути изменяют процессинг рилина при AD, AMD и сахарном диабете, могут выявить новые лекарственные мишени. Необходимо установить долгосрочные профили безопасности при снижении уровня периферического рилина, чтобы избежать нежелательных сосудистых или коагуляционных побочных эффектов. В то же время, потенциальные когнитивные преимущества усиления передачи сигналов Рилина в головном мозге заслуживают изучения, учитывая экспериментальные доказательства того, что добавки рилина могут восстанавливать синаптическую функцию в моделях AD.
Таким образом, Рилин связывает физиологию сетчатки и головного мозга, и его нарушение все чаще проявляется при AMD, AD и других хронических воспалительных заболеваниях [21]. Полное раскрытие многогранных функций Рилина, от развития и пластичности до модуляции иммунитета, может привести к разработке новых стратегий ранней диагностики и вмешательства. Продолжение междисциплинарных исследований, объединяющих офтальмологию, неврологию и иммунологию, будет иметь важное значение для реализации перспективных методов диагностики и терапии нейродегенеративных заболеваний на основе Reelin. Это будет включать в себя выяснение того, предшествуют ли изменения сетчатки патологическим изменениям головного мозга при AD/AMD или отражают их, а также оценку анализов циркулирующей сетчатки (и ее фрагментов) для раннего выявления когнитивных нарушений. Таким образом, выяснение регуляции, расщепления и функции Рилина в периферических тканях (печень, эндотелий, кишечник) и его влияния на нейродегенерацию, а также разработка методов лечения, направленных против Рилина (или усиливающих его действие), может обеспечить модуляцию воспаления без ущерба для передачи важных сигналов Рилина в ЦНС.
 Figure 1. Inflammatory signaling and Reelin downregulation drive neurodegeneration in aging-related disorders. This illustration highlights the progressive transformation of a healthy neuron (left) into a degenerating one (right) due to chronic inflammatory activation and molecular dysregulation. Central to this process is a reduction in expression of Reelin, a key extracellular matrix protein involved in synaptic plasticity and neuronal integrity. As Reelin levels drop, inflammatory mediators such as interleukin-6 (IL-6) and toll-like receptor 4 (TLR4) become upregulated, promoting a cascade of detrimental events including increased oxidative stress, accumulation of amyloid-Я plaques, and formation of neurofibrillary tangles composed of hyperphosphorylated tau protein. Together, these pathological features contribute to the breakdown of neuronal structure and function, ultimately leading to neurodegeneration, a hallmark of aging-related neurodegenerative diseases such as Alzheimer’s disease.
Figure 1. Inflammatory signaling and Reelin downregulation drive neurodegeneration in aging-related disorders. This illustration highlights the progressive transformation of a healthy neuron (left) into a degenerating one (right) due to chronic inflammatory activation and molecular dysregulation. Central to this process is a reduction in expression of Reelin, a key extracellular matrix protein involved in synaptic plasticity and neuronal integrity. As Reelin levels drop, inflammatory mediators such as interleukin-6 (IL-6) and toll-like receptor 4 (TLR4) become upregulated, promoting a cascade of detrimental events including increased oxidative stress, accumulation of amyloid-Я plaques, and formation of neurofibrillary tangles composed of hyperphosphorylated tau protein. Together, these pathological features contribute to the breakdown of neuronal structure and function, ultimately leading to neurodegeneration, a hallmark of aging-related neurodegenerative diseases such as Alzheimer’s disease.
 Рисунок 2. Дегенерация сетчатки, вызванная воспалением: общий путь развития с нейродегенерацией. На этом рисунке показаны структурные и молекулярные изменения в сетчатке, связанные с хроническим воспалением, которые аналогичны механизмам, наблюдаемым при церебральной нейродегенерации. Слева показана здоровая сетчатка с организованными слоями сетчатки, включающими фоторецепторы, клетки Мюллера, биполярные клетки и ганглиозные клетки. Справа хроническое воспаление, характеризующееся повышенным уровнем IL—6, TNF-α и TLR4 сигналов, приводит к усилению окислительного стресса и снижению регуляции Рилина, важнейшего белка внеклеточного матрикса, участвующего в стабильности нейронов. Эти молекулярные изменения способствуют накоплению ?-амилоидных бляшек и тау-клубков не только в головном мозге, но и в нейронах сетчатки, особенно затрагивая ганглиозные и биполярные клетки. Со временем эти патологические процессы способствуют образованию друзообразных отложений под пигментным эпителием сетчатки и истончению сетчатки, что является признаком дегенеративных заболеваний сетчатки, таких как возрастная макулярная дегенерация (AMD). Это приводит к прогрессирующей потере зрения на поздних стадиях, что отражает общую воспалительно–нейродегенеративную связь между сетчаткой и головным мозгом.
Рисунок 2. Дегенерация сетчатки, вызванная воспалением: общий путь развития с нейродегенерацией. На этом рисунке показаны структурные и молекулярные изменения в сетчатке, связанные с хроническим воспалением, которые аналогичны механизмам, наблюдаемым при церебральной нейродегенерации. Слева показана здоровая сетчатка с организованными слоями сетчатки, включающими фоторецепторы, клетки Мюллера, биполярные клетки и ганглиозные клетки. Справа хроническое воспаление, характеризующееся повышенным уровнем IL—6, TNF-α и TLR4 сигналов, приводит к усилению окислительного стресса и снижению регуляции Рилина, важнейшего белка внеклеточного матрикса, участвующего в стабильности нейронов. Эти молекулярные изменения способствуют накоплению ?-амилоидных бляшек и тау-клубков не только в головном мозге, но и в нейронах сетчатки, особенно затрагивая ганглиозные и биполярные клетки. Со временем эти патологические процессы способствуют образованию друзообразных отложений под пигментным эпителием сетчатки и истончению сетчатки, что является признаком дегенеративных заболеваний сетчатки, таких как возрастная макулярная дегенерация (AMD). Это приводит к прогрессирующей потере зрения на поздних стадиях, что отражает общую воспалительно–нейродегенеративную связь между сетчаткой и головным мозгом.
 Рисунок 3. Воспаление кишечника и нейропротекторная роль Рилина и NGF. Этот рисунок объясняет переход от здорового кишечника (слева) к воспаленному кишечнику (справа), вызванный дисбактериозом и чрезмерными воспалительными реакциями. Во время воспаления кишечника повышается уровень провоспалительных цитокинов (интерлейкинов, ILs) и окислительного стресса, что приводит к повреждению эпителия и потере полезной (“хорошей”) микробиоты. В свою очередь, это допускает колонизацию патогенной (“плохой”) микробиотой, увековечивая воспалительный процесс. Активируются молекулярные медиаторы, такие как преобразователь сигнала и активатор транскрипции 5 (STAT5), в то время как экспрессия Рилина, гликопротеина с известными нейропротекторными функциями, повышается. Одновременно фактор роста нервов (NGF) и остаточный Рилин действуют как компенсаторные сигналы, помогая смягчить воспаление и защитить целостность нейронов и эпителия кишечника.
Рисунок 3. Воспаление кишечника и нейропротекторная роль Рилина и NGF. Этот рисунок объясняет переход от здорового кишечника (слева) к воспаленному кишечнику (справа), вызванный дисбактериозом и чрезмерными воспалительными реакциями. Во время воспаления кишечника повышается уровень провоспалительных цитокинов (интерлейкинов, ILs) и окислительного стресса, что приводит к повреждению эпителия и потере полезной (“хорошей”) микробиоты. В свою очередь, это допускает колонизацию патогенной (“плохой”) микробиотой, увековечивая воспалительный процесс. Активируются молекулярные медиаторы, такие как преобразователь сигнала и активатор транскрипции 5 (STAT5), в то время как экспрессия Рилина, гликопротеина с известными нейропротекторными функциями, повышается. Одновременно фактор роста нервов (NGF) и остаточный Рилин действуют как компенсаторные сигналы, помогая смягчить воспаление и защитить целостность нейронов и эпителия кишечника.