Одним общим признаком всех эмбрионов позвоночных является их начало с оплодотворения одиночной клетки или зиготы. Последующие серии митотических делений ведут к формированию выглядящей не организованной в паттерн, недетерминированной массы идентичных клеток. Однако, незначительные отличия между этими клетками возникают очень рано, создавая асимметрию внутри эмбриона, которая важна для развития сложного нового организма. Прежде, чем стать морфологически видимой, инициальная эмбриональная полярность и асимметрии очевидны только на молекулярном уровне. Начато выяснение генетических и морфогенетических механизмов, генерирующих полярность у эмбрионов позвоночных. В конечном итоге эти процессы д. закладывать основу инициальных асимметрий, которые направляют установление трех основных осей тела: Anterio-Posterior (A-P), Dorso-Ventral (D-V) и Left-Right (L-R) оси.
Многие из инициальных исследований были осуществлены с использованием эмбрионов амфибий, Xenopus laevis, в качестве животной модели. Известные потребности для поддержания животных, легкое получение больших количеств оплодотворенных эмбрионов и относительно крупные размеры яиц, сделали их наиболее широко используемым в эмбриологических исследованиях. В 1924, Hans Spemann и Hilde Mangold продемонстрировали, что трансплантация губы дорсальной части бластопора эмбриона тритона на вентральную (противоположную) часть эмбриона хозяина вызывает образование новой оси тела или Сиамских близнецов (Spemann and Mangold, 1924). Более того, они наблюдали, что эта трансплантированная ткань способна индуцировать окружающие клетки к приобретению новых судеб, организуя таким способом образование новой ЦНС и осевой мезодермы (хорды), а также внося вклад в дорсализацию мезодермы и генерацию сомитов. Благодаря этим активностям губа дорсальной части бластопора была обозначена как "Organizer" или "Spemann Organizer".
Далее начались исследования молекулярных игроков, которые обеспечивают индуктивную активность Организатора. Goosecoid стал первой экспрессирующейся в Организаторе молекулой, которая была выделена из эмбрионов Xenopus laevis . Избыточная экспрессия на вентральной стороне эмбриона этого содержащего гомеодомен фактора оказалась способной эффективно генерировать вторичную ось тела, напоминая активность Организатора (Cho et al., 1991). Выделение и изучение гомологичных goosecoid генов у др. видов позвоночных привело к идентификации организатора как общего признака эмбрионов позвоночных. Организатор известен как Гензеновский узелок у кроликов и кур, как щиток у рыбок данио и как передний конец первичной полоски у эмбрионов мышей (Cho et al., 1991; Blum et al., 1992; Izpisua-Belmonte et al., 1993; Stachel et al., 1993; Schulte-Merker et al., 1994). Со времени этих первых находок несколько др. молекул, экспрессирующихся в организаторе позвоночных были выделены и изучены в отношении их молекулярных характеристик. Клетки организатора экспрессируют несколько транскрипционных факторов, подобных goosecoid, Siamois, HNF3β, Xtwn, Xlim-1, Xnot, и секретируемые транскрипционные факторы с "dorsalizing activity", подобные Chordin, Noggin, Follistatin, Frzb-1, crescent, SFRPs и DKK-1. Некоторые молекулы, секретируемые организатором во внеклеточное пространство соединяются и ингибируют активность "ventralizing factors", а именно BMP's и Wnt8, обеспечивая качественные особенности эктодермальных и мезодермальных клеток (see De Robertis et al., 1997; De Robertis and Kuroda, 2004). Среди вновь идентифицированных antagonizers, один наиболее впечатляет благодаря своим удивительным свойствам: Xenopus cerberus (Xcer). Этот новый секретируемый белок экспрессируется в наиболее переднем кончике не подверженных инволюции (noninvoluting) богатых желтком эндомезодермальных клеток, расположенных в глубоком слое Шпемановского организатора (Bouwmeester et al., 1996). Инъекция мРНК Xcer в вентральные бластомеры ведет к индукции второй головы. Этот характерный фенотип и привел к его названию, Cerberus, в чест мифологической собаки с тремя головами, охраняющей вход в царство теней.
Cerberus-родтвенные белки были идентифицированы у др. видов позвоночных (see Table 1): мышиный cerberus-like gene (cerl-1; Belo et al., 1997; Biben et al., 1998; Shawlot et al., 1998), куриный Cerberus (cCer; Rodriguez-Esteban et al., 1999; Yokouchi et al., 1999; Zhu et al., 1999), Xenopus Coco (Bell et al., 2003), Charon у рыбок данио (Hashimoto et al., 2004) и Cerberuslike-2 (Cerl-2; Marques et al., 2004) у мышей, которые теперь сгруппированы в семейство генов Cerberus/Dan. Xenopus XCer, куриный cCer и мышиный Cerl-1 гены синтеничны (www.metazome.net) и на пери-гаструляционной стадии экспрессируются в топологически эквивалентных эмбриональных структурах, таких как передняя часть эндомезодермы, гипобласт и передняя висцеральная энтодерма, соотв. (Bouwmeester et al., 1996; Foley et al., 2000; Belo et al., 1997). Напротив, Xenopus coco обнаружен экспрессирующимися во время пре-гаструляционных стадий исключительно на анимальном полюсе. На ст. гаструлы транскрипты coco могут быть выявлены как в дорсальной, так и вентральной маргинальной зоне, а также в эктодерме анимальной шапочки (Bell et al., 2003). На ранних стадиях нейруляции мышиный Cerl-1 и куриный cCer транскрипты также обнаруживаются в передней части дефинитивной мезэнтодермы (Belo et al ., 1997; Rodriguez-Esteban et al., 1999). Но на более поздних стадиях во время сомитогенеза, Cerberus-родственные гены обнаруживают оченть различающиеся паттерны экспрессии. Экспрессия XCer больше не обнаруживается. Мышиные Cerl-1 транскрипты обнаруживаются в ростральной половине двух только что сформировавшихся сомитов и ростральной части пресомитной мезодермы. Куриный cCer экспрессируется в левой параксиальной и латеральной пластинке мезодермы. Charon рыбок данио и мышиный Cerl-2 экспрессируются вокруг региона узелка, но с заметным отличием в их паттернах экспрессии: т.к. Charon имеет симметричный домен, Cerl2 строго экспрессируется на правой стороне (Bouwmeester et al ., 1996; Belo et al., 1997; Rodriguez-Esteban et al., 1999; Hashimoto et al., 2004; Marques et al., 2004). Недавно, Xcoco , как было показано, экспрессируется билатерально в задней части параксиальной мезодермы во время ст. нейрулы (Vonica and Brivanlou, 2007).
Cerberus-родственные гены принадлежат к сверхсемейству cysteine-knot и кодируют малые секреторные белки (от 185 a.a., Cerl-2 до 272 a.a., Xcer и cerl-1) с сигнальным пептидом на N-конце и Cystein-Rich Domain (CRD), содержащим 9 цистеинов в C-терминаьном регионе. После секреции эти белки протеолитически расщепляются и образуют активные димеры (Shawlot et al., 1998; Piccolo et al., 1999). Анализ последовательностей показал, что эти молекулы обнаруживают существенный уровень сходства в CRD, но вне этого региона в направлении N-конца они обнаруживают очень мало гомологии (Marques et al., 2004; Hashimoto et al., 2004). Пространственное распределение цистеинов в CRD напоминает мотив, названный цистеиновым узелком (cysteine-knot) (McDonald and Hendrickson, 1993; Isaacs, 1995), который обнаруживается также у ряда цитокинов, таких как BMP, NGF, PDGF, среди прочих. CRD в Cerberus-родственных белках содержит C-X-G-X-C мотив, законсервированный у всех cysteine-knot белков, а 3 из 4-х дополнительных цистеинов также присутствуют в NDP и mucins. Этот домен важен для биологической активности молекул Cerberus, которые, как было показано, секретируются мультивалентными антагонистами, которые связывают Nodal, BMP и Wnt белки, и возможно ингибируют их активность во внеклеточном пространстве (Belo et al., 1997; Hsu et al., 1998; Piccolo et al., 1999; Belo et al., 2000; Marques et al., 2004).
Cerberus in anterior-posterior patterning
Эмбриологические и генетические исследования предоставили доказательства существования самостоятельных головного и туловищного организаторов (Spemann, 1931; Thomas and Beddington, 1996; Belo et al., 1997; Bouwmeester and Leyns, 1997; Schneider and Mercola, 1999). Выделение и изучение Xenopus cerberus (Xcer; Bouwmeester et al., 1996), нового секретируемого фактора с сильной активностью индукции головы, экспрессирующегося в anterior dorsal endoderm (ADE), в первых сообщениях подчеркивали возможную роль этого региона в индукции передней части головы. Топографически эквивалентный этому региону у эмбрионов мыши, anterior visceral endoderm (AVE), также участвует в спецификации передних частей (Thomas and Beddington, 1996). Выделение мышиного cerberus-like гена (cerl-1; Belo et al., 1997; Biben et al., 1998; Shawlot et al., 1998), экспрессирующегося в AVE перед и во время гаструляции в регионе, лежащем в основе проспективной передней нейроэктодермы, вызвало заниженную оценку индуктивной роли этого региона у эмбрионов мыши.
Микроинъекции мРНК Xcer в вентральные бластомеры приводит к индукции второй головы. Они включают передний и средний мозг, глаза, цементную железу и обонятельные плакоды (Bouwmeester et al., 1996). Экспланты анимальной шапочки Xenopus широко используются для изучения клеточной дифференцировки, вызванной инъекциями мРНК, кодирующих специфические генные продукты, т.к. без инъекций анимальные шапочки обычно дают только эпидермис. В эксплантах анимальной шапочки микроинъекции мРНК XCer индуцировали маркеры передней части ЦНС, такие как Otx2, но не более задние, подобные Engrailed-2 или HoxB9, это согласуется с отсутствием структур головного мозга кзади от среднего мозга в генерируемой эктопической голове. Энтодермальный ( endodermin) и сердечный ( Nkx-2.5) маркеры также активируются в экспериментах с анимальной шапочкой (Bouwmeester et al., 1996). В некоторых случаях индукция этих похожих на голову структур сопровождалась удвоением сердца и печени. Этот факт может быть связан со способностью мРНК XCerberusиндуцировать упомянутые энтодермальные и сердечные маркеры. XCerberus экспрессируется в клетках, богатых желтком, которые образуют ведущий край гаструлирующей энтодермы Xenopus. Эта клеточная популяция д. в конечном итоге дать переднюю и среднюю кишку. включая печень, как показывает отслеживание клеточных клонов с DiI (Bouwmeester et al., 1996).
В попытке определить генетические и биохимические основы индукции головы с помощью XCer, Piccolo and colleagues продемонстрировали, что Cerberus действует как мультивалентный антагонист ростовых факторов, соединяясь с белками Nodal, BMP и Wnt (Piccolo et al., 1999), ингибируя тем самым активность этих белков во внеклеточном пространстве. Используя некоторые антагонисты этих сигнальных путей, удалось продемонстрировать, что ингибирование сигналов Nodal, BMP и Wnt в вентральных бластомерах достаточно, чтобы индуцировать вторую голову (Piccolo et al., 1999; Glinka et al., 1997). В свете этих фактов было предположено, но не подтверждено, что секреция Cerberus во внеклеточное пространство необходима для закрытия программы головного организатора путем одновременного противодействия трем сигнальным путям, участвующим в формировании туловища, тем самым ограничивается туловищная территория задней частью тела.
Чтобы попытаться выяснить роль XCer, мы использовали комбинацию подходов, используя нокдаун, избыточную экспрессию и рекомбинацию тканей. Morpholino oligonucleotides against XCer (Cer-MO) микроинъецироали в два дорсальных вегетативных бластомера на 4-8 клеточной стадии эмбрионов Xenopus, это нарушало индукцию головы, где уменьшались первичная голова и глаза (Silva et al., 2003; Kuroda et al., 2004). Чтобы выяснить биологическую роль XCer и ADE в формировании головы, мы решили изменить активность и локальную потребность в Xcerberus во время этого процесса.
Мы взялись за это, используя mcer-1 промотор для управления экспрессией BMP, Nodal или Wnt молекул в ADE. До этого мы генерировали лини трансгенных мышей, используя этот промоторный элемент для управления экспрессией EGFP в AVE (Mesnard et al., 2004). Мы также продемонстрировали, что этот мышиный промотор специфически активируется в Xenopus ADE и сильно напоминает пространственно-временной паттерн экспрессии эндогенного XCer (Silva et al., 2003). В этих экспериментах, целенаправленное увеличение BMP, Nodal и Wnt сигналов (которым предположительно противодействует XCer) в ADE, приводит к заметной синергичной потере передней части головы без нарушения задних (туловищных) структур. Но когда мы одновременно истощали уровни XCer и ко-микроинъецировали CerMO, то мы наблюдали сильное усиление фенотипов, генерируемых увеличением уровней активности BMP, Nodal и Wnt, а возникающие эмбрионы полностью лишены головных структур (Silva et al., 2003). Эти результаты демонстрируют, что фактически Xcerberus является биологическим ингибитором передачи сигналов BMP, Nodal и Wnt и что его активность необходима in vivo на ведущем крае ADE для собственно индукции и формирования паттерна головы. Это д. сопровождаться генерацией "headfield", защищенного от постериоризующих сигналов от туловища. Следовательно, правильный баланс агонистов и антагонистов в ADE является критическим для образования головы. Благодаря этой соотв. роли Xcer и ADE в процессе индукции головы, выделение и изучение его мышиного гомолога д. иметь важное значение для понимания механизма развития эмбриона млекопитающих. Мы и др. выделили мышиный Cerberus-like ген (cerl-1; Belo et al., 1997; Biben et al., 1998; Shawlot et al., 1998). Этот ген экспрессируется в AVE со ст. E5.5, а позднее постепенно смещается с помощью возникающей передней дефинитивной энтодермы. Эксперименты с анимальной шапочкой демонстрируют, что этот мышиный ген способен индуцировать тот же самый набор сигналов, как и XCer гомолог (Belo et al., 1997; Biben et al., 1998), но он не способен генерировать характерные эктопические головы, будучи микроинъецирован в вентральные вегетативные бластомеры (Belo et al., 1997). Эти индуктивные активности mCer-1 и Xcer в анимальных шапочках характеризуются ингибированием передачи сигналов BMP (Sasai et al., 1996). Используя биохимические и функциональные методы, мы продемонстрировали, что фактически cerl-1 соединяется и ингибирует сигналы BMP и Nodal, но в отличе от своего аналга у Xenopus , он неспособен соединяться с белками Wnt (Belo et al., 2000). Более того, эксперименты по тканевым рекомбинациям продемонстрировали. что экспрессия Otx2 сохраняется в эктодермальных эксплантах, рекомбинируемых с Cerl-1-экспресирующей сомитной-пресомитной мезодермой (Shawlot et al., 1998).
Итак, cerl-1 экспрессируется в AVE, в регионе, расположенном под проспективной передней нейроэктодермой, он обладает нейральной индуцирующей способностью в экспериментах с Xenopus и способен поддерживать экспрессию Otx2 в эксплантах мышей.
Otx2 и Lim1 являются генами экспрессирующимися в AVE и передней части нейроэктодермы. Сгенерированные KO мышиные линии демонстрируют свою необходимость для собственно образования передних головных структур (Acampora et al., 1995; Matsuo et al., 1995; Shawlot and Behringer, 1995). AVE топологически эквивалентна Xenopus ADE и участвует в спецификации передних частей (Thomas and Beddington, 1996; Belo et al., 1997). Эта роль была подтверждена находкой, что химерные эмбрионы мыши, состоящие из комбинации эпибласта дикого типа и мутантных внеэмбриональных тканей (а именно, AVE), лишенные или Otx2 или Lim1, не формируют собственно голову (Rhinn et al., 1998; Shawlot et al., 1999). В свете всех этих свойств, cerl-1 стал рассматриваться как критический игрок программы головного организатора.
Чтобы исследовать его роль в развитии, мы генерировали целенаправленную инактивацию cerl-1 у мышей (Belo et al., 2000; Shawlot et al., 2000; Stanley et al., 2000). Неожиданно, ни в одной из трех сгенерированных KO линий мышей не обнаружено дефектов головы или эмбриональной оси, это говорит против ранее широко принятой роли cerl-1 в раннем развитии.
Cerl-1, как было продемонстрировано, обладает сильной anti-BMP активностью (Belo et al., 1997; Biben et al., 1998). Др. секретируемые факторы также обладают сходной биохимической активностью: chordin, noggin и follistatin (Iemura et al., 1995; Piccolo et al., 1996; Zimmerman et al., 1996; Piccolo et al., 1999). Этот антагонизм генерирует градированное ингибирование передачи вентральных сигналов BMP, что существенно для формирования дорсо-вентрального паттерна и нейральной индукции у эмбрионов позвоночных (De Robertis and Sasai, 1996). Учитывая эти наблюдения мы предположили, что некоторые др. гены могут компенсировать отсутствие функции cerl-1 у KO мышей. Такой феномен наблюдался с BMP ингибиторами Chordin и Noggin, как указывалось выше (Bachiller et al., 2000). Оба гена экспрессируются в узелке эмбрионов мыши на ст. поздней гаструлы. Позднее они ко-экспрессируются на уровне хордальной и прехордальной пластинок. Удивительно, что двойные гомозиготные chordin;noggin обнаруживают усиливающие синергичные дефекты на уровне развития переднего мозга (Bachiller et al., 2000). Эти дефекты не индуцировались одиночными мутациями в отдельности (McMahon et al., 1998; Brunet et al., 1998; Bachiller et al., 2003), указывая на то, что некоторая компенсация происходит, когда отсутствует только один ингибитор BMP.
Эти доказательства ведут нас к тестированию, могут ли noggin или goosecoid (McMahon et al., 1998; Brunet et al., 1998; Yamada et al., 1995) компенсировать отсутствие функции cerl-1 у мышей. Оба участвуют в ингибировании передачи сигналов BMP и ко-экспрессируются с cerl-1 на уровне мезэнтодермы прехордальной пластинки, а позднее также в AVE (Belo et al., 1998). В экспериментах с Xenopus Xgsc репрессировал экспрессию BMP-4 в маргинальной зоне (Fainsod et al., 1994) и может индуцировать экспрессию chordin (Sasai et al., 1994). Однако сгенерированные двойные мутанты cerl-1;noggin и cerl-1;gsc не давали какого-либо синергичного фенотипа (Borges et al., 2001, 2002), указывая тем самым, что ни noggin, ни goosecoid не компенсируют потерю функции cerl-1 и что эти гены не взаимодействуют генетически. Эти результаты могут указывать на то, что настоящее биологическое значение cerl-1 у мышей может быть не связано с anti-BMP активностью.
Как упоминалось выше, cerl-1 обладает сильной anti-Nodal активностью (Belo et al., 2000). Исследования куриного гомолога Caronte (или chick Cerberus, cCer ) продемонстрировали, что его экспрессия в гипобласте (у кур эквивалент AVE мышей и ADE у Xenopus) необходима для образования головы (Bertocchini and Stern, 2002), путем предотвращения образования мезодермы туловища в проспективную головную нейроэктодерму посредством его anti-Nodal активности. Lefty1 является др. секретируемым узелком антагонистом и экспрессируется в клетках AVE (Meno et al., 1997). Подобно cerl-1 KO эмбрионам, сгенерированные мышиные мутанты, лишенные lefty-1, также лишены гаструляционных фенотипов (Meno et al., 1998; Belo et al., 2000). Однако, когда были получены cerl-1;lefty1 двойные мутантные животные, то развитие возникающих в результате эмбрионов было сильно нарушено из-за избыточной и нерегулируемой активности узелка (Perea-Gomez et al., 2002; Yamamoto et al., 2004). Yamamoto с коллегами показали, что асимметричное ингибирование Nodal управляет миграцией Distal Visceral Endoderm (DVE) в переднее положение. Эта миграция сопровождается стимуляцией пролиферации висцеральных энтодермальных клеток с помощью Nodal, тогда как Lefty1 и Cerl-1 детерминируют направление миграции за счет асимметричного ингибирования активности Nodal на проспективную переднюю сторону (Yamamoto et al., 2004). Позднее это сочетанное ингибирование активности Nodal в AVE также необходимо, чтобы ограничить формирование первичной полоски задним концом эмбриона мыши путем противодействия передаче сигналов Nodal (Perea-Gomez et al., 2002). Итак, эти исследования четко показывают потребность в ингибиторах узелка cerl-1 и lefty1, чьи перекрывающиеся активности во время раннего развития существенны для закладки A-P оси.
Итак, результаты исследований
Xcer, Cer-l и cCer строго подтверждают роль в генерации асимметрии на перигаструляционных стадиях. В этом контексте молекулы Cerberus проявляются как основные игроки в установлении Anterior-Posterior оси у ранних эмбрионов позвоночных.
Cerberus in left-right patterning
У позвоночных правильное развитие органов вдоль left-right (L-R) оси организации является важным для нормальной физиологии живых организмов. Следовательно, формирование симметрии тела вдоль left-right во время эмбриогенеза имеет большое значение. Установление этой асимметрии, как было показано, нуждается в асимметричной активации сигнального каскада Nodal на левой стороне стенки тела (for review see Hamada et al., 2002), в Left-Lateral Plate Mesoderm (L-LPM). В ходе эволюции позвоночных это базовое свойство сохранилось, хотя некоторые видовые специфичности дивергировали.
У эмбрионов кур первым сигналом морфологической асимметрии является наклонное положение Гензеновского узелка в конце гаструляции (Dathe et al ., 2002). Сигнальная молекула Sonic hedgehog (Shh) экспрессируется симметрично в эктодерме Гензеновского узелка до ст. HH4 (Hamburger and Hamilton 1951), времени, когда он оказывается ограниченным левой стороной узелка. Это на ст. HH7 сопровождается экспрессией Nodal на левой стороне. Nodal впервые экспрессируется в небольшом домене клеток, непосредственно соседствующих с клетками, экспрессирующими Shh, а затем в крупном домене в латеральной пластинке мезодермы. Хотя экспрессия Shh в узелке необходима и достаточна для индукции Nodal в не соседней L-LPM (PaganWestphal et al., 1998), точный механизм в основном неизвестен. Это привело к гипотезе, что существует неизвестная молекула в параксиальной мезодерме (промежуточной эмбриональной ткани), которая д. передавать эту информацию от узелка в направлении L-LPM.
Куриный гомолог XCer был выделен и изучен рядом групп (cCer; Rodriguez-Esteban et al., 1999; Yokouchi et al., 1999; Zhu et al., 1999). Помимо его экспрессии в гипобласте и передней эндомезодерме, cCer также экспрессируется в левой параксиальной и L-LPM мезодерме. Эксперименты с использованием неправильной экспрессии кусочков, смоченных белком, и in vitro исследования связывания показали, что cCer необходим и достаточен для передачи сигнала Shh от узелка к L-LPM, приводя к экспрессии Nodal и последующей активации экспрессии Left-Right специфичных генов (Rodriguez-Esteban et al., 1999; Yokouchi et al., 1999; Zhu et al., 1999). В свете этих свойств, этот новый Cerberus-like ген был переименован в Caronte (Car), по названию лодочника в Греческой мифологии, который перевозит души умерших через Реку Стикс. Caronte был затем описан как вторичный сигнал, индуцируемый с помощью Shh и репрессируемый с помощью Fgf8, а эксперименты с эктопической экспрессией Caronte подтвердили, что он достаточен, чтобы активировать Nodal в LPM. Caronte, как полагают, действует как антагонист BMP (Rodriguez-Esteban et al., 1999; Yokouchi et al ., 1999). активируя экспрессию Nodal в левой латеральной пластинке мезодермы путем осуществления репрессивного эффекта BMPs на транскрипцию Nodal.
Однако, молекулы Nodal, как было установлено, индуцируют экспрессию XCer (Osada et al., 2000) и мышиного Cerl-1 (Waldrip et al., 1998; Brennan et al., 2001), это противоположно тому, чтобы было описано для Caronte. Кроме того, экспрессия Nodal на левой стороне узелка кур может обнаруживаться до начала действия Caronte (Rodriguez-Esteban et al., 1999; Yokouchi et al., 1999; Zhu et al., 1999). Более того, у эмбрионов мыши экспрессия Nodal в L-LPM нуждается в белке Nodal, продуцируемом в узелке (Saijoh et al., 2003; Yamamoto et al., 2003). Все эти данные делают взаимоотношение между Caronte и Nodal неясными, открывая возможность, что индукция экспрессии Caronte с помощью Shh может быть опосредована с помощью Nodal а не др. способом. Более того, Caronte, как было установлено, соединяется с Nodal (Rodriguez-Esteban et al., 1999), как и др. члены семейства Cerberus; итак, если его биологическая активность также сходна с таковой его 'siblings', то он д. вести себя как ингибитор передачи сигналов узелка, а не как активатор.
Мы перепроверили роль Caronte, после переименования chicken Cerberus (cCer), в становлении асимметричной передачи сигналов от узелка. Мы использовали новый подход, а именно, электропортацию кДНК, нокдаун эксперименты с использованием morpholino олигонуклеотидов против cCer, имплантацию кусочков, смоченных белком Noda, и анализ транскрипции цис-регуляторных регионов гена cCer. В наших экспериментах неправильная экспрессия cCer в области узелка или на right-LPM никогда не была способна индуцировать Nodal, тогда как избыточная экспрессия cCer на левой стороне действительно репрессировала Nodal. Напротив, у cCer нокдаун эмбрионов, Nodal эктопически экспрессировался на правой стороне, демонстрируя, что cCer действует как негативный регулятор передачи сигналов Nodal (Tavares et al., 2007). Мы смогли также наблюдать, что фактически Nodal необходим и достаточен для индукции активности транскрипции гена cCer (Tavares et al., 2007), даже когда доставляется на Right-LPM. Мы смогли в самом деле установить, что Nodal ядерные эффекторы FoxH1 и SMAD элементы cCer левостороннего энхансера достаточны, чтобы индуцировать асимметричную экспрессию на левой стороне эмбрионов кур. Сходные энхансерные элементы обнаруживаются также в промоторах др. асимметрично экспрессируемых чувствительных к Nodal генов. таких как Leftys, Pitx2 и сам Nodal, и как было установлено, ответственны за асимметричную экспрессию этих генов. Как.в случае мышиного узелка (Saijoh et al., 2003), передача сигналов Nodal в Гензеновском узелке способна индуцировать экспрессию Nodal в L-LPM эмбрионов кур (Tavares et al., 2007). Однако индукция экспрессии cCer с помощью белка Nodal происходит быстрее, чем индукция самого Nodal.Следовательно, белок Nodal,высвобождаемый узелком, индуцирует сначала cCer в более медиальном домене (левая параксиальная мезодерма), а позднее Nodal в более латеральном домене (левой латеральной пластинке мезодермы).
Некоторые из этих данных напоминают взаимодействия, постулируемые реакционно-диффузионной моделью (Turing, 1990; Meinhardt and Gierer, 2000). Некоторые реакционно-диффузионные модели предполагают следующие 4 взаимодействия между активатором и ингибитором: активатор активирует свою собственную продукцию; активатор активирует ингибитор; ингибитор блокирует ауто-активацию активатора; ингибитор действует на большие расстояния, чтобы ограничить эффективно предел действия активатора. Взаимоотношение между Nodal и его антагонистами Lefty1 и 2 у эмбрионов мыши, как недавно было предположено, является реакционно-диффузионнного типа, само-усиливающего и латерально-ингибирующего типа (Nakamura et al., 2006). cCer может , следовательно, обладать некоторыми общими регуляторными свойствами Leftys, которые были описаны недавно.
Итак, эти данные строго подтверждают мнение, что Nodal является промежуточным сигналом, которые передает асимметрическую информацию от узелка к латеральной пластинке (Pagan-Westphal and Tabin, 1998) и что роль cCer заключается в ограничении передачи сигналов Nodal левой стороной посредством механизма негативной обратной связи, предупреждая тем самым сигналы Nodal от перехода на правую сторону эмбриона цыпленка (Tavares et al., 2007). Более того, учитывая сходство между паттернами экспрессии и функциями цыплячьего Cer и мышиного Lefty2 (for a review, see Juan and Hamada, 2001), мы предположили, что куриный, cCer выполняет роль мышиного Lefty2 в формировании лево-правостороннего паттерна и действует в дополнение к барьеру срединной линии, чтобы ограничить передачу сигналов Nodal левой стороной.
Недавно новые cerberus молекулы были выделены у мыши ( cerberus-like2; Cerl-2 ) и у рыбок данио (charon; Marques et al., 2004; Hashimoto et al., 2004). Cerl-2 тесно связан с мышиным cerberus-like (I=35%, P=47%), cCerberus (I=34%, P=51%), Xcoco (I=38%, P=53%), charon рыбок данио (I=33%, P=55%) и hCer-2 (I=57%, P=65%) человека. Функциональный анализ выявил, что оба гена играют важную роль в становлении Left-Right асимметрии (Marques et al., 2004; Hashimoto et al., 2004). Cerl-2 обнаруживает уникальный домен асимметричной экспрессии вокруг мышиного узелка, асимметрично экспрессируясь на правой стороне. Транскрипты cerl-2 могут сначала обнаруживаться в виде паттерна, похожего на подкову в регионе около узелка у E7.0 эмбрионов мыши, напоминая экспрессию Nodal на этой стадии (Lowe et al., 1996; Collignon et al., 1996). Однако позднее, на ст. головной складки, экспрессия cerl-2 начинает снижать свою интенсивность на левой стороне и на ст. E8.0 большинство её обнаруживается на правой стороне узелка, обнаруживая комплементарный паттерн экспрессии с Nodal на этой стадии (Lowe et al., 1996; Collignon et al., 1996). Мы продемонстрировали, что Cerl-2 является мощным антагонистом передачи сигналов Nodal за счет непосредственного связывания белка Nodal (Marques et al., 2004). Анализ полученной мутантной линии мышей, у которых делетирован ген Cerl-2 показал. что 1/ 3 новорожденный cerl-2-/- погибает в течение первых 48 ч после рождения и обнаруживает левый изомеризм легких, торакальный situs inversus и сердечно-сосудистые уродства, которые, по-видимому, и служат причиной их гибели. Мутантные животные, которые выживают становятся нормальными взрослыми, хотя 1/4 погибает между возрастом молочного вскармливания и 3 мес., большинство из них обнаруживает heterotaxia абдоминальных органов (Marques et al., 2004). Будучи проанализированы во время саннего сомитогенеза, было установлено, что потеря функции Cerl-2 ведет к билатеральной экспрессии специфичных для левой стороны генов Nodal, Lefty2 и Pitx2 (Marques et al., 2004).
В свете этих данных роль Cerl-2 заключается в ограничении nodal активности левой стороной узелка, предупреждая дополнительную активацию Nodal, Lefty-2 и Pitx-2 в R-LPM. В отсутствие антагонистической активности Cerl-2 в узелке, Nodal может теперь также активироваться в R-LPM, приводя к билатеральной экспрессии этого генетического каскада. Эти наблюдения подчеркивают, что
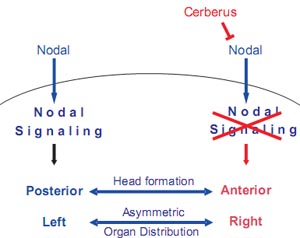 Fig. 1. Cerberus prevents Nodal signaling in the anterior and right sides of the vertebrate embryo in order to promote head formation and asymmetric distribution of the internal organs.
Fig. 1. Cerberus prevents Nodal signaling in the anterior and right sides of the vertebrate embryo in order to promote head formation and asymmetric distribution of the internal organs.
функция cerl-2 в четкой регуляции активности Nodal в узелке, указывая, что Cerl-2 играет важную роль в событиях раннего нарушения симметрия, которые происходят в узелке.
Для мышей была предложнеа модель, согласно которой моноцилии, выступающие из клеток на ст. поздней гаструлы генерируют слева направо ток внеклеточной жидкости, который и вызывает становление асимметричной экспрессии генов (Nonaka et al., 1998). Этот "nodal flow" нарушается у некоторых мутантных линий мышей, которые обнаруживают L-R фенотипы, это подтверждает его роль в становлении правильной лево-правосторонней оси тела (Nonaka et al., 1998; Marszalek et al., 1999). Работа с Cerl-2 подтверждает, что у мышей L-R асимметрия контролируется механизмом с двойной гарантией, состоящем из двух систем, работающих параллельно, первая связана с левонаправленным током нодальными ресничками, а вторая с антагонизмом междуCerl-2 и Nodal.
У эмбрионов рыбок данио Kupffer's пузырек, как было показано, является функциональным эквивалентом узелка мыши (Essner et al., 2002, 2005), с подвижными ресничками, которые создают направленный ток жидкости непосредственно перед началом асимметричной экспрессией генов в латеральных клетках. нарушение этого тока нарушает правильное формирование L-R паттерна (Essner et al., 2005). Charon рыбок данио экспрессируется в Kupffer's узелке на ст. 10 сомитов (14 hpf; Hashimoto et al., 2004). Паттерн экспрессии Charon принимает форму подковы, напоминая таковую для Cerl-2 на инициальных стадиях (Marques et al., 2004). Но у рыбок данио экспрессия southpaw (эквивалента мышиного Nodal) и Charon не являются асимметричными вблизи Kupffer's пузырька. Функциональное исследование с использованием микроинъекций мРНК Charon у эмбрионов рыбок данио продемонстрировало, что дорсализующая активность всех трех известных родственных Nodal молекул у рыбок данио ( southpaw, Cyclops и squint; Sampath et al., 1998; Long et al., 2003; Rebagliati et al., 1998) может быть ингибирована с помощью Charon. Одинаково с фенотипом cerl-2 мутантов, подавление Charon с помощью morpholino олигонуклеотидов нарушает правильное становление Left-Right оси. Происходит билатеральная экспрессия в LPM генов. специфичных для левой стороны southpaw, cyclops, lefty2 и pitx2 (Hashimoto et al., 2004), и дефекты асимметричного развития сердца.
Недавно сообщалось, что Xenopus Coco также играет важную роль в становлении L-R оси у эмбрионов Xenopus (Vonica et al., 2007). Coco, как было установлено, является nodal антагонистом, , которые экспрессируется билатерально в задней части параксиальной мезодермы на ст. нейрулы, где он обнаруживает тот же самый паттерн экспрессии, что и Xnr1 и derriere. Эксперименты с использованием Coco morpholinos показали, что Coco необходим исключительно на правой стороне, а Xnr1 на левой стороне для формирования соотв. Left-Right паттерна (Vonica et al., 2007). Эти результаты указывают на то, что Charon и Coco могут быть настоящими ортологами cerl-2. И, как и в случае с мышиными эмбрионами, антагонистическая активность Cerberus молекул Charon и Coco против Southpaw и Xnr1 (Nodal молекулы), играет важную роль в становлении L-R оси тела у эмбрионов рыбок данио и Xenopus.
Хотя куриный
Cer,
Xenopus Coco, рыбок данио
Charon и мышей
Cerl-2 имеют разные паттерны экспрессии, Cerberus-like белки, кодируемые этими генами, по-видимому, имеют эволюционно законсервированный механизм Nodal антагонизма у эмбрионов позвоночных. Этот законсервированный механизм является критическим для корректного L-R развития, он ограничивает передачу сигналов Nodal левой стороной эмбрионов позвоночных.
Final remarks
10 years after the isolation of Xcerberus (Bouwmeester et al ., 1996), the founding member of this still increasing family, Cerberus-like molecules emerge as key regulators of Nodal signaling. Although not signaling proteins per se, they are very important regulatory molecules, playing a primordial role in restricting Nodal signaling both in space and time. This data suggests that one efficient way of creating asymmetries in the early developing embryo is by restricting the activation of certain signals in a specific region in time. It is becoming more and more evident that biological processes like the generation of asymmetries arise from complex regulatory mechanisms, and inhibitory molecules like the Cerberus-family members are not secondary players in these pathways, but can now claim their intrinsic importance as generators of developmental processes. Our observations confirm the increasing body of evidence that patterning of the vertebrate embryo results mostly from antagonistic protein-protein interactions in the extracellular space (Fig. 1), being the Cerberus-like family of secreted inhibitors a crucial player in this process.
Bearing this in mind, and in order to further characterize the molecular mechanisms that play a role in the early A/P axis establishment, we have been using Cerberus-family members as a ‘bait’ to uncover potential new players. We have performed a differential screening using a generated transgenic mouse line in which EGFP is expressed in the AVE, under the control of the promoter region of the Cerl-1 gene. Gene expression profiling using GeneChips ® (Affymetrix ®) identified novel differentially expressed transcripts at the very early stages of A-P axis establishment (Mario Filipe, unpublished), some of them now currently being studied at our laboratory (Silva et al., 2006; Filipe et al., 2006; Salgueiro et al., 2006). We expect that this approach will allow us to learn more about asymmetry generation, tissue patterning and specification during early vertebrate development and that this knowledge can be applied in the future to regenerative medicine.
Сайт создан в системе
uCoz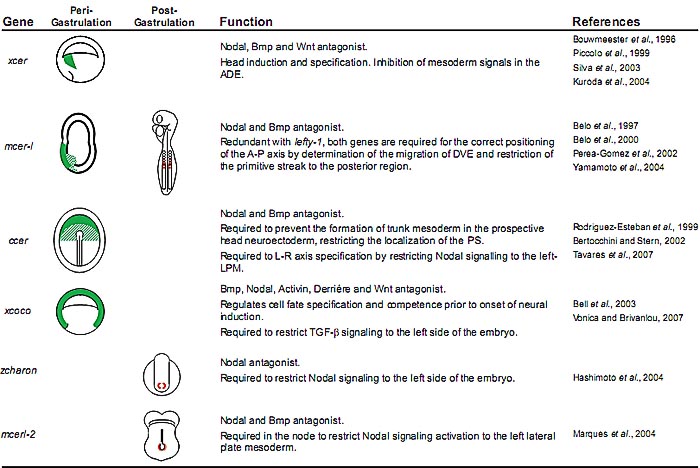
 Fig. 1. Cerberus prevents Nodal signaling in the anterior and right sides of the vertebrate embryo in order to promote head formation and asymmetric distribution of the internal organs.
Fig. 1. Cerberus prevents Nodal signaling in the anterior and right sides of the vertebrate embryo in order to promote head formation and asymmetric distribution of the internal organs.