Эволюционно законсервированная группа гомеобокс содержащих транскрипционных факторов, семейство
Dlx генов представлено тремя бигенными кластерами у позвоночных
Dlx1/Dlx2, Dlx3/Dlx7 и
Dlx5/Dlx6/ Все они являются гомологами гена
distal-less (dll) Drosophila. Их экспрессия обнаруживается в развивающейся нервной системе, в производных нервного гребня, бранхиальных дугах и развивающихся придатках. Известно, что
dll является критическим для формирования паттерна дистальных придатков (конечностей, антенн) (Cohen et al., 1989), семейство генов
Dlx также считается важным для развития дистальных структур конечностей и поддержания apical ectodermal ridge (AER) у мышей. Одновременное разрушение
Dlx5 и
Dlx6 дает фенокопию аутосомно доминантной формы split-hand/split-foot malformation (SHFM), гетерогенного уродства. характеризующегося отсутствием центральных пальцев и клешнеобразным видом autopod (кисть/ступня).
Dlx HOMEOBOX GENES PLAY AN ACTIVE ROLE IN LIMB PATTERNING
Успешное формирование конечностей у эмбрионов нуждается в росте и формировании паттерна вдоль трех осей (anterior-posterior (AP), dorsal-ventral (DV) и proximal-distal (PrDi). Это достигается за счет хорошо охарактеризованного взаимодействия сигнальных центров для каждой оси: zone polarizing activity (ZPA) посредством передачи сигналов Shh управляет АР формированием паттерна; non-ridge limb эктодерма посредством транскрипционных факторов En1 и Wnt7a детерминирует формирование паттерна вдоль DV оси; и AER с хорошо известными ключевыми игроками, членами семейства Fgf, играющими главную роль в формировании паттерна вдоль PrDi оси (Рис. 1). AER является временной структурой во время формирования конечностей, стратифицированный эпителий, идущий вдоль DV интерфейса на дистальном кончике зачатка конечности. AER является сигнальным центром, управляющим PrDi формированием паттерна конечности и его присутствие необходимо для роста в PrDi направлении (Saunders, 1948; Summerbell, 1974). Fgfs считались ключевыми сигнальными факторами AER, способными устранить дефекты формирования PrDi паттерна, возникающими в результате удаления AER (Niswander et al., 1993; Fallon et al., 1994), что подтверждалось исследованиями потери функции (Sun et al., 2002). Отсутствие Fgf4 и Fgf8 в AER предотвращает образование конечности. Сложная петля обратной связи между экспрессией Shh в ZPA и экспрессией Fgf в AER и BMPs в AER и мезенхиме гарантирует соотв. формирование паттерна конечности (Niswander et al., 1994; Pizette, Niswander, 1999; Zuniga et al., 1999). Недавнее исследование Robledo et al., (2002) показало, что гены Dlx также являются критическими игроками в формировании паттерна конечностей.
У млекопитающих Dlx1б Dlx2,Dlx5 и Dlx6 экспрессируются в развивающихся конечностях, при этом Dlx2,Dlx5 и Dlx6 ко-экспрессируются в AER зачатков передних и задих конечностей. У дрозофилы dll необходим для формирования паттерна дистальных частей конечностей, потеря же любогго одиночного Dlx гена не меняет фенотипа конечностей у мышей. Одновременная инактивация Dlx5 и Dlx6 у мышей дает фенокопию split-hand/split-foot malformation (SHFM1, MIM 183600) у людей (Robledo et al., 2002). У эмбрионов мышей, гетерозиготных по целенаправленно измененным аллелям, экспрессия Dlx5/Dlx6-lacZ в конечностях наблюдается по всему AER передних и задних конечностей Е10.5, вычленяя зрелый AER на Е11.5. На ст. Е12.5 экспрессиия Dlx5/Dlx6-lacZ всё ещё присутствует в натурально регрессирующем AER и видна в соедней подлежащей мезенхиме.
Мышиные эмбрионы, лишенные Dlx5 и Dlx6 обнаруживают нарушения в формировании паттерна вдоль PeDi оси развивающейся конечности, показывая тем самым , что они существенны для поддержания медиальной части AER во врея критического периода формирования PeDi паттерна конечности. Первые признаки нарушений в задних конечностях Dlx5-/-/Dlx6-/- эмбрионов становятся видимыми на ст. Е11.5, когда медиальная часть AER начинает регрессировать и уплощаться, тогда как латеральные границы остаются функциональными (Рис. 3). Детальный анализ экспрессии генов (Robledo et al., 2002) показал, что формирование DV паттерна, демонстрируемое нормальной экспрессией Lmx1b, остается не нарушенным. Более того, передача сигналов Shh, критического игрока обратной петли связи AER-ZPA, оказывается не нарушенной на ст. Е10.5 и Е11.5 в конечностях Dlx5-/-/Dlx6-/- эмбрионов. Однако, нормальная экспрессия маркеров AER, подобных Fgf8, Msx2 и Dlx2, на ст. Е10.5 отсутствует в медиальной области дистальных частей задних конечностей на Е11.5. Также экспрессия Dss1, потенциального гена кандидата уродства SHFM1, не изменена до ст. Е11.5, а затем снижается в дистальной медиальной части конечности. Дальнейшие молекулярные исследования продемонстрировали, что не происходит существенной миграции клеток или клеточной гибели ни в AER, ни в подлежащей мезенхиме конечностей Dlx5-/-/Dlx6-/- на ст. Е11.5. Вместо этого у этих мутантов снижается клеточная пролиферация в AER, но не мезенхиме на ст. Е10.5 и Е11.5. Далее было показано, что как регрессия ФУК, так и возникающий в результате фенотип SHFM в нижних конечностях Dlx5-/-/Dlx6-/- может быть полностью нормализован посредством избыточной экспрессии Dlx5 под контролем Msx2-AER специфического энхансера (Liu et al., 1994).
Интересно, что ни одна из одиночных мутаций Dlx не дает видимых изменений фенотипа, ни Dlx1/Dlx2 нулевая мутация, указывая тем самым на функциональное перекрывание. Однако, мутанты Dlx2/Dlx5 обнаруживают уродства конечностей (Panganiban, Rubinstein, 2002). C lh/ стороны, избыточная экспрессия Msx2-Dlx5 трансгена на генетическом фоне дикого типа не вызывает каких-либо фенотипических изменений (Robledo et al., 2002), указывая тем самым, что функция Dlx в этой ткани уже максимальна. Это указывает на значительное функциональное перекрывание между членами Dlxсемейства гомеобоксных генов в конечностях и на необходимость критического порога концентрации продукта Dlx генов для собственно формирования паттерна конечностей.
У мутантов Dlx5/Dlx6 с потерей функции наблюдается ранняя регрессия, уплощение AER и потеря генной экспрессии известных маркеров AER в медиальной части Dlx5-/-/Dlx6-/- нижних конечностей, еще до окончания нормальной функции AER между Е12.5 и Е13.5. Исследования на курах показали. что передача сигналов BMP скорее всего обеспечивает регрессию AER (Pizette, Niswander, 1999; Ahn et al., 2001) и имеется одна возможность, что Dlx транскрипционные факторы блокируют передачу сигналов BMP с началом регрессии AER.
SHFM-подобный фенотип конечностей у Dlx5/Dlx6 мутантных эмбрионов наблюдается в наиболее тяжелых случаях кистей подобных раковой клешне; однако, не наблюдается значительной клеточной гибели или потери клеточной пролиферации в мезенхиме конечностей на ст. Е11.5, чтобы объяснить "потерю" центральных пальцев. Потенциально, на Е11.5, когда возникает AER фенотип, конденсация stylopod и zeugopod элементов уже начата и следовательно, не затрагивается, т.к. конденсации элементов autopod, таких как tarsals. metattarsals и фаланг, ещё не инициирована. Следовательно, любое отсутствие пролиферации или гибель клеток в мезенхиме медиальной части конечности после Е11.5 может приводить к отсутствию критической клеточной массы в мезенхиме, чтобы инициировать или собственно сформировать хрящевые конденсаты. Эта идея подтверждается менее тяжелыми фенотипами в передних конечностях. .к. передние конечности слегка опережают задние в своем развитии, так что в это время стадия конденсации центральной части аутопода уже может быть инициированной.
Как уже указывалось (Niswander, 2003)вполне возможно, что критическая масса мезенхимы необходима для прогрессивного образования соотв. количества конденсаций, которые в дальнейшем дадут все скелетные элементы stylopod, zeugopod и autopod вдоль PrDi и АР измерений. При избытке мезенхимных клеток, который происходит, когда высвобождается эктопически Shh белок в конечности посредством трансплантации ZPA (Saunders, Gasseling, 1968), избыточно экспрессирующие клетки эмбрионов, гетерозиготных по мутациям потери функции Dlx5/Dlx6, наблюдается экспрессия Dlx5/Dlx6-lacZ аллеля во всех сайтах развивающихся мембранозно и эндохондрально формирующихся костей, инициирующихся на ст. Е12.5 в аксиальном скелете, ключицах и ведущем крае свода черепа. На ст. Е14.5 экспрессия Dlx5/Dlx6-lacZ присутствует в областях надхрящницы ребер и аппендикулярного скелета, включая пальцы.
Первые фенотипические отличия между эмбрионами гетерозиготными и гомозиготными по Dlx5/Dlx6 мутациям потери функции наблюдаются со ст. Е11.5, когда гомозиготные эмбрионы обнаруживают покоробленный хвост, указывающий на уродства осевого скелета (Robledo et al., 2002). На Е14.5 SHFM-подобный фенотип становится очевидным в задних конечностях, где часто центральный палец и, до некоторой степени зависимые от тяжести предшествующих дефектов AER соседние пальцы, отсутствуют. Отсутствующие элементы аутопода включают фаланги, метатразальные и тарзальные косточки. Оставшиеся пальцы ног в общем-то аномальны по форме и дистально слиты с соседними. Передние конечности затрагиваются довольно редко. На ст. Е16.5, когда происходит минерализация ранее хрящевых длинных костей, Dlx5/Dlx6 гомозиготные мутантные эмбрионы обнаруживают зедержку оссификации, с маленькими или отсутствующими центрами оссификации в аппендикулярном скелете, а также в ребрах и позвонках осевого скелета. На Е18.5 несмотря на незначительную минерализацию в центрах эндохондральной оссификации, становится очевидным. что оссификация остается сильно задержанной, делая эмбрионыDlx5-/-/Dlx6-/- тяжело дизморфными.
Гистологические и молекулярные доказательства показывают, что остеогенный путь нарушен у
Dlx5-/-/Dlx6-/- эмбрионов на ст. перехода от пре-гипертрофических к гипертрофическим хондроцитам [Robledo et al, 2002], возможно из-за отсутствия продукта генов
Dlx5/Dlx6, вызывающего задержку или блокаду
Fgf-Fgfr3 и Ihh-Pthrp-Ptbrpr сигнальных путей (Рис. 5). Напротив,
Dlx5/Dlx6 д. способствовать созреванию хондроцитов и остеобластов, путем влияния на семейство
Sox генов [Smits et al., 2001], ключевых игроков в созревании от пре-гипертрофических к гипертрофическим хондроцитам, или
Dlx5/Dlx6 д. способствовать экспрессии osteocalcin путем формирования комплекса с Msx2 ингибитором osteocalcin [Newberry et al, 1998; Shirakabe et al., 2001]. Любой механизм задержки созревания кости, как видно у мутантов
Dlx5-/-/Dlx6-/-, демонстрирует, что
Dlx5/Dlx6 играют критическую роль в созревнии хряща, что затем детерминирует начало остеогенеза.
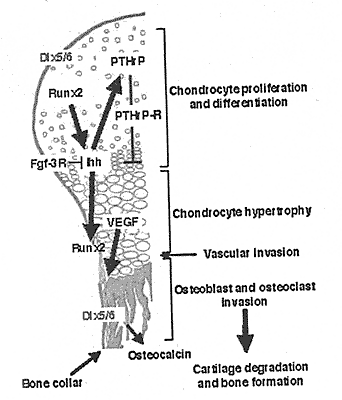 Fig. 5. Role of Dlx 5 and DLx6 in the genetic pathway regulating endochondral skeletal development. DLx5and Dlx6 lire expressed in the perichondrium where they direct the normal progression of endochondral development. Other major components of the genetic hierarchy are indicated including Runx2., Ihh, Fgf-3R, VEGF, and Pthrp-Ptbtpr. Bone drawing adapted from [Minina et al.. 2001].
Fig. 5. Role of Dlx 5 and DLx6 in the genetic pathway regulating endochondral skeletal development. DLx5and Dlx6 lire expressed in the perichondrium where they direct the normal progression of endochondral development. Other major components of the genetic hierarchy are indicated including Runx2., Ihh, Fgf-3R, VEGF, and Pthrp-Ptbtpr. Bone drawing adapted from [Minina et al.. 2001].
CRANIOFACIAL DEVELOPMENT REQUIRES Dlx HOMEOBOX GENES
Dlx5 экспрессируется, начиная с E8.0 в отической и обонятельной плакодах, а также в вентральном цефалическом эпителии, как показано с помощью анализа in situ РНК и экспрессии репортерного гена lacZ [Simeone et al., 1994; Yang et al, 1998; Acampora et al., 1999; Depew et al., 1999]. Сходная экспрессия Dlx5/6-lacZ описана в вентральном цефалическом эпителии и носовых и отических плакодах на ст. E8.5, что сопровождается экспрессией во внутреннем ухе: полукружных каналах и эндолимфатическом протоке [Robledo et al., 2002]. Все известные члены семейства Dlx гомеобоксных генов экспрессируются в миграторных клетках нервного гребня, которые занимают бранхиальные дуги [Depew et al. 1999, 2002], а на ст. E9.5 строго экспрессируются в бранхиальных дугах. Бранхиальные дуги представляют собой др. временную онтогенетическую структуру, дающей в конечном счете черепно-лицевые элементы, такие как верхняя и нижняя челюсти с ассоциированными мягкими тканями, структуры среднего уха, styloid связку, тело hyoid косточки и щитовидный и перстневидный хрящ. В бранхиальных дугах гены Dlx экспрессируются в виде гнезд вдоль Pr-Di оси, с широко экспрессируемыми Dlxl/Dlx2, тогда как Dlx5/Dlx6 и Dlx3/Dlx7 становятся всё более и более ограниченными дистально [Qiu et al, 1997; Depew et al., 1999, 2002]. Предполагается, что такой гнездовой паттерн экспрессии может быть функцией кода, чтобы обеспечить качественные особенности внутри бранхиальных дуг [Depew et al, 2002].
Черепно-лицевой фенотип, возникающий в результате мутаций генов Dlx, может быть подразделен грубо на уродства, затрагивающие (1) морфологию черепа: Dlxl, Dlx2, Dlxl/Dlx2, Dlx5 и Dlx5/Dlx6 [Qiu et al, 1997; Acampora et al., 1999; Depew et al., 1999; Robledo et al, 2002]; (2) внутреннее ухо, как это видно по эмбрионам, лишенным Dlxl, Dlx2, Dlxl/Dlx2, Dlx5 и Dlx5/Dlx6 [Acampora etal., 1999; Depew etal., 1999; Robledo et al., 2002], (3) челюсти: Dlx2, Dlxl/Dlx2, Dlx5 и Dlx5/Dlx6 [Qiu et al., 1997; Depew et al., 2002] и (4) зубы: Dlxl/Dlx2, Dlx3, Dlx5 [Qiu et al, 1997; Price et al, 1998; Depew et al, 1999]. Морфология черепа затрагивается в разной степени у перечисленных выше одиночных и двойных мутантов Dlx потери функции у мышей. Наблюдаемые фенотипы возникают в основном из уродств, смещений и отсутствия выравнивания бранхиальных дуг, а также из не происходящих из нервного гребня хрящевых элементов, напр., Meckel cartilage, alisphenoid, maxillary, styloid, squamosal и jugal костей [Qiu etal., 1997; Acampora etal, 1999; Depew etal., 1999; Robledo et al., 2002]. Однако, наиболее сильный эффект в своде черепа (Fig. 4). Сходная задержка эндохондральной оссификации Dlx5-/-/Dlx6-/- аксиального и эндохондрального скелета [Robledo et al., 2002], задержка оссификации затылочных костей у Dlx5 приводит к образованию широких черпных швов и открытых родничков [Acampora et al., 19991. В более тяжелых случаях величина уменьшения покрывающих костей ведет к экзэнцефалии у некоторых Dlx5 мутантов [Acampora et al., 1999], которая наиболее пенетрантна Dlx5/Dlx6 двойных мутантных мышей [Depew et al., 2002; Robledo et al., 2002]. Однако, покрывающие свод кости, по-видимому, не затрагиваются у Dlxl/Dlx2 двойных мутантов, указывая тем самым на уникальную функцию Dlx5/Dlx6 в формировании их паттерна. Но не только кости свода затрагиваются, у Dlxl, Dlx2, Dlxl/Dlx2, Dlx5 и Dlx5/Dlx6 описаны также изменения в основании черепа [Qiu et al., 1997; Acampora et al., 1999; Robledo et al, 2002]. Тяжелый фенотип морфологии черепа у эмбрионов Dlx5-/-/Dlx6-/- обнаруживается уже на El1.5 (Рис. 3). Интересно, что экспрессия Dlx5/Dlx6-lacZ в тканях, дающих черепно-лицевые структуры, таких как frontonasal, mandibular и maxillary ткани снижается на ст. E14.5 у Dlx5-/-/Dlx6-/- эмбрионов [Robledo et al., 2002], указывая тем самым, что Dlx5/Dlx6 не только существенны для формирования паттерна, но и также для рождения и/или выживания определенных черепно-лицевых клеточных клонов.
Все изученные Dlx мутации потери функции в разной степени затрагивают развитие внутреннего уха, указывая на возможно меньшее функциональное перекрывание, а следовательно, и меньшую толерантность к мутациям внутри семейства генов Dlx во время формирования паттерна и образования внутреннего уха. Наиболее тяжелые нарушения возникают у двойных мутантных Dlx5/Dlx6 эмбрионов: с отсутствием хрящей наружного уха и слиянием капсулы внутреннего уха и хряща среднего уха с неправильной формы зачатком височной кости, что делает структуры внутреннего уха нераспознаваемыми [Robledo et al., 2002]. Фенотип внутреннего уха в отсутствие функции Dlx слабый, слуховые косточки нормальных размеров и образуются в соотв. контактах с барабанной перепонкой и вестибулярным оконцем и ротированы [Acampora et al., 1999; Depew et al., 1999] У мутантов Dlx2 и Dlxl/Dlx2 слуховые косточки затрагиваются, а с более низкой пенетрантностью и у Dlx1 мутантов [Qiu et al., 1997].
Все двойные мутантные Dlxl/Dlx2 имеют расщепление вторичного нёба, наблюдаемое также у 80% из Dlx2-/- эмбрионов, в то время как только 10% у Dlx1-/- эмбрионов средней выраженности расщепление нёба [Qiu et al, 1997]. У Dlx5 и Dlx5/Dlx6 дефицитных эмбрионов носовые косточки укорочены и создают вид укороченного вдавленного носа [Acampora et al., 1999; Depew et al., 2002; Robledo et al, 2002]. Эмбрионы Dlx5-/-/Dlx6-/- часто и лишь некоторые изDlx5-/- эмбрионов дают расщепление нёба [Depew et al, 2002; Robledo et al, 2002]. Наиболее интересным у эмбрионов Dlx5-/-/Dlx6-/- является впечатляющая гомеозисная трансформация нижней в верхнюю челюсть [Depew et al, 2002], это подтверждает гипотезу, что гнездовой паттерн экспрессии Dlx в бранхиальных дугах может быть специфицирующим для качественных особенностей внутри бранхиальных дуг [Depew et al, 2002]. С эволюционной точки зрения изменения в паттернах экспрессии Dlx генов могут быть критическими для перехода от agnathan (безчелюстных) позвоночных к gnathan, потенциально параллельно с изменениями в экспрессии гомеобоксных генов семейства Hox [Cohn, 2002; Depew et al, 2002].
В развитии зубов спектр наблюдаемых дефектов варьирует от полного отсутствия верхнечелюстных коренных зубов у мышей, лишенных Dlxl/Dlx2 [Qiu et al, 1997], уродств и плохой минерализации кореных зубов и резцов у мутантных Dlx5 мышей [Depew et al, 1999], пациентов с tricho-dento-osseus синдромом (OMIM190320) в результате сдвига рамки считывания в гене DLX3 человека, с taurodontism и гипоплазией эмали [Price et al, 1998] до едва обнаружимых фенотипов у мышей с мутациями потери функции в одиночных генах Dlxl или Dlx2 [Qiu et al, 1997]. Ген DLX5 человека импринтируется и неправильно регулируется у индивидов, несущих мутации в гене MECP2 (кодирующем methyl-CpG-binding protein 2), и подтверждает молекулярный механизм патофизиологии у пациентов, страдающих от Rett синдрома (RTT, OMIM 312750), Х-сцепленного доминантного невррологического нарушения [Bapat and Galande, 2005; Horike et al, 2005].
В общем среди всех изученных Dlx мутаций, мыши с потерей функции Dlx5/Dlx6 обнаруживают наиболее тяжелые дефекты конечностей и черепно-0лицевые дефекты. Это указывает на то, что Dlx5/ Dlx6 бигенный кластер может быть эволюционно более молодым, чем Dlxl/Dlx2 бигенный кластер, и выполняет приобретенные уникальные функции, которые не могут быть компенсированы за счет перекрывания функции генами семейства Dlx. В частности в эволюционно более недавно возникших структурах, таких как конечности, где только Dlx5/Dlx6 двойные мутанты дают измененный фенотип. Исследования Sumiyama et al. [2003] подтверждают эту идею, указывая, что все три Dlx бигенных кластера возникли из pre-Dlxl/Dlx2 бигенного кластера.
Границы компартментов, как полагают, важны для стабилизации положения паттерн-формирующих центров во время морфогенеза [Dahmann and Basler, 1999]. Отсюда важность наблюдения Acampora et al. [1999]: т.к. результаты исследований пролиферации и апоптоза во время черепно-лицевого развития Dlx5-/- мышей подтвердили, что Dlx гены закладывают границы, которые ограничивают онтогенетические поля высоко пролиферирующих клеток. это предположение особенно интересно в отношении наблюдаемого фенотипа AER у Dlx5/Dlx6 двойных мутантов [Robledo et al, 2002]. Они продемонстрировали, что две границы в возникающем AER существенны для гарантии собственно морфологии и функции AER [Kimmeletal, 2000]. Потеря D-V границы приводит к уплощению AER [Kimmel et al, 2000]. Уплощение медиальной части AER задних конечностей и достоверное снижение количества пролиферирующих клеток внутри AER задних конечностей описано у мутантов Dlx5/Dlx6 [Robledo et al, 2002]. Одной из критических ролей для бигенного кластера Dlx5/Dbc6 следовательно, является его участие в стабилизации границ.
Сайт создан в системе
uCoz Fig. 5. Role of Dlx 5 and DLx6 in the genetic pathway regulating endochondral skeletal development. DLx5and Dlx6 lire expressed in the perichondrium where they direct the normal progression of endochondral development. Other major components of the genetic hierarchy are indicated including Runx2., Ihh, Fgf-3R, VEGF, and Pthrp-Ptbtpr. Bone drawing adapted from [Minina et al.. 2001].
Fig. 5. Role of Dlx 5 and DLx6 in the genetic pathway regulating endochondral skeletal development. DLx5and Dlx6 lire expressed in the perichondrium where they direct the normal progression of endochondral development. Other major components of the genetic hierarchy are indicated including Runx2., Ihh, Fgf-3R, VEGF, and Pthrp-Ptbtpr. Bone drawing adapted from [Minina et al.. 2001].