Семейство FGFR состоит из 4-х очeнь сходных членов чьи аминокислоные последовательности высоко законсервированы. Они регулируют множественные клеточные процессы, включая рост, дифференцировку, миграцию, выживаемость клеток, они участвуют и патологических процессах, включая ангиогенез, заживление ран и рак. FGFRs взаимодействуют с fibroblast growth factors (FGFs), из которых сейчас охарактеризовано 13 членов. Лиганды FGF взаимодействуют с внеклеточной частью молекул FGFR molecules, которая состоит из 3-х иммуноглобулин (Ig)-подобных доменов с короткими связующими сегментами (Рис.1). В сегменте между IgI и IgII имеется run кислых остатков глютаминовой и аспартиковой кислоты, которые обозначаются как кислотный бокс `acid box', а такжк как трех-аминокислоный мотив histidine-alanine-valine (HAV). Последовательности HAV обнаруживаются также в молекулях адгезии N-CAM, L-CAM и N-cadherin, и, по-видимому, обеспечивают связь между молекулами. Имеется одиночная трансмембранная часть и внутри клетки имеется домен, расщепляющий тирозин-кинаду. В результате альтернативного сплайсинга у этих рецепторов может отсуствовать первый Ig (IgI)домен, отсуствовать IgI и область acid-box или,что важнее, содержат альтернативные последовательности C-терминальной половины третьего Ig-подобного домена, кодируемого отдельным экзоном (Рис.1)
Взаимодействие между фактором роста, рецептором и гепаран сульфат протеогликаном необходимо для активизации сигналов. После связывания лиганда молекуля рецептора димеризуется и это сопровождается автофосфорилированием некоторых остатков тирозина во внутриклеточном домене. |
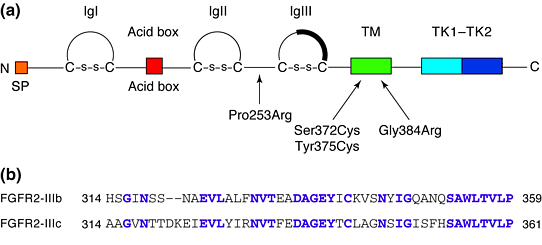 |
Рис. 1. (a) Рецептор фактора роста фибробластов состоит из: N-терминального сигнального пептида (SP); области кислотного бокса (a run of acidic residues); трех иммуноглобулиновых доменов (IgI, IgII and IgIII); трансмембранной области (TM); и домена, расщепляющего тирозин-киназу (TK1–TK2). Два цистеина, формирующие дисульфидные мостики, показаны в каждом Ig-подобном домене. Темная область в IgIII объяснена в тексте. (b) Расположение последовательностей в альтернативных форм C-терминальной половины IgIII домена (IgIIIb and IgIIIc) у FGFR2. Показанные последовательности представляют полный экзон. Идентичные остатки показаны пурпурным цветом. Figure 1. (a) The fibroblast growth factor receptor, consisting of: the N-terminal signal peptide (SP); the acid-box region (a run of acidic residues); the three immunoglobulin-like domains (IgI, IgII and IgIII); the transmembrane region (TM); and the split tyrosine-kinase domain (TK1–TK2). The two cysteines forming the disulphide bridge are shown in each Ig-like domain. The dark region in IgIII is explained in the text. (b) Sequence alignment of the alternative forms of the C-terminal half of the IgIII domain (IgIIIb and IgIIIc) of FGFR2. The sequences shown represent the complete exon. Identical residues are shown in purple. |
Table 1. Birth defects associated with mutation in fibroblast growth factor receptorsa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
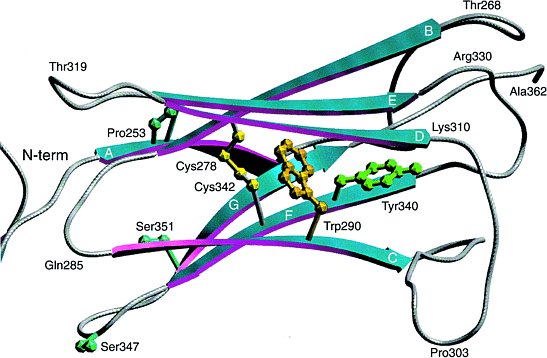 |
Рис.2.
Диаграмма сравнительной модели третьего иммуноглобулинового (IgIII) внеклеточного с `c' splice формой FGFR2. Этот домен и эквивалентные домены FGFR1, недавно смоделированы по аналогии с IgV , IgC , IgC-like и IgV-like доменами. Однако домен обладает высоко законсервированными признаками,которые недавно определены в I-set Ig семействе . Они включают законсервированные цистеиновые зачатки Cys278 и Cys342, инвариантный остаток триптофана Trp290 и законсервированный остаток тирозина Tyr340. Домен состоит из двух 4-нитчатых бета-слоев (ABED and A'GFC). Показаны законсервированные остатки, которые часто мутируют и вызывают скелетные аномалии. Figure 2. A ribbon diagram of a comparative model of the third immunoglobulin (IgIII) extracellular domain with the `c' splice form of FGFR2. This domain, and the equivalent domains within FGFR1, have previously been modelled by analogy to IgV domains16, IgC domains33, IgC-like domains34 and IgV-like domains35. However, the domain has been shown to possess well-conserved features of the recently defined I-set Ig family17. These include the conserved cysteine residues Cys278 and Cys342, the invariant tryptophan residue Trp290, and the conserved tyrosine residue Tyr340. We have constructed the model using the COMPOSER36 suite of programs (Sybyl; Tripos Inc., USA) by analogy with the crystal structure37 of telokin, the C-terminal domain of myosin light-chain kinase from turkey gizzard. Telokin is one of only three members of the I-set Ig family of proteins whose structure has been characterized. Telokin was chosen because it gave the best amino acid sequence alignment with FGFR2, with the fewest insertions or deletions. This is in agreement with Bateman and Chothia17, who analysed the sequence similarities of each of the three extracellular Ig domains of FGFR2 and concluded that each of the domains contained all the major secondary structure elements found in telokin. The domain consists of two four-stranded beta-sheets (ABED and A'GFC). The conserved residues, which are often mutated and cause skeletal disorders, are shown. The picture was produced using the program SETOR38. |