Следовательно, источник неспособности развития HDAC1-дефицитных мышей нуждается в дальнейших исследованиях. В резком контрасте с существенной ролью HDAC1 во время эмбриогенеза то, что истощение HDAC2 не вызывает фенотипических отклонений во время раннего развития (Montgomery et al., 2007; Zimmermann et al., 2007). Эти находки подчеркивают критический набор генов мишеней регулируется исключительно HDAC1 во время эмбриогенеза. Альтернативно, что HDAC1 и HDAC2 выполняют сходные функции, но количества белка HDAC2 недостаточно для компенсации отсутствия HDAC1. Соотв., HDAC1 белок экспрессируется на достоверно более высоких уровнях, чем HDAC2 в ES клетках (Jennifer Jurkin and Christian Seiser, unpublished data). Делеция или either HDAC1 или HDAC2 в широком наборе тканей не влияет на жизнеспособность (Montgomery et al. , 2007) (Christian Seiser, unpublished results), указывая тем самым на перекрываемость функций HDAC1 и HDAC2 во многих типах клеток.
Первые сообщения об участии HDACs в нейрональной дифференцировке базировались на экспериментах с использованием общего HDAC inhibitor (HDI) trichostatin A в PC12 линии клеток (Futamura et al., 1995; Sano and Kitajima, 1996). Кстати разнообразные HDIs были протестированы на нескольких культуральных клеточных системах, обладающих или ингибирующими или вспомогательными эффектами на рост нейронов.
Недавние исследования выявили непосредственное участие HDAC1/HDAC2 в nerve growth factor (NGF)-обеспечиваемой дифференцировке, репрессии экспрессии нейрональных генов и в апоптозе или жизнеспособности нервных клеток. В 2005, Bai and сотр. связали HDAC2 со специфической функцией в NGF-индуцированной дифференцировке PC12 клеток крыс (Bai et al., 2005). Др. компонент аппарата эпигенетического молчания, DNA methyltransferase 3b (DNMT3b), как было показано, является критическим для роста нейритов. DNMT3b-зависимая дифференцировка обеспечивается рекрутированием HDAC2. Особенно заметное репрессивное действие комплекса DNMT3b/HDAC2 было обнаружено независимо от DNMT3b ферментативной активности, указывающее ием самым на центральную роль HDAC2. Лежащий в основе механизм скорее всего использует рекрутирование HDAC2 и DNMT3b на промоторы генов мишеней, чтобы поддержать молчание генов, которые предупреждают дифференцировку нейронов. Те же авт. верифицировали свою гипотезу, что DNMT3b/HDAC2 репрессорный комплекс способствует дифференцировке нейронов с помощью идентификации T-Cadherin (T-Cad) в качестве гена мишени, регулируемого с помощью DNMT3b/HDAC2 (Bai et al., 2006). Также работая с NGF-обеспечиваемой дифференцировкой PC12 клеток, Zhang с коллегами показали, что HDAC1/HDAC2 рекрутируются с помощью укороченной версии p73, члена семейства p53 белков опухолевых супрессоров, репрессируя тем самым промотор NGF-high affinity рецептора TrkA (Zhang and Chen, 2007). Авт. продемонстрировали, что супрессия TrkA посредством ΔNp73/HDAC1/ HDAC2 комплекса ослабляет NGF-обеспечиваемый MAP kinase путь и ведет к блокированию выростов нейритов. Эта находка может внести существенный вклад в понимание механизма патогенеза нейробластом, т.к. высокие уровни TrkA and ΔNp73 оказались связанными с плохим прогнозом у пациентов с нейробластомой.
HDAC1 также, по-видимому, участвует в регуляции жизнеспособности нейронов посредством E2F-обеспечиваемой генной репрессии в кортикальных нейронах и PC12 клетках крыс (Liu and Greene, 2001). Некоторые исследования показали, что
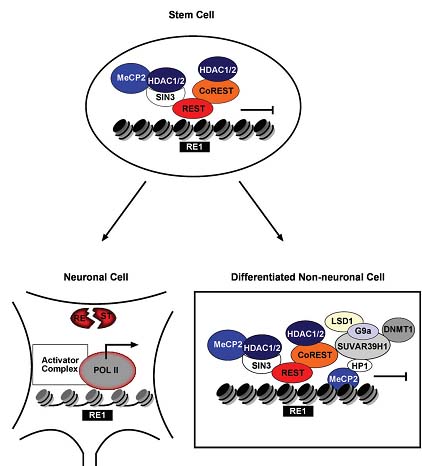 Fig. 4. Chromatin state of neuronal genes in distinct stages of differentiation. In embryonic stem cells, neuronal genes with an internal RE-1 DNA element are associated with REST, its corepressor CoREST and additional factors such as SIN3A, HDAC1/HDAC2 and MeCP2. Although neuronal gene expression is almost entirely abolished, the chromatin is poised for consecutive activation. In addition to the core CoREST complex, inducers of heterochromatin are recruited to neuronal genes in differentiated non-neuronal cells. Due to recruitment of heterochromatic protein-1 (HP1), histone demethylase LSD1, histone methyltransferases SUVAR39H1/G9a as well as DNA methyltransferase1 (DNMT1), neuronal specific gene expression is completely inhibited and heterochromatin formation is induced. In terminally differentiated neuronal cells, REST is proteasomally degraded, thereby relieving the repressive chromatin state. Polymerase recruitment by activator complexes leads to expression of neural specific genes. This schematic view does not mirror physical interaction of the subunits.
Fig. 4. Chromatin state of neuronal genes in distinct stages of differentiation. In embryonic stem cells, neuronal genes with an internal RE-1 DNA element are associated with REST, its corepressor CoREST and additional factors such as SIN3A, HDAC1/HDAC2 and MeCP2. Although neuronal gene expression is almost entirely abolished, the chromatin is poised for consecutive activation. In addition to the core CoREST complex, inducers of heterochromatin are recruited to neuronal genes in differentiated non-neuronal cells. Due to recruitment of heterochromatic protein-1 (HP1), histone demethylase LSD1, histone methyltransferases SUVAR39H1/G9a as well as DNA methyltransferase1 (DNMT1), neuronal specific gene expression is completely inhibited and heterochromatin formation is induced. In terminally differentiated neuronal cells, REST is proteasomally degraded, thereby relieving the repressive chromatin state. Polymerase recruitment by activator complexes leads to expression of neural specific genes. This schematic view does not mirror physical interaction of the subunits.
апоптические стимулы, подобные повреждениям ДНК способствующие активности CDK4/6 и последующему гиперфосфорилированию pRb, ведут к дерепрессии апоптических генов мишеней для E2F в нервных клетках (Liu and Greene, 2001; Park et al., 1997; Park et al., 1996). Liu с коллегами установили, что член семейства карманных белков p130 в комплексе с E2F4 рекрутирует HDAC1 и histone methyltransferase SUV39H1, репрессируя тем самым про-апоптические гены, такие как B-myb. Вследствие апоптических стимулов в постмитотических нейронах комплекс p130/E2F4/HDAC1/Suv39H1 отсоединяется от про-апоптического B-myc промотора, запуская апоптоз и гибель нейронов. Недавно histonedeacetylase related protein (HDRP) , как было показано, выполняет нейрозащитную функцию в культивируемых гранулярных нейронах мозжечка посредством своего взаимодействия с HDAC1 (Morrison et al., 2006). HDRP приобретает активность HDAC благодаря рекрутированию HDAC1, и в кооперации предупреждается ассоциированная с апоптозом экспрессия c-jun.
HDAC1 and HDAC2 in neuronal multiprotein complexes
HDAC1/HDAC2-содержащие мультипротеиновые комплексы обладают важными функциями в регуляции экспрессии нейрональных генов. Среди них, CoREST комплекс действует как критический регулятор нейрональных специфических генов (Chong et al., 1995; Schoenherr and Anderson, 1995), кодирующих, напр., ионные каналы, белки синаптических пузырьков и рецепторы нейротрансмиттеров. CoREST регулирует переходы от плюрипотентных стволовых клеток к предшественникам нейронов и от них к зрелым нейронам (Ballas et al., 2005). ДНК связывающий компонент CoREST, REST/NRSF, обеспечивает репрессию транскрипции нейрональных генов мишеней посредством рекрутирования HDAC1/ HDAC2 посредством корепрессоров mSIN3 и CoREST в не-нейрональных клетках (Ballas et al., 2001; Grimes et al., 2000; Humphrey et al., 2001; Naruse et al., 1999; Roopra et al., 2000; You et al., 2001). Более того, др. эпигенетические факторы молчания, подобные MeCP2, HP1, G9a, SUVAR39H1, LSD1 (Lunyak et al., 2002; Roopra et al., 2004; Shi et al., 2004) и DNMT1 (Ballas and Mandel, 2005) рекрутируются на REST/NRSF-чувствительные гены, чтобы необратимо замалчивать экспрессию нейрональных генов в не-нейрональных клетках (Fig. 4). Интересно, что хроматин REST/NRSF-чувствительных генов в эмбриональных стволовых клетках и нейрональных предшественниках лишен метилирования ДНК и индукторов рекрутирования гетерохроматина, таких как HP1 или histone methyltransferases (Ballas and Mandel, 2005). Т.к. HDAC1/ HDAC2, mSIN3 и REST/NRSF всё ещё ассоциируеют с RE1 элементами в стволовых клетках, то эти эпигенетические модификаторы обеспечивают обратимое, но пермиссивное состояние молчания хроматина, готовое для последующей активации. Эта модель подтверждается тем фактом, что ингибирование активности HDAC ведет к экспрессии REST/NRSF-чувствительных генов (напр., neuroD) в клетках нейральных предшественников взрослых крыс (Hsieh et al., 2004), но не в дифференцированных не-нейральных клетках (Ballas et al., 2005). Следовательно, HDAC1 и HDAC2, по-видимому, важные игроки в поддержании пластичности REST/NRSF чувствительных нейрональных генов.
BRAF-HDAC complex (BHC) (Hakimi et al., 2002) отличается от HDAC1/HDAC2-содержащего мультипротеинового комплекса, родственного каноническому CoREST комплексу и участвует в замалчивании нейрональных генов. Комплекс BHC также рекрутируется на RE1 сайты REST-чувствительных генов посредством корепрессора CoREST, подтверждая родственную функцию у обоих комплексов.
HDAC1 and HDAC2 in the embryonic nervous system
Большая часть наших знаний о функции HDAC1/HDAC2 в эмбриональной нервной системе получена в исследованиях с использованием рыбок данио. В результате исследований инсерционного мутагенеза было предположено, что hdac1 является регулятором множественных онтогенетических процессов в эмбрионе (Golling et al., 2002). Два исследования 2004 выявили Hdac1-зависимые нарушения развития в результате детальной характеристики плейотропных фенотипов (Cunliffe, 2004; Pillai et al., 2004). Анализ выявил тяжелые нейрональные аномалии, такие как неспособность образования нейронов и глиальных клеток в заднем мозге, потеря сегментной организации пост-митотических нейронов и ассоциированных глиальных клеток, накопление нейрональных предшественников и драматический дефицит branchiomotor нейронов (Cunliffe, 2004). Авт. идентифицировали Hdac1 как критический репрессор Notch-responsive transcriptional repressor her6, вызывающий ингибирование экспрессии пронейральных генов.
Потеря HDAC1 ведет к нарушению пролиферации нескольких контекстов развития позвоночных (Lagger et al., 2002) , а HDIs , как было показано, вызывает арест роста в различных опухолях и клеточных линиях (Johnstone and Licht, 2003; Yang and Seto, 2007). Однако этот эффект является регион- и ткане-специфическим, поскольку Hdac1 способствует выходу из клеточного цикла и последующей нейрональной дифференцировке в сетчатке рыбок данио (Stadler et al., 2005; Yamaguchi et al., 2005). Yamaguchi с сотр. описали Hdac1 мутантных рыбок данио, обладающих тяжелыми дефектами дифференцировки нейрональной сетчатки и постоянно пролиферирующими клетками нейрональных предшественников. Авт. предложили модель, где Hdac1 репрессирует канонический путь Wnt, а также передачу сигналов Notch в развивающейся сетчатке рыбок данио, способствуя тем самым выходу из клеточного цикла и инициации нейрогенеза в сетчатке рыбок данио. В соответствии с этими данными др. мутантные рыбки обнаруживали полное восстановление за счет избыточной экспрессии антагонистов канонического Wnt пути (Nambiar and Henion, 2004). Недавно надежные доказательства были получены, что Hdac1 не только регулирует передачу сигналов канонического Wnt, но и также действует как позитивный регулятор неканонического Wnt/PCP пути, контролирующего аксиальное удлинение (Nambiar et al., 2007). Более того, Hdac1 необходим для дифференцировки меланофор, происходящих из нервного гребня благодаря репрессии гена foxd3 (Ignatius et al., 2008).
Наконец, Hdac1 участвует также в регуляции онтогенетических сигнальных каскадов, таких как Hedgehog и Fgf8 во время эмбрионального эмбриогенеза (Cunliffe, 2004; Cunliffe and Casaccia-Bonnefil, 2006; Plaster et al., 2007). Plaster с коллегами предоставили доказательства для in vivo функции REREa/ Hdac-обусловленной транскрипционной репрессии, способствующей передаче сигналов Fgf, и тем самым формированию паттерна теленцефалона и поддержанию границы между средним и задним мозгом (Plaster et al., 2007). Cunliffe и Casaccia идентифицировали Hdac1 в качестве важного фактора дифференцировки клеток нейрональных предшественников в олигодендроциты за счет облегчения обусловленной hedgehog экспрессии маркеров олигодендроцитов olig2.
На мышах MacDonald и Roskams показали, что HDAC1 и HDAC2 экспрессируются в нейральных предшественниках и стволовых клетках (MacDonald and Roskams, 2008). Поразительно, но после клональной спецификации или в глиальные клетки или нейробласты и пост-митотические нейроны, HDAC1 и HDAC2 обнаруживают взаимоисключающую экспрессию. Следовательно, после комбинированной экспрессии в общих предшественниках HDAC1 и HDAC2 обнаруживают специфические функции во время спецификации клонов.
Zinovyeva с коллегами идентифицировали важную функцию для C. elegans hda-1 во время нейрогенеза у развивающихся эмбрионов. Мутация hda-1 обусловливала высоко пенетрантный, фенотип нескоординированных движений с тяжелыми дефектами нахождения путей аксонами и фасцикуляцией нервного ствола и миграции нервных клеток (Zinovyeva et al., 2006).
Myogenesis and cardiogenesis
HDAC1 и HDAC2 in skeletal muscle differentiation
Переход от недифференцированных, пролиферирующих скелетных мышечных клеток к зрелым многоядерным мышечным трубкам управляется набором транскрипционных факторов, которые обладают потенциалом включать транскрипцию специфичных для дифференцировки генов. Среди них MyoD играет важную роль в выходе дифференцирующихся клеток из клеточного цикла за счет позитивной регуляции ингибиторов cyclin dependent kinase (CDK) и активации специфичных для мышц генов. MyoD постоянно экспрессируется в недифференцированных мышечных трубках, а также в дифференцирующихся миобластах; тем не менее, он неспособен действовать как активатор транскрипции в недифференцированных миобластах. Точный механизм того, как активность MyoD регулируется остается неясным, хотя недавняя работа продемонстрировала, что контроль активности MyoD, по крайней мере, частично выполняется с помощью HDAC1/HDAC2-зависимого механизма. Используя мышиную клеточную модельную систему миогенеза, Mal с коллегами установили, что белок MyoD ацетилируется только после дифференцировки. HDAC1 и HDAC2 соединяются с MyoD в миобластах (Mal et al., 2001; Puri et al., 2001) , чтобы ингибировать ацетилирование белка MyoD и хроматина генов мишеней для MyoD (Mal and Harter, 2003), поддерживая тем самым состояние молчания. После дифференцировки HDAC1/HDAC2 отделяется от MyoD с помощью гипофосфорилированного pRb белка (Puri et al., 2001), и это отделение делает возможным соединение histone acetyltransferase PCAF с MyoD. Возникающее в результате ацетилирование MyoD, а также хроматина генов мишеней дляMyoD индуцирует активацию транскрипции мышце-специфических генов. В свою очередь, pRb связывает E2F, приводя к репрессии E2F-заивисмых генов, влияя тем самым на ход клеточного цикла.
Др. транскрипционный фактор, существенный для миогенеза, MEF2, как было установлено, рекрутирует class II HDACs, чтобы репрессировать мышце-специфические гены в миобластах. Однако имеются сообщения, показывающие участие HDAC1/HDAC2 в этом процессе посредством CABIN1/ MITR-зависимого рекрутирования на MEF2 (Backs and Olson, 2006).
HDAC1 and HDAC2 in heart development
Два сообщения выявляют критическую роль HDAC1/HDAC2 в морфогенезе, росте и функционировании сердца (Montgomery et al., 2007; Trivedi et al., 2007). Интересно, что обе лаб. использовали технику нокаута, чтобы инактивировать HDAC2 у мышей, одна группа собщила от постнатальной гибели всех детенышей, погибших в течение первых 25 дней. Выжившие были маленькими, летаргическими восстанавливались спустя 2 мес. и затем развивались нормально. В обоих случаях постнатальная летальность был связана с аномалиями морфологии сердца, таких как утолщение стенки желудочков (из-за повышенной пролиферации), уменьшенные размеры полсти желудочков и с изменением экспрессии плодных кардиальных генов. Остальное расхождение было связано с пенетрантностью фенотипа постнатальной гибели. Возможной причиной может быть различие в генетическом фоне использованных мышей в двух исследованиях. Альтернативно, мутации HDAC2, создаваемые частичной делецией гена, могут приводить к образованию гипоморфного аллеля или экспрессии укороченного белка, обладающего доминантно негативными свойствами в одном из описанных случаев. Чтобы ответить, может ли летальный фенотип HDAC2 нокутных мышей отражать клеточно-автономную функцию HDAC2 в кардиомиоцитах группа Eric Olson's условно делетировала ген HDAC2 в кардиомиоцитах. Такие мыши были жизнеспособны и не обнаруживали серьёзных аномалий в сердце, подтверждая витальную функцию HDAC2 во множественных клеточных клонах сердца. Напротив комбинированная делеция HDAC1 и HDAC2 в кардиомиоцитах давала строгий фенотип: мыши погибали на 14 день после рождения и обнаруживали кардиальные аритмии и тяжелую дилятацию желудочков. Причиной, по-видимому, является повышенная экспрессия определенных Ca2+ ионных каналов, вызывающая патологический приток Ca2+ и повышенную экспрессию контрактильных белков, специфичных для скелетных мышц. Итак, эти данные демонстрируют важную и частично перекрывающуюся функцию HDAC1/HDAC2 в развитии сердца.
Haematopoiesis
Во время гематопоэза все кровяные и иммунные клетки организма генерируются из общих лимфоидных или миэлоидных клеток предшественников. Гематопоэтические транскрипционные факторы, такие как GATA-1, GATA-2, NF-E2, EKLF, Tal-1/SCL, C-myb или PU.1 рекрутируются на клон-специфические гены и тем самым детерминируют судьбу клеток предшественников. Большинство из этих транскрипционных факторов оперируют как транскрипционные активаторы или репрессоры за счет одинакового рекрутирования histone acetyltransferases (HATs) и HDACs и контроля переключения генной экспрессии для предопределения судеб клеток.
Использование HDIs четко показывает, что обратимое ацетилирование является важным механизмом терминальной дифференцировки, напр., для B клеток (Lee, 2003). Кроме того, HATs и HDACs не ограничиваются модификациями гистонов, но также способны ацетилировать/деацетилировать гематопоэтические транскрипционные факторы. Как следствие, функция этих транскрипционных факторов модулируется благодаря зависимым от ацетилирования изменениям в межбелковых взаимодействиях, в сродстве связывания ДНК или в активации/репрессии транскрипции (Huo and Zhang, 2005). Действие histone deacetylases также важно для регуляции быстрого включения/выключения генной экспрессии генов. ответственных за собственно иммунные реакции. Недавнее сообщение указывает на HDAC1 как на члена репрессорного комплекса ZEB1/CtBP2 в регуляции cytokine IL-2 в покоящихся T клетках (Wang et al., 2009). Интересно, что применение бактериального суперантигена ведет к рекрутированию HDAC1, замалчиванию экспресси IL-2 и тем самым способствует толерантности и инертности T клеток (Kametani et al., 2008).
Haematopoietic regulators influenced by HDAC1 and HDAC2
Мастер регулятор раннего гематопоэза - это гематоспецифическое клеточно-специфическое семейство zinc fingerДНК-связывающих белков IKAROS, состоящее из IKAROS, AIOLOS, HELIOS, EOS и PEGASUS. IKAROS регулирует активность hematopoietic stem cell (HSC) и делает возможной дифференцировку в лимфоидный клон, но ограничивает детерминацию миэлоидных судеб (Georgopoulos, 2002). Следовательно, IKAROS может действовать как транскрипционный репрессор в дополнение к его функции как активатора транскрипции. В дифференцирующихся тимоцитах и зрелых T клетках, большинство белка IKAROS инкорпорируется в NuRD комплекс и в меньшей степени в SWI/SNF комплекс, представленный также HDAC1/HDAC2 (Kim et al., 1999). Т.к. NuRD комплекс содержит хроматин ремоделирующие, а также HDAC1/HDAC2 deacetylase активности, то предполагается регуляция "bivalent" хроматина. Этот бивалентный Ikaros/NuRD комплекс может предоставлять потенциал для позитивной и негативной регуляции транскрипции генов мишеней, это делает возможной клональную пластичность и способность к дифференцировке клеток гематопоэтических предшественников (Ng et al., 2007).
Недавно HDAC2 была идентифицирована как регулятор генов immunoglobulin IgM H-цепи и L-цепи в линии B клеток DT40. Авт. сообщили, что HDAC2 обладает позитивным влиянием на экспрессию IKAROS, AIOLOS, PAX5 и EBF1, которые затем репрессируют транскрипцию мРНК IgM H/L цепи (Nakayama et al., 2007). Дальнейшие исследования также показали участие HDAC2 в модуляции частот конверсии гена Ig (Lin et al., 2008), но осталось неясным HDAC2 вовлекается непосредственно или действует посредством косвенно регуляции др. факторов.
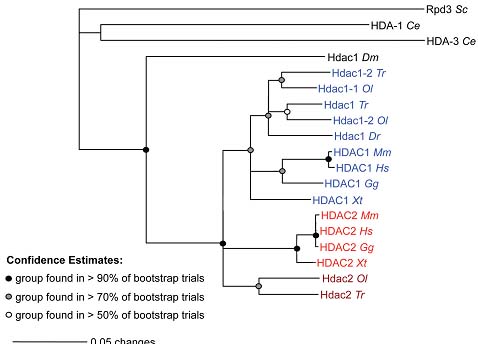 Fig. 1. Phylogenetic relationship between animal HDAC1/ HDAC2 proteins. Bootstrapped neighbour-joining phylogenetic tree of selected eukaryotic HDAC1/HDAC2 protein sequences. Caenorhabditis elegans harbours two genes encoding HDAC1/ HDAC2-like proteins originating from an ancient gene duplication event (HDA-1; HDA-3), Drosophila melanogaster a single one (Hdac1). Vertebrates included in the analysis possess paralogs falling into an HDAC1-like (blue) or an HDAC2-like (red) subgroup. Note that HDAC2-like sequences from fish ( Oryzies lapides; Takifugu rubripes; dark red) do not unambiguously group with HDAC2 proteins from higher vertebrates with the methods employed. Alignment of complete protein sequences was performed using ClustalW with default settings, tree building by PAUP 4.0. Bootstrap analyses (1000 trials) provide a measure of confidence for the detected relationship. The sequence of Saccharomyces cerevisiae Rpd3 was used as outgroup. Sc, Saccharomyces cerevisiae ; Ce, Caenorhabditis elegans; Dm, Drosophila melanogaster ; Dr, Danio rerio; Ol, Oryzias lapides; Tr, Takifugu rubripes; Xt, Xenopus tropicalis; Gg, Gallus gallus; Mm, Mus musculus; Hs, Homo sapiens. Protein sequences were derived from www.ensembl.org.
Fig. 1. Phylogenetic relationship between animal HDAC1/ HDAC2 proteins. Bootstrapped neighbour-joining phylogenetic tree of selected eukaryotic HDAC1/HDAC2 protein sequences. Caenorhabditis elegans harbours two genes encoding HDAC1/ HDAC2-like proteins originating from an ancient gene duplication event (HDA-1; HDA-3), Drosophila melanogaster a single one (Hdac1). Vertebrates included in the analysis possess paralogs falling into an HDAC1-like (blue) or an HDAC2-like (red) subgroup. Note that HDAC2-like sequences from fish ( Oryzies lapides; Takifugu rubripes; dark red) do not unambiguously group with HDAC2 proteins from higher vertebrates with the methods employed. Alignment of complete protein sequences was performed using ClustalW with default settings, tree building by PAUP 4.0. Bootstrap analyses (1000 trials) provide a measure of confidence for the detected relationship. The sequence of Saccharomyces cerevisiae Rpd3 was used as outgroup. Sc, Saccharomyces cerevisiae ; Ce, Caenorhabditis elegans; Dm, Drosophila melanogaster ; Dr, Danio rerio; Ol, Oryzias lapides; Tr, Takifugu rubripes; Xt, Xenopus tropicalis; Gg, Gallus gallus; Mm, Mus musculus; Hs, Homo sapiens. Protein sequences were derived from www.ensembl.org.  Fig. 2. Functional domains of HDAC1/HDAC2 proteins. Schematic view of the human HDAC1 and HDAC2 proteins as representatives for HDAC1-like and HDAC2-like proteins. Both share a highly conserved N-terminal part harbouring the HDAC association domain (HAD) important for protein-protein interaction as well as the catalytic domain (HDAC domain) essential for enzymatic function. Common to HDAC1/HDAC2 is an IAC(E/D)E motif required for the interaction with pocket proteins. Interaction between HDAC1 and the ubiquitin ligase Chfr depends on two amino acids within the HDAC domain (F287; M297). The C-terminus exhibits more diversity: while HDAC1 harbours a nuclear localisation signal (NLS), HDAC2 contains a coiled-coil domain for protein-protein interaction. Both enzymes are targets for posttranslational modifications such as phosphorylation, acetylation and sumoylation, which are thought to have influence on enzyme activity, protein stability, complex formation and nuclear import.
Fig. 2. Functional domains of HDAC1/HDAC2 proteins. Schematic view of the human HDAC1 and HDAC2 proteins as representatives for HDAC1-like and HDAC2-like proteins. Both share a highly conserved N-terminal part harbouring the HDAC association domain (HAD) important for protein-protein interaction as well as the catalytic domain (HDAC domain) essential for enzymatic function. Common to HDAC1/HDAC2 is an IAC(E/D)E motif required for the interaction with pocket proteins. Interaction between HDAC1 and the ubiquitin ligase Chfr depends on two amino acids within the HDAC domain (F287; M297). The C-terminus exhibits more diversity: while HDAC1 harbours a nuclear localisation signal (NLS), HDAC2 contains a coiled-coil domain for protein-protein interaction. Both enzymes are targets for posttranslational modifications such as phosphorylation, acetylation and sumoylation, which are thought to have influence on enzyme activity, protein stability, complex formation and nuclear import.
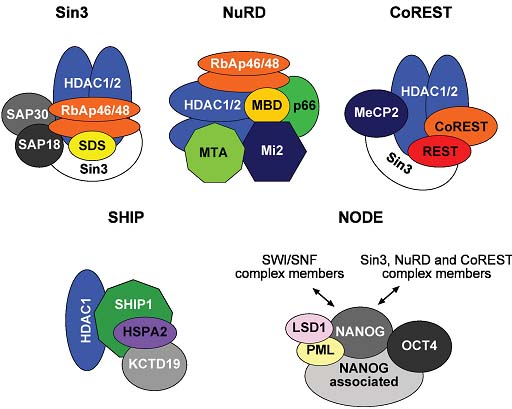 Fig. 3. Composition of HDAC1/HDAC2 containing multiprotein complexes. The SIN3 complex is comprised of HDAC1 and HDAC2 delivering enzymatic activity and the structural components SIN3, RbAp46, RbAp48, SAP18, SAP30 and SDS3. RbAp46, RbAp48, HDAC1 and HDAC2 are also found in the NuRD complex, together with the NuRD specific factors MTA, Mi-2, p66 and MBD. Both complexes are tethered to DNA via numerous transcription factors (not illustrated). The CoREST complex consists of CoREST, MeCP2, SIN3, HDAC1, HDAC2 and is targeted to DNA via the REST protein. Besides those three classical HDAC complexes, a testis specific complex containing SHIP1, HDAC1, HSPA2 and KCTD19 has been identified recently. In ES cells the transcription factors Nanog and Oct4, together with associated proteins interact with HDAC1 and HDAC2 and several other members of the SIN3, NuRD, CoREST and SWI/ SNF complexes. Note that the schematic view does not mirror physical interaction of the subunits.
Fig. 3. Composition of HDAC1/HDAC2 containing multiprotein complexes. The SIN3 complex is comprised of HDAC1 and HDAC2 delivering enzymatic activity and the structural components SIN3, RbAp46, RbAp48, SAP18, SAP30 and SDS3. RbAp46, RbAp48, HDAC1 and HDAC2 are also found in the NuRD complex, together with the NuRD specific factors MTA, Mi-2, p66 and MBD. Both complexes are tethered to DNA via numerous transcription factors (not illustrated). The CoREST complex consists of CoREST, MeCP2, SIN3, HDAC1, HDAC2 and is targeted to DNA via the REST protein. Besides those three classical HDAC complexes, a testis specific complex containing SHIP1, HDAC1, HSPA2 and KCTD19 has been identified recently. In ES cells the transcription factors Nanog and Oct4, together with associated proteins interact with HDAC1 and HDAC2 and several other members of the SIN3, NuRD, CoREST and SWI/ SNF complexes. Note that the schematic view does not mirror physical interaction of the subunits.
 Fig. 4. Chromatin state of neuronal genes in distinct stages of differentiation. In embryonic stem cells, neuronal genes with an internal RE-1 DNA element are associated with REST, its corepressor CoREST and additional factors such as SIN3A, HDAC1/HDAC2 and MeCP2. Although neuronal gene expression is almost entirely abolished, the chromatin is poised for consecutive activation. In addition to the core CoREST complex, inducers of heterochromatin are recruited to neuronal genes in differentiated non-neuronal cells. Due to recruitment of heterochromatic protein-1 (HP1), histone demethylase LSD1, histone methyltransferases SUVAR39H1/G9a as well as DNA methyltransferase1 (DNMT1), neuronal specific gene expression is completely inhibited and heterochromatin formation is induced. In terminally differentiated neuronal cells, REST is proteasomally degraded, thereby relieving the repressive chromatin state. Polymerase recruitment by activator complexes leads to expression of neural specific genes. This schematic view does not mirror physical interaction of the subunits.
Fig. 4. Chromatin state of neuronal genes in distinct stages of differentiation. In embryonic stem cells, neuronal genes with an internal RE-1 DNA element are associated with REST, its corepressor CoREST and additional factors such as SIN3A, HDAC1/HDAC2 and MeCP2. Although neuronal gene expression is almost entirely abolished, the chromatin is poised for consecutive activation. In addition to the core CoREST complex, inducers of heterochromatin are recruited to neuronal genes in differentiated non-neuronal cells. Due to recruitment of heterochromatic protein-1 (HP1), histone demethylase LSD1, histone methyltransferases SUVAR39H1/G9a as well as DNA methyltransferase1 (DNMT1), neuronal specific gene expression is completely inhibited and heterochromatin formation is induced. In terminally differentiated neuronal cells, REST is proteasomally degraded, thereby relieving the repressive chromatin state. Polymerase recruitment by activator complexes leads to expression of neural specific genes. This schematic view does not mirror physical interaction of the subunits.