Принципиальные оси тела животных закладываются в раннем эмбриональном развитии. Часть этого процесса использует гомеобоксные гены, группу транскрипционных факторов, которые содержат домен в 60-аминокислот (гомеодомен). Одна особая субгруппа гомеобоксных генов - Hox гены - состоит из генов, которые физически сцеплены на хромосоме в т.наз. 'Hox clusters'. Что особенно выделяет Hox гены так это не только из организация в хромосомные кластеры - состоящий из 8 гомеозисных генов в расщелине Antennapedia-Ultrabithorax (ANTP-UBX) комплекса у Drosophila melanogaster и из 39 Hox генов в 4 комплексах у млекопитающих - но и четкий феномен пространственной колинеарности. Последовательность генов в кластере воспроизводит порядок экспрессии шенов и их функционирование вдоль anterior-posterior (A-P) оси тела: гены на 5' конце кластера экспрессируются в и формируют паттерн задних частей тела, тогда как гены 3' конца формируют паттерн переднего конца тела1. В некоторых клонах (в основном позвоночных), гены внутри кластеров Hox обнаруживают временную колинеарность помимо пространственной колинеарности: передние гены экспрессируются раньше, чем задние гены2,3. Hox кластеры обнаруживаются почти у всех BILATERIAN животных и, по-видимому, возникают до разделения CNIDARIAN-bilaterian (BOX 1). Сохранение интактным колинеарного Hox кластера свыше 1,000 million years (Myr) указывает на то, что его организация эволюционно закреплена4.
| |
|
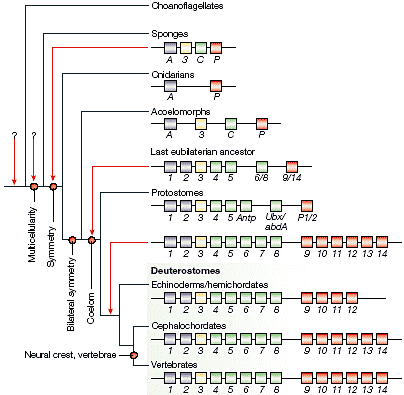
During evolution, large MACRO EVOLUTIONARY EVENTS
markedly altered the metazoan body plan and gave rise to the
morphological diversity and complexity of current
phyla78. The cladogram shows the main metazoan
groups and the associated body-plan transitions (indicated by red circles). The closest unicellular relatives of metazoans were
the choanoflagellates61; the question marks indicate
uncertainty about the Hox gene complement in these
evolutionary positions. The first body-plan transition in
metazoans was the origin of radial symmetry, which gave
rise, in the first instance, to cnidarians. The origin of
bilaterality involved the generation of two body axes
(anteroposterior and dorsoventral), the endomesoderm, and a
nervous system that was concentrated at the anterior (but see REF. 79 for alternative views on the origin of the nervous system). Acoelomorphs (acoel flatworms) are the simplest bilateral representatives16. Higher bilaterians (Eubilateria) are protostomes
(arthropods, nematodes, annelids, molluscs and platyhelminthes, among other phyla) and deuterostomes (hemichordates, echinoderms and chordates). These two groups arose from the last eubilaterian ancestor, which had coelomic cavities, was segmented, and had a THROUGHЖЄGUT, an excretory system and brain ganglia16. Non-vertebrate
chordates (urochordates and cephalochordates such as amphioxus) did not undergo the metazoan transition that generated the vertebrate lineage, which is characterized by having neural-crest-derived tissues, vertebrae and high brain complexity. (See main text for alternative views on the origin of bilaterality.)
The figure illustrates one plausible explanation for the current composition of the homeobox (Hox) cluster in each main metazoan group. Hox genes are divided into four distinct classes: Anterior (A, and the
corresponding paralogous groups 1 and 2, in purple), Group 3 (3, in yellow), Central (C, corresponding to paralogous groups 4--8 in deuterostomes and groups 4, 5, Antennapedia (Antp) and Ultrabithorax/abdominal A (Ubx/abdA) in protostomes, in green), and Posterior (P, P1/2 in protostomes, and paralogous groups 9--12 or
9--14 in deuterostomes, in red) genes. Cluster duplications in vertebrates are not indicated for simplicity. Red
arrows indicate the inferred Hox gene composition at relevant morphological transitions. The Hox cluster of the
common ancestor of cnidarians and bilaterians would have contained a member of each gene class. According to classical views, cnidarians secondarily lost the Group 3 and Central genes, and the origin of bilaterality was not coincident with an increase in the complexity of the Hox cluster. See BOX 2 for an alternative hypotheses on the
composition of the primordial Hox cluster. |
В последнее время найдено два очень близких кластера Hox. Первый - кластер ParaHox - является эволюционно близким родственником или паралогом кластера Hox5. Оба кластера Hox и ParaHox возникли в результате дупликаций родоначального ProtoHox кластера в эволюции ранних METAZOAN. Второе, более удаленное семейство гомеобоксных генов названо NK кластером. NK гомеобоксные гены эволюционно родственны и Hox и ParaHox генам, и обнаруживаются в виде кластеров в некоторых ветвях. Сравнительные геномные исследования строго показали, что Hox, ParaHox и NK кластеры были первоначально соседними в геноме. Имеются также доказательства того, что они составляют большой массив гомеобоксных генов, который я называю здесь 'megacluster', и который д. был иметь самостоятельные эволюционные пути в каждой из ветвей.
Паттерн экспрессии трех родственных наборов гомеобоксных генов интересен, т.к. каждый набор, по-видимому, соответствует грубо одному из трех эмбриональных зародышевых листков: Hox гены экспрессируются во всех зародышевых слоях, но преимущественно в нейроэктодерме6, ParaHox гены экспрессируются в первую очередь в энтодермальных производных5, a NK гены экспрессируются главным образом в мезодермальных производных7. До недавнего времени считалось, что происхождение гомеобоксных кластеров, связаное с происхождением и диверсификацией трех зародышевых листков, запутанно, т.к. гомеобоксные кластеры присутствуют даже у простейших metazoans, которые 'classically' лишены третьего зародышевого слоя, мезодермы. Однако, недавние находки у cnidarians, и критическая переоценка сложности плана тела у простейших metazoans, позволили предложить интересную идею: что мегакластер гомеобоксных генов эволюционно появился вместе с (а может был и причиной) появлением трех зародышевых слоёв, и что происхождение TRIPLOBLASTY предшествует расхождению cnidarian-bilaterian.
Здесь я суммирую наши современные знания о происхождении и структуре Hox и ParaHox кластеров. Описывается также структура и функция третьего Hox-подобного кластера генов, кластер NK, у CHORDATES и PROTOSTOMES, и обсуждается, что мы знаем о специфичности трех кластеров в отношении зародышевых слоев. Наконец, я прилижаюсь к загадке, окружающих причин образования кластеров гомеобоксных генов.
The Hox cluster
Hox гены важны для позиционирования структур тела вдоль A-P оси. Как они это делают и какие программы генных сетей они регулируют? Исходя из филогенетических реконструкций, Hox гены могут быть классифицированы на 4 группы - Anterior, Group 3, Central and Posterior - в соответствии с их положением в кластере и месте экспрессии вдоль оси тела8-10 (BOX 1). Хотя происхождение Hox генов не может быть реконструировано со всей определенностью, но последний общий родоначальник protostomes и DEUTEROSTOMES, как полагают, имел одиночный Hox кластер, состоящий из 7-9 генов. Кластер затем расширился, чтобы включить 8 или 9 членов в разных ветвях protostome11 и до 14 у хордовых12,13 (BOX 1). Дупликация кластера сопровождалась потерей генов, что объясняет наличие 39 Hox генов, которые присутствуют теперь в 4 кластерах млекопитающих или свыше 14 кластеров в ветви рыб14. Состав Hox генов у простейших metazoans не был известен до недавнего времени, до обширных исследований с помощью скрининга degenerate PCR и EST, и с помощью секвенирования генома. Независимо от клон-специфических удвоений, однако, по крайней мере, 4 гена присутствовали в родоначальнике самого раннего из существующих простейших bilaterians, acoelomorph flatworms15,16, и 2 гена в родоначальнике cnidarians17.
The ParaHox cluster
Некоторые Hox-родственные гены традиционно классифицировали как 'orphans': они были родственны некоторым группам Hox paralogous больше, чем др. группы паралогов др. к др. Этот кажущийся парадокс был объяснен Brooke et al.5, которые установили, что три из этих орфановых генов тесно сцеплены с геномом AMPHIOXUS. Этот новый кластер, который они назвали ParaHox, является паралогом кластера Hox. Он ограничен хордовыми, хотя отдельные гены - caudal-type homeobox (Cdx), genomic screened homeobox (Gsh) и Xenopus laevis homeobox 8/insulin promoter factor 1
(Xlox/Ipf1) - также присутствуют, хотя и разбросаны, и в геномах др. deuterostome и protostome10,18-20.
Origin of the ParaHox cluster. Большинство филогенетических моделей8,10,21,22 показывает, что Hox и ParaHox кластеры возникли до расхождения cnidarians и bilaterians (BOX 1) благодаря удвоениям гипотетического ProtoHox кластера. Этот кластер, по-видимому, существовал из 4 генов (одного Anterior, одного Group 3, одного Central и одного Posterior). После удвоения ParaHox кластер потерял центральный ген, а Hox кластер увеличился в центральной части за счет дальнейших цис-дупликационных событий (FIG. 1). Существуют, однако, и др. теории, предполагающие, что ProtoHox кластер обладал только двумя или тремя генами (BOX 2). Независимо от того, как много генов содержал ProtoHox кластер, сцепление Hox и ParaHox генов указывает на то, что кластер ProtoHox сам возник благодаря цист-дупликациям гена основателя ProtoHox (FIG. 1).
| |
|
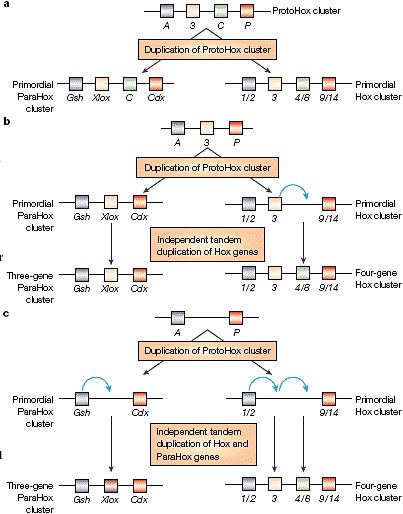
The homeobox (Hox) and ParaHox (its paralogue) clusters arose early in
evolution from the duplication of an ancestral
ProtoHox cluster, but the number of genes present in
the ProtoHox cluster at the time of duplication is still
uncertain. The original report of the ParaHox
cluster5 proposed a model in which the ProtoHox cluster
was composed of four genes (one Anterior (A), one
Group 3 (3), one Central (C), and one Posterior (P)).
According to this model, shown in panel a, this cluster
gave rise to a primordial Hox cluster of four genes
(paralogous groups 1/2, 3, 4/8, 9/14), and a primordial
ParaHox cluster of four genes (genomic screened
homeobox (Gsh), Xenopus laevis homeobox 8/insulin
promoter factor 1 (Xlox/Ipf1), C and caudal-type
homeobox (Cdx)). The ParaHox cluster would have
lost the C gene, and the Hox cluster would have expanded
differently in the various bilaterian lineages.
An alternative, the threegene model, which was also
mentioned in the original report5, was developed soon after21,22. According to this view, shown in panel b, the C Hox gene (4/8) originated by cis-duplication of 3 (as indicated by a blue arrow).
More recently, a two-gene model has been also proposed27 (panel c), in which Gsh generated the C ParaHox gene Xlox (blue arrow) by cis-duplication, and the anterior Hox gene (1/2) cis-duplicated sequentially to generate both 3 and 4/8 genes (blue arrows).
Phylogenetic analyses cannot distinguish between these three possibilities, but current data obtained from simpler
metazoans15–17 favour the two-gene or three-gene models as being the most parsimonious. Cnidarians seem to possess
only anterior and posterior Hox and ParaHox genes (Hox 1/2 and 9/14, and ParaHox Gsh and Cdx; other Hox genes are
probably cnidarian-specific duplicates)17,27. In both the two-gene and three- gene models three events are required to
account for the current Hox and ParaHox complement of cnidarians and bilaterians: the generation of Xlox, 3 and 4/8 in
bilaterians (two-gene model), and the generation of 4/8, and the loss of Xlox and 3 in cnidarians (three-gene model).
Phylogenetic analyses support (although weakly) a close relationship between 3 and Xlox, therefore favouring a
three-gene model, whereas the two-gene model fits nicely with the increase in complexity of Hox and ParaHox clusters
that correlates with major metazoan transitions, such as the origin of bilaterians and the CAMBRIAN EXPLOSION27.
|
Evx and Meox. Hox и ParaHox гены принадлежат ANTP классу гомеобоксных генов, одному из главных классов специфичных для животных гомеобоксных генов. Класс ANTP включает также два др. гена, even-skipped homeotic gene (Evx) и mesenchyme homeobox (Meox; известный также как Mox), которые филогенетически близки Hox и ParaHox генам и располагаются по обеим сторонам кластера Hox у позвоночных23 (FIG. 1). Evx тесно сцеплен в 5' концом Hox гена, даже у cnidarian видов24. Недавно филогенетический анализ20,25,26 и дальнейшие исследования по геномному картированию привели к предположению, что Evx и Meox возникли в результате дупликации родоначального гена, Evx/Meox родоначальника (или ProtoMoeve26,27), который находился по соседству с 5' концом ProtoHox кластера. The ProtoHox cluster и ProtoMoeve дуплицируются в цис-положении, помещая Evx 5' в Hox кластер, а Meox 3' в ParaHox кластер (FIG. 1). Хромосомные разрывы на любой из сторон кластера ParaHox затем привели к Meox и Evx на противоположных концах Hox кластера, и привели к отделению кластера ParaHox.
Вероятность того, что Hox и ParaHox кластеры были физически сцеплены, демонстрируется также косвенными уликами: Сцепление Cdx с Hox1 у urochordate Oikopleura dioica28.
Mnx, Gbx and En. Три др. члена класса ANTP филогенетически родственных генам Hox/ParaHox также картируются вблизи кластера Hox у позвоночных и amphioxus29-31. Этот кластер из трех генов, которому дали имя EGHBox30, состоит из motor neuron restricted (Mnx), gastrulation brain homeobox (Gbx) and engrailed (En). Сравнительные геномные исследования подтвердили существование расширенного Hox или ParaHox кластеров в ранней эволюции metazoan, которые содержали кластеры генов, обсуждаемые в этом разделе: Mnx, Gbx, En, Evx, Hox, Meox и ParaHox геныв31.
The NK cluster
В 1989 Kim and Niremberg сообщили о наличии 4-х новых гомеобоксных генов у D. melanogaster32, которые они назвали NK1 - NK4 (по Niremberg and Kim). Из них NK1, NK3 и NK4 картированы в том же самом цитологическом положении - дисках 93D/E на хромосоме 3. NK2 локализован на хромосоме 1. Впоследствии гены были переименованы, чтобы отражать известные мутационные аллели, которые они представляют: NK1 = S59 или slouch (slou), NK2 = ventral nervous system defective (vnd), NK3 = bagpipe (bap), и NK4 = muscle-specific homeobox 2 (msh2) или tinman (tin). Др. родственные гомеобоксные гены были обнаружены позднее7,33 вблизи оригинального кластера из трех NK генов: C15 (известного также как 311, 93Bal, Hox11-311), ladybird early (lbe) и ladybird late (lbl). Эти последние два гена удвоились недавно у D. melanogaster. Jagla et al.33 назвали этот кластер из 6 генов 93D/E кластером, по отношению к их цитологическому положению в третьей хромосоме.
NK гены имеют также ортологов у хордовых, так NK кластер сам по себе д. присутствовать у ранних bilaterians. Pollard and Holland30 идентифицировали остатки 4-х NK кластеров в черновом варианте генома человека (FIG. 2a). Заметим, однако, что номенклатура NK генов ещё не систематизирована (TABLE 1): напр., NKX2-3, NKX2-5 и NKX2-6 являются человеческими ортологами D. melanogaster tin (NK4), a NKX3-1 и NKX3-2 ортологами D. melanogaster bap (NK3).
Из-за разросшихся Hox и ParaHox кластеров, исторической серии геномных дупликаций, потерь генов и хромосомных перестроек трудно сделать заключение о родоначальном, одиночном NK кластере у позвоночных. Однако, Luke et al.34 недавно охарактеризовали организацию NK кластера у
amphioxus с помощью геномного клонирования и FLUORESCENCE IN SITU HYBRIDIZATION. Интересно, что кластеры NK у amphioxus и позвоночных расщеплены по одним и тем же межгенным позициям (FIG. 2a). У хордовых только TLX (T-cell leukaemia homeobox)-LBX (ladybirdrelated
homeobox) и NK3-NK4 сцепление поддерживались в качестве родоначального кластера. Дальнейшее геномное картирование добавило новые гены к кластеру NK: muscle-specific homeobox genes (Msx) и NK5 (FIG. 2a).
Всё вместе указывает на то, что кластер NK из 7 генов (Msx-NK4-NK3-Lbx-Tlx-NK1-NK5) д. существовать, по крайней мере, у общего родоначальника bilaterians до разделения на protostome-deuterostome. В резком контрасте с Hox и ParaHox кластерами, которые сохранялись интактными в ветви deuterostome, но не в ветви protostome, которые были подробно изучены, кластер NK сохранил в основном компактную родоначальную организацию у D. melanogaster и москитов, но оказался разорванным на три куска в ветви хордовых.
The ANTP megacluster
Из данных приведенных выше может быть прослежена полная эволюционная модель генеза и эволюции ANTP-класса гомеозисных генов (FIG. 3). В ранней эволюции metazoan ProtoANTP ген основатель сгенерировал два гена с помощью цис-дупликации - ProtoHox-подобный и ProtoNK. Каждый ген был умножен с помощью цис-дупликаций, давая набор Hox, ParaHox и NK кластеры (FIG. 1). Два хромосомных разрыва расщепили мегакластер на три современных синтеничных региона ParaHox, Hox и NK.
Хотя не известны современные геномы животных, которые содержат оригинальный набор генов ANTP-класса в виде одиночного массива, филогенетическая и gene-map реконструкция, которая показана на FIG. 1, иллюстрирует, что мегакластер из 25 гомеобоксных генов, включая Hox,
ParaHox и NK кластеры, существовал в ранней эволюции животных. Точное время инициальных цис-дупликаций не известно. Увеличенные Hox, ParaHox и NK гены присутствуют у DIPLOBLASTIC cnidarians17,35. Следовательно, генез мегакластера может предшествовать переходу от cnidarian к bilaterian. Не было описано определенно Hox или ParaHox генов у простейших metazoans (губок). Однако губки содержат NK гены - Msx, Tlx, NK3 и NK2 (REFS 36.38) (которые пока не картировны). Находка NK генов у губок указывает на то, что общий родоначальник для губок и др. metazoans (right at the origin of metazoans) обладал, по крайней мере, одним Hox-подобным геном. Однако, интенсивные исследования гомеобоксных генов у губок оказались безуспешными: Hox гены или были потеряны у ветви проанализированных губок или они были упущены при традиционном или PCR скрининге из-за дивергенции последовательностей. Проекты по геномному секвенированию могли бы оказаться информативными в этом отношении.
One cluster per germ layer?
Билатеральная симметрия плана тела строится на трех эмбриональных зародышевых листках: эктодерме, энтодерме и мезодерме. Сравнительный анализ экспрессии Hox, ParaHox и NK генов показал, что эти классы генов преимущественно экспрессируются в эктодермальных, энтодермальных и мезодермальных производных в соотв. порядке. Это позволяет выдвинуть интригующее предположение, что происхождение гомеобоксного мегакластера связано с возникновением или формированием паттерна зародышевых слоёв.
Hox gene expression. Без сомнения Hox кластер играет важную роль с формировании A-P паттерна тела. Тем не менее, экспрессия и функция Hox генов у D. melanogaster и хордовых наиболее доказана в эктодермальных и нейроэктодермальных тканях. Данные по экспрессии генов у amphioxus показывают, что примитивная роль Hox кластера у хордовых заключалась в формировании паттерна нейроэктодермы, включая как ЦНС, так и ПНС6. Lowe et al.39 элегантно описали колеблющуются экспрессию Hox генов у HEMICHORDATES, у которых Hox гены экспрессируются в циркулярных областях эктодермы вокруг всего животного, с A-P расположением, которое почти идентично тому, что найдено у хордовых.
ParaHox gene expression. В противоположность паттерну в основном эктодермальной экспрессии генов Hox, гены ParaHox обнаруживаются в основном в энтодермальных тканях. У amphioxus, ParaHox гены также обнаруживают пространственную и временную колинеарность5, хотя в меньшей степени, чем Hox гены (J.G.-F. & P.W.H. Holland, unpublished observations).
Задний ParaHox ген Cdx экспрессируется в каудальных тканях, а его доминантным местом экспрессии является задняя энтодерма. Напр., у позвоночных Cdx гены экспрессируются в самой каудальной области эмбриона и гены Cdx1 и Cdx2/3 важны в раннем процессе морфогенеза кишечника40. Сходным образом у мух caudal оген экспрессируется взади41.
Центральный ParaHox ген Xlox (или Ipf1) также экспрессируется в энтодерме хордовых, хотя он имеет более центральный домен экспрессии, чем Cdx (что и предполагалось исходя из его более центрального положения внутри кластера). Xlox является критическим во время эмбрионального развития и для дифференцировки эндокринной части поджелудочной железы и передней части двенадцатиперстной кишки42. Не известен гомолог Xlox в геноме D. melanogaster, но у пиявок Xlox ген экспрессируется в тканях средней кишки43.
Принимая во внимание колинеарность кластера ParaHox мы ожидали увидеть экспрессию переднего ParaHox гена, Gsh, в передних энтодермальных тканях. Вместо этого, Gsh гены выявлялись в ЦНС позвоночных. Кроме того, у D. melanogaster, ген Gsh (intermediate neuroblast defective, ind) экспрессируется в нейроэктодерме44. Как же может объяснить отсутствие экспрессии Gsh в передней энтодерме? Если кластер cohesion необходим для управления экспрессией в передней кишке у D. melanogaster, то отсутствие экспрессии в передней кишке может быть объяснено износом (deterioration) кластера ParaHox в этом роду. Если кластер ParaHox исходно был patterned под колинеарность энтодермы - с Gsh вокруг примитивного рта - тогда отсутствие экспрессии в передней энтодерме Gsh у позвоночных может быть обусловлено радикальными изменениями в передней кишке во время эволюции deuterostome. Можно предположить, что у
protostomes, которые имеют интактный ParaHox кластер, Gsh д. экспрессироваться в передней энтодерме45. Более того, картирована экспрессия у позвоночных46 гена Gsh в энтодермальных производных и показано, что Gsh1 и Gsh2 экспрессируются в поджелудочной железе взрослых мышей.
NK gene expression. Экспрессия кластера генов NK изучена преимущественно у D. melanogaster (TABLE 2). Интересна находка, что все 6 членов оригинального кластера 93D/E (tin, bap, lbe, lbl, C15 и slou) участвуют в формировании раннего паттерна и дифференцировке мезодермы у D. melanogaster (rev. 7). Это в основном регуляторные взаимодействия между этими генами, которые, хотя и не ранжированы иерархически, имеют tin в качестве общего инициатора или модулятора (FIG. 2b). Является ли паттерн экспрессии генов NK у D. melanogaster колинеарным, не известно. Jagla et al.7 полагают, что NK гены обнаруживают временную колинеарность с отношении последовательности генов в кластере, аналогично кластерам Hox и ParaHox и что функциональные ограничения, которые поддерживаются компактной структурой кластера NK у D. melanogaster связаны с координированной экспрессией, которая связана со временной колинеарностью и последовательным функциональным развертыванием этих генов во время развития мезодермы.
У позвоночных NK кластер расщеплен на 3, только 2 пары генов остаются в тесной близи: NK3-NK4 и Lbx-Tlx
(FIG. 2a). Данные по экспрессии большинства NK генов млекопитающих во время эмбрионального развития сложны (TABLE 2): все они экспрессируются в мезодермальных производных, а некоторые (NK4, Lbx и Tlx) участвуют в развитии сердца47,48. NK гены позвоночных, по-видимому, не сохранили колинеарности экспрессии, хотя некоторые авт49,50 предполагают, что комбинации NK4 и NK2 паралогов формируют паттерн передне-вентрального домена, который включает мезодермальное кардиальное поле и некоторые энтодермальные области.
Three clusters, three germ layers. В заключение, сравнительная геномика и функциональные данные и данные по экспрессии у protostomes и deuterostomes указывают на провоцирующую идею: три кластера ANTP-класса гомеобоксных генов обнаруживают явную степень предпочтения и колинеарности, в трех зародышевых слоях у билатерально симметричных животных: Hox в отношении эктодермы, ParaHox энтодермы и NK мезодермы. Можно предположить, что в эволюции ранних metazoan стержневой массив гомеобоксных генов удваивался, давая три набора генов. собранных в кластеры, с самостоятельными паттерн-формирующими свойствами. Так как разворачивание этих кластеров облегчало эволюционное возникновение или независимое формирование паттернов зародышевых слоев.
The origin of triploblasty and bilateral symmetry
Имеющие два зародышевых листка cnidarians имеют Hox, ParaHox и NK
гены, а общий родоначальник cnidarians и bilaterians д. уже обладать тремя кластерами. Следовательно, если мы обратимся к трём кластерам, чтобы узаконить теорию происхождения трех зародышевых листков, то как мы объясним присутствие трех классов генов (и clustering) у последнего общего родоначальника cnidarians и bilaterians? Этот родоначальник д. существовать до возникновения мезодермы и билатеральной симметрии, двух основных эволюционных новоприобретений, которые появились одновременно в эволюции животных.
Что, кажется парадоксом Kafkaesque было недавно высказано в работе Finnerty и др.17, чьи данные по starlet sea anemone
Nematostella vectensis показали, что время пересмотреть происхождение билатеральной симметрии (whether cnidarians
are diploblastic is also a subject of current debate51,52).
Морские полипы принадлежат к базовому cnidarian классу Anthozoa. Поперечные срезы взрослых не обнаруживают радиальной симметрии, а обнаруживают план билатеральной симметрии, который, как известно, является директивной осью. Эта билатеральная симметрия была выявлена Stephenson в 1928 (REF. 53) и Hyman в 1940 (REF. 54), но не была включена в какие-либо учебники. Hox гены у N. vectensis экспрессируются в неустойчивых доменах, которые напоминают их паттерн экспрессии у bilaterians17. Только передний и задний гены Hox N. vectensis обнаруживают гнездовую экспрессию: передний паралог ген anthox6 экспрессируется вблизи PLANULA BLASTOPORE, a задний паралог anthox1 экспрессируется на противоположном конце. Итак, данные показывают, что oral-aboral ось у cnidarians является гомологом A-P оси у bilaterians. Т.к. для второй оси ген decapentaplegic (dpp), (который жизненно необходим для построения дорсальной стороны у arthropods и вентральной стороны у позвоночных) экспрессируется асимметрично на одной стороне бластопора у sea anemones и кораллов17,55. Это указывает на то, что директивная ось у sea anemones гомологична дорсо-вентральной оси bilaterians56. Более того, стадия медузы у некоторых cnidarians обнаруживает хорошо развитый слой исчерченных мышц, который происходит из мезодерм-подобного третьего листка, который устанавливается в начале образования медузы (entocodon)52.
Следовательно, если cnidarians развиваются посредством того же самого процесса, который ведет к билатеральной симметрии, и если современный радиально симметричный вид достигнут вторично - и если cnidarians имеют тканевой слой, который гомологичен мезодерме - то генез трех кластеров, которые сцеплены с эктодермой, энтодермой и мезодермой, всё ещё имеет смысл. Где, тогда мы д. локализовать происхождение bilaterians и трех зародышевых слоёв?
Ответ могут дать губки. Они классически рассматриваются как простейшие metazoans, лишенные видимой симметрии. Гомеобоксный набор ANTP-класса у губок сегодня ограничен немногими NK-подобными генами, тогда как гены Hox или ParaHox не найдены38. Поэтому время поместить возникновение мегакластера на момент расхождения sponge-cnidarian, действительный источник bilaterality и triploblasty (исходя из предположения, что cnidarians являются bilaterians и triploblastic). Если эти рассуждения верны, то почему губки имеют несколько NK генов и не имеют Hox или ParaHox генов? Тот факт, что Hox или ParaHox не были идентифицированы может быть просто обусловлен техническими трудностями обнаружения старых, дивергентных или экспрессирующихся эмбрионально последовательностей или выбором не основополагающих видов. Несмотря на это примитивность губок сегодня оспаривается57. Неясно формируют ли губки монофилетическую сестринскую группу прикрепленных (rest) metazoans, или являются парафилетическими. Как и в случае с cnidarians, эволюционная информация получена в исследованиях эмбрионального развития. Личинки губок архитектурно ближе, чем взрослые губки к др. metazoans. Одна из возможностей заключается в том, что др. metazoans (включая cnidarians) произошли от личинок NEOTENOUS родоначальных губок и что губки были фактически простейшими bilaterian metazoans58, имеющими одиночный или несколько Hox-подобных генов и несколько NK генов. Необходимо принять, что сегодня не существует базовых non-bilaterian животных. Интригующим исключением может быть PLACOZOANS, загадочная группа, которая не имеет симметрии и Hox-подобных генов, которые могли бы напоминать родоначальные Hox или ParaHox гены59.
The origin of metazoans. Наконец, мы подошли к возникновению metazoans. Исходя из последних данных по EST и митохондриальному геному60 и сходства с губками CHOANOCYTES, последними одноклеточными общими родоначальниками metazoans,по-видимому,
были choanoflagellates61. Не выявлено генов ANTP-класса у choanoflagellates, это указывает на то, что многоклеточность связана с возникновением генов ANTP-класса и что производные ранних metazoans, которые имели по одиночному члену основателю трех кластеров, сегодня не живут. Опять же может быть предложена альтернативная гипотеза - что
choanoflagellates не были родоначальниками metazoans, а дегенеративными производными губок, которые потеряли свою многоклеточность и возможно и гены ANTP-класса58.
Caveats. Хотя и привлекателен тезис, что связано происхождение трех кластеров с возникновением трех зародышевых слоёв, но необходима осторожность по многим причинам. Во-первых, специфичность зародышевых листков далека от окончательной (conclusive); эти кластеры генов используются независимо сотни миллионов лет и их функции на сегодняшний день могут быть сложным сплавом родоначальных и производных функций. Выяснение оригинальной функции на время зарождения кластеров, следовательно, рискованно. Во-вторых, теория базируется на идее, что cnidarians были первоначально triploblastic. Если же нет, то привязка Hox, ParaHox и NK кластеров к формированию паттерна трех зародышевых слоёв д. произойти после возникновения трех кластеров в ранней ветви bilaterian, а не одновременно с их возникновением. В-третьих, если cnidarians являются примитивными triploblastic, то необходимо объяснить, как три кластера становятся ассоциированы с определенными зародышевыми слоями: происходит ли ассоциация после расхождения cnidarian-bilaterian или ассоциация теряется вторично у cnidarians, на что указывает энтодермальная экспрессия Hox генов17 или эктодермальная экспрессия ParaHox гена Gsh62 у N. vectensis? В-четвертых, формально не было установлено, что исходные Hox, ParaHox и NK кластеры были сцеплены вместе в геноме во время их возникновения. Эта реконструкция базируется на сцеплении и филогенетической информации из существующих phyla, но среди существующих животных не найдены еще представители с мегакластером.
Homeobox clustering: functional constraints
Hox genes. Известно, что порядок генов не случаен, и что гены со сходным или скоординированным паттерном экспрессии часто собраны в кластеры4,63. Спустя более 25 лет после открытия Hox кластера и колинеарности64, всё ещё неясно, почему Hox собраны в кластер и не обходим ли кластер для колинеарности. Гомеобоксные кластеры ANTP-класса возникают рано в эволюции metazoan. Если бы не было функциональных связей, влияющих на поддержание сцепления, то гены со временем были бы разбросаны по геному. Duboule с коллегами показал с использование engineered мышей, что временная, а не пространственная колинеарность ответственна за удерживание комплекса вместе. Они идентифицировали глобальную контролирующую область, которая находится на 5' конце кластера HoxD65 и ранний контролирующий конечности элемент, который находится на 3' конце того же самого кластера66, которые действуют как глобальные регуляторы количественной экспрессии HoxD гена в развивающихся конечностях. Механистически уже давно предполагалось, что модуляция структуры хроматина лежит в основе колинеарной регуляции Hox генов3. Недавно было показано, что в культуре клеток, а также у эмбрионов мышей ремоделирование хроматина обеспечивает компетентность последовательной транскрипции в кластере67,68. Становится ясным, что существует строгая корреляция между обладанием интактными Hox кластерами, имеющих медленный способ развития, и обнаруживающей временную колинеарность генной экспрессией. Напротив, животные, которые развиваются быстро, лишены временной колинеарности и имеют расщепленные или дизинтегрированные Hox кластеры10,19,28. Помимо позвоночных временная колинеарность обнаруживается у amphioxus, но временно колинеарности не наблюдается для Hox генов у др. беспозвоночных deuterostomes - которые включают urochordates Ciona intestinalis69 и Oikopleura dioica28 и иглокожих Strongylocentrotus purpuratus70,71 - каждый из которых имеет разорванные или необычные Hox кластеры. Временная колинеарность отсутствует также у protostomes, которые имеют разорванные или дизинтегрированные Hox кластеры, которые включают ветви Drosophila72,73, более базовое насекомое Bombyx
mori74 и C. elegans75. Быстрый и детерминативный тип эмбрионального развития может быть слишком быстрым, чтобы сделать возможной временную последовательность активации Hox генов:
времени оказывается недостаточным для появления временной колинеарности у этих животных, тогда как пространственная колинеарность всё ещё существует. Если ограничивающие условия, которые поддерживают тесное сцепление в Hox кластере, необходимы для достижения временной колинеарности, то однажды оказывается, что временная колинеарность более не нужна - в результате онтогенетических изменений, которые позволяют быстрое развитие - и отбор на интеграцию кластера ослабляется. Согласно этой модели остатки кластера в любой определенной ветви оказываются в основном результатом филогенетической инерции. Со временем эти не стесняемые кластеры будут стремиться к дезинтеграции.
ParaHox genes. Кластер ParaHox ограничен cephalochordates и позвоночными, Он обнаруживает и пространственную и временную колинеарность. Однако. временная колинеарность инвертирована по отношению к Hox кластеру и задние Cdx гены активируются первыми. Кластер ParaHox дизинтегрирован в геноме C. intestinalis19, а O. dioica потеряла центральный ParaHox ген20. У protostomes, D. melanogaster и C. elegans потеряны некоторые из ParaHox генов (D. melanogaster лишена Xlox, a C. elegans лишена Gsh и Xlox). Эта потеря генов может быть вторичной, т.к. все три гена присутствуют у др. protostomes18. И снова последовательное разворачивание этих генов д. быть ограничено для сохранения ParaHox кластера у животных, которые медленно развиваются из-за строгой детерминации клеточных клонов.
NK genes. Поддержание кластера NK у D. melanogaster, но не у хордовых, может ставить в тупик: кластер в основном законсервирован у D. melanogaster, в то же время разорван на три куска у позвоночных. Это селективное удерживание, которое функционирует в кластере D. melanogaster возможно связано с последовательным функциональным разворачиванием этих генов во время мезодермального развития, тогда как это селективное давление ослабляется во время эволюции deuterostome или развития хордовых. И снова мы видим, что время - скоординированная временная экспрессия соседних NK генов - может быть движущей силой, которая поддерживает тесное сцепление генов у D. melanogaster.
Приписывание поддержания организации ANTP-кластера последовательному во времени разворачиванию привлекательно. Это объяснение имеет признаки, общие с онтогенетическими переключениями, которые были описаны для β-globin кластера76 и с недавно открытым мышиным Rhox гомеобоксным кластером - это кластер из 12 гомеобоксных генов, которые экспрессируются во время развития мышиных зародышевых клеток и для которых время активации зависит от их положения в кластере
77.
Summary and outlook
The data presented in this article allow us to propose
a model to explain the origin of Hox genes. Early in
metazoan evolution, the founder member of the
ANTP class of homeobox genes underwent a series
of cis-duplications, generating an extensive array of
homeobox genes that included the extended Hox,
ParaHox and NK clusters. The clusters followed distinct
evolutionary pathways in different lineages, with splits,
losses and dispersions around the genome, ending with
compact Hox and ParaHox clusters in vertebrates and
compact NK clusters in insects. The early steps for the
genesis of the megacluster are uncertain, and most probably
occurred early in metazoan evolution — certainly
before the cnidarian–bilaterian split. It is also tempting
to imagine that the origin, diversification and increasing
complexity of the three germ layers coincided with the
generation, and expansion, of the three ANTP clusters.
The apparent paradox that the clusters appeared before
the ‘radial’ cnidarians might be explained if, as new
molecular data indicate, cnidarians were primitively
bilateral and triploblastic.
The driving force that maintains the close linkage
is probably temporal collinearity or the sequential
functional deployment of genes. When the temporal
collinearity of Hox and ParaHox genes is lost owing to
a rapid mode of embryonic development, the selective
pressure that maintains linkage is no longer active and
phylogenetic inertia in each lineage tends to split up
the cluster.
Curiously, the main invertebrate model systems such
as D. melanogaster, C. elegans or C. intestinalis have been
chosen owing to their short life cycle, small size, rapid
development and ease of culture. In the light of the
arguments outlined here, it is not surprising that gene
databanks record more broken Hox and ParaHox clusters
than intact ones. Evolutionary and developmental
biologists are searching for an extant animal that has an
intact megacluster, and another animal (or perhaps a
protozoan) with a single ANTP-class gene, which would
allow them to demonstrate the phylogenetic reconstruction
that is suggested here. Sponges, cnidarians and basal
bilaterians are good candidates. Nevertheless, if cluster
disintegration and fast and derived development are correlated,
those models should be chosen on the basis of
their evolutionary and developmental properties, rather
than on their ease of handling.
Approaching the enigma — why temporal coordinated
expression needs clustering — is a great challenge.
The answer will probably be found by researching chromatin
structure and remodelling, histone modification,
DNA domain architecture, and intranuclear localization
of given regions of DNA. Even so, the selective
pressure to maintain gene clustering could be too
subtle to be detected by experimental methods, and
often changing a gene from its position out of the cluster
does not markedly change its pattern of expression.
Small differences in fitness might be detected only by
population genetics, for example, by studying linkage
disequilibrium in the cluster. In the words of the
geneticist who pioneered the study of homeotic genes,
Ed Lewis, “We know the fly looks OK with the gene
moved, but we do not know if she goes to the theatre.”
Сайт создан в системе
uCoz 


 , P.Carpintero, A.J.Pazos, M.Abad, J.L.Sanchez
, P.Carpintero, A.J.Pazos, M.Abad, J.L.Sanchez

