Hox transcription factors and their elusive mammalian gene targets | |
|
|
Гомеобоксные гены кодируют транскрипционный факторы, которые5 действуют во время развития (Lewis, 1978). Общим свойством этих белков является присутствие сильно законсервированного в 60-аминокислот мотива, гомеодомена, который ответственен за связывание с ДНК со специфически распознаваемыми сайтами связывания, что приводит к регуляции транскрипции соотв. генов мишеней (Levine and Hoey, 1988; McGinnis and Krumlauf, 1992). К настоящему времени огромное число гомеобоксных генов охарактеризовано, они представлены сверхсемейством регуляторных генов, представители которых обнаружены у всех видов животных. Имеется большой каталог дивергентных гомеобоксных семейств, из кеоторых лучше всего охарактеризовано и изучено Hox семейство.
У видов млекопитающих имеется 39 Hox генов, организованных в 4 кластера, обозначаемых A, B, C и D и расположенных на 4-х разных хромосомах от 1 до 13, хотя не обнаружено кластеров, содержащих полный набор. Они, как полагают, возникли благодаря комбинации цис-амплификации и транс-дупликациям Drosophila комплексов bithorax и antennapedia во время самостоятельных эволюционных событий (Scott, 1992). Как следствие, транс-паралоги (гены, занимающие одну и ту же относительную позицию вдоль 5'-3' координат и поэтому обозначаемые тем же самым номером) обладают более высокой степенью гомологии последовательностей, чем цис-паралоги (гены, занимающие соседние позиции вдоль 5'-3' координат). Высокая степень гомологии между транс-паралогами указывает на то, что они д. действовать как функциональные complements, что было подтверждено экспериментально для Hoxa3 и Hoxd3 (Greer et al, 2000). Однако, др. Hox паралоги выполняют разные биологические роли, возможно благодаря subfunctionalisation (одна из копий приобретает новую функцию) или neofunctionalisation (функция исходного гена расщепляется между двумя копиями) (Walsh, 2003).
В обзоре суммируются известные данные относительно транскрипционной специфичности Hox при этом основное внимание уделяется семейству Hox млекопитающих. Transcriptional versus functional specificity - the homeodomain paradox Гомеодомен состоит из трех alpha спиралей, которые формируют helix-turn-helix мотив, и дополнительного домена, известного как N-терминальное плечо, локализованное непосредственно рядом с первой спиралью. Такая гомеодоменовая структура высоко законсервирована среди видов, от мух до человека, тогда как остальная часть белков нет. Функциональная специфичность была картирована в аминокислотных остатках внутри этих законсервированных областей гомеодомена (Kuziora and McGinnis, 1989; Lin and McGinnis, 1992). Т.к. функциональная специфичность Hox была законсервирована на значительном эволюционном расстоянии (Malicki et al, 1990; McGinnis et al, 1990), то термин Hox специфичность стал неким синонимом специфичности гомеодомена.
Стержневые консенсусные последовательности ДНК распознаются большинством гомеодоменовых белков, поэтому возникает вопос, как возникает транскрипционная и биологическая специфичность. Многие гомеодомен-содержащие транскрипционные факторы оказывают самостоятельные и отличающиеся эффекты на нижестоящие гены мишени, контролируя уникальные грани внутри транскрипционной кухни (machinery) и в конечном итоге предопределяя клеточные судьбы, но с помощью какого механизма? Конечно, распознавание ДНК последовательностей является не единственным детерминантом биологической специфичности, однако, сиквенс-специфическое связывание является критической частью транскрипционной регуляции и тем самым биологической специфичности.
Соединение гомеодомена со специфическими последовательностями ДНК было описано на основании генетических и структурных исследований. Генетически, законсервированный TAAT-мотив был идентифицирован как сайт соединения с высоким сродством для многочисленных гомеодоменовых белков (Desplan et al, 1988). Рентгеновская кристаллография (Kssinger et al, 1990) и ядерно-магнито резонансная спектроскопия (Otting et al, 1990) выявили, что helix-turn-helixмотив гомеодомена укладывается так, чтобы контактировать с большой бороздой ДНК, с дополнительным контактом с малой бороздой посредством N-терминального плеча. Используя то же самое соглашение для перечисления аминокислот гомеодомена, как это первоначально было описано (Qian et al, 1989), было установлено, что базовые остатки в позициях 3 и 5 соединяются с T1 and A2 нуклеотидами, в то время как законсервированный остаток Asn в позиции 51 соединяется с нуклеотидом A3 и, наконец, гидрофобный остаток в позиции 47 соединяется с T4 нуклеотидом (Kissinger et al, 1990) (Figure 1). Hox белки млекопитающих также обнаруживают белок-ДНК взаимодействия с вовлечением N-terminal arm остатка 5 (Arg) и helix 3 остатка 51 (Asn) и 47 (Ile) для Hoxbl (Piper et al, 1999) и Hoxa9 (LaRonde-LeBlanc and Wolberger, 2003).
Т.к. предпочтительной последовательностью распознавания ДНК большинства гомеодоменовых белков является TAAT и 5' пара оснований из мотива для выбора in vitro сайтов связывания, гомеодомен, по-видимому, обладает способностью различать основания в минорной борозде, несмотря на обычное ожидание, что взаимодействия с минорной бороздой обладают низкой специфичностью связывания из-за структурных и биохимических свойств двойной спирали (Seeman et al, 1976). Тем не менее исследования показали, что гомеодомены могут различать между A:T и T:A парами оснований в позиции 1 стержневой последовательности распознавания (Ades and Sauer, 1995). Ades and Sauer (1995) также установили, что две пары оснований непосредственно с 3' концом стержневого мотива (позиции 5 и 6) обладают более высокой специфичностью, чем позиции 1 and 2 и причастны к аминокислотному остатку 50 из гомеодомена, как участвующему в контакте с этими основаниями. Мутационные исследования подтвердили, что остаток 50 из гомеодомена может менять специфичность связывания при преимущественном изменении engrailed связывающего мотива TAATTA на TAATCC, когда Gln50 замещается Lys50 (Ades and Sauer, 1994).
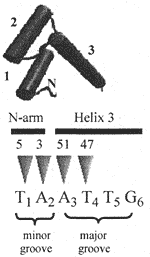 Figure 1 The homeodomain contacts the DNA recognition sequence through amino-acid residues in the N-terminal arm and third helix. A 3D view of the homeodomain is shown arranged over the consensus recognition sequence. The N-terminal arm is labelled 'N' and the three alpha helices are also indicated with their respective numbers. The contacts between the homeodomain amino-acid residues 3, 5, 47 and 51 and the TAAT binding motif are delineated by triangles. Amino acids 3 and 5 of the homeodomain N-terminal arm make contacts in the minor groove whereas amino acids 47 and 51 (in helix 3) make contact in the major groove (Qian et al, 1989; Piper et al, 1999; LaRonde-LeBlanc and Wolberger, 2003). Nucleotides 5 and 6 are also thought to make specific contact with the homeodomain through other helix 3 residues (Ades and Sauer, 1995). И удивительно, что хотя все Hox белки кодируют Gln в позиции 50, они всё ещё обнаруживают врожденную способность различать между парами оснований 3' сердцевины TAAT (Ekker et al, 1992). При исследовании 5 Hox белков (Hoxa5, Hoxa7, Hoxbl, Hoxb4 и Hoxc8), 3'-фланкирующие пары оснований (позиция 5) имели последствия для сродства связывания ДНК. Последовательность TAATTG была определена в качестве оптимального мотива, а замены пар оснований в позиции 5 с T но G были толерантными только для Hoxb4, но не для др. 4-х Hox белков. Замены в этом положении с T на или A или C снижали связывающую активность всех 5 Hox белков, а дальнейшие альтерации в составе пар оснований в позиции 6 оказывали варьирующие эффекты на специфичность Hox связывания (Pellerin et al, 1994). Тот факт, что пары оснований, соседствующие с 3' стержневым TAAT мотивом, участвуют в специфичности связывания ДНК белками Hox стало неожиданностью. Для дивергентных семейств гомеодоменовых белков это может быть объяснено варьирующим аминокислотным составом спирали 3, в особенности остатка 50. Hox белки, однако, высоко консервативны по спирали 3, в частности, эти остатки участвуют в непосредственной связи белок-ДНК. Все 39 Hox белков содержат одни и те же 6 аминокислот WFQNRR в позициях 48-53, заключая в себе законсервированный остаток Gln50. Если остаток 50 отвечает за предопределение специфичности для пары оснований 5, то почему Hoxb4 толерантен к G в этой позиции, тогда как Hoxa5, Hoxa7, Hoxbl и Hoxc8 нет? Существование Hox кофакторов открывает дополнительное измерение сродства и специфичности связывания ДНК. Hox cofactors and transcriptional specificity Pbxl, не-Hox гомеодоменовый белок, ортолог Drosophila extradenticle (exd) кодируемого белка, первым был охарактеризован как Hox кофактор. Взаимодействия кофакторов сильно зависят от последовательности hexapeptide, содержащей четыре основных остатка YPWM (расположенных непосредственно на N-конце Hox гомеодомена), которые законсервированы среди групп Hox паралогов 1-8 (Chang et al, 1995; Phelan et al, 1995). Группы Hox паралогов 9-10, которые лишены консенсусного YPWM мотива, также кооперативно связываются с ДНК, при этом Pbxl связывание зависит от законсервированного остатка Trp (Chang et al, 1995; Shen et al, 1997b). Др. член TALE семейства гомодоменовых белков Meisl, ортолог Drosophila Homothorax (Hth), который действует как партнер по связыванию ДНК для остальных групп паралогов 11-13 (Shen et al, 1997a). Т.о., все 39 Hox белка могут кооперативно связывать ДНК посредством гетеродимеризации с др. не-Hox гомеодоменовыми белками, причем оба имеют предпочтительные последовательности распознавания ДНК и партнеры по связыванию предопределяются их позицией в 5'-3' хромосомных координатах.
Очевидно, что Hox белки обнаруживают относительно ослабленную избирательность в связывании ДНК in vitro, и в конечном итоге более сильную избирательность in vivo благодаря кооперативному связыванию ДНК вместе с др. белками. И хотя эти механизмы еще полностью не выяснены, разумное объяснение заключается в том, что кофакторы могут выявлять латентные специфичности внутренне присущие индивидуальным Hox гомеодоменам (Mann and Morata, 2000). Это д. также частично объяснить увеличение связывающей активности Hox белков, связанных с ДНК вместе с кофактором по сравнению со сродством связывания Hox мономеров.
Заслуживает также внимания то, что многие из идентифицированных Hox сайтов распознавания ДНК внутри генных промоторов спариваются с Pbx/Meis сайтами связывания, это строго указывает на важность TALE-класса белков в качестве кофакторов Hox in vivo. Следовательно, можно ожидать, что устранение функции Pbx/Meis будет воспроизводить те эффекты, некорые наблюдаются при мутантных Hox белках и даже при мутациях Hox hexapeptide, напоминающих фенотипические эффекты мутаций потери Hox функции. В самом деле, это подтвердили более поздние наблюдения с нацеленными на hexapeptide мутациями Hoxb8 (Medina-Martinez and Ramirez-Solis, 2003). В этой in vivo мышиной модели, Hoxb8 неспособен взаимодействовать со своим кофактором Pbx, приводя к доминантному фенотипу, характеризующемуся передней гомеозисной трансформацией первых двух торакальных позвонков, не влияя на паттерн экспрессии др. тесно родственных Hoxb генов. Хотя эти исследования оставляют возможным мнение, что Hoxb8 в отсутствие своего партнера по связыванию ДНК д. оккупировать связывающие элементы близко родственных белков, таких как Hoxb6 и Hoxb7, приводя к аномальной транс-регуляции Hox генов мишеней.
Упомянутое выше исследование подчеркивает важность моделей in vivo , чтобы полностью оценить функциональную специфичность, обнаруживаемому у Hox транскрипционных факторов. Ясно, что они могут связывать элементы ДНК как мономеров, так и кооперативно с др. факторами, такими как TALE-класса белки. Сходным образом ткане-специфическая коэкспрессия Hox кофакторов скорее всего наводит Hox белки на соответ. им гены мишени, это частично объясняет дилемму, связанную с их униформными in vitro элементами распознавания. Hox proteins function as both transcriptional repressors and activators Др. измерением Hox транскрипционной специфичности является из способность действовать как транскрипционные репрессоры и активаторы и хотя механизмы, лежащие в основе этих регуляторных переключений в основном неизвестны, некоторые постулаты возможны. Pinsonneault et al, (1997) предложена модель, согласно которой гетеродимеризация Drosophila Exd белка с Hox белками устраняет врожденную репрессорную функцию Hox белков, которая влияет на ген мишень, когда связь осуществляется в виде мономера, что делает возможной простую, даже элегантную модель функциональной специфичности Hox. Имеются др. наблюдения, противоречащие, однако, mis-model. Недавно Exd, также как и Drosophila белок Hth, как было показано, репрессирует ген distalless (dll) за счет прямых взаимодействий с продуктом гена Ultra-bithorax (Ubx) (Gebelein et al, 2002). Хотя, гетеродимеры также могут действовать как супрессорные комплексы в этом контексте.
Поскольку Hox транскрипционные факторы млекопитающих также обладают более низким сродством связывания ДНК, когда соединяются с мономерами и т.о. потенциальная низкая специфичность (Shen et al, 1996, 1997a, b) их также противоречит модели, согласно которой они всегда действуют как репрессоры, когда связываются слабо с мономерной формой и как активаторы, если связываются с кофакторами в комплексы более сильного сродства (Shen et al, 2004). Открытие, что Hox белки связывают CREB binding protein (CBP) и могут модулировать активность histone acetyltransferase указывает на то, что Hox белки могут также регулировать экспрессию генов не связываясь непосредственно с ДНК (Shen et al, 2001) что еще больше усложняет поиск нижестоящих мишеней. Mammalian Hox downstream target genes Поскольку Hox были первоначально идентифицированы как регуляторы формирования передне-заднего паттерна во время развития, то сегодня очевидно, что Hox гены активны также в нормальных клетках взрослых и внимание сфокусировано на выяснении роли Hox белков в полностью дифференцированных клетках metazoan. Было предположено, что д. действовать как ключевые master гены в контроле клеточных качественных особенностей и как таковые д. регулировать гены, которые необходимы для клеточных делений, клеточной адгезии и миграции, морфологической дифференцировки и апоптоза, помимо своей роли во время эмбриогенеза (Ulijaszek et al, 1998).
Набор разнообразных генов мишеней был идентифицирован в последние годы. Экспериментальные процедуры, которые были использованы сначала для идентификации и затем для характеристики каждой из мишеней, варьируют существенно, что делает трудным с определенностью установить, являются ли некоторые из них непосредственными мишенями и ели это так, то Hox связывающие сайты, ответственные за регуляцию транскрипции, могут быть не подтверждены экспериментально. Однако, используя доступную информацию современное состояние возможно непосредственных мишеней приведены в Table 1 и на Figure 2.
Первым идентифицуированным геном мишенью для Hox транскрипционных факторов, иным. чем сами Hox гены стал ген neural cell adhesion molecule (N-CAM) (Jones et al, 1992), который обеспечивает адгезию в
Table 1 Current list of mammalian Hox gene targetsThe list contains likely Hox gene targets and the Hox protein responsible for the frtms-regulatory effect. The (+/-) symbols represent either a positive or negative regulatory effect on the target gene and (?) symbol indicates an unknown effect. Also, note that although there is some experimental evidence to suggest all are likely direct gene targets, not all have been exclusively verified of being so through in vivo experiments. The corresponding reference(s) for each gene target is also shown. 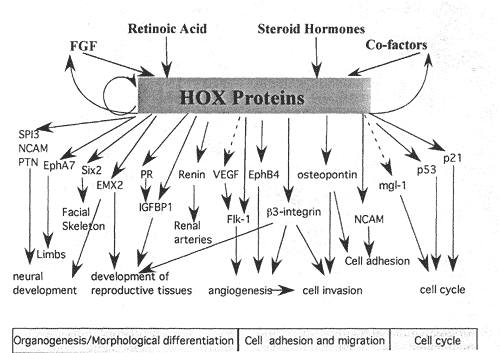 Figure 2 Hox downstream targets are involved in numerous cellular processes including organogenesis, cellular differentiation, cell adhesion and migration, cell cycle and apoptosis. Several downstream targets play multiple roles in several pathways, with many acting as transcription factors and regulating their own subset of genes. Hox proteins also participate in autoregulatory circuits in addition to regulating expression of some binding cofactors and other factors that influence Hox expression. Targets not shown on this figure include the differentiation markers alpha-2(V) collagen, the murine hair keratin family and the TTF-1. A dotted line indicates direct regulation has not yet been confirmed. нервной системе и играет роль в нейральной индукции во время развития. Затем были идентифицированы и др. мишени. участвующие в нейрогенезе. Ген, кодирующий SPI3, serine protease ингибитор, выявлен в нервной системе мышей как регулируемый с помощью Hoxb5 (Safaei, 1997), хотя Hox связывающие сайты в промоторе ещё не идентифицированы. Недавно гомеодоменовый белок. наз. Six2, который играет роль в процессе, с помощью которого клетки нервного гребня формировали лицевой скелет, был определен как нижестоящаяя мишень Hoxa2. Hoxa2 действует во время развития второй бранхиальной дуги, ограничивая формирование специфической области (Grammatopoulos et al, 2000) и как часть этого процесса Hoxa2 негативно регулирует экспрессию Six2 (Kutejova et al, 2005). Гена pleiotrophin (PTN) промотор был охарактеризован как непосредственная мишень для HOXA5 , а его белковый продукт обладает активностью, способствующей росту нейритов (Chen et al, 2005). Идентифицированы и Hox мишени, ассоциированные с репродукцией млекопитающих. HOXA1O и HOXA11 экспрессируются как в эмбриональном, так взрослом репродуктивном тракте с HOXA1O важным для развития матки (Block et al, 2000). EMX2 является дивергентным гомеобоксным белком для развития урогенитального тракта и кодируется геном, негативно регулируемым с помощью HoxalO в клетках эндометрия (Troy et al, 2003). EMX2 является ортологом Drosophila empty spiracles (ems), который позитивно регулируется с помощью AbdB, ортолога HOXA1O (Jones and McGinnis, 1993), хотя идентифицированные сайты связывания не обнаруживают сходства. EMX2 и ems участвуют также в развитии коры головного мозга (Muzio and Mallamaci, 2003).
HOXA1O и HOXA11 необходимы для успешной имплантации эмбриона и их экспрессия регулируется половыми стероидами (Taylor et al, 1998). Insulin-like growth factor binding protein-1 (IGFBP-1) экспрессируется на высоком уровне во время decidualisation и его экспрессия зависит от progesterone, как и HoxalO (Bell et al, 1991). HOXA1O активирует промотор IGFBP-1 в разного типа клетках эндометрия (Gao et al, 2002) в кооперации с FKHR, членом подсемейства FOXO forkhead (fkh) транскрипционных факторов (Kim et al, 2003). Промотор IGFBP-1 активируется также с помощью progesterone receptor (PR) и FOXOIA, др. fkh транскрипционного фактора (Kim et al, 2005). Белок HOXA5 взаимодействует с FKHR, чтобы стимулировать IGFBP-1 промотор (Foucher et al, 2002), и что интересно, HOXA5 может активировать PR промотор (Raman et al, 2000b), указывая тем самым на некоторые сложные пути и взаимодействия, с помощью которых Hox белки регулируют имплантацию эмбриона.
Приведенные выше результаты показывают, что множественные HOX могут взаимодействовать с FKHR, расширяя т.о. список потенциальных Hox кофакторов. Drosophila forkhead (fkh) ген позитивно регулируется in vivo с помощью scr, члена гомеотического комплекса, тогда как Hoxb4 непосредственно стимулирует транс-активацию TALE класса гомеодоменового гена IRX5 у Xenopus laevis (Theokli et al, 2003). Т.о., Hox белки не только регулируют экспрессию др. Hox генов, но также генов, кодирующих Hox кофакторы.
Дифференцировка эндотелиальных клеток необходима как первая ступень сосудистого развития, включая ангиогенез. Самым ранним маркером для эндотелиальных клеток фактор роста сосудистого эндотелия flk1. Ген, кодирующий flk1 транс-активируется с помощью Hoxb5, соединяясь с сайтом, который расположен внутри первого экзона скорее, чем в промоторной области (Wu et al, 2003). Экспрессия его лиганда, VEGF, позитивно регулируется с помощью Hoxb7 (Care et al, 1996), но еще не подтверждено, что он является непосредственной мишенью. Идентифицированы и дополнительные мишени Hox белков во время ангиогенеза. Семейство Eph рецепторов является крупнейшим из известных подсемейств рецепторных тирозин киназ и позитивная регуляция промотора рецепторного гена EphB4 с помощью Hoxa9, как было показано, модулирует миграцию эндотелиальных клеток и формирование трубок (Bruhl et al, 2004). Кроме того, экспрессия гена субъединицы β3-integrin непосредственно регулируется с помощью HOXA1O в клетках эндометрия (Daftary et al, 2002) и представляет собой еще одну Hox М, участвующую в ангиогенезе и имплантации эмбрионов.
Др. член семейства Eph рецепторных тирозин киназ, EphA7, как известно, играет роль в развитии конечностей, а промотор мышиного гена, как было показано, непосредственно активируется с помощью Hoxal3 and Hoxdl3 (Salsi and Zappavigna, 2006). Интересно, что мутантная версия белка HOXD13 найдена у пациентов с синдромом полидактилии, она была неспособна активировать промотор гена EphA7, тем самым выявляется строгая связь между членами семейства Hox Group 13 и развитием конечностей посредством регуляции экспрессии белков Eph proteins.
Renin является компонентом renin-angiotensin системы, которая регулирует кровяное давление. Экспрессия renin онтогенетически регулируется и выявляется во вность сформированных почечных артериальных веточках (Jones et al, 1990). Промотор гена renin мышей (Pan et al, 2004) активируется с помощью Hox/Pbx гетеродимеров посредством одиночного Hox связывающего сайта в промоторе гена, это открывает др. связь между Hox белками и формированием кровеносных сосудов.
Osteopontin (OPN) является секретируемым белком, который регулирует адгезию и миграцию клеток в ряде биологических процессов, включая ангиогенез, воспаление, апоптоз и ремоделирование кости. Hoxc8 (Shi et al, 1999) и Hoxa9 (Shi et al, 2001) действуют как транскрипционные репрессоры, соединяясь с одиночным связывающим Hox мотивом в Opn промоторе. Эти исследования идентифицировали др. кофактор для Hox белков, т.к. Smadl формирует гетеродимеры с Hoxc8, а Smad4 формирует гетеродимеры с Hoxa9. Семейство белков Smad обеспечивает сигнальную трансдукцию, стимулируемую с помощью bone morphogenetic proteins (BMP). Smad-Hox гетеродимеры вытесняют Hox мономеры из сайта связывания, в результате происходит BMP управляемая инициация транскрипции с мышиного промотора Opn (Shi et al, 1999, 2001). Анализ последовательностей промотора Opn показал. что Hoxc8 и Hoxa9 используют один и тот же консенсусный мотив TAAT, чтобы обеспечить репрессию.
Нижестоящие HOX мишени с ролями в клеточном цикле предсказаны, однако идентифицировано мало примеров. HOXA5 является мощным активатором транскрипции гена опухолевого супрессора p53. Значительное увеличение активности p53-promoter-зависимого репортерного гена наблюдается в клетках линий рака груди после совместной трансфекции с HOXA5, эффект отсутствовал при использовании др. членов HOX, HOXB4, HOXB5 и HOXB7 (Raman et al, 2000a). Такие же транс-регуляторные эффекты наблюдались для гомолога p53 мышей, с одиночным связывающим Hox элементом, 200 bp выше предполагаемой стартовой точки транскрипции, который идентифицирован как ответственный за транс-активацию.
Др. ген мишень, кодирующий продукт с функцией в клеточном цикле, это cyclin-зависимый киназный ингибитор p21, с негативными и позитивными регуляторными эффектами (Bromleigh and Freedman, 2000). HOXA1O, но не HOXA9 или HOXB7, как было установлено, строго активируют промотор p21 в линиях клеток моноцитов и фибробластов. Мутационные исследования выявили специфический связывающий сайт, ответственный за эту активацию и выявили соседний консенсусный связывающий Hox элемент, ответственный за негативную регуляторную роль.
Hox белки, как известно, регулируют экспрессию др. Hox генов и некоторых генов, кодирующих кофакторы. Дальнейшим уровнем авторегуляторного контроля явилось обнаружение basic fibroblast growth factor (bFGF) в качестве непосредственной мишени для HOXB7 (Care et al, 1996). Градиенты некоторых молекул, включая и FGF и ретиноевую кислоту, ответственны за контроль экспрессии Hox генов и формирование сегментов у эмбрионов (Diez del Corral and Storey, 2004), и возможно, что Hox белки могут в свою очередь регулировать экспрессию этих градиентов.
Наконец, экспрессия Pax3, гена класса paired-homeodomain, позитивно регулируется в нервной трубке мышей за счет комбинированного действия POU-доменовых транскрипционных факторов и Hox белков (Pruitt et al, 2004). Brn2 обеспечивает экспрессию Pax3 посредством синергичных сигналов от субнабора Hox белков, потенциально за счет разных связывающих элементов в промоторе Pax3. Транс-активация промотора Pax3 подчеркивает сложность механизмов, с помощью которых Hox белки вовлекаются в управление биологической специфичностью. Для этого гена мишени Hox семейство кооперируется с членами из TALE и POU семейств дивергентных гомеодомен-содержащих транскрипционных факторов, чтобы регулировать экспрессию четвертого гомеодоменового семейства, paired-homeodomain класса. Hox binding sites identified in target gene promoters Чтобы лучше понять Hox транскрипционную специфичность, мы исследовали идентифицированные Hox связывающие мотивы генов мишеней млекопитающих, чтобы охарактеризовать выбор пар оснований вне канонического
TAAT мотива. Представленные на Figure 3 характеризуют Hox связывающие мотивы в промоторных областях генов мишеней, а также фланкирующие последовательности. Связывающие мотивы локализованы в промоторных областях генов bFGF, PR, IGFBP-1, N-CAM, thyroid transcription factor-1 (TTF-1), EPHB4, β3 Integrin subunit, PTN, renin и p21 как вызывающие активацию транскрипции. Мотив T(T/A)AT , как было показано экспериментально, ответственен за репрессию с помощью Hox белков внутри промоторных областей p21, OPN и EMX2. Следовательно, возможно, что пары оснований, фланкирующие канонический из 4-х оснований связывающий Hox мотив, играют роль в связывающей Hox специфичности.
T(T/A)AT стержневой элемент и фланкирующие пары оснований асе содержат T или C остаток в позиции 5, за исключением PTN и p21 активируемого HOXAlO мотива, который имеет A основание в этой позиции. In vitro изучение сайтов связывания также продемонстрировало предпочтительность T в позиции 5 (Catron et al, 1993). Ограниченное число четко установленных связывающих Hox сайтов, как показано на Figure 3 не позволяет определить, имеется ли ещё дополнительные основания селекции вне канонического мотива из 4-х оснований для связывания определенных Hox белков или комплекса Hox-кофактор.
Парадокс Hox транскрипционной избирательности заключается в способности как супрессировать, так и активировать экспрессию генов посредством сходных ДНК мотивов. Из трех T(T/A)AT супрессорных мотивов, все содержат G в позиции 5, в то время как ни один из активирующих мотивов этого не имеет. Кроме того, промотор гена Six2 содержит два связывающих сайта для Hoxa2, TAATTT и TAATGG (Kutejova et al, 2005). Пока неизвестно, какой из этих сайтов для Hoxa2 действует, чтобы репрессировать экспрессию Six2, но было бы интересно, если бы это был один из связывающих сайтов, содержащий G в позиции 5. Необходимо подчеркнуть, что размер выборки мал и поэтому нельзя сделать удовлетворительного заключения, но было бы интересным пронаблюдать сохранение этой тенденции при увеличении размера выборки, где Hox белки действуют как репрессоры.
Conclusions This review has focussed on the transcriptional and functional specificity elicited by the Hox proteins, outlining homeodomain--DNA interactions and the gain of binding specificity through cooperative binding with cofactors. Furthermore, the aim was to summarise the list of known Hox downstream target-genes in mammalian systems. Unfortunately, this list is still very short and contains genes not conclusively shown to be direct targets, albeit strongly suggestive. To fully appreciate the role of Hox proteins both in development and adult tissues, future research inevitably needs to characterise more direct gene targets. This raises the question of why so few targets have yet been identified, and highlights the complexity in which Hox proteins operate in the cellular machinery, potentially rendering the Hox targets to be very elusive.
Obvious problems are that more than one Hox protein can potentially bind to the same element and it is difficult to distinguish between direct and indirect targets. Many Hox targets are also transcription factors, which in turn regulate their own subset of regulatory factors. Yet another dimension of complexity is introduced with the extensive auto- and crossregulation reported for the Hox complex, which was not discussed herein. Similarly, the view that Hox proteins may regulate gene expression by pathways not involving direct DNA binding further complicates the search for gate targets (Shen et al, 2001; Williams et al, 2005). Microarray technology has been utilised to identify large numbers of possible gene targets regulated by specific Hox proteins (Lei et al, 2005; Williams et al, 2005), but further experimentation is still required for verification as direct targets. The use of chromatin immunoprecipita-tion (ChIP) assays to search for downstream targets would also greatly increase the likelihood that direct targets are identified. Many of the target genes described here have only been shown to trans-regulate the respective gene promoters in in vitro models, still raising questions regarding their in vivo functionality.
The TALE-class homeodomain proteins Pbx and Meis are well-known Hox cofactors, but other proteins can also fulfil such a role in vivo. In particular, it would be interesting to further elucidate the cooperative interactions between Hox and Smad proteins, which themselves are essential for proper transforming growth factor-β (TGF-β) signalling. From what is known thus far, Hox proteins interact with numerous regulatory pathways, including FGF, BMP, retinoic acid and sex steroid signalling through cofactor-dependent and -independent regulation. The emergence of FOXO fkh transcription factors as potential cofactors that provide a synergistic input with Hox proteins could explain tissue-specific functionality where simply Hox expression patterns fail to do so.
As another dilemma regarding Hox transcriptional specificity is concerned with the observation that many Hox members act as both transcriptional activators and suppressors depending on cellular context, this review proposes a mechanism in which the flanking nucleotides 3' of the canonical Hox binding elements could act as an activator-suppressor switch. Taking into account the high sequence homology of relevant peptide sequences within the Hox homeodomains, it is further proposed that the switch is highly dependent on cofactor interactions, which again could account for tissue-specific trans-regulatory potential of the Hox complex.
It is clear that in order to further elucidate many of the unresolved issues regarding Hox in vivo transcriptional specificity, more direct target genes must be defined. Preferably, new target genes would be identified from animals such as the mouse, which ultimately would allow for more comprehensive studies utilising conditional knockout and targeted knock-in approaches.
|