Транскрипция ген prolactin (PRL3) может быть активирована или с помощью Pit-1/GHF-1, который специфически экспрессируется в клетках гипофиза, или в меньшей степени с помощью Oct1 (POU-гомеодоен содержащего белка) и Pbx1 в не-гипофизарных клетках (Subramaniam et al., 1998). Промотор PRL3 содержит negative glucocorticoid response element (nGRE), который предупреждает экспрессию гена в не-гипофизарных клетках, если он связывается ядерными glucocorticoid receptor (GR). Эти авт. продемонстрировали, что ген может, несмотря на это экспрессироваться в этих клетках при некоторых физиологических условиях. В самом деле, не-гипофизарные клетки наделяют повышенной экспрессией ген благодаря связыванию повсеместно экспрессируемого Oct-1 с AT-богатой последовательностью, присутствующей в промоторе PRL. Далее они показали, что полная транскрипционная активность гена нуждается в связывании Pbx1. Интересно, что связывание как Oct-1 так и Pbx1 с PRL3 nGRE было обнаружено, как необходимое для glucocorticoid репрессии. Они предположили, что механизм GR-обусловленной репрессии транскрипции связано или со смещением этих активирующих факторов или с некоторым вмешательством в их потенциал активации. Вовлечение гомеобоксного белка Pbx1в репрессию glucocorticoid посредством nGRE подчеркивает новую роль этого белка во взаимодействии с передачей сигналов ядерными рецепторами. В противоположность репрессивному эффекту GR на Pbx1-связанный PRL3 nGRE, глюкокортикоиды, как было установлено, действуют синергично с retinoic acid (RA) усиливая активацию транскрипции репортерного
гена, несущего Hoxb1-ARE. Это усиление, как было установлено, обеспечивается за счет связывания Pbx1/Hoxb1 гетеродимера (Subramaniam et al., 2003) и было предположено, что совместная деятельность GC/RA строится на физическом взаимодействии между GR и Pbx1 белками. Однако, согласно этим авт. неясно, действует ли GR как прямой активаторо или как фактор, позволяющий рекрутирование др. активаторов транскрипции на промотор. Т.к. GR и Pbx1 экспрессируются повсеместно, то многочисленные Pbx1-регулируемые гены могут быть важными мишенями для GC-обусловленных взаимных помех ("cross-talk"). Подтверждением этой гипотезы стало то, что , взаимодействия GR с гомеодоменовыми белками, как было показано, вмешиваются в процесс развития
и рыбок данио (Gao et al., 1994, Wang et al., 1999).
Если Pbx белки могут быть медиаторами определенных сигнальных путей, то они могут также инициировать экспрессию ключевых белков. участвующих в трансдукции клеточных сигналов. В кооперации с Hox, белки Pbx индуцируют транскрипцию sonic hedgehog во время развития зачатков конечностей (Capellini et al., 2006). Участие Hox белка Lin 39 и его Exd/Pbx-подобного кофактора Ceh-20 в Notch-обеспечиваемой передаче сигналов в развитии вульвы у
Caenorhabditis elegans было изучено недавно (Takacs-Vellai et al., 2007). Авт. продемонстрировали, что как Lin-39, так и Ceh-20 необходимы для экспрессии Lin-12/Notch рецептор и одного из их лигандов в клетках предшественниках вульвы, наделяя их компетентностью к последующим Lin-12/Notch индукционным событиям. Эти результаты указывают на то, что транскрипционные факторы Lin-39 и Ceh-20, которые действуют в самом низу RTK/Ras и Wnt путей в индукции вульвы, служат в качестве основных сайтов интеграции в координации и передаче сигналовк каскаду Lin-12/Notch, чтобы регулировать судьбы клеток вульвы. Figure 2 представляет схематическую диаграмму центральной роли PBC белков в индукции и обеспечении путей клеточных сигналов во время развития.
Pbx proteins interact with chromatin-remodeling protein complexes
Дифференцировка мышечных клеток управляется с помощью 4-х миогенных регуляторных генов MyoD, Myogenin, Myf5 и Mrf4. Эти bHLH (basic Helix Loop Helix) факторы ассоциируют с E2a, связывая и активируя множественные E box элементы, содержащие специфичные для мышц промоторы (Arnold and Winter, 1998). В трансфекционных подходах соединение Pbx1-Meis1 с элементом, соседствующим с E box, усиливает транскрипционную активацию с помощью E2a-MyoD, указывая на синергичный эффект между MyoD/E2a и Pbx/Meis гетеродимерами. Т.к. миогенные bHLH белки обладают мотивом PID, то было предположено, что подобная совместная деятельность может обеспечиваться с помощью физического взаимодействия между Pbx1 и bHLH белками (Knoepfler
et al., 1999). В самом деле, некоторые авт. приходят к заключению, что Pbx1/Meis комплекс постоянно связан с промотором myogenin, тогда как ассоциация MyoD с промотором myogenin усиливается во время дифференцировки (Bergstrom et al., 2002). Для лучшего понимания механизма транскрипционной активации Myogenin был осуществлен временной анализ событий связывания белка с его промотором с помощью ChIP экспериментов (Berkes et al., 2004). Эти авт. показали, что MyoD взаимодействует с промотором косвенно посредством Pbx1 и рекрутирует SWI/SNF энзимы хроматин-ремоделирующего комплекса, которые затем облегчают связывание MyoD и др. регуляторов и наконец приводит к транскрипционной активации гена Myogenin gene. Действительно, SWI/SNF энзимы физически взаимодействуют с histone acetyltransferases (HATs), histone deacetylases (HDACs) и methyltransferases и т.о., обладают потенциалом координировать хроматин-ремоделирующие активности; этот комплекс, как кроме того было показано, активирует или репрессирует субнабор генов (Martens and Winston, 2003, Sif, 2004). Рекрутирование SWI/SNF хроматин-ремоделирующих энзимов на промотор myogenin обеспечивается за счет физических взаимодействий между Brg1 (ATPase принадлежащая комплексу SWI/SNF) и Pbx1, а также между Brg1 и MyoD (de la Serna et al., 2005). Эти результаты согласуются с др. данными, подтверждающими, что SWI/SNF хроматин-ремоделирующие энзимы обычно рекрутируются во время поздних стадий процесса активации, после сборки факторов на промоторах (Martens and Winston, 2003, Salma et al., 2004, Soutoglou and Talianidis, 2002, Spilianakis
et al., 2003). В то время как исследование Berkes et al. (2004) продемонстрировало прямое взаимодействие между Pbx1 и хроматин моделирующим аппаратом, то др. данные показали, что Pbx1
белки сцеплены с HDACsи HATs и тем самым обладают способностью репрессировать или активировать транскрипцию в ответ на специфические клеточные сигналы. Как уже упоминалось выше Pbx1/Pdx1 гетеродимер поочередно ингибировать или активировать транскрипцию панкреас-специфических генов. Комплекс Pbx1b/Pdx1 запускает транскрипционную активацию посредством рекрутирования CBP, histone acetylase, тогда как Pbx1a/Pdx1 репрессирует транскрипцию путем связывания NcoR и SMRT (Asahara et al., 1999). Хотя механизм, с помощью которого NCoR и SMRT репрессируют экспрессию генов мишеней не совсем ясен в этом случае, ими ранее было показана ассоциация с histone deacetylases посредством Sin3 комплексов (Alland et al., 1997, Heinzel et al., 1997, Nagy et al., 1997). Т.о., NCoR и SMRT могут блокировать активность Pdx1 с помощью противодествия CBP-обусловленному ацетилированию нуклеосом. Hoxb1 ауторегуляторный элемент представлен тремя Hox-Pbx связывающими сайтами. Хотя этот энхансер не способен активировать экспрессию репортерного гена в монослое клеток P19 , обработанных ретиноевой кислотой (RA), он оказывается функциональным, когда клетки культивируются в агрегатах в присутствии RA. В самом деле, гетеродимер Hoxb1/Pbx1 способен переключать с репрессора на net activator после агрегации клеток или передачи сигналов PKA (Saleh et al., 2000). Точный механизм этого превращения неясен, но было показано, что репрессивная активность обеспечивается за счет физического взаимодействия Pbx1a N-конца и ко-репрессорного комплекса, включая HDAC1, HDAC3, mSIN3B и N CoR/SMRT, тогда как активация обеспечивается за счет PKA-опосредованного рекрутирования CBP с помощью Hoxb1. Интересно. что Pbx1/Hoxb1 димер может быть переключен с репрессора на активатор в ответ на передачу сигналов PKA или агрегацию клеток, поэтому это подтверждает, что передача клеточных сигналов, обеспечиваемая с помощью внутриклеточных cAMP, может быть детерминантом для функции Hox/Pbx. Ряд исследований демонстрирует, что CBP взаимодействует с различными Pbx/partner комплексами и может модулировать транскрипцию генов с помощью этого взаимодействия (Asahara et al., 1999, Saleh et al., 2000, Shen et al., 2001). Shen et al.,
(2001) показали, что CBP способен также предупреждать Hox ДНК связывание in vitro и что взаимодействие между Hox и CBP ингибирует CBP histone acetylase активность. Следовательно, эти взаимные ингибирующие взаимодействия могут объяснить неспособность CBP усиливать низкий уровень генной активации, индуцированный Hox белками в рамках метода репортеров. До тех пор пока эти in vitro данные не будут изучены в более физиологическом контексте, мы может тем не менее предположить о важности этого CBP/Hox взаимодействия in vivo. Путем ингибирования Hox ДНК связывания взаимодействие CBP с Hox ками может быть переключено в некоторых онтогенетических генетических программах. В самом деле, взаимодействие между CBP и Hox белками д. приводить к высвобождению Hox белков с генов мишеней, также м к ингибированию активности CBP. В такой модели, возникает вопрос о роли не-гомеодоменовых форм Hox белков Вместе с др. авт. мы показали, что некоторые Hox гены продуцируют не-гомеодоменовые изоформы (Dintilhac et al., 2004,Komuves et al., 2000). Некоторые из этих укороченных Hox белков обладают способностью взаимодействовать с CBP столь же эффективно, как и изоформы полной длины. В частности, мы показали, что HoxA9T, лишенная гомеодомена форма HoxA9, способна связывать CBP и следовательно, может конкурировать с типичными Hox белками за CBP (Dintilhac et al., 2004). Такие укороченные формы гомеодоменовых белков возможно играют важную роль в секвестрировании специфических кофакторов и, следовательно, в генной регуляции специфических Hox генов мишеней.
Др. пример связи между Pbx1 и хроматин-ремоделирующим белковым комплексом предоставляется транскрипционным фактором FoxC1, членом семейства генов Forkhead Box (FOX) . FoxC1 обычно участвует в специфическом образовании множественных структур, таких как глаза, осевой скелет, сомиты, сердце и окружающая васкулатура, а также урогенитальная система (Kidson
et al., 1999, Kume et al., 2000, Kume et al., 2001, Winnier et al., 1999). FoxC1 , как недавно было сообщено Berry and colleagues (2005), взаимодействует с Pbx1a в ядре, особенно в HP1-rich (heterochro-matin Protein 1) компартментах ядра. Будучи локализованным в этих регионах, FoxC1 не способне рекрутировать необходимые коактиваторы, важные для инициации транскрипции. Однако, всё ещё неясно, может ли локализация в FoxC1в богатых HP1 регионах вызывать или быть следствием FoxC1-Pbx1a-обусловленного ингибирования. Авт. полагают, что Pbx1a является компонентом ингибирующей транскрипцию сети, действующей на FoxC1 в клетках (Berry et al., 2005).
Pbx acts as a bridging protein within the transcriptional
complex
Так, упомянутые выше Pbx белки взаимодействуют с широким набором белков на генах мишенях.
of proteins on target genes. Эти взаимодействующие с Pbx партнеры соответствуют гомеодоменовым (Hox, Meis/Prep, Pdx1) и не-гомеодоменовым (FoxC1, HPIP, ZFPIP, Smad, NR, MyoD) белкам, обладают большей временной и/или пространственно ограниченной экспрессией во время развития, чем Pbx. Поэтому они д. рассматриваться, как кофакторы Pbx и они обозначены на figure 3 как XPIP (X Pbx Interacting Proteins, где X соответствует любому специфически экспрессируему фактору, взаимодействующему с Pbx). Эта концепция согласуется со сравнением фенотипов XPIPs и Pbx-нулевых мышей. Аномалии, наблюдаемые у мышей, лишенных Pbx1 более широко распространены, чем те, что наблюдаются у XPIP-нулевых мышей. Кроме того, Pbx белки взаимодействуют с Meis/Prep белками, формирующими гетеродимеры, которые в многочисленных временных трансфекционных испытаниях не обнаруживали радикальной транскрипционной активности. В самом деле, гетеродимеры, продуцируемые Pbx/Meis/XPIP являются более эффективными транскрипционными регуляторами, чем Pbx/Meis гетеродимеры, демонстрируя, что последние нуждаются в кооперации с др. транскрипционными факторами. Такая кооперация может происходить только на растянутых последовательностях промоторов, которые обычно не используются в испытаниях репортеров. В статьях данного номера сообщается о нескольких примерах такой кооперации, обусловленной физическими взаимодействиями с Pbx и др. специфическими транскрипционными факторами. Т.о., очевидно, что транскрипция Pbx генов мишеней может быть модулирована за счет динамической организации этих факторов в ответ на разные клеточные сигналы. Внутри комплекса каждый из партнеров способен рекрутировать хроматин-ремоделирующие энзимы, такие как CBP, HAT, HDAC и SWI/SNF белки. Транскрипционный эффект этих комплексов скорее всего соответствует сумме этих противоположных и/или синергичных ферментативных активностей и вытекает из интеграции нескольких сигнальных путей, таких как те. что используют Smad, PKA и ядерные рецепторы. Детальный анализ фенотипов Pbx1-нулевых мышей показал, что функция Pbx является критической для развития и особенно для органогенеза. В самом деле, хотя Pbx не является обязательным для инициальной ступени органогенеза, Pbx необходим для др. ступеней органного развития (Selleri et al., 2001, Brendolan et al., 2005, DiMartino et al., 2001, Schnabel et al., 2003, Manley et al., 2004, Dutta et al., 2001). У мышей. у которых отсутствует PID-кодирующая часть гена Pdx1, наблюдается содействие завершению панкреатической генетической программы. Было предположено, что Pdx1 мономеры и Pdx1/Pbx1 гетеродимеры запускают генетические программы, которые могут отличаться (Dutta et al., 2001). Эти результаты подтверждают гипотезу, что гомеопротеины могут регулировать энхансеры мишени без кофакторов путем связывания мономеров с сайтами (Galant et al., 2002).
В последнем цитированном исследовании, поиск генетических взаимодействий Pbx с онтогенетическими маркерами оказался неспособным показать участие Pbx в хорошо известных генетических путях. Согласно общим данным, нами предложена модель, в которой XPIP/Pbx гетеродимеры действуют как адапторы на промоторах, чтобы интегрировать информацию от нескольких сигнальных путей после инициации генетических программ органогенеза (Fig. 3). Мы полагаем, что во время инициации органогенза промоторы генов мишеней Pbx позиционно маркированы с помощью XPIP, которые затем кооперируют с Pbx и др. регуляторными факторами, чтобы активировать или репрессировать транскрипцию. На основании большинства примеров. найденных в литературе, мы могут предположить, что XPIP способны соединяться с некоторыми консенсусными сайтами в виде мономеров (Galant et al., 2002). После того как Pbx становится доступным в ядре в результате импорта в ядро, XPIP может быть частично смещен с помощью Pbx и вновь сформированные гетеродимеры будут соединяться с соседними димерными сайтами. Этот сдвиг XPIP с мономерных на димерные связывающие сайты д. происходить, т.к. взаимодействие между XPIP и мономерными сайтами более слабое, чем между XPIP/Pbx и димерными сайтами связывания. Таким путем, Meis/Prep д. рекрутироваться или как партнер, не связывающийся с ДНК, или как ДНК-связывающий партнер (в этом последнем случае комплекс соединяется с тримерным сайтом связывания) , чтобы стабилизировать сборку. Т.о., формирование XPIP/Pbx гетеродимеров (или гетеротримеров, если используется Meis/Prep) является ответственным за рекрутирование хроматин-ремоделирующих энзимов, которые скорее всего делают стабильным связывание ДНК с др. транскрипционными факторами. Рекрутирование возможно обусловлено Pbx свойствами связывания и объясняет кооперацию между соседними регуляторными сайтами, связанными с разными транскрипционными факторами, собранными вокруг Pbx. Транскрипционная регуляция генов мишеней д. соответствовать интеграции антагонистических и синергических сигнальных путей с помощью Pbx. Следовательно, генетические программы органогенеза д. соответствовать модуляции молчания, поддержания или усиления экспрессии ключевых генов с помощью Pbx белков и их различных партнеров.
Sub-cellular localization of Pbx proteins is tightly regulated
Представленные выше разделы подчеркивают роль Pbx белков в регуляции генов внутри транскрипционных комплексов. Присутствие Exd/Pbx белка в ядрах клеток является таким образом детерминантом установки соотв. генетических программ. Во время развития
Drosophila Exd является цитоплазматическим в дистальных областях придатков, тогда как он является ядерным в проксимальных областях. Эктопическая экспрессия Exd в ядрах дистальных клеток блокирует развитие дистальных частей приводя к возникновению укороченных придатков (Gonzalez-Crespo et al., 1998, Gonzalez-Crespo and Morata, 1996). Локализация Pbx1 в ядре также является критической для корректного развития проксимальных структур конечностей у позвоночных. В самом деле, дефицитные по Pbx1 мыши, обнаруживают уродства с вовлечением только проксимальных скелетных элементов в регионах, где Pbx1 является ядерным. Напротив, дистальные элементы не затрагиваются у этих мышей (Selleri et al., 2001). Многочисленные др. исследования показали, что ядерное/цитоплазматическое распределение Pbx1 является предметом для сложных регуляторных
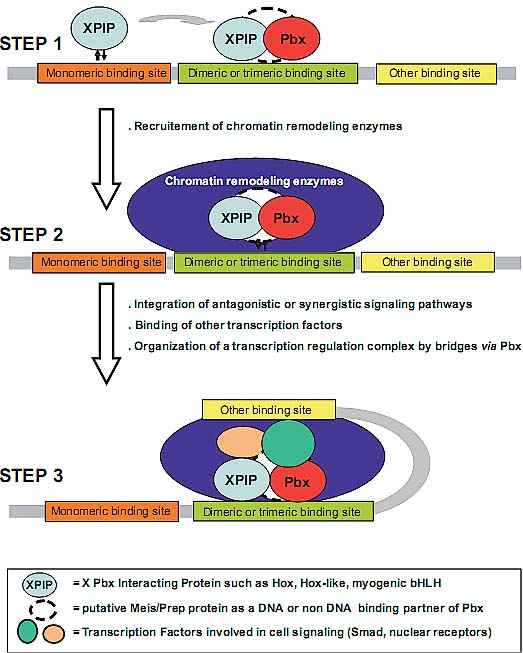 Fig. 3. Pbx proteins have a major role in integrating cell signaling and triggering subsequent developmental genetic programs. During development, differentiation genes are firstly bound by monomeric XPIP ("X" Pbx
Interacting Protein) and Pbx/Meis (or Pbx/Prep) dimer. Then, XPIP is recruited by the Pbx/Meis dimer (Meis could be involved in the complex either as a non-DNA or DNA-binding partner). The XPIP/Pbx/Meis heterotrimer is subsequently able to recruit chromatin-remodeling enzymes that allow stable DNA binding of other transcription factors. The target gene is thus transcribed at a rate defined by the
overall complex interaction with the basal transcriptional machinery. (Step 1) Developmental genetic program initiated by XPIP/Pbx proteins; (Step 2) Integration of cell signaling pathways; (Step 3) Modulation of developmental genetic programs by Pbx-containing transcription complex.
Fig. 3. Pbx proteins have a major role in integrating cell signaling and triggering subsequent developmental genetic programs. During development, differentiation genes are firstly bound by monomeric XPIP ("X" Pbx
Interacting Protein) and Pbx/Meis (or Pbx/Prep) dimer. Then, XPIP is recruited by the Pbx/Meis dimer (Meis could be involved in the complex either as a non-DNA or DNA-binding partner). The XPIP/Pbx/Meis heterotrimer is subsequently able to recruit chromatin-remodeling enzymes that allow stable DNA binding of other transcription factors. The target gene is thus transcribed at a rate defined by the
overall complex interaction with the basal transcriptional machinery. (Step 1) Developmental genetic program initiated by XPIP/Pbx proteins; (Step 2) Integration of cell signaling pathways; (Step 3) Modulation of developmental genetic programs by Pbx-containing transcription complex.
механизмов, которые возникают в результате взаимодействий между несколькими взаимодействующими с Pbx партнерами, соединяющимися с NLS (Nuclear Localization Signal) и NES (Nuclear Export Signal) в Pbx1. В самом деле, регион, соответствующий аминокислотам 45-90 в PBC-A , содержит два независимых NESs, способных обеспечивать экспорт в ядро Pbx1 посредством CRM1 (exportin 1) рецептора, экспортирующего в ядро (Kilstrup-Nielsen et al., 2003). Pbx1 содержит также два кооперативных NLSs внутри гомеодомена, которые ингибируются, когда замаскированы за счет внутримолекулярных взаимодействий между N-концом и гомеодоменом Pbx1 (Saleh et al., 2000). Более того, конкуренция между сигналами импорта и экспорта в ядро может испытывать влияние клеточно-специфическим образом. Напр., в клетках, экспрессирующих PBX партнеров, Meis/Prep белки, соединение Pbx1с Meis/Prep белками ведет к конформационным изменениям, открывающим Pbx1 NLS, который затем направляется в ядро (Berthelsen et al. , 1999, Saleh et al., 2000). Субклеточная локализация Pbx1 регулируется также с помощью пост-трансляционного механизма. В самом деле, активация protein kinase A ведет к фосфорилированию Pbx1 и это усиливает его ядерную локализацию (Kilstrup-Nielsen et al., 2003). Недавно было предположено, что актин-связывающий белок Filamin A (FLNA) может обеспечивать ядерную локализацию Pbx1a или за счет влияние на его статус фосфорилирования или за счет участия в сборке Pbx1-Meis/Prep. Однако, пока неизвестно, связывается ли FLNA непосредственно с Pbx1 или Meis/Prep белками и как он регулирует правильную ядерную локализацию Pbx1 (Berry et al., 2005). Было продемонстрировано, что NMHCB (non-muscle myosin heavy-chain B) обладает функцией удержания в цитоплазме Pbx1. Более того, область Pbx1, участвующая во взаимодействии с NMHCB перекрывает область, необходимую для связывания Meis1a, указывая тем самым, что субклеточная локализация Pbx1 может быть результатом конкуренции между несколькими путями (Huang et al., 2003). Взаимодействие Pbx1/NMHCB подтверждает также гипотезу, что актиновый цитоскелет может играть роль в аккуратной регуляции импорта в ядро Pbx1. В согласии с этой идеей то, что Haematopoietic Pbx1 Interacting Protein (HPIP), впервые идентифицированный как партнер PBX (Abramovich et al., 2000), обладает потенциалом челночного белка между цитоплазмой и ядром, т.к. он содержит NLS, NES и цитоскелетный связывающий домен (Abramovich et al., 2002). Т.о., ассоциация HPIP с цитоскелетом может обеспечивать регуляторный механизм, контролирующий доступность функциональных ядерных Pbx белков. Кроме того, др. компоненты цитоскелета, такие как tubulin, и были идентифицированы в нашем двугибридном скрининге на белки, взаимодействующие с Pbx1b (Fig. 1). Эти взаимодействия, как ожидалось, д. способствовать удержанию Pbx1 в цитоплазме.
Хотя многочисленные исследования были предприняты для изучения регуляции субклеточной локализации Pbx, некоторые вопросы остались нерешенными. В частности, как разные Pbx белки и/или изоформы, присутствующие в том же самом типе клеток, обладают разным субклеточным распределением. Это иллюстрируется локализацией Pbx1a в ядрах панкреатических ацинарных клеток, тогда как Pbx2 является ядерно-цитоплазматическим, а Pbx3b исключительно цитоплазматическим в тех же самых клетках. Регуляция локализации Pbx безусловно более сложная, чем первоначально предполагалось после идентификации Meis/Prep белка в качестве уникального ядерно/цитоплазматического челнока для Pbx (Fig. 2). Более того, присутствие разных изоформ, в семействе Meis/Prep предотвращает множественные партнерства и множественные пути регуляции локализации Pbx
Conclusion
This review highlights the fundamental role of Pbx proteins in initiating, mediating and integrating physiological and cellular contexts during development (Fig. 2). In their position downstream of crucial signaling pathways, Pbx proteins are able to initiate developmental programs and, by interacting with cell-
signaling effectors, they can also adapt new genetic networks. This functional plasticity might explain the localisation of the proteins in critical areas of developing organs. Indeed, the detailed description of Pbx1 expression in mice clearly demonstrates the presence of this protein not only in proliferating zones,
but also in non-cycling cells of the developing embryo (Schnabel et al., 2001). As suggested by these authors, Pbx1 expression during organogenesis indicates a potential function in determining cell fate in a variety of tissues that depend on mesenchymal-epithelial interactions for their coordinated morphogenesis. We
can thus imagine that Pbx proteins are able to switch from one gene regulatory network to another, allowing proliferating cells to go through a genetic differentiation program necessary to obtain specialized cell types in functional organs. The overall results of studies in the literature indicate that Pbx proteins functionally
interact with a wide variety of transcription factors, thus forming heterodimers, heterotrimers or multimers on promoter target genes that play key roles in cell fate. These Pbx-associated factors often possess a PID that is an imperfectly conserved motif, indicating that competition between these PID-bearing proteins
could occur under certain conditions. The positive or negative effects of Pbx- containing complexes on target-gene transcription depend on their composition, with each component participating directly or indirectly in the recruitment of chromatin-remodeling enzymes such as HAT, HDAC, CBP or the whole SWI/SNF complex. The level of transcriptional regulation mediated by Pbx/partners seems to be a balance between the opposite activities of chromatin-remodeling enzymes that they recruit. This overall assembly of transcriptional complexes onto gene promoters would result in the expression of specific gene networks, integrated by cells to ultimately undergo mitosis or specific differentiation programs.
Сайт создан в системе
uCoz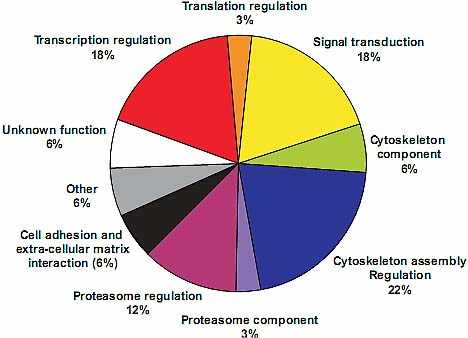 Fig.1. Identification of Pbx1 partners. Using the full-length Pbx1b
protein as bait in a yeast two-hybrid screen, positive clones were selected
by their ability to activate reporter genes. True positive clones were then
discriminated from false positives by GST-pull down analysis. Plasmid
DNAs corresponding to putative Pbx1 partners were purified, sequenced
and identified by Blast analysis. The different putative partners were
classified according to their biological functions.
Fig.1. Identification of Pbx1 partners. Using the full-length Pbx1b
protein as bait in a yeast two-hybrid screen, positive clones were selected
by their ability to activate reporter genes. True positive clones were then
discriminated from false positives by GST-pull down analysis. Plasmid
DNAs corresponding to putative Pbx1 partners were purified, sequenced
and identified by Blast analysis. The different putative partners were
classified according to their biological functions. 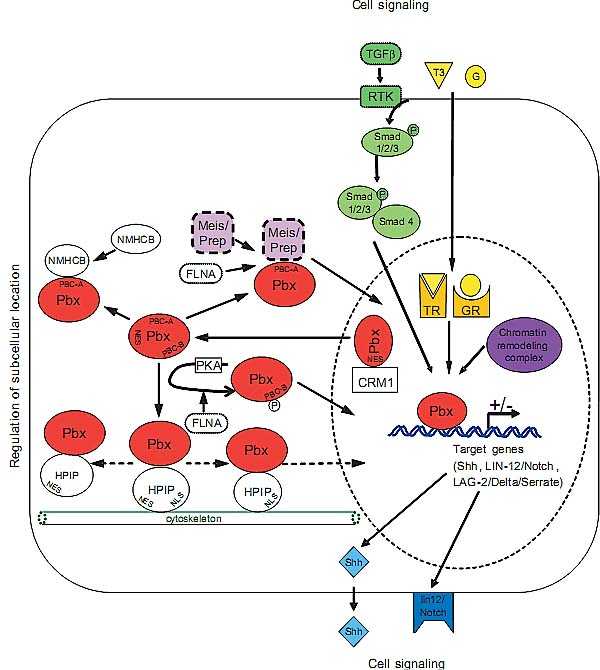
 Fig. 3. Pbx proteins have a major role in integrating cell signaling and triggering subsequent developmental genetic programs. During development, differentiation genes are firstly bound by monomeric XPIP ("X" Pbx
Interacting Protein) and Pbx/Meis (or Pbx/Prep) dimer. Then, XPIP is recruited by the Pbx/Meis dimer (Meis could be involved in the complex either as a non-DNA or DNA-binding partner). The XPIP/Pbx/Meis heterotrimer is subsequently able to recruit chromatin-remodeling enzymes that allow stable DNA binding of other transcription factors. The target gene is thus transcribed at a rate defined by the
overall complex interaction with the basal transcriptional machinery. (Step 1) Developmental genetic program initiated by XPIP/Pbx proteins; (Step 2) Integration of cell signaling pathways; (Step 3) Modulation of developmental genetic programs by Pbx-containing transcription complex.
Fig. 3. Pbx proteins have a major role in integrating cell signaling and triggering subsequent developmental genetic programs. During development, differentiation genes are firstly bound by monomeric XPIP ("X" Pbx
Interacting Protein) and Pbx/Meis (or Pbx/Prep) dimer. Then, XPIP is recruited by the Pbx/Meis dimer (Meis could be involved in the complex either as a non-DNA or DNA-binding partner). The XPIP/Pbx/Meis heterotrimer is subsequently able to recruit chromatin-remodeling enzymes that allow stable DNA binding of other transcription factors. The target gene is thus transcribed at a rate defined by the
overall complex interaction with the basal transcriptional machinery. (Step 1) Developmental genetic program initiated by XPIP/Pbx proteins; (Step 2) Integration of cell signaling pathways; (Step 3) Modulation of developmental genetic programs by Pbx-containing transcription complex.