Эта область распространяется с C-конца до спирали 12 в RARs, но отсутствует в RXRs. Она очень изменчивая по длине и последовательностям среди разных субтипов RAR , а её трехмерная структура всё ещё неизвестна. Интересно, что область F фосфорилируется по многим позициям, которые могут модифицировать свойства RARs [Bastien et al., 2000; Rochette-Egly et al., 1997]. Функции области F всё ещё плохо изучены, предполагается, что в отсутствие лиганда эта область д. стабилизировать H12 в RARα субтипе в незакрытой конформации, усиливая тем самым связывание корепрессора [Farboud and Privalsky, 2004]. Согласно недавним исследованиям эта область способна соединяться со специфическими мотивами мРНК [Poon and Chen, 2008].
The canonical RAR-mediated regulation of transcription with the LBD as the main actor
RARs рассматриваются как высоко-регулируемые ДНК-связывающие транскрипционные факторы, которые контролируют транскрипцию посредством нескольких самостоятельных механизмов, включая как репрессию, так и активацию. Ранее было установлено, что после сайт-специфического связывания ДНК, финальная транскрипционная активность RARs зависит от набора ассоциированных белков, т. наз. корепрессоров и коактиваторов. С мол. точки зрения различия между корепрессорами и коактиваторами управляются за счет позиции H12, которая управляется с помощью лиганда и вносит вклад критическим способом в создание или удаления поверхностей для взаимодействия.
The position of helix 12 governs the exposure of interaction surfaces for corepressors or coactivators
Повторяющиеся структурные признаки корепрессоров и коактиваторов - это присутствие высоко-консервативных мотивов, которые участвуют в их рекрутировании на LBD в RARs. Корепрессор ядерного рецептора (NCoR/NCoR1/RIP13) и медиатор замалчивания для рецепторов ретиноидов и тироидного гормона (SMRT/NCoR2/TRAC) [Aranda and Pascual, 2001; Glass and Rosenfeld, 2000; Privalsky, 2004] содержат в своей C-терминальной части два и три домена взаимодействия с ядерным рецептором, соотв., с LxxI/HIxxxI/L мотивом, который формирует расширенную α helix. Коактиваторы, которые включают по-существу p160 подсемейство steroid receptor coactivators (SRC), а именно SRC-1 (также обозначается как NCoA-1), SRC-2 (TIF-2, GRIP-1) и SRC-3 (pCIP, ACTR, AlB1, TRAM1, RAC3) [Glass and Rosenfeld, 2000; Lefebvre et al., 2005; Perissi et al., 1999], содержат три копии высоко консервативных мотивов LxxLL , которые образуют короткую α helix.
В отсутствие лиганда поверхность RARα LBD представляет собой гидрофобную брозду, образуемую с помощью H3, L3-4 и H4. Это значит, что поверхность топологически связана с таковой, которая участвует во взаимодействи коактиватора, но без H12 [Hu and Lazar, 1999] она может связывать расширенный LxxI/HIxxxI/L мотив корепрессора. N-терминальная часть этого мотива простирается таким способом, что она маскирует интерфейс взаимодействия H12, это объясняет, почему связывание корепрессора и коактиватора взаимно исключающее. Интересно, что RARγ и RARβ субтипы взаимодействуют плохо с корепрессорами [Farboud et al., 2003; Hauksdottir et al., 2003; Privalsky, 2004]. Было предположено, что гидрофобные взаимодействия между H3 и H12 секвестрируют H12 в закрытую конформацию даже в отсутствие лиганда, тем самым закрывая сайт присоединения корепрессора. Отметим, что эта закрытая конформация предупреждает также связывание коактиватора.
После связывания лиганда RARα подвергается конформационным изменениям и H12 оказывается переориентированным с консервативным остатком glutamate, формирующим заряженное соединение (clamp) с lysine в H3. Такая заряженный зажим (clamp) может специфически сжимать концы спирали специфической длины с помощью LxxLL мотива коактиваторов, тем самым позволяя leucine боковым цепочкам упаковываться в гидрофобную полость. Поскольку эта активируемый лигандом заряженный зажим не соответствует расширенному LxxI/HIxxxI/L мотиву корепрессоров, то было предположено, что альтернативные взаимодействия RARα с корепрессорами и коактиваторами возникает в результате различий в длине взаимодействующих мотивов, которые могут быть приспособлены к гидрофибной щели в двух конформациях [Germain et al., 2006c; Perissi et al., 1999].
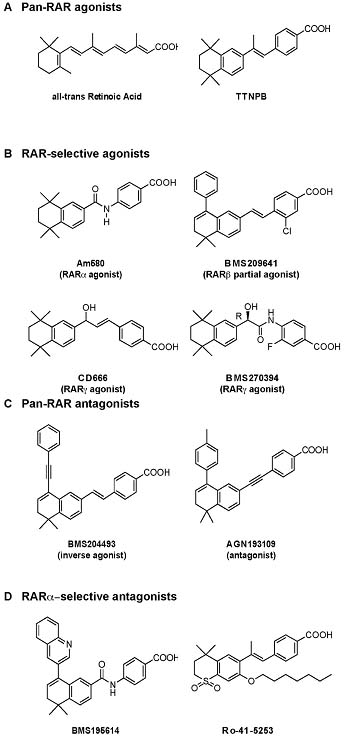
Некоторые кристаллические структуры RAR LBDs связывают синтетические ретиноиды, они обнаруживают, что взаимодействия лиганда с H11 и H12, или с остатками в их близи, являются первичными детерминантами позиции спирали 12 и что H12 может принимать не только активное и неактивное положение, но и также некоторые промежуточные позиции. Это указывает на то, что относительно легкие модификации лигандом могут существенно менять конформацию LBD и молекулярное переключение H12, генерируя тем самым разные интерфейсы связывания корегуляторов. Следовательно, генерируемая панель соединений, представлена не только агонистами, но и также антагонистами, обратными агонистами и частичными агонистами, избирательными или нет для RAR субтипов [Altucci et al., 2007; de Lera et al., 2007; Vivat-Hannah and Zusi, 2005] (Figure 1).
Со структурной точки зрения агонисты индуцируют репозиционирование спирали 12 и вносят вклад в критический способ распознавания поверхности с помощью LxxLL boxes коактиваторов. Напротив, антагонисты, которые присутствуют в массе боковой цепи, которые не могут приспособиться к связывающей полости для агониста, предохраняют RARs от принятия этой конформации. Антагонисты включают чистые AF-2 антагонисты, представленные BMS195614, избирательным RARα антагонистом (Figure 1). Кристаллическая структура BMS195614-связанного RARα LBD комплекса показывает, что H12 упаковывается на борозде, формируемой carboxy терминальной частью H3, Loop L3-4 и H4 [Bourguet et al., 2000a], это соответствует сайту связывания коактиваторного LxxLL мотива. Поэтому разумно предположить, что BMS195614 может предупреждать взаимодействие коактиваторов. Т.к. сайт связывания коактиватора перекрывается с таковым для корепрессора, то BMS195614 может также препятствовать взаимодействию NCoR и SMRT корепрессоров.
Напротив, др. антагонисты, обозначаемые как обратные агонисты и представленные, AGN193109 или BMS204493 (Figure 1), высоко эффективны в индукции взаимодействия корепрессора, усиливая тем самым молчание [Germain et al., 2009; Germain et al., 2002; Klein et al., 1996; Sanglier et al., 2004]. Хотя молекулярные основы обратного агонизма пока не установлены, H12 в RAR LBD, соединяясь с обратным агонистом д. воспринимать альтернативную позицию, которая не закрывает гидрофобную борозду, образуемую H3 и H4.
Наконец, идентифицирован AF-2 частичный agonists-antagonists [Chen et al., 1995; Germain et al., 2004; Klein et al., 1996]. Интерес к этим соединениям связан с тем, что они обладают редуцированной эффективностью по сравнению с полными агонистами и что они могут действовать в клетках зависимым от типа клеток способом и/или активировать только субнабор соотв. индуцируемых лигандом функций.
Transcriptional repression in the absence of ligand
Когда гены молчат, то ДНК упакована в высоко-организованную и компактную нуклеопротеиновую структуру, известную как гетерохроматин, который ограничивает доступ промоторным последовательностям к транскрипционному аппарату и тем самым затрудняет все транскрипционные ступени [Richards and Elgin, 2002]. Базовой единицей хроматина является нуклеосома, которая состоит из ДНК, обернутой вокруг белковой сердцевины, состоящей из двух копий каждого из 4-х гистоновых белков. Выставляются из нуклеосом N-терминальные "хвосты" стержневых гистонов, чьё взаимодействие с ДНК может быть модулировано за счет ковалентных модификаций (acetylation, phosphorylation, methylation, ubiquitination, etc.) [Narlikar et al., 2002].в
Согласно современной модели генной регуляции с помощью RARs [Dilworth and Chambon, 2001], в контексте хроматина, где нуклеосомы не препятствуют соединению с RAREs, субтип RARα является строгим репрессором экспрессии генов мишеней в отсутствие лиганда. Эта репрессивная активность отражает способность RARα связывать корепрессоры, такие как NCoR или SMRT (see above), которые не обладают прирожденной ферментативной активностью, но располагаются в или рекрутируют высокго м.в. комплексы, наделенные histone deacetylase activity (HDACs). такие комплексы обладают хорошо известной ролью в репрессии транскрипции за счет деацетилирования остатков лизина в N-терминальных хвостах гистонов и генерации конденсированной структуры хроматина поверх промотора мишени. Корепрессорные комплексы также содержат др. компоненты, такие как TBL1 (Transducin β-like 1) и TBLR1 (TBL1-related protein 1), которые служат в качестве адапторов, регулирующих сборку и функционирование корепрессоров [Perissi et al., 2004].
Стоит отметить, что в соответствии с недавними исследованиями в отсутствии RA, гены мишени для RAR взаимодействуют с др. типа репрессорами, такими как Topoisomerase IIβ [McNamara et al., 2008], Polycomb group proteins (PcG) [Gillespie and Gudas, 2007a; Gillespie and Gudas, 2007b] или calmodulin kinase IIγ (CaMKIIγ) [Si et al., 2007], которые также диссоциируют в ответ на RA. Белки PcG действуют в крупных мультимерных комплексах, которые обеспечивают молчание генов, тогда как CaMKIIγ фосфорилирует RARs, усиливая тем самым их взаимодействие с корепрессорами.
Transcriptional activation upon ligand binding: coregulator exchange at the LBD
Чтобы активировать экспрессию гена, RXR-RARα гетеродимеры, связанные по DR5 элементам, д. конкурировать с репрессивными структурами хроматина, чтобы сделать возможным рекрутирование транскрипционного аппарата. Сегодня широко принято, что после связывания RARα агониста, связанные корепрессоры высвобождаются и RXR-RARα гетеродимеры взаимодействуют с коактиваторами из семейства p160 (see above), которые после ассоциации с крупными комплексами, обладающими хроматин модифицирующей и ремоделирующей активностью, д. декомпактизировать репрессивный хроматин.
Интересно, что RXR агонист не может активировать RXR-RARα гетеродимеры независимо от RARα партнера, связанного с первым. Было предложено несколько моделей для объяснения этого феномена, обозначенного как "subordination" или "silencing" (for review see [Greschik and Moras, 2003] and references therein), но большинство из них нуждается в оценке многих кристаллических структур. Важно, что одна из моделей предполагает, что связавший лиганд RXR, не может диссоциировать корепрессоры с RARα партнера [Germain et al., 2002] и что связывание агониста с RARα является важным для диссоциации корепрессоров. В согласии с этой идеей то, что RXR-RARβ гетеродимер, в котором RARβ очень слабо рекрутирует корепрессоры, реагирует лучше на RXR агониста [Germain et al., 2002]. Наконец, в присутствии как RAR, так и RXR агонистов обнаруживается синергизм, возникающий из RAR агонистом индуцированной диссоциации корепрессоров и последующего кооперативного связывания коактиваторов двумя партнерами.
Коактиваторы p160 служат в качестве адапторов, рекрутирующих др. комплексы с разными ферментативными активностями [Glass and Rosenfeld, 2000; Lefebvre et al., 2005; McKenna and O'Malley, 2002; Rosenfeld et al., 2006; Zhao et al., 2008]: (i) histone acetyltransferases (HATs) такие как CBP/p300 (CREB binding protein) и p/CAF (p300/CBP-associated factor) (ii) histone methyl transferases (HMTs) такие как CARM1 (coactivator-associated arginine methyltransferase 1) или PRMT1 (protein arginine methyl transferase 1), (iii) ubiquitinases/deubiquitinases и (iv) нуклеосомы ремоделирующие комплексы, такие как SWI/SNF (switch/sucrose non-fermenting). Все эти комплексы меняют структуру хроматина, окружающего промотор гена мишении создают метки или сайты связывания, которые формируют "гистоновый код", считываемый определенными эффекторами, это в свою очередь обеспечивает разные исходы [Sims and Reinberg, 2008]. В некоторых примерах, эти хроматиновые метки функционируют комбинаторным способом. Этот код координирует рекрутирование дополнительных HATs или HMTs для дальнейшей декомпакции хроматина. Он также руководит рекрутированием ремодельеров хроматина, которые используют энергию АТФ гидролиза для переустановки нуклеосом посредством скольжения их в цис- или смещения их в транс-положение, что делает возможным формирование свободных от нуклеосом или nucleosome-spaced регионов на промоторах [Narlikar et al., 2002]. Было также предположено, что активированные RARs рекрутируют транскрипционный аппарат, включая мульти-субъединичный Mediator комплекс, RNA polymerase II и общие транскрипционные факторы [Bastien and Rochette-Egly, 2004; Dilworth and Chambon, 2001; Rochette-Egly, 2005; Rosenfeld et al., 2006]. Эта ступень д. нуждаться с ассоциации RARs со специфическими субъединицами Mediator комплекса, которые были идентифицированы как DRIP205/TRAP220, и которые содержат два LxxLL мотива [Lefebvre et al., 2005].
Необходимо отметить, что
in vivo RARs, по-видимому, используют разные программы активации генов в зависимости от контекста промоторов генов мишеней. В самом деле, недавние эксперименты по иммунопреципитации продемонстрировали, что
in vivo, Mediator комплекс и RNA PolII уже могут оккупировать вместе с RARα промоторы некоторых эндогенных генов, даже в отсутствие RA [Flajollet et al., 2006; Pavri et al., 2005; Perissi et al., 2004]. В этом контексте инициация транскрипции и рекрутирование общих транскрипционных факторов, таких как TFIIH на промотор, как было установлено, зависят от диссоциации с Mediator комплекса, ингибирующей cyclin-dependent kinase 8 (cdk8) субъединицы [Andrau et al., 2006; Elmlund et al., 2006]. Кроме того, недавние исследования в нашей лаб. показали, что в отсутствие лиганда не все промоторы мишени для RA оккупируются RARs и что некоторые события инициировались и координировались, чтобы сделать чувствительные элементы доступными для рекрутирования RAR (see below and [Bruck et al., 2009]). Интересно, что в контексте промоторов с RAREs, которые удалены от точки старта транскрипции, RARs в ассоциации с корегуляторами и RNA PolII инициируют образование петель ДНК [Bruck et al., 2009].
Role of other unconventional coregulators
Модель использования коактиваторов, которые позитивно модулируют траснскрипуию, была поставлена под вопрос с открытием трех др. неконвенционных корегуляторов, receptor interacting protein of 140kDa (RIP140/NRIP1) [Augereau et al., 2006; Hu et al., 2004], preferentially expressed antigen in melanoma (PRAME) [Epping et al., 2005] и transcription intermediary factor-1 α (TIF1α/Trim24) [Le Douarin et al., 1995], которые репрессируют транскрипцию несмотря на их зависимое от лиганда рекрутирование на RARs посредством LxxLL мотивов (один TIF1α, семь в PRAME и девять плюс модифицированный LxxML мотив в RIP140) [Farooqui et al., 2003; Heery et al., 1997].Фактически эти корегуляторы д. составлять функциональный механизм негативной петли обратной связи, ограничивающий и/или завершающий активность RAR. Механизм TIF1α-обеспечиваемой репрессии пока не выяснен [Khetchoumian et al., 2007]. Однако репрессивная активность RIP140 была приписана присутствию 4-х репрессивных доменов, один из них рекрутирует HDACs [Wei et al., 2000], а таковая у PRAME связана с рекрутированием белков PcG [Epping et al., 2005].
Идентифицирована масса др. корегуляторных молекул для RA-связавших RARs. Среди них коактиваторы, лишенные LxxLL мотивов, такие как thyroid receptor interacting protein-1 (TRIP1/SUG-1) [vom Baur et al., 1996], который является субъединицей 19S регуляторного субкомплекса протеосом с ATPase активностью и который вносит вклад в транскрипцию генов мишеней для RAR [Ferry et al., 2009]. Существуют также корегуляторы, которые взаимодействуют с доменами, иными, чем коактиваторная гидрофобная щель, формируемая между H3, H4 и H12. Так, cyclin H взаимодействует с L8-9 и началом H9 [Bour et al., 2005a], делая возможным рекрутирование TFIIH (see below). Имеется также CRABPII, который в ассоциации с cyclin D3 [Delva et al., 1999; Despouy et al., 2003], служит в качестве RA-channeling молекулы к рецептору [Budhu and Noy, 2002; Dong et al., 1999]. Интересно, что после дерегуляции экспрессии CRABPII, RA направляется на peroxisome proliferator-activated receptors (PPARβ/δ) скорее, чем на RARs, с помощью др. внутриклеточного липид-связыающего белка, генерирующего резистентность к RA [Schug et al., 2008].
New unconventional nongenomic effects of RARs: kinase activation and translation induction
Activation of the MAPK pathways
Новая концепция, которая недавно развита, в дополнение к хорошо известной ядерной функции по регуляции экспрессии генов, RA быстро активирует mitogen-activated protein kinases (MAPKs). В самом деле, недавние исследования показали, что RA активирует p38MAPK в некоторых клеточных линиях, таких как фибробласты, клетки мышиной embryocarcinoma, клетки опухолей молочных желез и клетки лейкемии [Alsayed et al., 2001; Bruck et al., 2009; Gianni et al., 2002a; Gianni et al., 2006]. Далее, p38MAPK активирует нижестоящий mitogen and stress-activated kinase, MSK1 [Bruck et al., 2009]. Однако, в нервных клетках (neuroblastoma cells, hippocampus neurons и P19 cells) и клетках Sertoli, RA вместо этог быстро активирует p42/44 MAPKs [Chen and Napoli, 2008; Gupta et al., 2008; Masia et al., 2007; Zanotto-Filho et al., 2008].
Активация MAPK происходит очень быстро (в течение минут после добавления RA) вслед за предшествующей активацией вышестоящих киназ, таких как phosphoinositide 3-kinase (PI3K) [Bastien et al., 2006; Masia et al., 2007; Pan et al., 2005], RAC-1 [Alsayed et al., 2001] или protein kinase C δ (PKCδ) [del Rincon et al., 2004; Kambhampati et al., 2003]. Это указывает на атипичное, негеномное событие активации, сходное с таковым, описанным для стероидных рецепторов. В согласии с этой новой концепцией, хотя обычно полагается расположение в ядре, RARs недавно были описаны в цитозоле или на мембранах в ассоциации с PI3K или Src киназами [Dey et al., 2007; Masia et al., 2007]. Эти наблюдения строго подтверждают новую парадигму, согласно которому RARs д. интегрироваться с событиями в мембранах и цитоплазме, которые д. руководить некоторыми post- t reductional модификациями, чтобы обеспечить тонкую настроку транскрипции (Figure 3 and Figure 4).
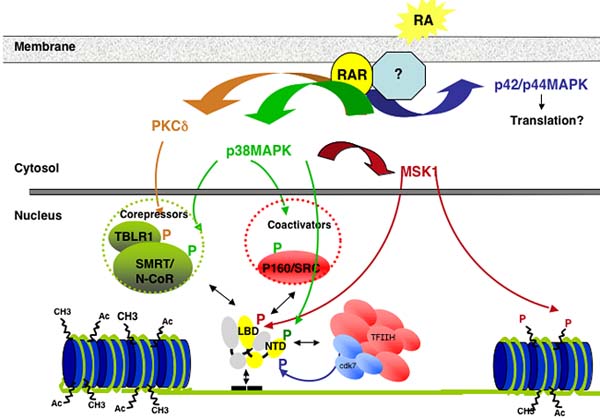 Figure 3
Crosstalk between kinase cascades and genomic pathways induced by RA.
Figure 3
Crosstalk between kinase cascades and genomic pathways induced by RA.
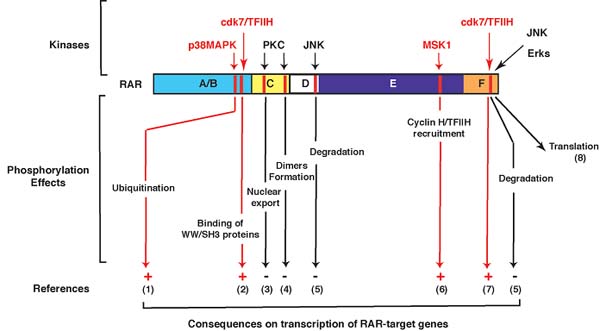
Figure 4
Recapitulation of the different signaling pathways involved in RAR phosphorylation.
RNA binding and translation control
Совсем недавние исследования выявили др. новую негеномную роль RARα в качестве РНК-связывающего белка. В двух лаб. независимо было продемонстрировано, что RA активирует синтез дендритного белка посредством процесса, который нуждается в RAR? (но не в др. субтипах RAR) и не зависит от транскрипционной регуляции [Chen and Napoli, 2008; Maghsoodi et al., 2008]. В самом деле, было установлено, что RARα экспортируется в дендриты нейронов, где он ассоциирует с субнабором мРНК, такой как мРНК glutamate receptor 1 (GluR1) [Chen et al., 2008]. Это соединение, которое обеспечивается за счет C-терминальной F области RARα, непосредственно репрессирует трансляцию этих мРНК [Poon and Chen, 2008]. Интересно, что соединение RA с RARα снижает её ассоциацию с мРНК GluR1 и ослабляет репрессию трансляции. Этот эффект коррелирует с синаптической функцией и пластичностью [Aoto et al., 2008]. Т.к. RA активирует также MAPKs в нейрональных клетках [Chen and Napoli, 2008] и т.к. F регион может быть фосфорилирован [Rochette-Egly et al., 1997], то необходимы дальнейшие исследования для выяснения влияния путей передачи сигналов киназ на трансляцию [Chen and Napoli, 2008]. Итак. эти новые негеномные эффекты охватывают рамки биологических функций RARα помимо их роли в качестве регуляторов генной транскрипции.
Crosstalk between kinase cascades and genomic pathways induced by RARs
The RA-activated p38MAPK/MSK1 pathway leads to a coordinated phosphorylation cascade targeting RARα, their coregulators and histones
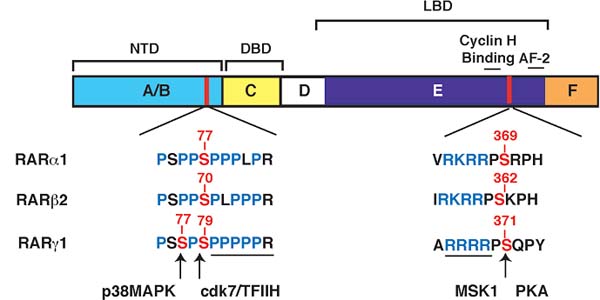
Недавние исследования нашей лаб. продемонстрировали, что RARα быстро фосфорилируются в ответ на RA по двум остаткам серина, один расположен в LBD (serine 369) и др. в NTD (serine 77) [Bruck et al., 2009] (Figure 2). Интересно, что serine 369 экспозирует остаток, расположенный между спиралями 9 и 10 в LBD. Он относится к мотиву, богатому arginine-lysine, который соответствует консенсусу мотива фосфорилирования для некоторых киназ, включая cyclic AMP-dependent protein kinase (PKA) и MSK1, указывая тем самым, что он может интегрировать несколько сигнальных путей [Bruck et al., 2009; Gaillard et al., 2006]. Напротив, serine 77, расположенный в NTD, принадлежит мотиву, богатому proline. Киназа, ответственная за фосфорилирование этого сайта идентифицирована как cdk7 [Rochette-Egly et al., 1997], активность которой зависит от её ассоциации с cyclin H и MAT1, чтобы сформировать трехсоставной cyclin-dependent kinase (CDK)-activating kinase (CAK) комплекс TFIIH, общий транскрипционный фактор, состоящий из 10 субъединиц [Giglia-Mari et al., 2004]. Корректное позиционирование cdk7 kinase и тем самым эффективности фосфорилирования NTD с помощью cdk7 зависит от связывания cyclin H специфическим сайтом LBD, расположенным в L8-9 и N-терминальной части H9 [Bour et al., 2005a; Gaillard et al., 2006]. Это первый пример кооперации между N- и C-терминальными доменами RARs посредством киназного комплекса. Сайт связывания cyclin H законсервирован среди RARs, но не в др. ядерных рецепторах и др. мишенях cdk7 и отличается от др. сайтов присоединения циклина. Поэтому необходимо выяснить специфичность фосфорилирования RAR с помощью cdk7.
Недавно, Bruck et al. продемонстрировали, что RA-индуцированное фосфорилирование RARα является результатом скоординированного каскада фосфорилирования, стартующего с фосфорилирования serine 369 с помощью MSK1 [Bruck et al., 2009]. Т.к. serine 369 находится в тесной близи к сайту присоединения (docking) cyclin H, то фосфорилирование этого остатка индуцирует аллостерическую сеть, которая способствует связыванию cyclin H [Gaillard et al., 2006] и тем самым cdk7, с характерными нижестоящими последствиями на фосфорилирование NTD по serine 77.
Фосфорилированные остатки серина в LBD и в NTD законсервированы среди RARs. Поэтому RARγ субтип также фосфорилирован по NTD (serine 79 в RARγ1 и serine 68 в RARγ2) с помощью cdk7 субъединицы TFIIH [Bastien and Rochette-Egly, 2004]. Интересно, что RARγ (но не RARα) также фосфорилируется по дополнительному ближайшему остатку серина (serine 77в RARγ1 и serine 66 в RARγ2) с помощью p38MAPK [Gianni et al., 2002a; Gianni et al., 2002b] (Figure 2). Однако может ли RAR? быть фосфорилирован по сайту в LBD (serine 371 в RARγ1 и serine 360 и RARγ2) [Rochette-Egly et al., 1995] с помощью MSK1 в ответ на RA неизвестно.
RA также активирует p42/p44MAPK, но способна ли эта киназа фосфорилировать RARs неизвестно. Однако заметим, что в нейрональных клетках, RA-активированная p42/p44MAPK фосфорилирует др. активаторы транскрипции, переключая их на репрессию др. генных программ [Gupta et al., 2008], тогда как в клетках Sertoli, они индуцируют апоптоз [Zanotto-Filho et al., 2008].
недавно p160 SRC-3 коактиватор [Gianni et al., 2006] и TBLR1, компонент корепрессорных комплексов [Perissi et al., 2008], как было установлено, фосфорилируются в ответ на RA с помощью p38MAPK и PKCδ, соотв.. Интересно, что семейство p160 коактиваторов [Lopez et al., 2001; Rowan et al., 2000; Wu et al., 2007; Wu et al., 2004; Yi et al., 2008], также как и p300/CBP [Vo and Goodman, 2001], RIP140 [Gupta et al., 2005; Huq et al., 2005] и SMRT [Jonas and Privalsky, 2004], также являются мишенями для MAPKs или др. киназ, но происходит ли их фосфорилирование в ответ на RA ещё предстоит выяснить. Наконец, MSK1 , как было недавно установлено, рекрутируется на промоторы мишени для RARα в активной фосфорилированной форме, приводя к усилению фосфорилирования serine 10 в гистоне H3 [Bruck et al., 2009].
RAR phosphorylation and the transcription of RA target genes
Ранние исследования продемонстрировали важность TFIIH-обеспечиваемого фосфорилирования RARs в транскрипции генов мишеней для RA [Bastien et al., 2000; Rochette-Egly et al., 1997]. Это было подтверждено в исследованиях с использованием пациентов, страдающих от Xeroderma pigmentosum, которые имели мутацию в TFIIH субъединице [Keriel et al., 2002]. Такие клетки характеризовались гипофосфорилированием субтипа RARα и недостаточной реакцией на RA, но лежащий в основе механизм неизвестен.
Недавние результаты Bruck et al. [Bruck et al., 2009] предоставили новую информацию о том, как фосфорилирование влияет на транскрипционную активность RARα. В самом деле, они продемонстрировали, что RA-индуцированный каскад фосфорилирования, инициируемый с помощью MSK1 и заканчивающийся фосфорилированием NTD с помощью cdk7, способствует рекрутированию RARα на промоторы мишени. Эти результаты подтверждают важность фосфорилирования NTD для транскрипционной активности RARs. Однако это ставит вопрос, как фосфорилирование этого неструктуированного домена может в действительности регулировать связывание с ДНК. Напротив, в случае RARγ, промоторы уже оккупированы рецептором в отсутствии лиганда [Gillespie and Gudas, 2007a; Gillespie and Gudas, 2007b] и фосфорилирование RARγ происходит на промоторах (our unpublished results), указывая тем самым, что фосфорилирование NTD может модулировать транскрипцию путем контроля межбелковых взаимодействий [Lavery and McEwan, 2005; Warnmark et al., 2003].
Фосфорилирование коактиваторов и корепрессоров, которое происходит в ответ на RA также является критическим для транскрипционной активности RARα [Perissi et al., 2004; Rosenfeld et al., 2006]. Аналогично steroid ядерным рецепторам [Dennis and O'Malley B, 2005; Wu et al., 2005; Yi et al., 2005], было предположено, что фосфорилирование SRC-3 [Gianni et al., 2006] тонко регулирует динамику обменов коактиваторов с RARα и/или др. коактиваторами. Напротив, фосфорилирование TBLR1 обеспечивает ubiquitination и деградацию NCoR/SMRT [Perissi et al., 2008] и тем самым преодолевается зависимая от SMRT/NCoR репрессия.
Наконец, MSK1-обеспечиваемое фосфорилирование H3 вносит вклад в индукцию генов мишеней для RARα, возможно, поскольку учет хроматиновых меток в кооперации с др. гистоновыми модификациями, важен для диссоциации репрессивных комплексов и/или рекрутирования хроматин-ремоделирующих комплексов [Bruck et al., 2009; Vicent et al., 2006].
Итак, эти недавние находки осложняют обычное представление о стабильных, базирующихся на RAR, связанных с матрицей комплексах и указывают на динамическую модель с быстрыми и последовательными сериями обменов между RARs и корегуляторами на промоторах [Bour et al., 2007; Rochette-Egly, 2005] (Figure 3). Такие обмены тщательно скоординированы с помощью фосфорилирования и д. действовать как "transcriptional time clock", так что в конце корректные белки присутсвуют в с соотв. активностью, на соотв. месте и в соотв. время.
RAR phosphorylation and other posttranslational modifications
Согласно недавним исследованиям RARs также являются мишенями для др. модификаций, таких как убиквитилирование и метилирование. Сегодня считается, что взаимодействие между разными посттрансляционными модификациями являются важным механизмом для достижение интегрированной регуляции активности RAR, предполагается, что белковый код, сходный с таковым, предложенным для гистонов, может быть приложим к RARs [Sims and Reinberg, 2008]. Наилучшим примером взаимосвязи между модификациями является зависимое от фосфорилирования убиквитилирование и последующая протеосомная деградация субтипа RARγ [Gianni et al., 2002a; Kopf et al., 2000]. Центральным в этой функции фосфорилирования оказалось наблюдение, что в RARγ serines, расположенные в NTD замещенные alanine остатками обнаруживают снижение убиквитилирования и деградации с помощью 26S протеосом после связывания соотв. лиганда. Контролирует ли фосфорилирование рекрутирование ubiquitin-proteasome аппарата непосредственно или косвенно посредством конформационных изменений, нуждается в дальнейших исследованиях.
RARs могут быть также метилированы. Группа Li-Na Wei сообщила, что RARα могут быть три-метилированы по лизиновому остатку, расположенному в LBD [Huq et al., 2007] и моно-метилированы по др. лизину, расположенному в DBD [Huq et al., 2008]. В обоих случаях метилирование играет позитивную роль в транскрипционной активности RARα, но базовые молекулярные механизмы, а также участвующие methylases, ещё предстоит охарактеризовать. Осуществляются ли функции метилирования комбинаторным способом с фосфорилированием. неизвестно. Наконец, могут ли RARs, как и большинство ядерных рецепторов, быть мишенями др. модификаций, таких как ацетилирование или SUMOylation, нуждается в дальнейших исследованиях.
RAR phosphorylation in response to other cellular signaling pathways: abrogation of the RA response
Сегодня новые роли фосфорилирования в регуляции RAR-обеспечиваемой транскрипции были открыты и становится всё яснее, что фосфорилирование RAR может также происходить в отсутствие лиганда. В самом деле, некоторые экзогенные сигналы, такие как ростовые факторы, insulin, стрессы или цитокины активируют цитозольные пути киназных каскадов, заканчиваясь на Akt, PKC или c-Jun N-terminal kinases (JNKs), которые могут поступать в ядро и фосфорилировать RARs по остаткам, иным чем те, что обычно фосфорилируются в ответ на RA (Figure 4). Т.к. такие процессы фосфорилирования обычно активируют транскрипционную активность стероловых рецепторов [Faus and Haendler, 2006; Moggs and Orphanides, 2001], они вместо этого инактивируют активность RARα. Напр., PKC может фосфорилировать DBD в RARs, приводя к ядерному экспорту [Sun et al., 2007] или устранению гетеродимеризации RARs и соединению с ДНК [Delmotte et al., 1999]. Более того, в раковых опухолях, охарактеризованных с помощью амплификации или дерегуляции активности JNK или Akt, в результате обусловленной амплификацией аберрантной активности рецепторных или цитоплазматических tyrosine kinases [Blume-Jensen and Hunter, 2001], некоторые остатки, располженные на C-терминальном конце RARα фосфорилируются, вноя вклад в деградацию RARα [Srinivas et al., 2005; Srinivas et al., 2006]. SMRT также фосфорилируется с помощью Akt [Lefebvre et al., 2006], с последующей стабилизацией взаимодействия RAR-SMRT. Негеномные эффекты RARs на путь p38MAPK/MSK1 также устраняются [Bruck et al., 2009]. Наконец, такие раковые опухоли являются резистентными к RA [Neri et al., 2003; Tari et al., 2002]. Итак, RAR транскрипционная активность, которая контролируется с помощью множественных игроков, действует под тонким контролем, скоординированным в пространстве и времени способом, необходимым для интеграции сигнальных путей.
New actors in RAR-mediated transcription: the ubiquitin-proteasome system and coregulators of the NTD
New roles for the ubiquitin-proteasome pathway, with and without proteolysis
Новый аспект заключается в том, что в ответ на RA, RARs [Gianni et al., 2002a; Kopf et al., 2000; Zhu et al., 1999], также как и их коактиваторы, такие как SRC-3 [Gianni et al., 2006], убиквитилируются и деградируют с помощью 26S, который состоит из 20S протеолитической сердцевины, покрытой шапочкой из 19S регуляторного комплекса, которая распознает убиквитилируемые беклки и готовит их к вступлению в 20S сердцевину (rev. [Pickart and Cohen, 2004]). Деградация RARs зависит от RA-индуцированного рекрутирования AF-2 домена на ubiquitin и/или аппарат деградации [Kopf et al., 2000]. В определенном случае RARγ субтипа, деградация и убиквитилирование рецепторов зависит от предварительного фосфорилирования NTD [Gianni et al., 2002a; Kopf et al., 2000]. Деградация SRC-3 также зависит от фосфорилирования коактиватора с помощью p38MAPK [Gianni et al., 2006].
Точная роль протеолитической активности протеосом в RAR-обеспечиваемой транскрипции ещё неясна [Bastien and Rochette-Egly, 2004; Bour et al., 2007]. Т.к. деградация RAR и SRC-3 происходит довольно поздно после добавления RA, когда транскрипция уменьшается, согласно радикальной гипотезе, что как и для большинства "activators" транскрипции, протеосомная деградация представляет собой эффективный путь ограничения функции RAR и/или сигнал окончания процесса транскрипции [Tansey, 2001]. Однако согласно вновь возникшей концепции, что динамические обмены корегуляторов необходимы для осуществления транскрипции, протеолиз может служить для очистки от корепрессоров и/или коактиваторов, так чтобы др. корегуляторы могли соединяться последовательно [Collins and Tansey, 2006; Dennis and O'Malley B, 2005; Lipford and Deshaies, 2003]. В согласии с этой темой, два компонента RAR корегуляторных комплексов, TBL1 и TBLR1, как было установлено служат в качестве специфических адапторов для рекрутирования протеосом и деградации корепрессоров, чтобы обеспечить обмен коактиваторов [Perissi et al., 2004; Perissi et al., 2008].
Однако растет число доказательств, что ubiquitin-proteasome система д. также играть роль в контроле RA-обеспечиваемой транскрипции без протеолиза. В этом контексте очевидно, что SUG-1, одна из 6 ATPases в 19S, взаимодействует с RARs [vom Baur et al., 1996] и SRC-3 [Ferry et al., 2009], и в результате рекрутируется на промоторы генов мишеней для RA, внося тем самым вклад в их транскрипцию [Ferry et al., 2009]. Было предположено, что субъединицы ATPase из 19S регуляторного субкомплекса д. раскручивать или снова укладывать компоненты регуляторных транскрипционных комплексов, такие как комплекс SAGA (spt-Ada-Gcn5-acetyl-transferase) [Lee et al., 2005], чтобы облегчить их загрузку и/или удаление с промоторов. Они также перенастраивают конфигурацию локального хроматина, чтобы способствовать рекрутированию соотв. модификаторов гистонов [Ezhkova and Tansey, 2004]. Т.о., протеосомный путь д. контролировать состав комплексов на промоторах генов мишеней для RAR и координировать разные ступени на промоторах в согласии с идеей, что транскрипция является динамичным процессом с постоянным обменом и оборотом корегуляторов [Collins and Tansey, 2006; Muratani and Tansey, 2003; Rochette-Egly, 2005].
A new role for the NTD of RARs via the binding of proteins with WW or SH3 domains
Сайт фосфорилирования NTD принадлежит мотиву, богатому пролином (Figure 2). Очень важно, что такие мотивы связывают белки с SH3 или WW доменами, при этом фосфорилирование или предупреждает или способствует взаимодействию [Kay et al., 2000; Macias et al., 2002; Sudol et al., 2001; Zarrinpar and Lim, 2000]. В согласии с этим фосфорилированные NTD в RARα , как было показано, связывают proline isomerase Pin1 (protein interacting with NIMA (never in mitosis A)) [Brondani et al., 2005; Gianni et al., 2009], WW содержащий белок, который индуцирует цис-транс изомеризацию пролиновых остатков, которые сопровождают фосфорилированные серины, чтобы создать новые специфические сайты распознавания для взаимодействующих факторов [Wulf et al., 2005].
Недавнее исследование, проведенное в нашей лаб. открыло взаимодействие между нефосфорилированным NTD из субтипа RARγ и vinexin β [Bour et al., 2005b], который является одним из актин-связывающих белков, которые присутствуют также в ядрах и модулируют транскрипцию [Bour et al., 2007]. Vinexin β лишен какой-либо ферментативной активности и является адаптором, характеризующимся присутствием трех SH3 доменов [Kioka et al., 2002], с третьим доменом на проксимальной части C-конца, участвующим во взаимодействии с богатым пролином мотивом в RARγ. Т.к. vinexin β является репрессором RARγ-обеспечиваемой транскрипции, то было предположено, что он д. действовать как поддержка между RARγ и ядерными белками, которые взаимодействуют с его двумя остальными SH3 доменами [Mitsushima et al., 2006a; Mitsushima et al., 2006b], потенциально формируя тремерный комплекс, которые поддерживает RARγ в неактивном состоянии [Bour et al., 2007]. Подтверждает эту гипотезу недавное описание прямого взаимодействия между vinexin β и SAFB2 (scaffold attachment factor B2 protein), новым ядерным рецептором корепрессоров [Townson et al., 2003]. Важно, что взаимодействие с vinexin β происходит только тогда, когда сайт фосфорилирования с помощью cdk7 в богатом пролоном мотиве не фосфорилирован [Bour et al., 2005b] и vinexin β высвобождается в ответ на RA (Lalevee and Rochette-Egly, unpublished results). Этот совместный вклад лиганда и cdk7-обеспечиваемого фосфорилирования NTD в диссоциации vinexin β, является предметом активного изучения в нашей лаб.
Недавно др. корегулятор, такой как Acinus-S', ядерный белок, участвующий в апоптической конденсации хроматина и процессинге мРНК, как было показано, взаимодействует с C-терминальной частью NTD, репрессируя тем самым транскрипционную активность RAR [Vucetic et al., 2008]. Однако это взаимодействие использует остатки, отличающиеся от тех, что в богатом пролином мотиве, указывая на иной механизм действия.
Transrepression by RARs (anti-AP1)
Накапливаются доказательства, что действие RARs не ограничивается регуляцией (позитивной или негативной) экспрессии родственных генов мишеней, но также связано с некоторыми др. генными программами путем столкновения с др. ядерными рецепторами [Gupta et al., 2008] или с комплексами транскрипционных факторов, такими как activating protein-1 (AP-1) (for review see [Germain et al., 2003; Lefebvre et al., 2005]). Комплекс AP-1 регулирует экспрессию некоторых генов, участвующих в онкогенной трансформации и клеточной пролиферации. Его активность детерминируется за счет композиции из димеров, которые включают членов fos (c-fos, FosB, Fra-1 and Fra-2) и jun (c-jun, junB and junD) семейств и которые контролируются с помощью сложной сети фосфорилирований. Ингибирование AP-1-управляемой трансактивации с помощью RARs является прототипом транс-репрессии и было выявлен в отношении некоторых генов, таких как ген collagenase и stromelysin [Lafyatis et al., 1990; Lin et al., 2000; Nicholson et al., 1990]. В общем, ингибирование AP-1 управляется за счет связывания лигандом RARs, при этом AP-1 ингибируется независимым от лиганда способом с помощью RARβ субтипа [De-Castro Arce et al., 2007; De-Castro Arce et al., 2004]. Как RARs вмешиваются в активность AP-1 и посредством каких доменов, непонятно, предложено несколько моделей ([Altucci and Gronemeyer, 2001; Lefebvre et al., 2005] and references therein), таких как (i) прямое взаимодействие с членами семейства Jun/Fos, (ii) нарушение димеризации Jun-Fos (iii) конкуренция с рекрутированием общего транскрипционного коактиватора. такого как CBP или (iv) ингибирование JNKs, и предупреждение тем самым зависимой от фосфорилирования активации c-jun [Dedieu and Lefebvre, 2006]. Несмотря на эти модели, молекулярные основы анти-AP-1 активности RARs остаются неизвестными и спорными [Benkoussa et al., 2002; Suzukawa and Colburn, 2002].
В целом, AP-1 ингибирование коррелирует с ингибирующим рост эффектом ретиноидов на опухоли [Karamouzis and Papavassiliou, 2005]. Следовательно, способность RARs ингибировать AP-1-чувствительные гены, по-видимому, является основой для химиопревентивных и химиотерапевтических эффектов RA при лечении гиперпролиферативных болезней [Altucci and Gronemeyer, 2001; Dong et al., 1994; Li et al., 1996]. В этом контексте получены избирательные ретиноиды, которые разъединяют ингибирование активности AP-1 и классическую RARE-зависимую активацию транскрипции [Chen et al., 1995; Fanjul et al., 1994; Resche-Rigon and Gronemeyer, 1998]. Такие соединения являются многообещающими терапевтическими агентами и могут служить ценным инструментом для поиска механизма взаимодействия RAR/AP-1, важность которого для контроля роста и рака установлена.
Conclusion
The well-established function of RARs is to regulate gene expression in the nucleus. In this context, it is clear that switching on RAR transcriptional activity relies on conformational changes induced by ligand binding and on dynamic series of exchanges with coregulatory complexes. However, today there is mounting evidence that RARs have a wider spectrum of biological activities, through nonconventional, nongenomic mechanisms. Indeed, in response to RA, RARs can activate translation, as well as signaling pathways, independently of transcriptional mechanisms. Further work is needed to determine how RARs activate MAPKs and how RAR phosphorylation at the NTD controls the association/dissociation of specific partners with SH3 or WW domains to modulate the transcription of RA target genes. Up to now, only a few proteins have been shown to interact with the NTD of RARs [Bour et al., 2005b; Brondani et al., 2005; Vucetic et al., 2008] and further studies are required to investigate whether the NTDs of the different RAR subtypes can interact with other proteins involved in processes such as mRNA processing and splicing, or are endowed with chaperone or actin-binding activities. As phosphorylation of the RARγ NTD marks the receptor for ubiquitination and proteasomal degradation, ubiquitin ligases might also be interesting candidates. Ultimately, the challenge is to decipher at the molecular level how coregulator exchanges at the NTD cooperate with phosphorylations to modulate transcription.
Finally, given that aberrant retinoid signaling mechanisms have been associated with several diseases [Keriel et al., 2002] or cancers [Neri et al., 2003; Tari et al., 2002], more work is required to understand the molecular pathways that are controlled by RARs, notably those underlying the antiproliferative and anticancer activities of retinoids, with a particular effort on the role of phosphorylation processes. Moreover, in line with the improved use of retinoids in therapy, novel synthetic RAR ligands harboring increased selective properties with little toxicity compared with classical retinoids, will have to be generated. Finally, combination of retinoids with agents targeting kinases [Vitoux et al., 2007] or epigenetic modifications such as HDAC inhibitors [Cras et al., 2007; Egger et al., 2004; Feinberg and Tycko, 2004] are increasingly being sought in order to improve the retinoid response and/or to overcome retinoid resistance.
Сайт создан в системе
uCoz