Аллергическая реакция у RORγ-/- мышей также тяжело нарушена, как показывает изнурительное эозинофильное легочное воспаление и уменьшение CD4+ лимфоцитов и уровня Th2 cytokines/chemokines [Tilley et al., 2007]. OVA сенсибилизированные и неполноценные RORγ-/- животные обнаруживают неожиданное увеличение TNF-α, IL-2, IL-10 и IFN-γ и реципрокное уменьшение IL-4, IL-5 и IL-13. Этот сдвиг в профиле цитокинов в купе со сниженнными уровнями IgG1 и повышенными IgG2c в сыворотке OVA-экспозированных RORγ-/- мышей указывает на критическую роль RORγ в регуляции продукции иммуноглобулинов и балансе между разными популяциями T helper клеток. Сниженная воспалительная реакция у RORγ-/- мышей может быть частично связана в ролью RORγ , выполняемой в детерминации клона Th17 [Ivanov et al., 2006; Ivanov et al., 2007; Yang et al., 2008d].Интересно, что мыши, лишенные IL-17, обнаруживают изнурительное эозинофильное воспаление легких и продукцию Th2 цитокина, тогда как IL-10, который продуцируется Treg клетками, ингибирует аллергическое воспаление [Umemura et al., 2007; Urry et al., 2006]. Юолее того, мыши, дефицитные по IL17 гену, но не по IL17F, также обнаруживают пониженную Th2 реакцию в подобной модели астмы [Yang et al., 2008b]. Т.о., редукция Th17 клеток у RORγ-/- мышей и наблюдаемое увеличение в IFN-γ (Th1) и IL-10 (Treg) у OVA-challenged RORγ-/- мышей согласуется с предположением, что пониженная чувствительность к аллергическому воспалению легких у этих мышей может быть связана со сдвигом в предопределении разных Th клонов. Эта гипотеза согласуется с концепцией, что взаимное общение между клон-специфическими транскрипционными факторами играет важную роль в спецификации клонов.
Circadian rhythms are daily cycles of behavioral and physiological changes that are regulated by endogenous circadian clocks [Hastings et al., 2007; Isojima et al., 2003; Ko and Takahashi, 2006; Liu et al., 2007a; Schibler and Naef, 2005; Schibler and Sassone-Corsi, 2002]. The circadian clock impacts virtually all physiological functions and behavior. It is therefore not surprising that abnormalities in circadian rhythm are implicated in an increasing number of diseases, including sleep and mood disorders, diabetes, obesity, and cancer [Barnard and Nolan, 2008; Gery and Koeffler, 2007; Ishida, 2007; Liu et al., 2007a; Maywood et al., 2006; Turek et al., 2005].
A number of studies have established links between nuclear receptor function and expression, the circadian regulatory circuitry, and the regulation of various physiological processes [Akashi and Takumi, 2005; Duez and Staels, 2008; Guillaumond et al., 2005; Horard et al., 2004; Jetten and Joo, 2006; Liu et al., 2008; Preitner et al., 2003; Ueda et al., 2002b; Yang et al., 2006; Yang et al., 2007a]. Many nuclear receptors, including RORs, display, at least in some tissues, rhythmic patterns of expression during the circadian cycle, indicating that their expression is controlled by the circadian clock. RORα expression shows a weak circadian oscillation in liver, kidney, retina, and lung [Akashi and Takumi, 2005; Kamphuis et al., 2005; Tosini et al., 2007; Ueda et al., 2002b; Yang et al., 2006]. In the SCN, RORγ exhibits a rhythmic pattern of expression with a peak at CT6-8. A similar circadian profile was observed for RORβ, while RORγ is not expressed in the SCN [Schaeren-Wiemers et al., 1997; Sumi et al., 2002; Ueda et al., 2002b]. ROR?2 displays a rhythmic expression pattern in mouse pineal gland and retina, with a maximum at CT18 [Andre et al., 1998a; Ueda et al., 2002b]. RORγ exhibits an oscillatory expression pattern in liver, brown adipose tissue, and kidney, but not in skeletal muscle and thymus [Guillaumond et al., 2005; Jetten and Joo, 2006; Kang et al., 2007; Ueda et al., 2002b; Ueda et al., 2005; Yang et al., 2006]. In these tissues, RORγ is expressed at low levels during the day and at optimum levels at night.
Mice deficient in RORα or RORβ exhibit an aberrant circadian behavior [Akashi and Takumi, 2005; Masana et al., 2007; Sato et al., 2004; Schaeren-Wiemers et al., 1997], while no abnormalities in circadian behavior have been noticed in RORγ-/- mice [Liu et al., 2008]. RORαsg/sg mice display an anomalous, slightly decreased, free-running period of locomotor activity and an altered feeding pattern during the circadian cycle [Akashi and Takumi, 2005; Guastavino et al., 1991; Sato et al., 2004], while RORβ-/- mice display an extended period of free-running rhythmicity under conditions of constant darkness [Andre et al., 1998a; Masana et al., 2007].
Regulation of clock genes by ROREs
Nearly every mammalian cell type contains its own circadian oscillator. The oscillators in peripheral tissues operate in a self-sustained, cell-autonomous manner [Isojima et al., 2003; Ko and Takahashi, 2006; Liu et al., 2007a; Reppert and Weaver, 2001; Reppert and Weaver, 2002; Ripperger and Schibler, 2001; Schibler and Sassone-Corsi, 2002]. Their synchronization is coordinated by signals originating from the master circadian clock residing in the SCN of the anterior hypothalamus. The phase of the master oscillator is set by the light-dark cycle input received by both visual and non-visual photoreceptor systems in the retina.
At the molecular level, the clockwork consists of an integral network of several interlocking negative feedback and positive feedforward loops. The basic molecular circuitry of circadian clocks is analogous between tissues. A major positive loop consists of the basic helix-loop-helix/PAS-type transcriptional activators BMAL1 and CLOCK or its paralog NPAS2, while two cryptochrome (CRY) and three period proteins (PER) are involved in the negative control of the oscillator [Albrecht, 2002; DeBruyne et al., 2007a; DeBruyne et al., 2007b; Isojima et al., 2003; Reppert and Weaver, 2002; Schibler and Naef, 2005; Schibler and Sassone-Corsi, 2002] (Figure 8). BMAL1-CLOCK heterodimers positively regulate the circadian expression of many genes, including PER and CRY, through interaction with E-box enhancers (CACGTG) in the promoter regulatory region of target genes. When PER and CRY proteins accumulate to a critical level, they in turn repress BMAL1:CLOCK-mediated transcription, including their own transcription, by interacting directly with BMAL1-CLOCK complexes. This subsequently leads to reduced levels of PER and CRY protein and to a new cycle of activation and repression.
 Figure 8 RORs function as integrators of circadian oscillators and the rhythmic expression of downstream (metabolic) genes. The rhythmic expression of RORs is greatly dependent on the ROR isoform and tissue type.The core loop of the oscillator consists of the heterodimeric activators BMAL1 and CLOCK that activate the expression of PERs and CRYs. PER and CRY heterodimers interact with the BMAL1-CLOCK complex and negatively regulate their transcriptional activity. BMAL1 and CLOCK also activate the expression of REV-ERBs, which through their interaction with ROREs repress the transcription of several genes, including BMAL1, CRY1, and RORγ . REV-ERBs are critical in the rhythmic expression of BMAL1, CRY1 and RORγ in liver and several other tissues. RORγ does not affect the rhythmic expression, but increases the peak level of expression of BMAL1, CRY1, NPAS2, CLOCK, and REV-ERB?.The major function of RORγ appears to be to regulate the oscillatory pattern of expression of downstream target genes and, therefore, the rhythmic nature of several physiological processes. RORα exhibits a very weak rhythmic pattern of expression in liver and its major function also appears to be in regulating the (rhythmic) expression of downstream target genes. SIRT, through its deacetylase activity, promotes the degradation of PER and inhibits the interaction of CRY with BMAL1/CLOCK complex, thereby enhancing BMAL1/CLOCK transcriptional activity.
Figure 8 RORs function as integrators of circadian oscillators and the rhythmic expression of downstream (metabolic) genes. The rhythmic expression of RORs is greatly dependent on the ROR isoform and tissue type.The core loop of the oscillator consists of the heterodimeric activators BMAL1 and CLOCK that activate the expression of PERs and CRYs. PER and CRY heterodimers interact with the BMAL1-CLOCK complex and negatively regulate their transcriptional activity. BMAL1 and CLOCK also activate the expression of REV-ERBs, which through their interaction with ROREs repress the transcription of several genes, including BMAL1, CRY1, and RORγ . REV-ERBs are critical in the rhythmic expression of BMAL1, CRY1 and RORγ in liver and several other tissues. RORγ does not affect the rhythmic expression, but increases the peak level of expression of BMAL1, CRY1, NPAS2, CLOCK, and REV-ERB?.The major function of RORγ appears to be to regulate the oscillatory pattern of expression of downstream target genes and, therefore, the rhythmic nature of several physiological processes. RORα exhibits a very weak rhythmic pattern of expression in liver and its major function also appears to be in regulating the (rhythmic) expression of downstream target genes. SIRT, through its deacetylase activity, promotes the degradation of PER and inhibits the interaction of CRY with BMAL1/CLOCK complex, thereby enhancing BMAL1/CLOCK transcriptional activity.
The core loop is further regulated by several accessory pathways, including one in which the D box-binding proteins, the activator D site-binding protein (DBP) and the repressor E4 promoter binding-protein 4 (E4BP4 or NFIL3), play a role, and another that involves regulation by RORs and REV-ERBs through ROREs [Burris, 2008; Ko and Takahashi, 2006; Liu et al., 2008; Preitner et al., 2003; Preitner et al., 2002; Ueda et al., 2005]. ROREs have been identified in several clock genes, including BMAL1, CLOCK, and CRY1 [Guillaumond et al., 2005; Kumaki et al., 2008; Nakajima et al., 2004; Preitner et al., 2002; Sato et al., 2004; Ueda et al., 2002b]. The BMAL1 gene, which contains two ROREs in its promoter region, is positively regulated by RORs, whereas REV-ERBs repress BMAL1 transcription (Figure 8). Mutation of these ROREs abolishes the circadian rhythmicity of the BMAL1 promoter activation, indicating that these response elements are essential for rhythmic transcriptional regulation of BMAL1. Further study showed that BMAL1 expression is elevated and its rhythmicity impaired in fibroblasts deficient in both REV-ERBα and β, but fibroblasts deficient in only one of the REV-ERB receptors still retain BMAL1 rhythmicity [Liu et al., 2008]. These observations suggested that REV-ERBα and β are functionally redundant and essential for the rhythmic expression of BMAL1. However, REV-ERBα and β are not required for the rhythmicity of several other clock genes, including PER and CRY.
In contrast to REV-ERBs, RORs are not required for the rhythmicity of BMAL1 expression [Liu et al., 2008]. RORαsg/sg fibroblasts, which lack RORα and do not express either RORβ or γ, display rhythmic oscillations of BMAL1 or PER2 promoter-regulated luciferase reporter expression that are similar to that observed in WT fibroblasts. These findings are in agreement with studies showing that the rhythmic expression of various clock proteins, including PER2, CRY1, BMAL1, and CLOCK, was not altered in RORαsg/sg or RORγ null mice [Liu et al., 2008; Sato et al., 2004]. However, the peak expression levels of BMAL1, as well as that of several other RORE-containing clock genes, including CLOCK, CRY1, and NPAS2, were reduced in both RORαsg/sg and RORγ null mice, while those of PER2 and DBP were not changed. Regulation of BMAL1 by RORs is supported by findings showing that RORs interact with ROREs in the BMAL1 promoter and induce transcriptional activation through this promoter region [Akashi and Takumi, 2005; Guillaumond et al., 2005; Sato et al., 2004; Ueda et al., 2005]. This activation of BMAL1 expression by RORs appears to be mediated through the coactivator PGC-1α [Liu et al., 2007b]. Thus, RORs are not essential for the rhythmic expression of BMAL1 or other clock genes, but do regulate their level of expression. Moreover, in contrast to common regulators of the circadian clock, which appear to be ubiquitously expressed, RORs exhibit a much more restricted pattern of expression, consistent with the view that they are not common constituents of clock regulatory circuitry mechanisms. In addition to modulating the expression of several components of the circadian clock, the major function of RORs might be regulating the rhythmic expression of downstream target genes. Therefore, RORs may function as intermediates that couple the circadian oscillators with the cyclic control of various physiological processes, including energy homeostasis, lipid, and xenobiotic metabolism [Kang et al., 2007; Liu et al., 2008; Sato et al., 2004] (Figure 8).
Regulation of circadian expression of RORs
Как упоминалось выше, в некоторых тканях RORs обнаруживают ритмическую экспрессию во время циркадного цикла [Liu et al., 2008; Panda et al., 2002; Sato et al., 2004; Ueda et al., 2002b; Ueda et al., 2005; Ukai-Tadenuma et al., 2008]. Идентифицированы некоторые функциональные элементы, имеющие отношение к циркадному ритму, в промоторах RORs. Функциональные D-boxes были идентифицированы в RORα и RORβ, предположительно для регуляции с помощью членов семейства bZIP. Проксимальный промотор RORγ1 и RORα1 содержат по одному функциональному E-box, тогда как таковой в RORα4 содержит два E-boxes, это указывает на регуляцию с помощью BMAL1/CLOCK. Исходя из присутствия функциональных ROREs в промоторных регионах RORs, было предположено, что их экспрессия может контролироваться с помощью REV-ERBs белков. Наблюдение, что в печени и некоторых др. тканях экспрессия RORγ1 и REV-ERBs связаны обратно пропорционально, согласуется с мнением, что REV-ERBs действуют как репрессоры транскрипции RORγ1 и регулируют ритмичность экспрессии RORγ1 ('repressor-antiphasic-to-activator' механизм) [Liu et al., 2008; Ueda et al., 2005; Ukai-Tadenuma et al., 2008]. RORγ1, по-видимому, играет минимальную роль в контроле транскрипции REV-ERBs, поскольку их экспрессия лишь слегка затрагивается в печени in liver from RORγ null mice. Анализ экспрессии мРНК RORγ1 в печени BMAL1-/- мышей показал, что ритмичность экспрессии RORγ1 почти целиком устраняется и что экспрессия RORγ1 на всех CTs сильно увеличена [Grechez-Cassiau et al., 2008; Liu et al., 2008]. Следовательно, по крайней мере, в печени потеря экспрессии репрессора REV-ERB обнаруживается у BMAL1-/- мышей скорее всего ответственен за отсутствие ритмичности и уменьшенную или увеличенную экспрессию RORγ1 у этих мышей [Liu et al., 2008]. Экспресия была особенно повышенной во время CT6-8, время, когда REV-ERB обычно экспрессируется на высоком уровне. Как же транскрипция RORγ1 активируется в печени BMAL1-/- mice? Было предположено, что экспрессия RORs может управляться с помощью не-циркадных, тонических сигналов, таких как путь cAMP:cAMP response element-binding (CREB) [Liu et al., 2007a; Liu et al., 2008; O'Neill et al., 2008].
SIRT1 and RORγ expression
Посттрансляционные модификации, включая фосфорилирование с помощью casein kinases и др. киназ и ацетилирование. играют критическую роль в регуляции межбелковых взаимодействий, ядерной локализации, транскрипционной активности и оборота clock белков [Eide et al., 2005; Gallego and Virshup, 2007; Ko and Takahashi, 2006; Ripperger and Schibler, 2001]. CLOCK, который функционирует как histone acetyltransferase, участвует в ремоделировании хроматина во время циркадного ритма [Doi et al., 2006]. Помимо гистонов, CLOCK также ацетилирует др. белки, включая BMAL1 [Hirayama et al., 2007]. Недавно sirtuin 1 (SIRT1), NAD+-зависимая deacetylase, была идентифицирована как важный регулятор экспрессии циркадных генов. Было предположено, что он обеспечивает функциональную связь между метаболической активностью и циркадным контролем [Asher et al., 2008; Belden and Dunlap, 2008; Nakahata et al., 2008]. SIRT1 деацилирует гистоны и ряд транскрипционных регуляторов и связывает BMAL1-CLOCK-PER2 комплексы circadian-зависимым способом. SIRT1 катализирует деацетилирование PER2, облегчая тем самым его деградацию с помощью протеосомной системы. Поэтому отсутствие экспрессии SIRT1 ведет к высоким уровням PER2, приводя к уменьшению транскрипционной активности BMAL1-CLOCK и репрессии clock-контролируемых генов мишеней, включая пониженную экспрессию PER2 и CRY1 (Figure 8). Кроме того, SIRT1 индуцирует деацетилирование BMAL1 по Lys537, это редуцирует эффективность CRY взаимодействовать с и замалчивать CLOCK-BMAL1 [Nakahata et al., 2008]. Хотя RORγ1 экспрессируется на низких уровнях в эмбриональных фибробластах мышей (MEFs), его экспрессия значительно уменьшается в SIRT1 KO MEFs. Поскольку экспрессия RORγ1 позитивно регулируется с помощью BMAL1-CLOCK, то его экспрессия в SIRT1 KO MEFs может быть связана с замалчиванием активности BMAL1-CLOCK. Напротив, подавление RORγ1 в SIRT1 KO MEFs может, по крайней мере, частично объяснить пониженную экспрессию BMAL1, наблюдаемую в этих клетках.
Становится всё яснее, что SIRT1 действует как связь между circuitry циркадного ритма, клеточным метаболизмом и ядерными рецепторами, включая и RORs [Asher et al., 2008; Nakahata et al., 2008; Schwer and Verdin, 2008]. Одна такая связь затрагивает PGC-1α. SIRT1, как сообщалось, индуцирует деацетилирование и активацию PGC-1α, который действует как коактиватор некоторых ядерных рецепторов [Rodgers et al., 2008]. Это вместе с регуляцией циркадного ритма экспрессии ядерных рецепторов, является частью сложного механизма, с помощью которого ядерные рецепторы регулируют клеточный метаболизм. Интересно отметить, что пик активности SIRT1 приходится примерно на то же самое время, что и экспрессия мРНК RORγ1 (на CT16).
RORs and cellular metabolism
Changes in lipid metabolism and ROR-deficient mice
Накапливаются доказательства. указывающие, что RORs играют важную роль в регуляции нескольких метаболических путей, особенно липидного и стероидного метаболизма [Boukhtouche et al., 2004; Duez and Staels, 2008; Genoux et al., 2005; Jetten, 2004; Jetten and Joo, 2006; Kang et al., 2007; Lau et al., 2008; Lau et al., 2004; Lind et al., 2005; Mamontova et al., 1998; Raichur et al., 2007; Raspe et al., 2001; Vu-Dac et al., 1997; Wada et al., 2008a; Wada et al., 2008b]. RORαsg/sg мыши при нормальной диете обнаруживают выраженную hypo-α-lipoproteinemia и имеют более низкие уровни общего холестерола, high density lipoprotein (HDL), ApoA1, основных составляющих HDL, ApoC3, ApoA2, и триглицеридов в плазме по сравнению с WT мышами. Пониженная экспрессия обратных транспортеров холестерола ABCA1 и ABCA8/G1 в печени иApoA1 в кишечнике могут быть частично ответственны за пониженные уровни HDL. Идентифицированы функциональные ROREs в промоторных регуляторных регионах APOC2 и APOA1 [Raspe et al., 2001; Vu-Dac et al., 1997]. RORE в APOA1 промоторе взаимодействуют избирательно с RORα1, но не с RORα2 или α3. Хотя ApoA5 человека был идентифицирован как ген мишень для RORα ? его экспрессия не менялась в печени RORαsg/sg мышей [Genoux et al., 2005; Lind et al., 2005]. После старения, RORαsg/sg мыши менее чувствительны к развитию печеночного steatosis, чем WT мыши [Lau et al., 2008]. Кроме того, несмотря на их высокое потребление пищи старые RORαsg/sg мыши обладают пониженным индексом жира в теле. Жировые клетки в коричневой и белой жировой ткани меньше и уровень триглицеридов ниже в печени RORαsg/sg мышей, чем WT мышей. Повышенное потребление пищи коррелирует с наблюдаемым снижением экспрессии leptin. Как наблюдается для старых RORαsg/sg mice, 2-3 мес. RORαsg/sg мыши менее чувствительны к ожирению и steatosis, индуцируемых высоким содержанием жира в пище [Lau et al., 2008].
В противовес RORαsg/sg мышам, уровни холестерола и триглицеридов остаются неизменными у RORγ-/- мышей; , однако эти мыши обнаруживают снижение до некоторой степени уровней глюкозы в крови [Kang et al., 2007]. Мыши, дефицитные по RORα и RORγ (DKO) обнаруживают сходные изменения холестерола и триглицеридов и глюкозы, как это наблюдается и у одиночных KO мышей. Сравнение профилей экспрессии генов из печени WT, RORα-deficient, RORγ-дефицитных и DKO мышей, указывает, что RORα and RORγ могут функционировать как позитивные и негативные регуляторы генной экспресси. Помимо регуляции экспрессии разных наборов генов, выявлены уникальные регуляторные функции, некоторые гены лишь позитивно- или негативно регулируются у DKO мышей, указывая на определенную степень функциональной перекрываемости degree между RORα and RORγ [Kang et al., 2007]. Последнее скорее всего связано с их сходством в сродстве связывания RORE. Однако основные функции RORα и RORγ по-видимому, различны.
RORs in the regulation of (lipid) metabolism
Эффект RORα на гомеостаз триглицеридов может быть обусловлен изменениями в регуляции ряда генов, включая те, что вовлечены в контроль липогенеза и окисления жирных кислот. Экспрессия sterol regulatory element-binding protein 1, изоформы c (SREBP1c), которая является критическим регулятором липогенеза, и некоторых липогенных генов, существенно снижена в печени и скелетных мышцах мышей RORαsg/sg [Lau et al., 2008; Wada et al., 2008a]. Это ассоциирует с супрессией некоторых генов мишеней для SREBP1c, включая fatty acid synthase (FAS). LXRs и carbohydrate response element-binding protein (ChREBP) считаются критическими факторами в регуляции SREBP1c [Cha and Repa, 2007; Pegorier et al., 2004; Wagner et al., 2003]. Однако экспрессия LXRs и ChREBP не изменяется существенно в печени RORαsg/sg vsitq. ChIP и промоторный анализ показали, что транскрипция SREBP1c находится под избирательным контролем RORα4, превалирующей изоформы RORα в печени [Lau et al., 2008]. Был сделан вывод, что RORα позитивно регулирует липогенез за счет увеличения экспрессии SREBP1c. Последнее может , по крайней мере, частично объяснить снижение тучности у RORαsg/sg мышей.
Экспрессия estrogen-related receptor α (ERRα) и peroxisome proliferators-activated receptors (PPARs) α, β, и γ, которые участвуют и в контроле липидного гомеостаза, не изменены у RORαsg/sg мышей [Desvergne et al., 2006; Tremblay and Giguere, 2007]. Однако экспрессия коактиваторов PGC-1α и β, которые участвуют в регуляции оксидативного метаболизма и глюкогенеза, была повышена в печени и коричневой жировой ткани, соотв. [Liu et al., 2008]. Экспрессия lipin 1, который выполняет множественные функции в липидном метаболизме и гомеостазе глюкозы в некоторых тканях, увеличена в печени и жировой ткани RORαsg/sg мышей [Lau et al., 2008]. Потеря функции lipin 1 ведет к печеночному steatosis и hypertriglyceridemia, но редуцирует печеночную ткань [Peterfy et al., 2001]. Lipin 1 взаимодействует непосредственно с ядерным рецептором PPAR-1α и коактиватором PGC-1α в комплексе, который модулирует экспрессии гена окисления жирных кислот в гепатоцитах [Finck et al., 2006]. Т.о., повышенные уровни PGC-1 и lipin 1 в RORαsg/sg печени могут усиливать метаболизм окисления и объясняют повышенную экспрессию acyl-coenzyme A dehydrogenase ACADM. Однако экспрессия carnitine palmitoyltransferases 1A и 1B (CPT1A/B), которые участвуют также в окислении жирных кислот, затрагивается незначительно в печени RORαsg/sg мышей. Необходимы дальнейшие исследования, чтобы понять сложные взаимоотношения между RORα, его регуляцией липидного метаболизма и его эффектами на тучность и уровни триглицеридов.
Regulation of CYP7b1 and sulfotransferases
Некоторые гены, регулируемые с помощью RORs кодируют белки, участвующие в Phase I и II энзимах, которые важны для метаболизма xenobiotics, лекарств, средовых химикалий и различных эндогенных соединений, включая стеролы и желчные кислоты [Kang et al., 2007; Wada et al., 2008a]. Эти энзимы играют важную роль в элиминации и детоксификации эндогенных и экзогенных соединений. Один из генов, регулируемый с помощью RORs это oxysterol 7alpha-hydroxylase (Cyp7b1), который играет роль в альтернативном пути метаболизма холестерола, тогда как экспрессия Cyp7a1 и Cyp27, которые играют роль в основном метаболическом пути холестерола, не затрагиваются у ROR-дефицитных мышей. Cyp7b1, который преимущественно экспрессируется в печени самцов мышей, подавляется у RORαsg/sg мышей и затрагивается лишь в незначительной степени у RORγ-/- мышей [Kang et al., 2007; Wada et al., 2008a]. RORα регулирует экспрессию Cyp7b1 непосредственно путем связывания RORE в nt -951 в промоторной регуляторной области гена Cyp7b1. Этот RORE преимущественно соединяется с RORα скорее, чем с RORγ. Эти наблюдения указывают на то, что RORα функционирует как позитивный модулятор экспресси Cyp7b1. Недавние исследования идентифицировали CYP2C8, который играет важную роль в метаболизме лекарств, в качестве предположительно гена мишени для ROR в гепатоцитах человека [Chen et al., 2009]. И RORα и RORγ были способны усиливать активацию посредством RORE в промоторе CYP2C8 и усиливать экспрессию CYP2C8 в первичных гепатоцитах человека.
Sulfotransferase 1e1 (Sult1e1) находится среди генов, наиболее драматически индуцируемых в печени RORαsg/sg мышей, тогда как экспрессия изменяется незначительно у RORγ-/- мышей, указывая тем самым, что она находится под селективным контролем пути передачи сигналов RORα [Kang et al., 2007]. Экспрессия Sult1e1 в печени ограничена самками мышей. Она катализирует sulfonation эстрогена и estrone, увеличивая тем самым их растворимость и облегчая их транспорт и экскрецию [Duanmu et al., 2006]. Экспрессия Sult2a1 индуцируется в печени и RORαsg/sg и RORγ-/- мышей, указывая, что и RORα и RORγ действуют как негативные модуляторы экспрессии Sult2a1. Она катализирует sulfonation проканцерогенов, ксенобиотиков, гидроксистеролов и желчных кислот, включая dehydroepiandrosterone и lithocholic кислоту [Kitada et al., 2003]. В дополнение к этим sulfotransferases, экспрессия некоторых членов семейства hydroxysteroid dehydrogenase, многие из которых участвуют в биосинтезе или инактивации стероидных гормонов, регулируются с помощью RORs [Kang et al., 2007]. Эти наблюдения указывают на то, что RORs и особенно RORα, играют важную роль в регуляции специфических ступеней метаболизма желчных кислот и стероидов. Контроль некоторых sulfotransferases с помощью RORα интересен в отноршении сообщений, показавших, что cholesterol sulfate действует в качестве лиганда для RORα [Kallen et al., 2004; Kallen et al., 2002]. Возможно и др. сульфатированные стероиды или метаболиты холестерола могут действовать как лиганды высокого сродства для RORα и являются частью регуляторной петли обратной связи, которая контролирует специфические ступени метаболизма стероидов и холестерола.
Некоторые метаболические гены, регулируемые с помощью RORs описаны в качестве генов мишеней для др. ядерных рецепторов [Akiyama and Gonzalez, 2003; Kalaany and Mangelsdorf, 2006; Kliewer, 2003; Qatanani and Moore, 2005; Runge-Morris and Kocarek, 2005]. Напр., экспрессия Sult2a1 регулируется несколькими рецепторами, включая constitutive androstane receptor (CAR), hepatocyte nuclear factor 4α (HNF4α) и pregnane X receptor (PXR) [Fang et al., 2007; Maglich et al., 2004]. Перекрывание между генами, регулируемыми с помощью RORα и liver X receptors (LXRs) особенно впечатляет [Gong et al., 2007; Wada et al., 2008b]. CD36, Sult1e1 и Sult2a1 индуцируются. тогда как экспрессия Cyp7b1 ингибируется с помощью активированного LXR, паттерн, который обратен наблюдаемому для RORα [Kang et al., 2007; Wada et al., 2008a; Wada et al., 2008b]. Это открывает возможность потенциально взаимодействия между путями RORα и LXR. Однако этого взаимодействия не происходит на уровне регуляции экспрессии LXR или ROR, поскольку экспрессия LXRα и β не меняется в печени RORαsg/sg мышей,тогда как экспрессия RORα остается неизменной в печени LXR DKO мышей [Lau et al., 2008; Wada et al., 2008a]. Хотя в культивируемых клетках наблюдается конкуренция между LXR и RORα за связывание общих коактиваторов, неясно, играет ли эта конкуренция физиологически важную роль. In vivo, противоположная регуляция общих мишеней с помощью RORα и LXR может использовать несколько механизмов, включая взаимодействие между ROR и LXR транскрипционными комплексами, связанными со своими соотв. чувствительными элементами в промоторе одного и того же гена мишени.
RORs and muscle
RORα и RORγ vHYR экспрессируется на высоком уровне в скелетных мышцах, указывая на регуляторную роль этих рецепторов в миогенезе или в функции мышц [Becker-Andre et al., 1993; Hirose et al., 1994; Lau et al., 1999]. Это подтверждается наблюдениями, показывающими, что RORαsg/sg мыши обнаруживают мышечную атрофию; , однако механизм, лежащий в основе этого фенотипа, четко не идентифицирован. C2C12 клетки скелетных мышц были использованы для проверки функции RORα и RORγ в миогенезе и липидном гомеостазе. Экспрессия доминантно-негативного RORα, лишенного LBD, задерживает морфологическую дифференцировку мышечных трубок и индукцию мышце-специфических генов, таких как helix-loop-helix транскрипционные факторы MyoD и myogenin, транскрипционные факторы, которые являются критическими для дифференцировки мышечных трубок [Lau et al., 1999]. Кроме того, экспрессия fatty acid translocase (FAT/CD36) и fatty acid binding protein 3 (FABP3), которые участвуют в потреблении липидов и жирных кислот, и lipoprotein lipase (LPL), CPT-1 и acyl-CoA-synthetase-4 (ACS4), участвующих в гидролизе и гидроксилировании триглицеридов, соотв., была снижена в этих клетках [Lau et al., 2004]. Экспрессия RORγ в C2C12 в клетках увеличивает экспрессию некоторых генов, включая CD36, FABP4, LPL, UCP3, fructose transporter GLUT5, adiponectin receptor 2 (ADPR2) и IL-15, указывая тем самым на роль RORγ в регуляции липидного метаболизма в мышцах [Raichur et al., 2007].
RORs and cancer
RORs and increased cancer susceptibility
Ряд исследований предоставил доказательства роли RORs при раке. Мыши, дефицитные по экспрессии RORγ обнаруживают высокий показатель тимусных лимфом, которые часто метастазируют в печень и селезенку [Jetten and Ueda, 2002; Ueda et al., 2002a]. В результате продолжительность жизни RORγ нулевых мышей сильно снижена. iПовышенное образование лимфом может быть связано с изменениями в гомеостазе тимуса, наблюдаемым у RORγ KO мышей [Kurebayashi et al., 2000; Sun et al., 2000]. Хотя молекулярный механизм. лежащий в основе усиленного образования лимфом ещё не установлен, он может быть связан с дерегуляцией дифференцировки и пролиферации в RORγ-/- тимоцитах. Интересно, что type B leukemogenic virus (TBLV), который вызывает T-клеточные лимфомы у мышей, часто обнаруживатся интегрированным на локусе RORγ [Broussard et al., 2004]. Однако в противоположность RORγ нулевым мышам экспрессия RORγ позитивно коррелирует с лимфомами. Участвует ли RORγ в лимфомах человека, пока неясно.
Др. потенциальная связь между RORγ и раком выявляется в исследованиях, показавших, что повышенная экспрессия Th17-ассоциированных генов, включая RORγ, IL-17 и IL-23, в опухолях желудка, возрастает в популяции циркулирующих Th17 клеток у пациентов с раком желудка [Zhang et al., 2008a], и высокий показатель Th17 клеток наблюдается в местах рака яичников [Miyahara et al., 2008]. Эти повышенные уровни провоспалительных цитокинов могут вносить вклад в патогенез рака. Альтерации в экспрессии или активности RORγt могут вызывать изменения в популяции Th17 клеток и в продукции провоспалительных цитокинов, влияя тем самым позитивно или негативно на прогрессирование рака.
Хотя нет явных связей между RORα и раком, в ряде исследований указывается на возможную роль RORα в развитии рака. Ген RORα занимает геномную область в 730 kb, которая расположена в средине ломкого сайта FRA15A в хромосомном диске 15q22.2 [Smith et al., 2006; Zhu et al., 2006]. Общие фрагильные сайты являются очень нестабильными регионами генома, обнаруживаемыми у всех индивидов, и являются они горячими точками для возникновения делеций и др. генетических альтераций, которые могут приводить к изменению экспрессии и функции генов, колируемых этими регионами. Общие ломкие сайты участвуют в некоторых заболеваниях человека и ассоциированы с рядом разных типов раковых опухолей [Smith et al., 2006]. Геномная нестабильность в FRA15A может приводить к изменениям экспресси RORα и играет роль в развитии определенных раковых опухолей. Эта гипотеза согласуется с наблюдениями, показавшими, что экспрессия мРНК RORa;часто подавлена в опухолевых клеточных линиях и первичных выборках раковых опухолей[Zhu et al., 2006]. Более того, исследования профилей генной экспрессии в разных раковых опухолях идентифицировали RORα в качестве гена обычно подавляемого в некоторых типах опухолей, особенно при раке груди и легких [Lu et al., 2007]. Анализ статуса метилирования ряда генов идентифицировал RORα в качестве одного из замалчиваемых за счет метилирования генов в линии клеток из рака желудка [Yamashita et al., 2006]. Последнее согласуется с концепцией, что пониженная экспрессия RORα позитивно скоррелирована с образованием опухолей.
RORs, hypoxia and stress
Некоторые исследования выявили связь между экспрессией RORα и гипоксией. Гипоксия важна в нормальной физиологии и при некоторых патологиях, включая ишемию, инсульты, сердечные атаки, хронические болезни почек и прогрессирование раковых опухолей [Pouyssegur et al., 2006; Semenza, 2000]. Восприятие кислорода является ключевым контрольным механизмом васкулогенеза и роста опухолей. Гипоксия запускает многочисленные клеточные реакции, в которых транскрипционный фактор hypoxia-inducible factor HIF-1α играет центральную роль. Некоторые исследования сообщают, что экспрессия RORα4, но не RORα1, индуцируется на высоком уровне в условиях гипоксии в разных типах клеток [Besnard et al., 2002; Chauvet et al., 2004; Chauvet et al., 2002; Miki et al., 2004]. Условия, которые воспроизводят эффекты гипоксии, включая воздействие cobalt chloride и iron chelator, desferrioxamine, также увеличивают и экспрессию RORα4 [Chauvet et al., 2002]. Помимо гипоксии некоторые др. стрессы индуцируют экспрессию RORα4, включая H2O2 и некоторые индукторы стрессов endoplasmic reticulum (ER) , включая farnesol, thapsigargin, tunicamycin и brefeldin [Joo et al., 2007; Zhu et al., 2006]. Эти наблюдения указывают на регуляторную роль RORα4 в реакции на гипоксию и стрессы. Исследования in vivo продемонстрировали, что ишемией вызываемый ангиогенез усиливается у RORα-дефицитных мышей [Besnard et al., 2001]. Эти наблюдения указывают на то, что RORα действует как важный негативный модулятор ангиогенеза. Ангиогенез контролируется с помощью про- и анти-ангиогенных факторов. Воспалительные клетки и цитокины также участвуют в регуляции ангиогенеза. Т.о., изменения в экспрессии про- и анти-ангиогенных или воспалительных генов у RORαsg/sg мышей могут объяснить наблюдаемое усиление ангиогенеза. Экспрессия про-ангиогенного vascular endothelial growth factor (VEGF) не изменяется при индуцированном ишемией ангиогенезе у RORαsg/sg мышей; , однако уровень interleukin 12 (IL-12), анти-ангиогенного цитокина, снижен.
Индукция экспрессии RORα4 с помощью гипоксии опосредуется через HIF-1α благодаря взаимодействию с hypoxia response element (HRE) в проксимальной части промоторного региона RORα4 [Chauvet et al., 2004]. Последующие исследования показали, что активация RORα4 с помощью гипоксии зависит от взаимодействия между HIF-1α и транскрипционными факторами Sp1/Sp3, связанными с GC-богатой последовательностью рядом с HRE [Miki et al., 2004]. Недавно было показано, что экзогенная экспрессия RORα повышает уровень белков HIF1α и VEGF, тогда как нокдаун экспрессии RORα с помощью siRNAs снижал экспрессию HIF1α и VEGF [Kim et al., 2008]. Более того, RORα усиливал образование капиллярных трубок с помощью эндотелиальных клеток пупочной вены человека. Эти наблюдения указывают на то, что RORα может действовать как усилитель HIF1α- опосредованной реакции на гипоксию. RORα стимулировал и hypoxia response element (HRE)-зависимую активацию транскрипции репортера. Усиление HIF1α-опосредованной трансактивации с помощью RORα увеличивает стабильность белка HIF-1α и влияет на непосредственное взаимодействие между HIF-1α и DBD в RORα [Kim et al., 2008]. Некоторые эксперименты этого исследования базировались на активации RORα с помощью melatonin, довольно противоречивым предполагаемым лигандом RORα. Т.о., необходимы дополнительные исследования роль RORα и melatonin при гипоксии.
RORα1 and RORγ1 участвуют и в др. регуляторных функциях, связанных со стрессами. RORα1 обеспечивает защиту от апоптоза, индуцируемого оксидативным стрессом в кортикальных нейронах за счет увеличения экспрессии антиоксидантных белков glutathione peroxidase 1 (GPX1) и peroxiredoxin 6 (Prx6), редуцируя тем самым накопление связанных со стрессом reactive oxygen species (ROS) [Boukhtouche et al., 2006b]. Эктопическая экспрессия RORγ в C2C12 клетках усиливала экспрессию UCP3 и снижала продукцию ROS [Raichur et al., 2007]. Идентификация генов, регулируемых с помощью RORα может пролить свет на его точную роль в реакциях на гипоксию и стрессы.
Summary
Recent studies of RORs have greatly widened our understanding of the physiological roles of this nuclear receptor subfamily and provided exciting clues about their critical functions in embryonic development, cellular differentiation and proliferation, immunity, cellular metabolism, and circadian rhythm. The rhythmic pattern of expression of RORs in certain tissues and the regulation of several components of the circadian clock and metabolic pathways by RORs are consistent with the emerging view that the controls of these processes are coupled. RORs function as a subcomponent of the circadian oscillator and integrate the control of the circadian clocks and the rhythmic pattern of expression of (metabolic) genes and, as such, regulate the cyclic nature of several physiological processes, including energy homeostasis, lipid and xenobiotic metabolism. The reduced susceptibility of ROR?-deficient mice to hepatic steatosis and obesity suggests a role for ROR? in energy homeostasis. The critical regulatory roles that RORs have in thymopoiesis, development of several secondary lymphoid tissues, and Th17 lineage specification are highly relevant to a variety of immune responses and inflammatory disorders, including autoimmune diseases and asthma. The greatly decreased susceptibility to allergic airway inflammation, experimental autoimmune encephalomyelitis, and colitis in ROR-deficient mice raises the possibility that RORs might serve as potential novel targets for chemotherapeutic strategies to intervene in these disease processes. The discovery that ROR activity can be modulated by ligands strongly supports this prospect. Hopefully, the next decade will see the discovery of ROR-specific, clinically-useful (ant)agonists.
Сайт создан в системе
uCoz
 Figure 2
Mechanism of action of RORs, physiological functions and roles in disease. RORs bind as a monomer to ROREs consisting of the GGTCA consensus core motif preceded by a 6A/T rich region. REV-ERBs can compete with RORs for binding to ROREs. RORs interact with coactivators or corepressors to positively or negatively regulate gene transcription. RORs are critical in the regulation of many physiological processes and may have a role in several pathologies. Although evidence has been provided indicating that certain ligands can modulate ROR transcriptional activity, whether ROR activity is modulated in vivo by endogenous ligands has yet to be determined. RORs might serve as potential novel targets for chemotherapeutic strategies to intervene in various disease processes.
Figure 2
Mechanism of action of RORs, physiological functions and roles in disease. RORs bind as a monomer to ROREs consisting of the GGTCA consensus core motif preceded by a 6A/T rich region. REV-ERBs can compete with RORs for binding to ROREs. RORs interact with coactivators or corepressors to positively or negatively regulate gene transcription. RORs are critical in the regulation of many physiological processes and may have a role in several pathologies. Although evidence has been provided indicating that certain ligands can modulate ROR transcriptional activity, whether ROR activity is modulated in vivo by endogenous ligands has yet to be determined. RORs might serve as potential novel targets for chemotherapeutic strategies to intervene in various disease processes.  Figure 3
Regulation of Purkinje cell maturation and cerebellar development by RORα. RORα regulates the expression of several genes in Purkinje cells. ROR? becomes highly expressed in postmitotic Purkinje cells. It regulates their maturation, particularly dendritic differentiation. Dendritogenesis and the expression of several genes, including Shh, Itpr1, Pcp4, Calb1, Pcp2, and Slc1a6, normally expressed in mature Purkinje cells, are inhibited in ROR? -deficient mice.The transcription of several of these genes is under direct control of ROR? . Shh released by Purkinje cells interacts with Patched (Ptch) receptors on granule cell precursors, leading to activation of GLI transcription factors and the subsequent induction of proliferation-promoting genes. Reduced Shh expression in Purkinje cells from ROR?-deficient mice is a major factor in the cerebellar atrophy observed in these mice. Cerebellar granule cells and Purkinje cells mutually interact (e.g., glutamatergic synapses).
Figure 3
Regulation of Purkinje cell maturation and cerebellar development by RORα. RORα regulates the expression of several genes in Purkinje cells. ROR? becomes highly expressed in postmitotic Purkinje cells. It regulates their maturation, particularly dendritic differentiation. Dendritogenesis and the expression of several genes, including Shh, Itpr1, Pcp4, Calb1, Pcp2, and Slc1a6, normally expressed in mature Purkinje cells, are inhibited in ROR? -deficient mice.The transcription of several of these genes is under direct control of ROR? . Shh released by Purkinje cells interacts with Patched (Ptch) receptors on granule cell precursors, leading to activation of GLI transcription factors and the subsequent induction of proliferation-promoting genes. Reduced Shh expression in Purkinje cells from ROR?-deficient mice is a major factor in the cerebellar atrophy observed in these mice. Cerebellar granule cells and Purkinje cells mutually interact (e.g., glutamatergic synapses).
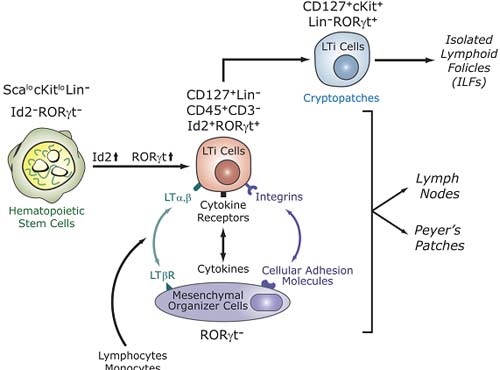 Figure 4. RORγ t is essential for the development of secondary lymphoid tissues. Lymphoid tissue inducer (LTi) cells are derived from fetal liver hematopoietic stem cells.This differentiation is accompanied by induction of the transcription factors Id2 and RORγ t. LTi cells are recruited from the circulation by mesenchymal organizer cells.This is mediated by multiple receptor-ligand interactions. LTi cells are required for the development of lymph nodes, Peyer' s patches, cryptopatches, and isolated lymphoid follicles (ILFs), which are thought to be derived from cryptopatches after the colonization of the intestine by bacteria. Recently, a novel lymphocyte population (NKp46 +int NK1.1 CD127+ RORγ t hi) was identified in the gut that may be derived from LTi-like cells in cryptopatches. RORγ t is required for the generation and/or survival of LTi cells.The absence of LTi cells in RORγ-deficient mice is responsible for the lack of lymph nodes, Peyer' s patches, cryptopatches, ILFs, and NKp46 +NK1.1
int CD127+ RORγ t hi cells.
Figure 4. RORγ t is essential for the development of secondary lymphoid tissues. Lymphoid tissue inducer (LTi) cells are derived from fetal liver hematopoietic stem cells.This differentiation is accompanied by induction of the transcription factors Id2 and RORγ t. LTi cells are recruited from the circulation by mesenchymal organizer cells.This is mediated by multiple receptor-ligand interactions. LTi cells are required for the development of lymph nodes, Peyer' s patches, cryptopatches, and isolated lymphoid follicles (ILFs), which are thought to be derived from cryptopatches after the colonization of the intestine by bacteria. Recently, a novel lymphocyte population (NKp46 +int NK1.1 CD127+ RORγ t hi) was identified in the gut that may be derived from LTi-like cells in cryptopatches. RORγ t is required for the generation and/or survival of LTi cells.The absence of LTi cells in RORγ-deficient mice is responsible for the lack of lymph nodes, Peyer' s patches, cryptopatches, ILFs, and NKp46 +NK1.1
int CD127+ RORγ t hi cells. 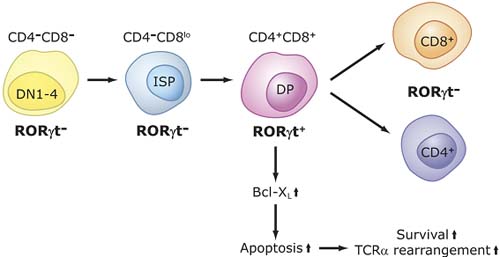 Figure 5. Role of RORγ t in thymopoiesis. CD4- CD8- CD25- CD44+ (DN1) cells differentiate via DN2, DN3, DN4 into immature single positive (ISP) cells (CD3- CD4- CD8low).These cells subsequently differentiate into CD3+ CD4+ CD8+ , DP thymocytes. RORγ t, as well as Bcl-X L , are induced during the ISP-DP transition and again down-regulated during the differentiation of DP into CD4+ and CD8+ single positive cells. RORγ t promotes the differentiation of ISP into DP cells and positively regulates the expression of the anti-apoptotic gene Bcl-XL .The latter enhances cell survival that subsequently promotes TCR rearrangements. Lack of RORγ t expression inhibits the ISP-DP transition and reduces expression of Bcl-X L in DP thymocytes.The latter results in accelerated apoptosis, reduced lifespan of DP thymocytes and, consequently, impaired TCRα rearrangements.
Figure 5. Role of RORγ t in thymopoiesis. CD4- CD8- CD25- CD44+ (DN1) cells differentiate via DN2, DN3, DN4 into immature single positive (ISP) cells (CD3- CD4- CD8low).These cells subsequently differentiate into CD3+ CD4+ CD8+ , DP thymocytes. RORγ t, as well as Bcl-X L , are induced during the ISP-DP transition and again down-regulated during the differentiation of DP into CD4+ and CD8+ single positive cells. RORγ t promotes the differentiation of ISP into DP cells and positively regulates the expression of the anti-apoptotic gene Bcl-XL .The latter enhances cell survival that subsequently promotes TCR rearrangements. Lack of RORγ t expression inhibits the ISP-DP transition and reduces expression of Bcl-X L in DP thymocytes.The latter results in accelerated apoptosis, reduced lifespan of DP thymocytes and, consequently, impaired TCRα rearrangements. 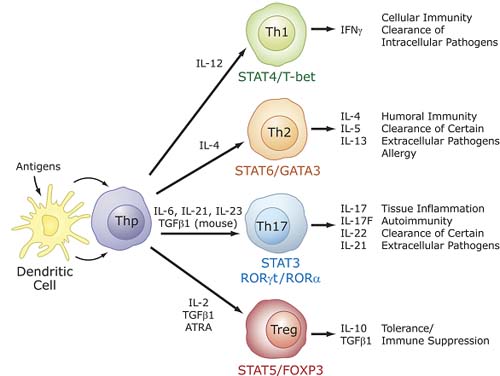 Figure 6. Specific role for RORs in T cell lineage specification. Differentiation into different effector CD4 T cell lineages, T helper (Th) 1, Th2, Th17, and T regulatory (Treg ) cells is initiated through an interaction of dendritic cells with uncommitted (naive) CD4+ T helper cells (Thp).The effector cell types are characterized by their synthesis of specific cytokines and their immuno-regulatory functions, as indicated on the right.The differentiation along different lineages involves different cytokines and the activation of distinct signaling cascades and transcription factors that result in the induction of additional cyto/chemokines and cyto/chemokine receptors, which may be part of positive and negative feedback loops.These cytokines and transcription factors may favor one cell lineage, while inhibiting another (not indicated). RORα and RORγ t are induced during differentiation of Thp into the Th17 lineage and are critical for this lineage specification.
Figure 6. Specific role for RORs in T cell lineage specification. Differentiation into different effector CD4 T cell lineages, T helper (Th) 1, Th2, Th17, and T regulatory (Treg ) cells is initiated through an interaction of dendritic cells with uncommitted (naive) CD4+ T helper cells (Thp).The effector cell types are characterized by their synthesis of specific cytokines and their immuno-regulatory functions, as indicated on the right.The differentiation along different lineages involves different cytokines and the activation of distinct signaling cascades and transcription factors that result in the induction of additional cyto/chemokines and cyto/chemokine receptors, which may be part of positive and negative feedback loops.These cytokines and transcription factors may favor one cell lineage, while inhibiting another (not indicated). RORα and RORγ t are induced during differentiation of Thp into the Th17 lineage and are critical for this lineage specification. 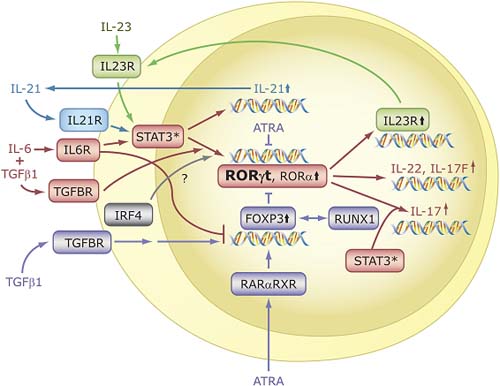 Figure 7. RORs are essential for Th17 cell differentiation and IL-17 expression. In the presence of TCR engagement, treatment of Thp cells with IL-6 plus TGFβ 1 induces differentiation along the Th17 lineage and the activation of several genes, including IL-21, RORα, RORγ t, IL-17, IL-17F, IL-22, and IL23R. Interaction of IL-23 and IL-21 with, respectively, IL23R and IL21R, reinforce Th17 differentiation and ROR expression. RORα and RORγ t are required for the induction of IL-17, IL-17F, and IL23R, but not IL-21. A balance between FOXP3, which is induced by treatment with TGFβ alone, determines whether Thp cells differentiate into Th17 or Treg cells. ATRA, through activation of RARα-RXR complexes, leads to increased FOXP3 and reduced ROR expression. FOXP3 inhibits RORα and RORγ t transcriptional activity by interacting directly with RORs, thereby promoting differentiation along the T T reg reg lineage and inhibiting Th17 differentiation.Transcriptional regulators IRF4 and RUNX1 have also been implicated in the regulation of and Th17 differentiation.
Figure 7. RORs are essential for Th17 cell differentiation and IL-17 expression. In the presence of TCR engagement, treatment of Thp cells with IL-6 plus TGFβ 1 induces differentiation along the Th17 lineage and the activation of several genes, including IL-21, RORα, RORγ t, IL-17, IL-17F, IL-22, and IL23R. Interaction of IL-23 and IL-21 with, respectively, IL23R and IL21R, reinforce Th17 differentiation and ROR expression. RORα and RORγ t are required for the induction of IL-17, IL-17F, and IL23R, but not IL-21. A balance between FOXP3, which is induced by treatment with TGFβ alone, determines whether Thp cells differentiate into Th17 or Treg cells. ATRA, through activation of RARα-RXR complexes, leads to increased FOXP3 and reduced ROR expression. FOXP3 inhibits RORα and RORγ t transcriptional activity by interacting directly with RORs, thereby promoting differentiation along the T T reg reg lineage and inhibiting Th17 differentiation.Transcriptional regulators IRF4 and RUNX1 have also been implicated in the regulation of and Th17 differentiation.  Figure 8 RORs function as integrators of circadian oscillators and the rhythmic expression of downstream (metabolic) genes. The rhythmic expression of RORs is greatly dependent on the ROR isoform and tissue type.The core loop of the oscillator consists of the heterodimeric activators BMAL1 and CLOCK that activate the expression of PERs and CRYs. PER and CRY heterodimers interact with the BMAL1-CLOCK complex and negatively regulate their transcriptional activity. BMAL1 and CLOCK also activate the expression of REV-ERBs, which through their interaction with ROREs repress the transcription of several genes, including BMAL1, CRY1, and RORγ . REV-ERBs are critical in the rhythmic expression of BMAL1, CRY1 and RORγ in liver and several other tissues. RORγ does not affect the rhythmic expression, but increases the peak level of expression of BMAL1, CRY1, NPAS2, CLOCK, and REV-ERB?.The major function of RORγ appears to be to regulate the oscillatory pattern of expression of downstream target genes and, therefore, the rhythmic nature of several physiological processes. RORα exhibits a very weak rhythmic pattern of expression in liver and its major function also appears to be in regulating the (rhythmic) expression of downstream target genes. SIRT, through its deacetylase activity, promotes the degradation of PER and inhibits the interaction of CRY with BMAL1/CLOCK complex, thereby enhancing BMAL1/CLOCK transcriptional activity.
Figure 8 RORs function as integrators of circadian oscillators and the rhythmic expression of downstream (metabolic) genes. The rhythmic expression of RORs is greatly dependent on the ROR isoform and tissue type.The core loop of the oscillator consists of the heterodimeric activators BMAL1 and CLOCK that activate the expression of PERs and CRYs. PER and CRY heterodimers interact with the BMAL1-CLOCK complex and negatively regulate their transcriptional activity. BMAL1 and CLOCK also activate the expression of REV-ERBs, which through their interaction with ROREs repress the transcription of several genes, including BMAL1, CRY1, and RORγ . REV-ERBs are critical in the rhythmic expression of BMAL1, CRY1 and RORγ in liver and several other tissues. RORγ does not affect the rhythmic expression, but increases the peak level of expression of BMAL1, CRY1, NPAS2, CLOCK, and REV-ERB?.The major function of RORγ appears to be to regulate the oscillatory pattern of expression of downstream target genes and, therefore, the rhythmic nature of several physiological processes. RORα exhibits a very weak rhythmic pattern of expression in liver and its major function also appears to be in regulating the (rhythmic) expression of downstream target genes. SIRT, through its deacetylase activity, promotes the degradation of PER and inhibits the interaction of CRY with BMAL1/CLOCK complex, thereby enhancing BMAL1/CLOCK transcriptional activity.