Вторая RTK ErbB-3, которая соединяется с ростовым фактором heregulin, постоянно присутствует в нерасщепленной форме в ядре и вместе со своим лигандом влияет на распределение рецепторов между ядром и цитозолем. Когда ErbB-3-экспрессирующие клетким росли на фильтрах, чтобы индуцировать эпителиальную полярность, то ErbB-3 сигнал концентрировался в ядрышках.
Третья RTK является fibroblast growth factor receptor I
(FGFR-I). Ядерная локализация рецепторов полной длины усиливается при добавлении FGF в клетки и, по-видимому, необходима для взаимодействия этих рецепторов с importin
β. Удаление клеточной АТФ не только усиливает FGF-зависимое накопление в ядре FGFR-I, но и также достаточно для обеспечения накопления их в ядре в отсутствие FGF. Очевидно, что удаление АТФ приводит к повышению уровня цитоплазматического importin β, это облегчает ядерную локализацию этой RTK. Подтверждено, что эти ядерные RTKs
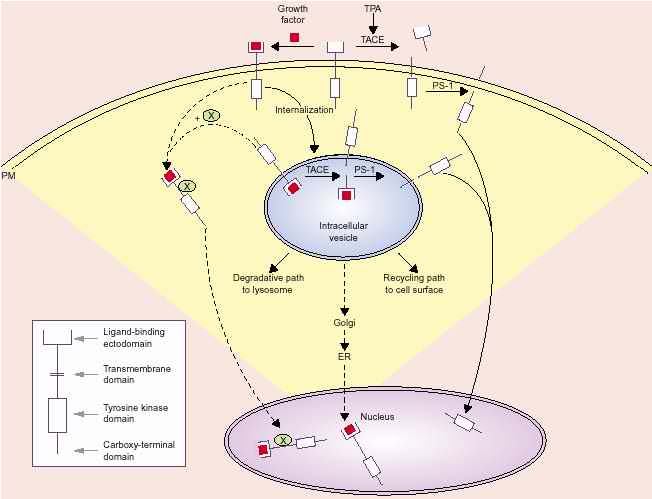
не находятся в ядерной оболочке, а скорее присутствуют в нуклеоплазме. В случае ErbB-1 и FGFR-I, ядерная локализация лиганд-зависима и м.б. связана с эндоцитозом и еще неизвестным механизмом переноса этих RTKs в ядро (Рис. 1). Следовательно, основным осложнением м.б. механизм для удаления интактных рецепторов из мембранного бислоя или на клеточной поверхности или внутри внутриклеточного компартмента, такого как эндосомы.
Т.к. такой механизм неизвестен для внутриклеточного переноса рецепторов, то такой механизм д. существовать в endoplasmic reticulum (ER) для экстракции интактных трансмембранных белков в цитоплазму. Такая система ER-associated degradation (ERAD), которая функционирует с целью обнаружения направильно упакованных белков в ER и с целью высвобождения таких молекул интактными в цитоплазму, где они ubiquitinated и деградируются. М. предложить модель, согдасно которой эндосомы, несущие рецепторы, сливаются с аппаратом Гольджи и затем ретроградно транспортируются в ER, экстрагируемые с помощью ERAD системы,при этом они не деградируют, а транспортируются в ядро (Рис. 1). Некоторые токсины, добавляемые к внеклеточной среде, осуществляют свое проникновение в цитоплазму с помощью этого пути. Установлено, что поступление вирусов в кавеолах ведет их в ER без интерванции эндосом. Возможно , следовательно, что интернализация некоторых RTK, особенно в клетках, с избыточной экспрессией рецептора, происходит через non-coated pit механизмы, такие как кавеолы, которые обязательно связаны с высвобождением в ER.
Nuclear functions for receptor tyrosine
kinases
В случае ErbB-4 протеолитического процессирнга, ингибирование γ-secretase блокирует heregulin-зависимое подавление роста клеток T47. Хотя ингибитор м. иметь и др. неизвестные эффекты, он не влияет на EGF-зависимую стимуляцию роста тех же самых клеток. Остается только показать физиологическое значение ядерной локализации RTK в терминах действия факторов роста. Некоторые эксперименты намекают на роль RTKs в контроле экспрессии генов. Продемонстрирована трансактивирующая функция для С-терминального домена ErbB-1. В тех же экспериментах С-терминальный домен ErbB-4 провоцировал более слабое увеличение транскрипции. днако, нет доказательств, что свободные С-терминальные домены находятся в ядре.
Дополнительным доказательством роли ErbB-1 в транскрипции является демонстрация in vitro связывания этой RTK со специфическими последовательностями ДНК (обозначаемыми ATRS [adenine/thymidine-rich sequence]). Эксперименты in vivo показали EGF-зависимую стимуляцию репортерной конструкции, содержащей ATRS последовательности, a с помощью
chromatin immunoprecipitation assay продемонстрировано связывание ErbB-1 с промотором cyclin D1, который содержит последовательности ARTS, и EGF-зависимая стимуляцияуровней мРНК cyclin D1. Способность FGF-2 индуцировать экспрессию мРНК c-Jun или cyclin D1 чувствительна к присутствию/отсутствию искусственной ядерной локализации последовательностей. инкорпорированных в трансфицируемую FGFR-I конструкцию. В др. исследовании получены доказательства того, что FGFR-I действует как транскрипционный фактор на промотор FGF-2. Однако, из-за того, что лиганд-зависимая ядерная локализация ErbB-1 или FGFR-I не м.б. блокирована, необходимо установить, зависит ли эта зависимая от ростовых факторов транскрипция от ядерной локализации рецепторов. Т.к. RTKs обладают ферментативной функцией, то возможно, что модификация ядерных белков м.б. др. следствием ядерной локализации рецепторов или фрагментов их цитоплазматического домена. Ядерные нерецепторные тирозин киназы, такие как c-Abl, известны, ног их взаимоотношения с ядерными субстратами неясны.
Наконец, возможно, что RTKs поставляют др. молекулы в ядро и что эти ассоциированные с рецепторами молекулы и являются функциональными в ядре. Предполагается, что ErbB-1м. транспортировать STAT-1, a tyrosine-phos-phorylated
транс крипционный фактор из цитозоля в ядро. В случае ErbB-1 и вообще
FGF-I, возможно, что соотв. факторы роста вносятся рецепторами в ядро. Значение ростовых факторов в ядре очевидно. Известна активность ДНК topoisomerase в высоко очищенных препаратах этой RTK. Затем было показано, что активность топоизомеразы м.б. отделена от рецептора с помощью дополнительной очистки. Тем не менее эти сообщения указывают на то, что топоизомеразная активность физически ассоциипрована с ErbB-1, по крайней мере in vitro.
Conclusions
The new observations discussed above raise provocative
ideas about the trafficking and signaling mechanisms of
RTKs. The nuclear localization of other cell surface
molecules or their cytoplasmic domain fragments are parallel examples of direct communication between these two cellular compartments. It seems logical to expect that
additional examples, including other RTKs, will be added
in the near future. The most important questions that
remain to solidify the importance of these observations
are twofold. First, how do intact receptors move from the
cell surface to the nucleus; and second, is the nuclear
localization of an RTK a necessary part of the cellular
response to growth factors?
Update
Previous reports have identified PSD-95 as a molecule
that associates with a PDZ-domain recognition motif at
the carboxyl terminus of ErbB-4. Those reports
suggest that ErbB-4 association with PSD-95 facilitates
ligand-dependent activation of ErbB-4, ErbB-4 oligomerization,
or both. A new report indicates that when the
carboxy-terminal three residues of ErbB-4 are deleted, a
mutation that prevents association with PDZ-domain-containing
proteins, ErbB-4 proteolytic processing by
γ-secretase is significantly impaired [48]. However, ectodomain
proteolytic processing is not impaired in this
mutant. These data suggest a mechanism to facilitate
ErbB-4 processing by γ-secretase.