The Role of Pax Genes in Development of Tissues and Organs: Pax3 and Pax 7 Regulate Muscle Progenitot Cell Functions | |
|
Neural crest: neuroectodenn-derived cells that give rise to different cell types, including those of the peripheral nervous system, and melanocytes Somites: segments of paraxial mesoderm that form progressively on either side of the neural rube, following an anterior-to-posterior developmental gradient Dermomyotome: dorsal epithelial compartment of the somite that gives rise to skeletal muscle and other cell types Myogenesis: formation of skeletal muscle Myf5, MyoD, Mrf4, Myogenin: members of the superfamily of basic-helix-loop-helix transcription factors; required for the formation of skeletal muscle Myotome: central compartment of the somite where skeletal muscle first forms in the embryo Satellite cell: adult skeletal muscle progenitor cell located under the basal lamina of the muscle fiber Six: a family of homeodomain-containing transcription factors c-Met: a tyrosine kinase receptor that binds the ligand scatter factor/ hepatocyte growth factor and is involved in cell delamination, migration, and proliferation in skeletal muscle progenitors Sox: a family of transcription factors characterized by the presence of an SRY domain Follicular cells of the thyroid: the cell type that produces thyroid hormones Hox proteins: homeodomain-containing transcription factors present as large gene clusters expressed progressively on the anterior-to-posterior axis and involved in conferring positional information SUMMARY POINTS |
Рах гены играют ключевые роли в формировании тканей и органов вол время эмбрионального развития. Это семейство генов кодирует транскрипционные факторы, которые характеризуются присутствием paired домена, которые обеспечивает сиквенс-специфическое связывание с ДНК. Они могут также иметь octapeptide мотив и частично или полностью гомеобоксный ДНК-связывающий домен (Chi & Epstein 2002; Lang et al., 2007). На основании присутствия некоторых или всех этих признаков и гомологии последовательностей между paired доменами различают 4 подсемейства Рах генов (Табл. 1). Внутри каждого класса Рах факторов члены обнаруживают некоторое перекрывание в отношении тканевой специфичности и пространственно-временной экспрессии (Vorobyov , Horst 2006). Белки Рах присутствуют в начале клеточной дифференцировки, а мутации генов Рах у эмбрионов мышей демонстрируют функции разных Рах факторов в предопределении выбора клетками судьбы, а также в активации ткане-специфических генов. 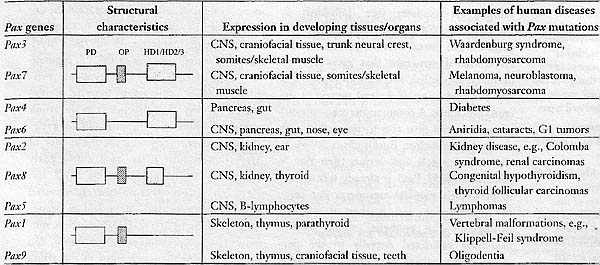 aThe paired domain (PD) characterises tins family of transcription factors, members of which also have an octapeptide (OP) and a homeodomain (HD) that may include the helix-turn-helix motif of the homeodumain (HD2/3) as well as the first helix (HD1). Primarv expression domains during embryonic development are listed. CNS denotes regions of the central nervous system. Trunk neural crest derivatives include the peripheral nervous system, melanocytes, some endocrine glands, and connective tissues such as those at the arterial pole of the heart. Somites are segments of paraxial mesoderm of which the dorsal part gives rise to skeletal muscles of the body as well as dermal, endothelial, and smooth muscle derivatives. For human diseases, see Lang et al. (2007). Mutations in these genes affect the development of many of the structures in which these genes ara expressed. Это древнее и довольно консервативное семейство генов; Pax гены были идентифицированы у многих видов животных (Vorobyov & Horst 2006). Разительный пример (см Kozmik 2005) предоставляется Рахб, необходимым для образования глаз позвоночных и его гомолог у беспозвоночных, такой как eyeless у Drosophila. Экспрессия мышиного гена Рахб может устранять eyeless фенотип и даже способна индуцировать эктопические глаза у плодовых мушек (Gehring & Ikeo 1999), это демонстрирует удивительную функциональную и структурную консервацию. Спонтанные мутации в гене Pax у мышей и людей приводет к дефектам развития, а гаплонедостаточность может также приводить к дисморфным фенотипам . Table 1 показывает примеры синдромов у человека, обусловленные аномальными Pax белками или уровнями белков Pax. Нарушения функции Pax могут также приводить к раку, отражая роль этих факторов в выживании, пролиферации, подвижности и дифференцировке тканевых стволовых клеток (Robson et al. 2006). THE ROLE OF PAX3 AND PAX7 DURING MYOGENESIS IN REGULATING MYOGENIC CELL FATE During Embryonic Development Скелетные мышцы туловища и конечностей происходят из сомитов, сегментов параксиальной мезодермы, формирующейся по бокам от оси благодаря передне-заднему онтогенетическому градиенту (Tajbakhsh & Buckingham 2000). Когда эпителиальные сомиты созревают, то дорсальный дермомиотом сохраняет свою эпителиальную структуру, которая дает дермальные, эндотелиальные и гладкомышечные типы клеток, а также все скелетные мышцы туловища и конечностей. Общий демомиотомный предшественник может давать производные более, чем одной ткани (Buckingham 2006), это продемонстрировано для мышц и дермиса (Ben-Yair & Kalcheim 2005). РахЗ уже транскрибируется в пресомитной параксиальной мезодерме непосредственно перед сегментацией и затем транскрибируется по всему эпителиальному сомиту прежде чем стать ограниченным дорсальнее дермомиотома, где его экспрессия распространяется на epaxial и hypaxial края. Напротив,транскрипты Pax7 концентрируются в центральном домене. РахЗ необходим для формирования hypaxial мышц туловища и для вычленения и миграции клеток миогенных предшественников в др. места миогенеза, такие как те, что в конечностях (Tajbakhsh & Buckingham 2000). Когда клетки покидают дермомиотом и вступают в немиогенные клоны, то экспрессия РахЗ/7 подавляется (Ben-Yair & Kalcheim 2005, Esner et al. 2006, Gros et al. 2005).
Дифференцировка скелетных мышц в целом зависит от миогенных регуляторных генов, которые кодируют семейство basic-helix-loop-helix транскрипционных факторов. Детерминация скелетных мышц и приобретение судьбы миобластных предшественников зависит от Myf5, MyoD и Mrf4, тогда как Myogenin, MyoD и Mrf4 необходимы для терминальной скелетно-мышечной дифференцировки (Buckingham 2006). В начале миогенеза в сомитах, клетки миогенных предшественников вычленяются с краев дермомиотома, чтобы переместиться в подлежащий миотом. На этой стадии Myf5 и Mrf4, независимо от Pax3/7, регулируют вступление клеток в миогенную программу. Однако, последующая hypaxial активация Myf5 является РахЗ зависимой в туловище и конечностях, где РахЗ непосредственно контролирует регуляторные последовательности, необходимые для транскрипции Myf5 этими сайтами (Bajard et al. 2006). Ранняя экспрессия MyoD зависит от Myf5 и Mrf4, но экспрессия затем активируется в отсутствие Myf5/Mrf4 и происходит миогенез. У тройных мутантов Myf5/Mrf4/Pax3 экспрессия MyoD поставлена под удар и скелетные мышцы не формируются в туловище и конечностях, указывая тем самым, что РахЗ, as well as Myf5/Mrf4, генетически расположены выше MyoD (Kassar-Duchossoy et al. 2004, Tajbakhsh et al. 1997). Экспрессия MyoD контролируется с помощью эмбрионального энхансера (Goldhamer et al. 1995), который труден для анализа на уровне хорошо-известных регуляторов при отсутствии, кстати, доказательств прямой активации с помощью Pax3/7.
В 2005 описана популяция Pax3/Pax7-позитивных клеток в развивающихся скелетных мышцах и было показано её происхождение от центрального домена дермомиотома, т.к. она теряла свою эпителиальную структуру во время созревания сомитов (Ben-Yair & Kalcheim 2005, Gros et al. 2005. Kassar-Duchossoy et al. 2005, Relaix et al. 2005). Эти клетки присутствуют также в мышцах конечностей, где они появляются из hypaxial части дермомиотома (Schienda et al. 2006). эта пролиферирующая РахЗ/7-позитивная популяция клеток
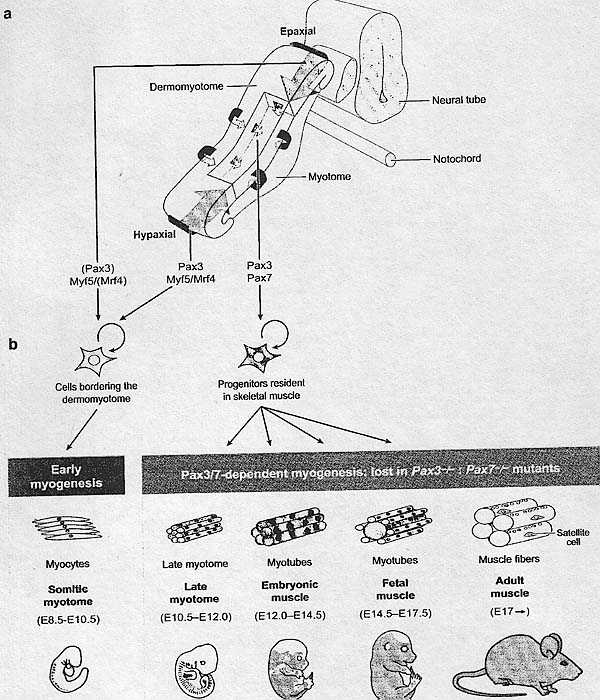 Fig. 1. Pax3/7 function during the formation of skeletal muscle, (a) The epithelial dermomyotome of a somite [green) and the underlying skeletal muscle of the myotome {beige) are initially formed by delaminauon of cells from the edges of die dermomyotome {blue arrows). Subsequendy, as the central dermomyotome loses its epithelial structure, a second wave of resident myogenic progenitor cells enters die myotome {red arrows). The transcription factors that regulate these events are shown in red. (b) A schematic of the progenitor cells and their muscle derivatives, together with the timing of diese events in the mouse embryo. Circular gray arrows indicate proliferation. The gray box shows myogenic events that are lost in the absence of РахЗ and Pax7. E, embryonic day. также дает миогенные клетки, маркированные с помощью экспрессии Myf5 и MyoD и впоследствии мышечные волокна, создавая резерв клеток миогенных предшественников во время эмбрионального и плодного развития. У двойных РахЗ/Paxl мутантных эмбрионов эти клетки предшественники не запускают миогенную программу, приводя в результате к большому дефициту скелетных мышц (Relaix et al. 2005); присутствуют только мышечные волокна, происходящие из ранних миотомов (Figure 1). Интересно, что миогенез в голове не зависит от Pax3/7. РахЗ не экспрессируется в головных мышцах, а Pax7 хотя и присутствует в миогенных клетках бранхиальных дуг, которые дают лицевые мышцы, экспрессируется после Myf5 и MyoD (Horst et al. 2006) и не является, по-видимому, критическим для миогенеза, т.к. головные мышцы формируются у Pax7 мутантов (see Noden & Francis-West 2006, Relaix et al. 2004). Однако, Pax7 маркирует клетки предшественники головных мышц на плодной стадии (F. Relaix & M. Buckingham, unpublished observation). During Postnatal Muscle Growth and Regeneration
К концу плодного развития мышц [приблизительно с embryonic day (E) 16 у эмбрионов мышей], Pax3/7-позитивные клетки предшественники начинают развиваться под базальной пластинкой, которая формируется вокруг мышечных волокон (Relaix et al. 2005). Это является характерным местоположением сателлитных клеток в постнатальных скелетных мышцах. Классические сателлитные клетки. как полагали, происходят из параксиальной мезодермы сомитов на основании трансплантационных экспериментов между курами и перепелом (see Armand et al. 1983). Сегодня продемонстрировано снова с помощью трансплантационных экспериментов на эмбрионах птиц, что Pax3/7-позитивные клетки присутствуют в центральной части дермомиотомов, давая сателлитные клетки туловища (Gros et al. 2005),в то время как сателлитные клетки мышц конечностей происходят из РахЗ-экспрессирующих клеток мышечнфх предшественников, которые мигрируют из hypaxial части дермомиотома (Schienda et al. 2006). Сателлитные клетки маркированы экспрессией Pax7 (Seale et al. 2000) и РахЗ во многих, но не во всех мышцах (Relaix et al. 2006). РахЗ перестает транскрибироваться в определенных мышцах. таких как те, что из задних нижних конечностей (Relaix et al. 2006). В тех мышцах, в которых РахЗ продолжает экспрессироваться, уровень белка РахЗ редуцируется в клетках мышечных предшественников на поздней плодной стадии (Horst et al. 2006), хотя РахЗ всё ещё обнаружим в сателлитных клетках после рождения (Relaix et al. 2006). Сателлитные клетки остаются молчащими под базальной ламиной мышечных волокон до тех пор, пока мышца не будет повреждена и ламина не будет разорвана, тогда активированные сателлитные клетки начинаю пролиферировать, прежде чем сформировать новвые мышечные волокна (Figure 2). В последнее время роль сателлитных клеток в репарации мышц находится под вопросом. Однако, новые подходы к очистке сателлитных клеток, или из препаратов изолированных волкон (Collins et al. 2005) или с помощью проточной цитометрии из Pax3GFP/+ мышей (Montarras et al. 2005), продемонстрировали, что они являются основной популяцией клеток миогенных предшественников, которые эффективно участвуют в репарации скелетных мышц и которые также подвергаются само-обновлению. В отличие от РахЗ/7-позитивной популяции, присутствующей во время пренатального развития мышц, многие (~ 80%) сателлитные клетки уже имеют активированный Myf5 ген (Beauchamp et al. 2000), хотя белок не выявляется. Это указывает на то, что сателлитные клетки соответствуют клеткам, которые уже ангажированы в миогенную программу, но затем возвращаются в сателлитные клетки состояния покоя. Гетерогенность популяции сателлитных клеток также указывает на присутствие минорных клеток, которые если активированы, то обнаруживают признаки сходные с сохранением родительской нити ДНК подобно стволовым клеткам (Shinin et al. 2006). Активация сателлитных клеток сопровождается экспрессией MyoD, а также высокими уровнями Myf5, что ведет к негативной регуляции Pax7, активации Myogenin и к формированию новых мышечных волокон (Figure 2). Некоторые клетки сохраняют высокие уровни Pax7 и теряют MyoD, возможно в результате асимметричных клеточных делений (Conboy & Rando 2002, Shinin et al. 2006,
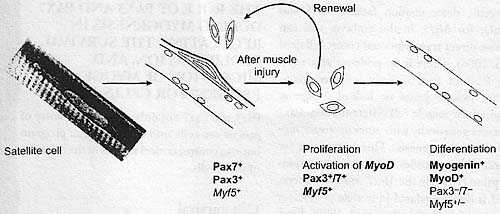 Fig. 2. Adult muscle progenitors/satellite cells. A scanning electron micrograph (left) shows a satellite cell associated with a muscle fiber, stripped of its basal lamina. Satellite cells are marked by Pax7 and also, m many muscles, by РахЗ. Most satellite cells transcribe low levels of the myogenic determination gene MyfSy seen as (3-galactosidase-positive cells in Myf5nU,cZ'IJr mice (see Tajbakhsh & Buckingham 2000). On muscle injur)' or during growth, satellite cells become activated, proliferate, activate the myogenic determination gene MyoD, downrcgulatc Pax3/7, and differentiate into muscle fibers. Self-renewal of the satellite cell population is assured by some cells that maintain high Pax7 levels. Bold red print indicates the primary factors present at each stage. Fig. 2. Adult muscle progenitors/satellite cells. A scanning electron micrograph (left) shows a satellite cell associated with a muscle fiber, stripped of its basal lamina. Satellite cells are marked by Pax7 and also, m many muscles, by РахЗ. Most satellite cells transcribe low levels of the myogenic determination gene MyfSy seen as (3-galactosidase-positive cells in Myf5nU,cZ'IJr mice (see Tajbakhsh & Buckingham 2000). On muscle injur)' or during growth, satellite cells become activated, proliferate, activate the myogenic determination gene MyoD, downrcgulatc Pax3/7, and differentiate into muscle fibers. Self-renewal of the satellite cell population is assured by some cells that maintain high Pax7 levels. Bold red print indicates the primary factors present at each stage. Zammit et al. 2004), позволяя тем самым сателлитным клетками самообновляться. Имеются различные сообщения об эффектах избыточной экспрессии Pax3/7 при дифференцировке сателлитных клеток (Epstein et al. 1995, Olgiiin & Olwin 2004) или что она может происходить в присутствии Pax3/7 (Relaix et al. 2006, Zammit et al. 2004), возможно в зависимости от уровня. Экспрессия в культивируемых сателлитных клетках доминатно негативных форм РахЗ или Pax7, у которых ДНК-связывающие домены Pax слиты с репрессионным доменом Engrailed, что ведет к подавлению MyoD (Relaix et al. 2006) и задержке начала экспрессии Myogenin (Zammit et al. 2006). Однако, миогенез происходит; экспрессия Myf5 не зависит от Pax в этих постнатальных клетках, и в самом деле Myf5 уже транскрибируется в большинства покоящихся сателлитных клеток. В сателлитных клетках, которые лишены Myf5, экспрессия доминантно негативных Pax3/7 предупреждает дифференцировку. Следовательно, в сателлитных клетках взросых скелетных мышц Pax3/7 регулируют миогенез посредством MyoD (Relaix et al. 2006). В конексте взрослых мышц некоторые РахЗ-позитивные интерстициальные клетки, присутствующие в мышечной ткани, могут вносить валад в регенерацию у Pax7-дефицитных мышей (Kuang et al. 2006). Интересно, что происходящие из кровеносных сосудов mesoangioblast стволовые клетки (Minasi et al. 2002) также обладают миогенным потенциалом, который зависит от присутствия РахЗ (G. Cossu, personal communication). Последние клетки также обнаруживают удивительную способность репарировать поврежденные мышцы, если инъецируются в кровоток (Sampaolesi et al. 2003) и могут быть связаны с РахЗ-экспрессирующими клетками в параксиальной мезодерме или сомитах, которые могут давать клетки кровеносных сосудов (Esner et al. 2006). Роль таких клеток для нормального мышечного роста и репарации еще предстоит продемонстрировать. Genetic Hierarchies and РахЗ/7 Gene Function in the Context of Myogenesis Как было рассмотрено выше, РахЗ и Pax7 осуществляют свой контроль за приобретением судьбы миогенных клеток посредством факторов миогенной детерминации Myf5 и MyoD; для Myf5, у эмбрионов, это может быть связано с непосредственным контролем транскрипции (Bajard et al. 2006). Пока нет доказательств, что РахЗ или Pax7 непосредственно активируют нижестоящие мышечные гены или на самом деле Myogenin, необходимый для дифференцировки мышечных клеток. РахЗ взаимодействует генетически с др. вышестоящими регуляторами миогенеза. Это имеет место в случае Mox2, который кодирует гомеодоменовый транскрипционный фактор; у Mox2-мутантных эмбрионов, РахЗ подавляется в клетках мышечных предшественников в конечностях (Mankoo et al. 1999). РахЗ, возможно также и Pax7, обнаруживает сложные взаимоотношения с Six1 и Six4, которые кодируют гомеодоменовые белки, влияющие на миогенез у эмбрионов , а также на детерминацию типа мышечных волокон у взрослых (Grifone et al. 2004). Эти транскрипционные факторы регулируют Myogenin (Spitz et al. 1998) и некоторые нижестоящие мышечные гены, такие как Aldolase, но они вместе со своими кофакторами Eya и Dach экспрессируются также в клетках миогенных предшественников (Heanue et at. 1999, Laclef et al. 2003). Мутанты Six1 лишены некоторых мышц в конечностях (Laclef et al. 2003),а Sixl/Six4 двойные мутанты обнаруживают заметный миогенный фенотип в туловище и конечностях, где отсуствует большинство мышц (Grifone et al. 2005). У этих двойных мутантов РахЗ подавляется в определенных местах, где клетки предшественники происходят из hypaxial частей сомитов, а маркированный Six репортерный ген всё ещё присутствует. Двойные мутантные Eya1/Eya2 эмбрионы имеют сходный миогенный фенотип, это согласуется с облигатной ролью Eya 1/2 как и Six1/4 коактиватора (Grifone et al. 2007). Возможно, что имеется регуляторная петля обратной связи между Six1/4 и РахЗ/(7), на это указывает РахЗ регуляция Six1 и Eya2 у эмбрионов птиц (Heanue et al. 1999) и в клетках P19 (Ridgcway & Skerjanc 2001). Регуляторный элемент Myf5, который нуждается в связывании с РахЗ для активации в миогенных клетках эмбриональных конечностей (Bajard et al. 2006), также связывает Six1/4 в соседнем сайте, необходимом для сильной экспрессии репортера in vivo (Giordani et al. 2007). THE ROLE OF РАХЗ AND PAX7 DURING MYOGENESIS IN REGULATING THE SURVIVAL, PROLIFERATION, AND MIGRATION OF MYOGENIC PROGENITOR CELLS РахЗ и Pax7не только регулируют вступление клеток предшественников в миогенную программу, но и также контролируют критические аспекты поведения этих клеток. Cell Survival Поразительным признаком Pax3-мутантных эмбрионов является потеря hypaxial части дермомиотома, которая обусловлена апоптозом (Borycki et al. 1999). Этот феномен вызывает затруднения анализа роли РахЗ в гипоксиальных миогенных производных . Эта ситуация частично разрешается у РахЗPax3-En-IRESnlacZ/+ эмбрионов (у которых доминантно негативный РахЗ-Engrailed слитый транскрипт замещает один из аллелей РахЗ), которые обнаруживают умеренный дефект гипоксиального дермомиотома (Bajard et al. 2006). Что затронуты миогенные мишени РахЗ, особенно Myf5, подтверждает, что анти-апоптические мишени РахЗ требуют разных порогов активности РахЗ или обладают самостоятельной регуляцией. Некоторые структурные нарушения происходят в epaxial части дермомиотома; однако, epaxial миогенез осуществляется. Более поздний вклад клеток миогенных предшественников из центральной части дермомиотома в растущие мышцы не нарушается у мутантов Pax . Это связано с ко-экспрессией Pax7, который компенсирует потерю РахЗ, как это наблюдается также в дорсальной части нервной трубки, где домен экспрессии Pax7 расширяется у мутантов РахЗ (Borycki et al. 1999). В присутствии только одного аллеля РахЗ или Pax7, миогенные предшественники растущих мышц выживают. Однако, у Pax3/Pax1 двойных мутантов миогенная спецификация нарушена и наблюдается обширная клеточная гибель (Relaix et al. 2005).
В сателлитных клетках мышц Pax7 играет критическую роль в выживании, а у Pax7 мутантов эти клетки быстро теряются после рождения из-за апоптоза (Relaix et al. 2006). Это наблюдается в случае с диафрагмой, где РахЗ экспрессируется, а также в мышцах задних конечностей, которые негативны по РахЗ . Негативная регуляция транскрипции РахЗ в перинатальный период может указывать на то. что некоторые РахЗ-негативные взрослые мышцы уже начинают терять сателлитные клетки ещё до рождения (see Kuang et al. 2006), но подсчет клеток показал, что потеря минимальна после рождения (Relaix et al. 2006). Уровни белка РахЗ могут быть слишком низки. чтобы компенсировать анти-апоптическую функцию Pax7 в сателлитных клетках (Horst et al. 2006). Однако, введение доминантно негативной формы РахЗ или Pax7 (Pax-Engrailed) в культивируемые сателлитные клетки ведет к к более выраженной клеточной гибели с доминантно негативным Pax7. Эти эксперименты подтвердили, что в постнатальных клетках мышечных предшественников РахЗ и Pax7 антиапоптическая функция дивергирует (Relaix et al. 2006), тогда как у эмбрионов антиапоптическая функция РахЗ в hypaxial сомитах может быть замещена с помощью Pax7 (Relaix et al. 2004). Proliferation Малоизвестно о молекулярной роли РахЗ или Pax7 в пролиферации мышечных клеток. В сателлитных клетках от Рaх7-мутантных мышей пролиферация может быть поставлена под угрозу (Oustanina et al. 2004), и фаза G2/M клеточного цикла удлиняется (Relaix et al. 2006). Анализ поведения сателлитных клеток в одиночных волокнах указывает на то, что клетки подвергаются абортированным митозам (Kuang et al. 2006). РахЗ может быть важным для пролиферативного состояния активированных сателлитных клеток (Conboy & Rando 2002), но т.к. сателлитные клетки из мышц задних конечностей могут пролиферировать in vitro (Relaix et al. 2006) и in vivo (Montarras et al. 2005) без обнаружимой экспрессии РахЗ, то его экспрессия не является обязательной, Во время развития РахЗ и Pax7 экспрессируются в популяции клеток мышечных предшественников и в самом деле Pax3/Pax7-позитивные клетки в дермомиотоме также делятся как и в РахЗ -позитивных клетках, которые мигрируют в зачатки конечностей. В клетках миогенных предшественников развивающихся конечностей, где Pax7 обычно активируется позднее, замещение функции РахЗ на Pax7 у эмбрионов приводит к пролиферативному дефекту, который не наблюдается в туловище (Relaix et al. 2004). Migration У эмбрионов миграция клеток миогенных предшественников из hypaxial части сомитов чтобы создать мышечные массы ещё где-либо, как и в конечностях, является важным аспектом миогенеза. Рецептор c-Met является критическим для этого процесса (Birchmeier & Brohmann 2000) и у мутантных c-Met эмбрионов клетки предшественники не способны вычленяться из эпителия hypaxial дермомиотома и в конечностях отсутствуют мышцы. c-Met участвует также в клеточной миграции посредством своего лиганда, scatter factor (или hepatocyte growth factor), который экспрессируется клетками, расположенными на путях миграции. . c-Met и его лиганд могут также участвовать в пролиферации миогенных предшественников в конечностях (Maina et al. 1996). Регуляторные последовательности в промоторе c-Met реагируют на РахЗ (Epstein etal. 1996). In vivo у Pax3PAX3-FKHR-IRESnlacZ/+ эмбрионов c-Met избыточно экспрессируется и эктопически активируется в присутствии сильного транскрипционного активатора РАХЗ-FKHR [РАХЗ DNA-binding site + FOX01A transcriptional activation domain (see Keller et al. 2004, Relaix et al. 2003)]. В альвеолярных rhabdomyosarcomas, которые ассоциируют с присутствием PAX3-FKIIR, c-Met строго экспрессируется и как полагают вносит вклад в инвазивность опухолевых клеток (see Robson et al. 2006). THE ROLE OF PAX GENES IN REGULATING CELL DETERMINATION AND DIFFERENTIATION IN NONMYOGENIC TISSUES Обсудим роль генов Pax в др. тканях сначала в выборе судьбы клетками и клеточной дифференцировке, а затем в выживании, пролиферации клетоки в др. аспектах клеточного поведения.
Во время формирования различных тканей и органов гены Pax играют важные роли в спецификации территорий и популяций клеток предшественников, в поддержании мультипотентного состояния клеток предшественников и в направлении клеток предшественников в данный клеточный клон часто за счет альтернативных судеб клеток. Как и в случае миогенеза, белки Pax контролируют ткане-специфические регуляторные гены, но в клетках др. типа они могут непосредственно активировать нижестоящие гены дифференцирующейся ткани. Эти аспекты функции Pax генов в разных системах представлены в последующих подразделах. РахЗ in Neural Crest and its Derivatives РахЗ и Pax7 не ограниваются клетками предшественниками клона скелетных мышц; они также экспрессируются в субдоменах развивающейся нейроэктодермы. РахЗ и Pax7 экспрессируются в дорсальной части нервной трубки, где РахЗ маркирует клетки нервного гребня, которые вносят существенный вклад в формирование тканей и органов во время развития позвоночных (Le Douarin & Kalcheim 1999). Периферическая нервная система или меланоциты, напр., происходящие из нервного гребня, нарушены у мутантов РахЗ . Так, в скелетных мышцах РахЗ действует в пролиферирующих клетках предшественниках нервного гребня, где он модулирует их вступление в программу тканевой дифференцировки. В этом контексте, РахЗ действует совместно с Sox1O, членом семейства SRY транскрипционных факторов, напр., при их активации гена c-Ret , необходимого для формирования энтерических ганглиев, или гена the Mitf, который кодирует ключевой транскрипционный регулятор дифференцировки меланоцитов (Chi & Epstein 2002). В последнем случае РахЗ может непосредственно контролировать транскрипцию генов меланоцитов, таких как Dct (Lang et al. 2005). Детальный анализ ключевых регуляторных последовательностей Dct установили способ, с помощью которого активации Mitf и Sox1O противодействует связывание РахЗ и его ко-репрессора, Groucho. Каноническая передача сигналов Wnt посредством соседнего сайта Lef/Icf, смещает РахЗ и делает возможным связывание Mitf/Sox1O. В этой ситуации РахЗ является негативно регулирующим Mitf-обусловленную терминальную дифференцировку и в то же самое время активирующим Mitf, играя таим образом ключевую роль в балансе между клетками предшественниками и их дифференцированными производными (Lang et al. 2005). В клоне нервного гребня амфибий РахЗ действует вместе с Zic1, индуцируя ранние гены нервного гребня, такие как Foxd3 (Sato et al. 2005). Msx1 также участвует в регуляции РахЗ развивающегося нервного гребня (Monsoro-Burq et al. 2005). Ген паралог Msx1, Msx2, непосредственно регулируется с помощью РахЗ, который репрессирует его активность в дорсальной части нервной трубки. У РахЗ-мутантных эмбрионов, Msx1 позитивно регулируется, приводя к дефектам нервного гребня (Kwang et al. 2002). Интересно, что Msx1 экспрессируется в субнаборе РахЗ-позитивных клеток миогенных предшественников на уровне передних конечностей (Houzelstein et al. 1999). Миогенная функция не была ещё продемонстрирована in vivo, хотя Msx1 , как полагают, противодействует связыванию РахЗ с ДНК (Bendall et al. 1999). Pax4 and Рахб in the Specification of Endocrine Pancreatic Lineages Pax4 и Рах6 играют важную роль в развитии клонов эндокринных клеток в поджелудочной железе (Dohrmann et al. 2000, Sosa-Pineda 2004) и представляют разительный пример роли Pax генов в выборе клеточных судеб. Рахб экспрессируется сначала в клетках препанкреатической энтодермы и он постепенно маркирует все панкреатические эндокринные клетки во время развития и у взрослых. В отсутствие Рахб, glucagon-продуцирующие α-клетки отсутствуют; обнаруживаются повышенные количества grehlin-экспрессирующихγ-клеток, которые могут происходить из общего α/γ предшественника; а морфология панкреатических отсровков нарушается. Экспрессия Pax4 также обнаруживается в ранней панкреатической энтодерме и постепенно подавляется в α-клетках. В отсутствие Pax4, зрелые β- (инсулин-продуцирующие) и δ- (somatostatin-продуцирующие) клетки отсутствуют, тогда как популяция α- и γ-клеток увеличивается. Pax4 и Рахб, следовательно, необходимы для выбора клеточных судеб в эндокринном клоне поджелудочной железы. Рахб играет роль в регуляции ключевых панкреатических контролирующих генов, таких как Pdx1, или Pax4, который также содержит Рахб-связывающие сайты. Рахб также непосредственно регулирует гены α-панкреатических клеток, такие как glucagon с помощью кооперации с Cdx2/3 и Мaf транскрипционных факторов, чтобы активировать промотор (e.g., Planque et al. 2001). Рахб регулируется с помощью вышестоящих генов, которые специфицируют поджелудочную железу. Pdx1 и прежде всего Islet1 расположены генетически выше Рахб во время панкреатического развития. Pdx1 и Рахб, подобно РахЗ и Six 1/4 в миогенных клонах, по-видимому, регулируются с помощью петель обратной связи. Генетически, Pax4 контролируется с помощью проэндокринного гена Neurogenin3 и возможно также с помощью HNF4α, KТАlα, Pdx1 bNeuroD1 (Sosa-Pineda 2004). Neurogenin3 регулирует также Nkx2.2, участвующий подобно Pax4, в выборе судьбы β-клеток, в котором также участвует Рах4-зависимая экспрессия Pdx1. Pax4, по-видимому, непосредственно репрессирует экспрессию гена greblin и тем самым предупреждает выбор γ-клеточной судьбы. Антагонистические генетические взаимодействия между Pax4 и Arx, который кодирует гомеодоменовый фактор, способствуют β- и δ- или α-клеточным судьбам (Collombat et al. 2003). Выбор клеточной судьбы в эндокринном клоне поджелудочной железы т.о. зависит от сложного баланса между Pax4, Рахб и др. ключевыми регуляторами (see Figure 3 a). Рахб and Pax2 in Cell Fate Determination in the Eye Рахб играет ключевую роль в развитии глаз и был описан как мастер контролирующий ген (Gehring & Ikeo 1999), в основном на основании индукции им формирования эктопических глаз. Др. Pax гены при избыточной экспрессии м. активировать ткане-специфические гены-мишени. Напр., РахЗ, когда избыточно экспрессируется в культивируемых эксплантах нервной трубки, то может индуцировать эктопическую экспрессию MyoD (Maroto et al. 1997). Однако, в нормальном эмбриональном контексте Pax гены действуют внутри более крупной онтогенетической программы. В самом деле у эмбрионов Drosophila эктопические глаза индуцируются внутри регуляторной сети только в определенном пространственно-временном контексте, где Рахб модифицирует существующую программу развития сенсорного органа скорее, чем инициирует всю программу морфогенеза глаз (Kozmik 2005, Zuber et al. 2003). У эмбрионов мышей экспрессия Рахб (Hever et al. 2006) обнаруживается в поверхностной эктодерме поля проспективного хрусталика и в области нейральной эктодермы, которая д. сформировать оптический пузырёк из которого развивается сетчатка. Несмотря на принадлежность к двум разным подсемействам Pax и Рахб и Pax2 экспрессируются рано в предшественниках сетчатки; в самом деле, или Pax ген достаточен для активации гена Mttf, который здесь, как и в клоне меланоцитов, является непосредственной мишенью Pax (Baumer et al. 2003). Презумптивная сетчатка может развиваться до стадии оптического бокала без Рахб. Pax2 является существенным для генерации оптической ножки и предопределение этих двух территорий глаза зависит от взаимной репрессии Pax2/Pax6 на этой стадии развития (Schwarz et al. 2000).
Условный генный targeting Рахб показал, что он играет роль в поддержании мультипотентного состояния пролиферирующих клеток предшественников сетчатки. В отсутствие Рахб, эти клетки сохраняют ретинальные характеристики и они продолжают экспрессировать др. регуляторные гены, такие как Rx1, Six3, Six6 и Lhx2 , но их дифференцированная клеточная судьба ограничивается amacrine промежуточными нейронами, Подобно функции РахЗ/7 в миогенном клоне
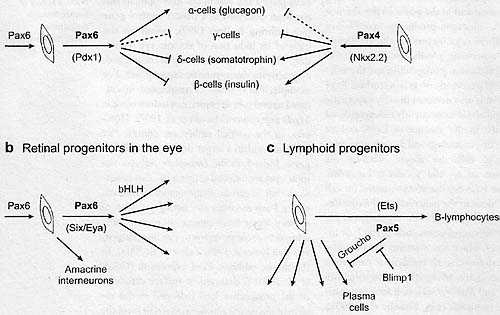 Fig. 3. Pax functions in progenitor cells. Schematic representation of examples of Pax function in cell lineage decisions, (a) The differentiation of endocrine cell lineages of the pancreas depends on a complex balance between Рахб and Pax4, revealed when the Рахб and Pax4 genes are mutated. Cofactors such as Pdxl and Nkx2.2 act with Рахб and Pax4, respectively, (b) The multipotency of progenitor cells in the retina depends on Рахб. In its absence, only amacrme interneurons fonn. Tn this system, Рахб acts with the Six/Eya genetic network to activate genes encoding basic-helix-loop-helix factors (bHLH) required for the determination of retinal cell types, (c) The emergence of the B-lymphocyte lineage depends on Pax5, which collaborates with Ets transcription factors to activate lymphocyte-specific genes. Pax5 and its corepressor, Groucho, repress other lymphoid lineages. This repression is in turn repressed by Blimpl, also expressed in non-B-lymphocyte derivatives. Multiple arrows in h and с indicate different retinal or lymphoid cell fates. See text for references and further discussion. Fig. 3. Pax functions in progenitor cells. Schematic representation of examples of Pax function in cell lineage decisions, (a) The differentiation of endocrine cell lineages of the pancreas depends on a complex balance between Рахб and Pax4, revealed when the Рахб and Pax4 genes are mutated. Cofactors such as Pdxl and Nkx2.2 act with Рахб and Pax4, respectively, (b) The multipotency of progenitor cells in the retina depends on Рахб. In its absence, only amacrme interneurons fonn. Tn this system, Рахб acts with the Six/Eya genetic network to activate genes encoding basic-helix-loop-helix factors (bHLH) required for the determination of retinal cell types, (c) The emergence of the B-lymphocyte lineage depends on Pax5, which collaborates with Ets transcription factors to activate lymphocyte-specific genes. Pax5 and its corepressor, Groucho, repress other lymphoid lineages. This repression is in turn repressed by Blimpl, also expressed in non-B-lymphocyte derivatives. Multiple arrows in h and с indicate different retinal or lymphoid cell fates. See text for references and further discussion. судьбы др. ретинальных клеток зависят от on basic-helix-loop-helix транскрипционных факторов, кодируемых генами, такими как Ngn2, Mash1 или Math5, которые непосредственно регулируются с помощью Рахб (Marqnardt ct al. 2001) (Figure 3b). В дополнение к этой его роли в ретинальном развитии Рахб является также существенным для развития хрусталика, регулируя гены, необходимые для формирования хрусталика, такие как L-Maf (Reza et al. 2002), а также непосредственно активируемые нижестоящие структурные гены хрусталика, такие как те, что кодируют δ-crystallin (Kondoh et al. 2004). Рахб играет сходную роль в инициации регенерации хрусталиков (e.g., Madhavan et al. 2006) или в самом деле заживляет раны в роговице, где они может также непосредственно активировать нижестоящие гены, такие как те, что кодируют α-4 integrin (e.g., Zaniolo et al. 2004). Во время развития глаз Рахб является частью сложной сети регуляторных факторов, в которой Six3 и Sox2 играют важную роль. В классической Drosophila модели eyeless (Pax) и sine oculis (Six), вместе со свои кофактором, eyes absent (Eya), являются существенными для развития глаз. Pax активирует Six, который затем петлей обратной связи регулирует Pax и вместе с Pax, активируют нижестоящие гены (Relaix & Buckingham 1999). Этот парадигм законсервирован в глазах позвоночных (e.g., Goudreau et al. 2002) и появляется снова в скелетном миогенезе. Sox2 регулируется с помощью и является потенциальным регулятором Рахб (see Hever et al. 2006). Sox2 действует кооперативно с Рахб, чтобы активировать гены, такие, которые кодируют δ-crystallin во время развития хрусталиков (Kamachi etal. 2001).
Функция Рахб (и Sox2) во время формирования глаз предоставляет удивительный пример важности дозы гена (see Hever et al. 2006). Необходим критический пороговый уровень белка Pax, а мутации, которые его нарушают, ведут к дефектам глаз у мышей и людей.У мышей избыточная экспрессия Рахб также ведет к тяжелым аномалиям глаз, хотя др. ткани, подобно поджелудочной железе не затрагиваются (Schedl etal. 1996). Функция др. Pax генов не обязательно д. зависеть от дозы гена; миогенез у мышей, у которых нарушен один из аллелей Pax 3 выглядят нормально, хотя РахЗ гетерозиготные мыши обнаруживают дефекты в клоне клеток нервного гребня (Lang et al. 2007). Дозовые эффекты обнаруживаются также в искусственных ситуациях, при которых РахЗзамещается на Pax7-кодирующую последовательность (Relaix et al. 2004). Pax2 and the Six/Eya Network in the Inner Ear Pax2 и Pax8 участвуют в развитии внутреннего уха. Pax2 мутанты, напр., имеют крупную улитку и дефекты сенсорной ткани (Burton et al. 2004). Эта система является типичным примером перекрывания регуляции Pax и Six/Eya в развитии ткани. Ранее уже упоминалось, что эти два регуляторных пути действуют параллельно. Однако, генетические взаимодействия между Pax2, Eya1, и Six1 были недавно продемонстрированы; Eya1 может действовать синергично с Pax2 во время развития сенсорных областей внутреннего уха (see Zou et al. 2006). Pax2 and Pax8 in the Specification of the Nephric Lineage Pax2 играет ключевую роль в развитии урогенитального тракта (Eccles et al. 2002) и регулирует экспрессию важных нефрогенных молекул, таких как транскрипционный фактор WT1 или c-Ret лиганд, GDNF. Вместе с Pax8, Pax2 является существенным для спецификации нефрического клона (Bouchard et al. 2002). В их отсутствие эпителиально-мезенхимные переходы, необходимые для формирования нефрических протоков, не происходят и ранние нефрические маркерные гены, включая те, что кодируют транскрипционные факторы Lim1 и Gata3, не активируются (Grote et al. 2006). Gata3, по-видимому, является непосредственной мишенью для Pax2/8 и необходим для экспрессии c-Ret. Pax2 сам по себе может индуцировать эктопические почечные структуры в промежуточной мезодерме, из которых могут формироваться нормальные почки (Bouchard et al. 2002). Сеть Pax2/Six/Eya также оперирует во время развития почек, когда Six1 и Six2, вместе с Eya1, экспрессируются, а мутации в Six1 затрагивают развитие почек (see Bouchard 2004). Pax2 and Pax8 in the Specification of Thyroid Follicular Cells Pax8 также является существенным для развития фолликулярных клеток энтодермального происхождения в щитовидной железе. Мутанты Pax8 лишены этих thyroglobulin-продуцирующих клеток, а мутации гена PAX8 человека также ассоциированы с врожденным hypothyroidism ( De Felice & Di Lauro 2004). В линии тироидных клеток все маркеры дифференцировки фолликулярных клеток зависят от Pax8 (Pasca di MagHano et al. 2000), и ряд из них является прямыми мишенями. Pax8 действует синергично с Nkx2.1, с которым он непосредственно взаимодействует (Di Palm a et al. 2003), чтобы активировать элементы. которые регулируют ген thyroglobulin. Pax8 регулирует также транскрипцию Nkx2.1 и Foxe1, который кодирует др. вышестоящий регулятор развития щитовидной железы (D'Andrea et al. 2006, Parlato et al. 2004). Экспрессия Pax8 поддерживается во взрослой щитовидной железе и ассоциирует с раками щитовидной железы (Robson et al. 2006). Pax5 and the B-Lymphocyte Lineage Dj время гематопоэза Pax5 необходим для развития клона В-лимфоцитов из клеток общего лимфоидного предшественника (Busslinger 2004). Он действует как непосредственно активируя экспрессию генов, таких как mb-1 (Igα), CD19 b BLNK, необходимых для детерминации B-клона, так и репрессируя транскрипциюM-CSFR или Notch 1, который. когда активен делает В-клеточные предшественники чувствительными к др. онтогенетическим выборам посредством миэлоидного цитокина M-CSF или T-клетки индуцирующих Notch лигандов. Pax5 необходим также для поддержания характеристик В клеток в противоположность Pax3/7 в скелетных мышцах, где детерминация клона гарантируется миогенными регуляторными факторами. Pax5 играет роль ключевого регулятора в В клетках, особенно в тяжелой цепи immunoglobulin (Fuxa et al. 2004) или перестройках легких цепей, при которых он непосредственно активирует транскрипцию k-sterile (Sato et al. 2004). Pax5 также непосредственно активирует промотор рекомбинацией активируемого гена Rag2 в незрелых В клетках (Jin et al. 2002). Это предоставляет пример сотрудничества между Pax5 и c-Myb, членом семейства Ets транскрипционных факторов. Более того, Pax5 и c-Myb действует кооперативно на промотор mb-1, который также активируется с помощью E2A и EBF (early B-cell factor) (see Busslinger 2004). Pax5 располагается ниже E2A и EBF в контроле развития B-лимфоцитов. Дифференцировка лимфоидных предшественников в immunoglobulin M-секретирующие плазматические клетки зависит от прямой репрессии Pax5 с помощью Blimp1, zinc-finger класса транскрипционного фактора (Lin et al. 2002) (Figure 3c).Интересно, что ubo гомолог гена prdm1/Blimp1 у рыбок данио играет ключевую роль в развитии клона медленных мышц (Baxendale et al. 2004), в котором РахЗ/7 не экспрессируются (Hammond et al. 2007). Pax 1/9 in the Formation of Cartilage and Bone Во время созревания сомитов экспрессия РахЗ (и Pax7) становится ограниченной дермомиотомом, тогда как частично перекрывающая экспрессия Pax1 и Pax9 маркирует вентральный склеротомный компартмент сомита (Borycki & Emerson 1997). Pax1/9 двойные мутанты лишены костей позвоночного столба и проксимальных частей ребер, а склеротомные клетки, которые вносят вклад в эти структуры неспособны к хондрогенезу (Peters et al. 1999). Bapx1 (Nkx3.1), который кодирует ключевой хондрогенный регуляторный фактор, является прямой мишенью Pax1/9 (Rodrigo et al. 2003). Pax1-мутантные эмбрионы обнаруживают дефекты позвоночного столба, видимые в меньшей степени у гетерозиготных Pax1 эмбрионов, указывая на гаплонедостатчность (Wilm et al. 1998). Рах9 имеют фенотипы, отражающие функцию Pax9 в местах образования кости в голове и теле, а также в производных фарингеальных карманов, таких как тимус, который неспособен развиваться у мутантов (Peters et al. 1999). Кроме того, развитие зубов арестовывается на стадии зубных зачатков в отсутствие Pax9, с потерей мезенхимной экспрессии Bmp4, Lef1 и Msx1, указывая тем самым на роль Pax9 в установлении индуктивной способности зубной мезенхимы. Непосредственное взаимодействие может происходить между Pax9 и Msx1, которые обнаруживают перекрывающуюся экспрессию во время развития зубов (Ogawa et al. 2005); Msx1 может противодействовать функции Pax9 путем ингибирования связывания Pax9 с ДНК, как это было предположено для Msx1/РахЗ в мигрирующих миогенных клетках (Bendall et al. 1999).
Pax гены, такие как Pax1 или Pax9 (Lang et al. 2007), экспрессируются во многих местах вдоль передне-задней оси развивающегося эмбриона. Сведения о том, как позиционная информация может быть интегрирована в функцию Pax получены в результате демонстрации генетических взаимодействий между Pax1 и Hoxa5 во время формирования плечевого пояса (Aubin et al. 2002) или взаимодействий между Pax1 и Hoxa3 во время органогенеза тимуса и паратироидных желез (Su et al. 2001). В обоих примерах Pax1 и Hoxa гены участвуют в ранних стадиях тканевой дифференцировки. Pax Regulatory Networks During Boundary Formation in the Central Nervous System Др. важным аспектом Pax функции является поддержание границ и ассоциированной региональной спецификации. Это иллюстрируется в сомитах, где Pax3/7 отграничивает дорсальный дермомиотом в противоположность экспрессии Pax 1/9 в склеротоме или внутри дермомиотома, где РахЗ, но не Pax7, накапливается в epaxial и hypaxial частях краёв. Выразительным примером роль генов Pax в региональной спецификации является ЦНС, где гены Pax экспрессируются в самостоятельных и частично перекрывающихся территориях развивающегося и взрослого головного мозга (Stoykova & Grass 1994). Экспрессия Рахб на di-mesencephalic границе репрессирует En1 и Pax2, лимитируя ростральное распространение tectum (Matsunaga et al. 2000). Pax2 важен для формирования истмического организатора на границе между средним и задним мозгом, где идентифицированы гены мишени, особенно Brn1 ген, который регулирует Fgf8 (Eouchard et al. 2005). Pax гены участвуют также в нейрогенезе per se, на что указывает потребность в Рахб для нейрогенеза в дорсальной части telencephalon (e.g.. Hack et al. 2004). В дополнение к роли РахЗ в нервном гребне его экспрессия вместе с Pax7, в дорсальной части нервной трубки является важной для предупреждения распространения характеристик вентральных нейронов (Mansouri & Grass 1998). THE ROLE OF PAX GENES IN REGULATING SURVIVAL, PROLIFERATION, AND CELL INTERACTIONS IN NONMYOGENIС TISSUES Cell Survival Связь между Pax транскрипционными факторами и жизнеспособностью клеток доказана джлдя многих тканей во время развития и является также важной в опухолях, ассоциированных с дерегуляцией генов Pax, что способствует выживанию раковых клеток ( Muratovska et al. 2003). Примеры апоптоза в результате потери функции Pax во время развития предоставляются фенотипами мутантов Pax1/Pax9 в склеротоме, который д. сформировать позвоночный столб (Peters et al. 1999) или мутантов Pax2/Pax8 во время образования почек (Bouchard et al. 2002). Интересно, что клеточная гибель в почках распространяется на соседние Pax-негативные регионы промежуточной мезодермы, указывая тем самым, что они распространяют свои эффекты на диффундирующие факторы клеточной жизнеспособности , Функция клеточной жизнеспособности Pax генов также важна при репарации тканей, что демонстрируется , напр.. ролью Рахб в регенерации хрусталиков (Goto et al. 2004) илиЯ. как обсуждалось выше ролью Pax7 в постнатальных сателлитных клетках (Relaix et al. 2006). Потеря экспрессии Рахб и последующий апоптоз хрусталиковых клеток оказывают влияние на онтогенетический арест в формировании глаз, наблюдаемый у слепых пещерных рыб, предоставляя пример того, как эта функция Pax может приводить к эволюционной адаптации (Tian & Price 2005). Прямые мишени для анти-апоптической функции Pax не были идентифицированы четко in vivo, но эксперименты на культивируемых клетках подтвердили, что bcl2 или bcl-xl могут отвечать как мишени Pax8 (Hewitt et al. 1997) или Pax4 (Brun et al. 2007), соотв. В самом деле, в клеточной линии rhabdomyosarcoma, РАХЗ или PAX3-FKHR также модулируют уровни BCL-XL (Margue et al. 2000). p53 также участвует в жизнеспособности клеток и может регулировать Pax белки, как это подтверждает негативная регуляция Pax-связывающего сайта в промоторе p53 с помощью Pax2/5/8 (Stuart et al. 1995). Генетические взаимодействия между p53 и Pax генами также были документированы, напр., при нормализации в случае потери функции p53 дефектов нервной трубки у Pax 1-мутантных эмбрионов, благодаря p53-зависимому апоптозу (Pani et al. 2002; but see also Borycki et al. 1999). Proliferation Экспрессия генов Pax часто обнаруживается в популяциях пролиферирующих клеток предшественников. Потеря функции Pax или избыточная экспрессия Pax, демонстрируют, что эти транскрипционные факторы играют роль в обеспечении пролиферации помимо клеточной спецификации. Это наблюдается с Pax2/Pax8 в развивающихся почках (Dressier & Woolf 1999), с Pax2 во внутреннем ухе (Li et al. 2004) и с Paxl/Pax9 в склеротоме (Peters et al. 1999). Рах6 участвует в прролиферации всех типов эндокринных клеток в поджелудочной железе (see Dohrmann et al. 2000) и играет также роль в клеточной пролиферации во время развития глаз (van Heyningen & Williamson 2002) и во время регенерации хрусталиков у взрослых (Madhavan et al. 2006, Ooto et al. 2004). Рах6 предупреждает также преждевременный выход из клеточного цикла в развивающейся коре головного мозга (Quinn et al. 2007), где отсутствие Рах6 влияет на продолжительность клеточного цикла и переход от асимметричных к симметричным делениям клеток предшественников(Estivill-Torrus etal. 2002). Cell Interactions Наблюдения за Pax-мутантными фенотипами подчеркивает роль Pax факторов в регуляции белков, участвующих в клеточных взаимодействиях. Дефекты миграции нервного гребня в отсутствие РахЗ опосредуются как через клоны нервного гребня, так и миграторное окружение (see Chan et al. 2004). Избыточная экспрессия chondroitin sulfate протеогликана versican ассоциирует с этим Pax-мутантным фенотипом (Henderson et al. 1997). Др. примером является роль Рах6 в раннем развитии глаз, во время которого он обеспечивает взаимодействия между оптическим пузырьком и поверхностным эпителием (Collinson et al. 2000). В случае Рах6 имеются доказательства потенциальной регуляции экспрессии молекул клеточной адгезии, включая α5β1 integrin (Duncan et al. 2000), с развитием катаракты во взрослых глазах.
В ряде систем. в которых Pax гены активированы, миграция клеток становится важным аспектом развития ткани. Помимо c-Met гена, который является мишенью для РахЗ в клетках миогенных предшественников, РахЗ в производных нервного гребня активирует также ген c-Ret. Этот ген кодирует рецептор, который взаимодействует с GDNF (glial cell-derived neurotrophic factor), который секретируется мезенхимными клетками, которые окружают энтерические ганглии, детерминируя тем самым их расположение (Lang etal. 2000). Эта сигнальная система также важна как наводящий сигнал в формировании почечных канальцев, дирижируемая с помощью Pax2 (Grote et al. 2006). Др. примером является активность Pax2 в потенциально переворачиваемой (reversing) транскрипционной репрессии промотора Rig-1, которая способствует экспрессии этого члена семейства Robo neuronal guidance рецепторов в заднем и спинном мозге (Yuan et al. 2002). TRANSCRIPTIONAL PROPERTIES OF PAX FACTORS Чтобы понять, как Pax белки регулируют спецификацию клеточных типов и поведение клеток предшественников, необходимо знать, как они действуют как транскрипционные факторы. В некоторых клетках, подобно Pax5 в B-lymphocyte клоне, молекулярные механизмы известны, тогда как для Pax3/Pax7 в миогенном клоне они в основном неизвестны. Нормализация РахЗ- мутантного фенотипа с помощью слитого белка PAX3-FKHR подтверждает, что РахЗ,в миогенном контексте, действует в основном как транскрипционный активатор, возможно с коактиваторами (Relaix et al. 2003). The Pax Protein Характерный 128-аминокислотный paired домен белков Pax содержит два субдомена, N-терминальный PAI домен и C-терминальный RED домен, распознающие двухсоставной сайт связывания ДНК из примерно 17 нуклеотидов (see Chi & Epstein 2002). Домен PAI законсервирован наиболее сильно и оказывает доминантный эффект на связывание ДНК. Он объясняет сходство ДНК-связывающих сайтов белков Pax, а различия в специфичности обусловлены преимущественно модификациями этих последовательностей, ка это было показано для Pax2/5/8 (G GCA TGAAGCGTGAA) и Рахб (у которого терминальный С замещен на A), которые отличаются по трем аминокислотам в домене PAI этих Pax белков (Czerny & Busslinger 1995). Некоторые Pax белки, подобно РахЗ и Pax7, содержат также гомеодомен (see Table 1), который в этом семействе характеризуется серином в позиции 50, необходимом для детерминации специфичности распознавания гомеодоменовых последовательностей палиндромного TAAT (N)2-3 ATTA мотива или как гомодимера или как гетеродимера с др. гомеодоменом. Высоко законсервированный octapeptide, который расположен между paired и homeodomains, обнаруживается во всех Pax белках за исключением Pax4 и Рахб (Table 1). Он обнаруживает гомологию с Engrailed repression доменом (Chi & Epstein 2002). Pax белки обладают слабым доменом активации транскрипциив -COOH части (e.g., Czerny & Busslinger 1995), которая в случае Pax3/7 охарактеризована недостаточно.
Pax гены могут давать ряд изоформ в результате альтернативного сплайсинга или используют разные промоторы. Разные транскрипты и изоформы РахЗ и Pax7 были описаны во время развития и в культивируемых линях клеток нервного гребня и миогенных, включая клетки rhabdomyosarcoma и опухолей (напр., Du et al. 2005, Lamey et al. 2004). Неясно, каково функциональное значение этих изоформ, хотя потеря домена транскрипционной активации может вызывать доминантно негативные эффекты (Pritchard et al. 2003). В случае Pax8, альтернативный сплайсинг создает, по крайней мере, 6 разных вариантов, которые обладают самостоятельными паттернами экспрессии во время развития мышей и разным трансактивационным потенциалом (Xozmik et al. 1993), но опять же значение in vivo ещё предстоит выяснить. Функциональный анализ двух альтернативных изформ Pax5, одна из которых действует как доминантно негативная форма, подтверждает регуляторную роль во время активации и пролиферации В клеток (Lowen et al. 2001). наиболее охарактеризованным примером сплайс-форм является Рахб (5a) вариант, в котором PAI субдомен paired домена потерян благодаря инсерции дополнительного в 14 аминокислот экзона (Hever et al. 2006), отсуюда измененные ДНК-связывающие свойства белка. Мутантный анализ подтвердил, что Рахб (5a) не играет существенной роли в спецификации глаз (Singh et al. 2002), но может влиять на пролиферацию клеток (Haubst et al. 2004). Рахб (5 a) экспрессируется также на высоком уровне после рождения и может действовать кооперативно с Рахб в глазах взрослых (Chauhan et al. 2004).
Pax подвергаются также модификациям. Окислительно-восстановительные эффекты на цистеиновый остаток в Pax8 paired домене могут влиять на связывание ДНК (Cao et al. 2002), а манипуляции с такими модификациями выявляют функциональную зависимость между paired и гомеодоменами (Apuzzo & Gros 2002). Pax белки часто фосфорилированы, напр., в случае Pax2, модификация аминокислот в трансактивационном домене с помощью JNK-обусловленного фосфорилирования, может увеличивать его активность (Cai et al. 2002). В миогенном контексте, неканоническая передача сигналов Wnt , вызванная protein kinase С (PKC) из дорсальной эктодермы, регулирует транскрипционную активность РахЗ и его способность активировать MyoD (Brunelli et al. 2007). Это может быть связано с фосфорилированием РахЗ или модуляцией коактиватора. Pax Cofactors Pax белки взаимодействуют со многими кофакторами, которые опосредуют их транскрипционную активность. Одним из таких наиболее изученных примеров является корепрессор, член семейства Groucho (Grg/TLE), который взаимодействует с Pax octapeptide доменом (Chi & Epstein 2002; Table 1). Классическим примером является репрессия транскрипции Pax2/5/8 за счет прямого взаимодействия с семейством Groucho (Eberhard et al. 2000). Соединение Grg4 (Groucho) с Pax5 нуждается в др. взаимодействующем с Groueho транскрипционным фактором (напр., PU-I) для стабильного рекрутирования белков Groucho, чтобы репрессировать гены мишени во время возникновения клона В лимфоцитов (Linderson etal. 2004). Рахб и Pax7 также действуют как репрессоры путем взаимодействия в белками Grg proteins, это функционально важно для формирования паттерна нервной трубки (Muhr et al. 2001). Дополнительным аспектом связывания Groucho может быть лимит доступности киназ, как это показано в случае Pax2 (Cai et al. 2003).идентифицированы и др. кандидаты на роль корепрессоров. Для РахЗ, транскрипционные корепрессоры HIRA и Daxx, как было установлено. взаимодействуют с РахЗ гомеодоменом (Chi & Epstein 2002). Хотя HIRA экспрессируется в нервном гребне, значение in vivo этих взаимодействий еще предстоит продемонстрировать. Взаимодействие между EF-hand кальций-связывающим белком calmyrin, экспрессируемым в миобластах, и доменом paired РахЗ обеспечивает негативную регуляцию за счет вмешательства в связывание РахЗ с ДНК (Hollenbach et al. 2002). Негативная регуляция функции Pax2/5/8 может осуществляться за счет взаимодействия Id helix-loop-helix белков, которые также взаимодействуют с paired доменом и, следовательно, вмешиваются в связывание ДНК (Roberts et al. 2001). Id участвует в регуляции миогенного фактора (Benezra et al. 1990).
Pax белки действуют как активаторы совместно с др. транскрипционными факторами и в ряде случаев управляют физическими взаимодействиями. Ярким примером важности межбелковых взаимодействий для функции Pax является взаимодействие paired и Ets доменов, которое происходит, когда Pax5 рекрутирует субнабор Ets белков на Ets-связывающий сайт с низким сродством, меняя тем самым распознавание ими ДНК последовательностей (see Busslinger 2004). Рахб сотрудничает с Sox2 во время развития хрусталика, а РахЗ сотрудничает с Sox10 во время развития нервного гребня. При развитии хрусталика такое непосредственное взаимодействие способствует ассоциации Sox2 с ДНК, что ведет к синергичной активации генов мишеней (Kamachi et al. 2001). Рахб также непосредственно взаимодействует с Cdx2/3 и Maf1 (напр., Planque et al. 2001) . чтобы активировать гены во время панкреатического эндокринного развития. Pax4 сотрудничает с гомеодоменовыми белками Nkx2.2 во время развития почек (see Sosa-Pineda 2004), а Pax8 с Nkx2.1 во время развития щитовидной железы (De Felice & Di Lauro 2004). В то время как в первом примере они действуют независимо, в последнем они формируют транскрипционный комплекс. действующий синергично на гены мишени во время дифференцировки фолликулярных клеток (Di Palma et al. 2003). Взаимодействия Pax гомеодомена с др. гомеодоменами также было продемонстрировано in vitro для Mox1 с Pax1 и для Mox2 с РахЗ, соотв. (Stamataki et al. 2001). Сложные генетические взаимодействия между Pax белками и Six гомеодоменовыми факторами - которые играют важную роль в миогенезе (Pax3/7 и Six 1/4) (see Grifone et al. 2005), ы развитии глаз (Pax6/Six3) (see Groudreau et al. 2002), и в развитии почек (Pax2/Sixl, 2) (see Bouchard 2004) и внутреннего уха (Pax2, Sixl) (see Zou et al. 2006)- по-видимому, не связаны с физическим взаимодействием между белками. Однако, факторы могут находить соседние регуляторные последовательности (напр., Giordani et al. 2007).
Pax белки взаимодействуют с членами семейства pRb посредством Pax гомеодомена, как это было показано для РахЗ (Wiggan et al. 1998) или Pax5 (Eberhard & Busslinger 1999). Rb белки контролируют выход из клеточного цикла благодаря модуляции факторов, таких как E2F. Т.о., РахЗ модуляция активности Rb белка может составлять потенциальный механизм регуляции клеточного цикла и контроля пролиферации. Однако, это взаимодействие может затрагивать и активность Pax белков. Взаимодействие с нефосфорилированными формами Rb может приводить к секвестрации Pax5 в цитоплазме (Sato et al. 2001). Rb может также действовать как транскрипионный коактиватор, как это было продемонстрировано в отношении взаимодействия Pax8-Rb на промотор гена thyroper-oxidase во время дифференцировки фолликулярных клеток щитовидной железы (Miccadei et al. 2005). Взаимодействие Pax белков с членами семейства Rb может следовательно, создавать функциональное сцепление между спецификацией клеток и контролем за ходом клеточного цикла. Др. примером подобной потенциальной связи является PTIP (Pax transactivation domain-interacting protein), который взаимодействует с Pax белками (напр., Pax2) и содержит BRCT домен, ассоциированный с активным хроматином (Lechner et al. 2000) и участвующий в контроле клеточного цикла (Cho et al. 2003).
Дальнейшими аспектами Pax транскрипционной функции является связь с основной транскрипционной кухней, как указывает взаимодействие Pax5 гомеодомена с TATA-связывающими белками (Eberhard & Buss linger 1999) или взаимодействие Pax с потенциальными адапторными молекулами. такими как WBP-2, которые взаимодействуют с -COOH доменом Pax8 (Nitsch et al. 2004), это потенциально делает возможным дополнительный ранг взаимодействий Pax/белок.
Роль Pax комплексов как транскрипционных активаторов или репрессоров, действующих внутри клетки, где они синтезируются, является центральной для функции Pax. Однако, существует и др. измерение, которое не следует игнорировать. Оно связано с потенциалом гомеодоменовых белков, таких как Pax, чтобы подвергнуться секреции и интернализации др. клетками и тем самым, чтобы действовать не клеточно автономно как сигнальные молекулыю Напр., недавние наблюдения за функцией Рахб во время развития глаз у рыбок данио подтверждают такую возможность
(Lesaffre et al. 2007). CONCLUDING REMARKS The functions of РахЗ/1 in the formation of skeletal muscle (Figure 4) are similar to those of other Pax genes, notably in directing progenitor cells into the myogenic program and in assuring their survival. This dual role ensures that a stem cell that has lost its myogenic potential will die rather than proliferate or adopt other cell fates, thus avoiding deleterious consequences for the organism. Compared with the function of other Pax-regulated lmeages, such as that of Pax5 in the B-lymphocyte lineage, РахЗ/7 function at the molecular level is still poorly understood. Few direct targets have been identified, and cofactors that interact with РахЗ/7 in the myogenic context in vivo are unknown. Ongoing microarray analyses and chromatin im-munoprecipitation approaches should rapidly yield more information. The collaboration between Pax3/7 and other transcriptional regulators, including input from signaling pathways, remains to be elucidated. This is evidenced by the complex genetic interactions with the Six/Eya family, which are seen also for a number of other Pax genes in other tissue contexts. Unraveling such interactions, or indeed the question of Hox gene input and positional information, will also require examination of РахЗЛ gene regulation. Tills is outside the scope of this reviewr, but again little is known about РахЗЛ regulation during myogenesis; an enhancer driving hypax-ial somite expression has been identified upstream of РахЗ (Brown et al. 2005). This is in contrast to, for example, Рахб, for which 5' enhancers as well as an important regulatory region at >100 kb 3' to the gene control its spatiotemporal expression in the pancreas and eye (e.g., van Heyningen & Williamson 2002). Pax gene regulation is central to the question of where Pax genes function within a tissue-specific hierarchy. There are examples, such as the pancreas, for wiiich upstream genes delimit pancreatic fate prior to Pax function. In the case of myogenesis, the emergence of paraxial mesoderm and somitogenesis depend 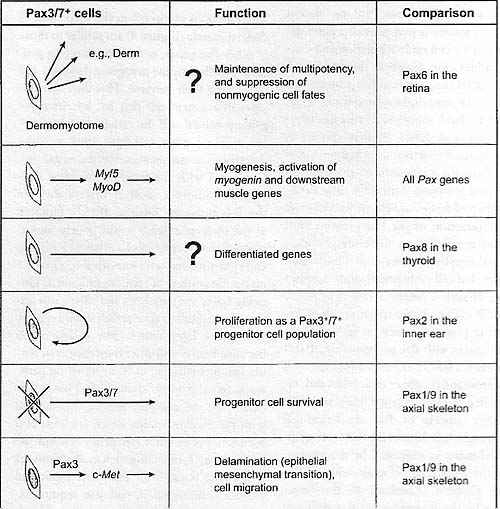 Fig. 4 . Pax3/7 functions in myogenic progenitor cells are listed schematically with reference to those of other Pax factors. A question mark indicates that this function, seen for another Pax, has not yet heen established for Pax3/7. Fig. 4 . Pax3/7 functions in myogenic progenitor cells are listed schematically with reference to those of other Pax factors. A question mark indicates that this function, seen for another Pax, has not yet heen established for Pax3/7. on upstream regulators. However, РахЗ and Pax7 appear to function at the top of the genetic hierarchy that leads to the formation of skeletal muscle. |