Др. объяснением жизнеспособности MBD-нокаутных мышей является то, что метилирование ДНК само по себе может быть достаточным для замалчивания генов путем ингибирования связи транскрипционных активаторов. MBD белки могут быть необходимы не для инициации репрессии, а только для её поддержания, и поэтому оказывают незначительные эффекты. Возможно также, что non-MBD белки, включая Zinc finger или SRA-содержащие белки важны для распознавания метилированной ДНК во время раннего развития.
Даже если они не являются существенными для жизнеспособности, белки MBD выполняют некие важные роли в др. специфических контекстах. MBD1 скорее всего участвует в поддержании стабильности генома. MBD1 нокаутные мыши обнаруживают повышенную геномную нестабильность и повышенную экспрессию повторяющихся элементов IAP (Zhao et al., 2003). более того, MBD1 взаимодействует с methylpurine-DNA glycosylase (MPG), которая вырезает поврежденные основания из ДНК субстрата и репарирует повреждения оснований в области гетерохроматина (Watanabe et al., 2003). Эти находки открывают возможность, что MBD1 связан с поддержанием генома с транскрипционно молчащими структурами хроматина.
MBD2-нулевые мыши более резистентны, чем мыши дикого типа к кишечному туморогенезу, если скрещиваются с APC
Min/+ мышами, моделирующими семейный adenomatous polyposis человека (Sansom et al., 2003). Это указывает на то, что MBD2 необходим для формирования опухолей, из-за того, что он репрессирует некоторые метилированные гены опухолевых репрессоров. Интересно, что MBD2 обилен в толстом кишечнике и репрессирует экспрессию экзокринных панкреатических генов, которые не обязательны для функции толстого кишечника зависимым от метилирования ДНК образом (Berger et al., 2007). MBD2
TABLE 2
KNOCKOUT PHENOTYPES OF MBP GENES IN THE MOUSE
нокаутные мыши также обнаруживают материнский дефект поведения (Hendrich et al., 2001). причина этого неизвестна, но может быть связана с существованием множества генов, подвергающихся импринтируемой экспрессии в головном мозге и это может влиять на поведение (Davies et al., 2005). MBD2 также участвует в регуляции гена interleukin4 во время дифференцировки T-helper клеток в Th2-helper клетки (Hutchins et al., 2002). Кроме того, некоторые др. гены сходным образом регулируются с помощью MBD2. Недавнее исследование показало, что MBD2 участвует в репрессии метилированного
Xist гена на активной Х хромосоме (Barr et al., 2007).
Functions of the MBD proteins in the nervous system
Метилирование ДНК важно для нейрогенеза. Хорошо известно, что оно регулирует время дифференцировки астроцитов (Kondo, 2006). Напр., метилирование CpG сайта внутри STAT3-связывающей последовательности, расположенной в промоторе GFAP является критическим детерминантом дифференцировки астроцитов в головном мозге плода (Takizawa et al., 2001). Соотв., белки MBD, по-видимому, играют важную роль в головном мозге. MBD1 экспрессируется на высоком уровне в гиппокампе и в субпопуляции незрелых клеток, а MBD1-дефицитные нейральные стволовые клетки обнаруживают пониженную дифференцировку нейронов (Zhao et al., 2003). MBD1 нокаутные ES клетки или мыши обнаруживают снижение нейрогенеза и дефицит пространственного обучения и dentate gyrus-специфической долговременной потенциации. Хотя точный молекулярный механизм, с помощью которого MBD1 регулирует эти пути, всё ещё неясен, MBD1, по-видимому, играет важную роль в эпигенетической регуляции функции ЦНС.
Мутации в гене MeCP2 ассоциированы с Rett синдромом, X-сцепленным нейрологическим заболеванием человека, которое возникает почти исключительно у женщин (Amir et al., 1999). MeCP2 мутантные мыши также обнаруживают сходный фенотип (Chen et al., 2001, Guy et al., 2001),указывая тем самым, что MeCP2-дефицитные мыши являются модельной системой Rett синдрома человека. Т.к. MeCP2 действует как транскрипционный репрессор, то предполагается, что уровни экспрессии специфических для MeCP2 генов мишеней нарушены у пациентов с Rett синдромом или у MeCP2-нулевых мышей. Хотя первоначальный анализ микромассивов для дикого типа и MeCP2 нокаутного головного мозга не выявил глобальных изменений в экспрессии генов (Tudor et al., 2002), но недавнее исследование идентифицировало несколько кандидатов на роль генов мишеней для MeCP2 (Kriaucionis et al., 2006; Chahrour et al., 2008). Важно, что один из генов мишеней для MeCP2 это нейротрофный фактор BDNF, который репрессируется с помощью MeCP2/Sin3A комплекса, но активируется с помощью передачи сигналов Ca2+ (Chen et al., 2003, Martinowich et al., 2003). MeCP2 участвует также в регуляции нейрональных генов благодаря кооперации с REST (Ballas et al., 2005) и импринтируемыми генами Dlx5 и Dlx6 (Horike et al., 2005). Недавно было показано, что специфичная для головного мозга микроРНК, miR-184, регулируется с помощью MeCP2 (Nomura et al., 2008). Однако механизм регуляции генов мишеней с помощью MeCP2 всё ещё до конца непонят, он д. действовать посредством механизмов, иных чем репрессия инициации транскрипции (Bienvenu and Chelly, 2006). В самом деле, MeCP2 регулирует сплайсинг путем взаимодействия с РНК-связывающим белком YB1 (Young et al., 2005). Более того, анализ всего генома с помощью ChIP-on-chip технологии в клетках нейробластомы идентифицировал сайты связывания MeCP2 исключительно в экспрессируемых генах, но не в репрессированных генах, как ожидалось (Yasui et al., 2007). Необходим дальнейший анализ, чтобы понять роль MeCP2 в Rett синдроме. Недавно установлено, что фенотип, вызываемый отсутствием MeCP2 обратим, если белок добавляется обратно к мутантным нейронам (Guy et al., 2007).
Methyl-CpG binding proteins of the Zinc finger family
Известны три белка, распознающие methyl-CpG посредством цинковых пальчиков: Kaiso, ZBTB4 и ZBTB38.
Kaiso первоначально был идентифицирован с помощью дрожжевого двугибридного скрининга при поиске белков, которые взаимодействуют с p120 catenin (Daniel and Reynolds, 1999). Kaiso содержит три тандемных цинковых пальчика на С-конце и BTB домен на N конце (Fig. 1). Т.к. p120 catenin сходен с клеточным адгезивным кофактором β-catenin и plakoglobin, то предполагается, что Kaiso является нижестоящим ээффектором передачи сигналов β-catenin и p120 catenin (van Roy and McCrea, 2005). Kaiso был также независимо идентифицирован как компонент белкового комплекса. который соединяется с регионом S100A4 гена мыши зависимым от метилирования образом (Prokhortchouk et al., 2001). В то время как MBD белки распознают одиночные метилированные CpG, Kaiso нуждается в двух последовательно и симметрично метилированных CpG последовательностях для оптимального связывания. Kaiso также был биохимически идентифицирован в ядерных экстрактах клеток HeLa как компонент NCoR корепрессорного комплекса, включая HDAC3, GPS2 и TBL1/TBLR1 (Yoon et al., 2003). Kaiso непосредственно соединяется с NCoR посредством своего BTB домена; такого типа взаимодействие с корепрессорами с участием BTB является общим признаком BTB-zinc finger транскрипционных факторов (Collins et al., 2001). Kaiso рекрутирует комплекс NCoR на MTA2 промотор зависимым от метилирования ДНК способом, приводя к гипоацетилированию и метилированию K9 H3 в промоторном регионе (Yoon et al., 2003). Это показывает, что Kaiso является зависимым от метилирования ДНК транскрипционным репрессором гена MTA2 (Fig. 3). Однако т.к. культивируемые клетки не отражают нормальный паттерн метилирования ДНК, то остается неизвестным является ли MTA2 действительно мишенью для Kaiso в нормальных клетках, пока нет информации и метилированных генах мишенях для Kaiso в нормальных клетках.
Геном человека кодирует два белка, которые имеют Kaiso-подобные цинковые пальчики: ZBTB4 и ZBTB38 (Filion et al., 2006). Оба белка содержат BTB домен и они более длинные и более сложные, чем Kaiso, возможно из-за того, что они содержат дополнительные цинковые пальчики (Fig. 1). Эти два белка подобно Kaiso, соединяются с метилированной ДНК благодаря своим трем Kaiso-подобным цинковым пальчикам. Однако в противоположность Kaiso, они могут связываться с одиночными метилированными CpG последовательностями. ZBTB4 и ZBTB38 репрессируют транскрипцию метилированных промоторов и локализуются в плотно упакованных метилированных перицентромерных гетерохроматиновых регионах в клетках мыши зависимым от метилирования ДНК способом. Это подтверждает идею, что ZBTB4 и ZBTB38 являются bona fide methyl-CpG-связывающими белками. Как и для Kaiso, однако, их гены мишени в нормальных клетках неизвестны.
Bimodal DNA binding activity of Kaiso and ZBTB4
Помимо связывания метилированной ДНК, Kaiso соединяется с высоким сродством с ДНК последовательностью TCCTGCNA, которая не метилирована. Эта последовательность названа Kaiso-binding sequence или KBS (Daniel et al., 2002). KBS присутствует в промоторе matrilysin, мишени для Wnt/ beta-catenin/TCF. Она связывается с помощью Kaiso, который, по-видимому, репрессирует её транскрипцию in vivo (Fig. 3) (Spring et al., 2005). Кроме того, Kaiso соединяется с 5' beta-globin insulator, который содержит KBS in vivo (Defossez et al., 2005). ZBTB4 также может связывать KBS, по крайней мере in vitro, но ZBTB38 не может (Filion et al., 2006). Конечно Kaiso-подобные цинковые пальчики ZBTB38 могут связывать различные неметилированные консенсусные последовательности, которые неизвестны.
Как одни и теже 3 цинковых пальчика направляют Kaiso (и ZBTB4) к метилированной ДНК или неметилированнным консенсусным последовательностям? Детальный анализ показал, что третий пальчик, по крайней мере, эволюционно законсервирован, тогда как первый и второй пальчики обнаруживают высокую гомологию у Kaiso, ZBTB4 и ZBTB38 у разных
Fig. 3. Mechanisms of Kaiso-mediated transcriptional repression. Kaiso binds to the KBS of target promoters and represses their transcription by recruiting a corepressor complex including HDAC3 and NCoR (left). Kaiso also represses methylated promoters via recruitment of the NCoR complex (right). The binding of Kaiso to these sequences is inhibited by direct interaction of p120 catenin with the zinc finger region of Kaiso.
Fig. 4. Evolutionarily conserved methyl-CpG-binding zinc fingers. (A) Multiple alignments of methylCpG binding zinc fingers of Kaiso, ZBTB4 and ZBTB38 from human (Homo sapiens), mouse (Mus musculus) , chicken (Gallus gallus), frog (Xenopus tropicalis ) and zebrafish (Danio rerio) . We searched for proteins that contain three methyl-binding zinc finger motifs in the NCBI and Ensembl databases. Based on their structure and sequences, the proteins were classified as orthologs of Kaiso, ZBTB4 or ZBTB38. The alignment was performed using the Clustal W algorithm. (B) The domain structures of human (HsZBTB38) and two zebrafish ZBTB38 proteins (DrZBTB38a and DrZBTB38b). The methyl-binding zinc fingers are indicated by bold lines.
видов позвоночных (Fig. 4). Это указывает на то, что эти два пальчика играют важные роли в распознавании ДНК, , однако ясно также, что они участвуют во взаимодействии с партнерскими белками. Хотя Kaiso, ZBTB4 и ZBTB38, как было установлено, соединяются с различными метилированными зондами in vitro (Prokhortchouk et al., 2001, Filion et al., 2006), неясно, можетли их связывание испытывать влияние со стороны последовательностей, фланкирующих метилированые CpGs, как в случае MeCP2 (Klose et al., 2005).
Mechanism of transcriptional repression by Kaiso-like proteins
Kaiso репрессирует транскрипцию путем рекрутирования NCoR комплекса, но ZBTB4 и ZBTB38 ведут себя по-другому. ZBTB38, скорее всего, рекрутирует комплекс, содержащий корепрессорный белок CtBP: мышиный ортолог ZBTB38 взаимодействует с двумя близко родственными белками CtBP1 и CtBP2 и рекрутирует их на плотно метилированный перицентромерные гетерохроматин (Sasai et al., 2005). CtBP участвует в репрессии эпителиальных и проапоптичеких генов, а нокдаун CtBP ведет к апоптозу независимым от p53 образом (Grooteclaes et al., 2003, Zhang et al., 2003). Более того, CtBP1 и CtBP2 выполняют перекрывающиеся и уникальные роли во время развития, а нокаут обоих генов ведет к эмбрональной летальности (Hildebrand and Soriano, 2002). CtBP ассоциирует со многими транскрипционными факторами и кофакторами (Chinnadurai, 2002), а ZBTB38 может быть одним из них. Комплекс CtBP включает гистоновые деацетилазы, метилтрансферазы и деметилазы (Shi et al., 2003), и вполне возможно, что ZBTB38 рекрутирует эти энзимы, чтобы репресировать метилированные гены мишени.
ZBTB4 также является транскрипционным репрессором, но способ его действия неизвестен и скорее всего отличен от такового у Kaiso или ZBTB38. В самом деле. мы установили, что мотив взаимодействия с CtBP, обнаруживаемый в ZBTB38, отсутствует в ZBTB4. BTB домен, который важен для репрессии у Kaiso, не нужен для репрессии с помощью ZBTB4 (Filion et al., 2006). Фактически, домен BTB в ZBTB4 прерывается длинной вставкой, богатой серином, и, по-видимому, потерял свою репрессивную функцию lost its repressive function (Perez-Torrado et al., 2006). Недавно было показана ассоциация ZBTB4 с Sin3/HDAC комплексом при репрессии промотора p21, хотя репрессия не зависела от связывания метилированной ДНК (Weber et al., 2008).
Kaiso is essential for amphibian development
Геном Xenopus кодирует гомолог Kaiso, xKaiso (Kim et al., 2002). Истощение xKaiso с помощью morpholino oligos ведет к эмбриональной гибели из-за неспособности к гаструляции, преждевременной активации зиготических генов до перехода к mid-blastula и апоптоза (Kim et al., 2004, Ruzov et al., 2004). xKaiso как полагают, репрессирует разные гены пути Wnt, которые содержат KBSs в своих промоторах (Wnt11 (Kim et al., 2004), Siamois, c-Fos, Cyclin-D1 и c-Myc (Park et al., 2005)), и это объясняет его эффект. Интересно, что , однако фенотип при нокдауне xKaiso сосершенно одинаков с таковым у гипометилированных эмбрионов, у которыех истощена DNA methyltransferase xDnmt1 (Stancheva and Meehan, 2000, Stancheva et al., 2001). Однако, DNMT1, по-видимому, играет многофункциональную не-ферментативную роль в развитии, недавнее исследование показало, что xDNMT1 функционирует как транскрипционный репрессор независимо от её каталитической активности во время раннего развития (Dunican et al., 2008). Несмотря на это, Richard Meehan с сотрудниками недавно показали, что фенотипы деплеции xKaiso устраняются с помощью Kaiso рыбок данио, который соединяется с метилированной ДНК, но не с KBS (Ruzov et al., 2009b). Эти нахродки указывают на то, что функция связывания KBS у Kaiso не нужна для развития Xenopus.
Functional redundancy among Kaiso family proteins?
Учитывая возможное вовлечение Kaiso в репрессию генов пути Wnt и важность xKaiso для амфибий, ожидалось, что Kaiso у мышей будет важным для эмбрионального развития. Однако неожиданно нокаут Kaiso мыше не вызывал явных фенотипических отклонений (Table 2) (Prokhortchouk et al., 2006). Экспрессия предполагаемых генов мишеней для Kaiso, таких как MTA2, S100A4 и Wnt11 также оказалась неизменной в kaiso-дефицитных тканях мыши.
Почему дефицит Kaiso дает разные результаты у Xenopus и мыши? Одно из возможных объяснений заключается в том, что роль метилирования ДНК в контроле зиготических генетичеких программ различна у мышей и лягушек (Prokhortchouk et al., 2006). Это подтверждается и в случае MeCP2, который несущественен для эмбрионального развития мышей (Chen et al., 2001, Guy et al., 2001), но регулирует экспрессию Hairy2a у Xenopus. Соотв. деплеция MeCP2 у Xenopus ведет к тяжелым дефектам нейрогенеза во время развития (Stancheva et al., 2003). Кроме того, важно также отметить возможность, что Kaiso функционально перекрывается с ZBTB4 и ZBTB38 или с семейством белков MBD. Недавнее исследование показало, что Kaiso, MBD2 и MeCP2 не перекрываются во время эмбриогенеза, но обнаруживают перекывающиеся функции в нейральной дифференцировке (Martin Caballero et al., 2009). Учитывая сходство свойства связывания ДНК Kaiso и ZBTB4, эти два белка могут быть функционально перекрывающимися (Filion et al., 2006). ZBTB4 может быть фактором, который устраняет дефицит Kaiso у мышей, отсутствие аналога ZBTB4 у Xenopusтакже может объяснить присутствие фенотипических отклонений у лягушек.
Хотя паттерны экспрессии Kaiso, ZBTB4 и ZBTB38 перекрываются в некоторых тканях взрослых мышей (Daniel and Reynolds, 1999, Sasai et al., 2005, Filion et al., 2006), степень перекрывания между Kaiso, ZBTB4 и ZBTB38 неизвестна и может быть выяснена только после получения мутантных мышей по всем трем генам. Пока предполагается, что гены перекрываются частично и обладают некоторыми неперекрывающимися функциями. Во-первых, p120 catenin, по-видимому, регулирует Kaiso: Kaiso-p120 catenin взаимодействие устраняет связывание Kaiso с ДНК (метилированной или нет) и ингибирует его репрессивное действие (Daniel et al., 2002, Kelly et al., 2004). ZBTB4 и ZBTB38, в противопложность Kaiso, не взаимодействуют с p120 catenin (Filion et al., 2006). Следовательно, ZBTB4 и ZBTB38 вряд ли используются при передаче сигналов catenin. Во-вторых, различия между Kaiso и ZBTB4/ZBTB38 касаетя и их рапределения в клетках: в трансфицированных фибробластах мышей ZBTB4 и ZBTB38 преимущественно локализуются в перицентромерном гетерохроматине, тогда как Kaiso обнаруживает паттерн диффузного заполнния ядра (Filion et al., 2006). В-третьих, домен BTB у Kaiso, как известно, гомодимеризуется (Daniel and Reynolds, 1999), тогда как у ZBTB4 и ZBTB38 не может димеризоваться посредством BTB доменов, но гомодимеризуется или гетеродимеризуется посредством цинковых пальчиков (Kiefer et al., 2005, Filion et al., 2006). Чтобы лучше понять функциональные различия белков семейства Kaiso, необходимо определить, имеют ли все три белка связь с теми же самыми сайтами или имеют разные предпочтения связывания.
Evolution of Kaiso family proteins: ZBTB4 is restricted to mammals
Исследования геномных баз данных показали, что родственные Kaiso белки обнаруживаются у позвоночных, но не у беспозвоночных, таких как Ciona intestinalis и у растений, даже если эти виды содержат метилированную ДНК (Table 1). Это указывает на то, что семейство Kaiso выполняет специфические роли у позвоночных. Kaiso и ZBTB38 обнаруживаются в геномах всех позвоночных от рыбок данио (Danio rerio) tдо человека, тогда как ZBTB4 обнаруживается у млекопитающих, но не у рыбок, Xenopus или кур (Gallus gallus) (Table 1). Это указывает на следующую последовательность событий: Kaiso и ZBTB38 возникают из общего родоначального гена в определенный момент, близкий к переходу от беспозвоночных к позвоночным. ZBTB4 затем образуется за счет дупликации гена ZBTB38 неколько позднее (Filion et al., 2006).
Геномы рыбок данио, medaka (Oryzias latipes) и колюшки (Gasterosteus aculeatus) содержат по два ZBTB38-подобных гена, DrZBTB38a и DrZBTB38b. DrZBTB38b лишен BTB домена, но обнаруживает общее сходство с ZBTB38 скорее, чем с ZBTB4, указывая тем самым, что этот ген возник в результате дупликации DrZBTB38a (Fig. 4). Эта дупликация является специфической только для некоторых видов рыб, так как Fugu (Takifugu rubripes) и Tetraodon nigroviridis содержат только один ген ZBTB38, подобно Xenopus tropicalis и Xenopus laevis. Интересно, что это напоминает MBD3, для которого найдено два родственных гена у рыбок данио и Fugu, но только один у млекопитающих (Hendrich and Tweedie, 2003). Поскольку мы незнаем в точности, какие аминокислоты важны для связывания ДНК, то пока невозможно предсказать связывают ли Kaiso-подобные белки у низших позвоночных KBS, или метилированную ДНК или и то и др. или ни один из них. В то время как для Kaiso очевидно, что methyl-связывающая активность эволюционно законсервирована, тогда как KBS-связывающая активность варьирует между видами (Ruzov et al., 2009).
SRA proteins: essential proteins for the maintenance of DNA methylation
Третий класс methyl-CpG связывающих факторов это UHRF1 (также наз. Np95 и ICBP90) и родственный белок UHRF2 (также наз. NIRF). У этих белков SRA домен (SET and Ring finger-associated) ответственен за связывание methyl-CpG. Они также содержат ubiquitin-подобный домен, Ring finger мотив и PHD finger (Fig. 1). UHRF1 был первоначально идентифицирован как белок. который соединяется с CCAAT box в промоторе гена topoisomerase IIα (Hopfner et al., 2000). Однако, UHRF1 и UHRF2, как оказалось, соединяются с более высоким сродством с метилированной ДНК, чем с CCAAT box (Unoki et al., 2004). UHRF1 участвует в регуляции клеточного цикла и контроле за повреждениями ДНК (Bonapace et al., 2002, Muto et al., 2002) и регулирует клеточную пролиферацию путем репрессии метилированных генов опухолевых супрессоров путем рекрутирования HDAC комплекса на промоторы (Unoki et al., 2004). UHRF1 колокализуется с фокусами репликации в средней - поздней S фазе и необходим собственно для образования гетерохромтина в клетках млекопитающих (Papait et al., 2007). Т.к. Ring finger в UHRF1 функционирует в качестве E3 ubiquitin ligase для гистона H3 (Citterio et al., 2004), то предполагается, что UHRF1 транслирует метилирование ДНК в модификации гистонов.
Недавно было четко продемонстрировано, что UHRF1 обеспечивает эпигенетическое наследование метилирования ДНК (Bostick et al., 2007, Sharif et al., 2007). UHRF1 ассоциирует с DNMT1 и PCNA в регионах реплицирующегося гетерохроматина. Т.к. UHRF1 обладает предпочтительной связывающей активностью к полу-метилированной ДНК по сравнению с полностью метилированной ДНК (Bostick et al., 2007), DNMT1 специфически рекрутируется на полу-метилированные сайты с помощьюUHRF1 во время репликации ДНК. UHRF1 нокаутные мыши погибают во время раннего эмбриогенеза точно также как Dnmt1 мутанты (Table 2) (Sharif et al., 2007). Более того, у UHRF1-дефицитных мышей и ES клеток, метилирование импринтированных генов и сателлитных повторов снижено. В итоге, UHRF1рассматривается
Fig. 5. Functions of UHRF1 during DNA replication. (A) Schematic representation of UHRF1. UHRF1 binds to methylated DNA as well as DNMT1 and HDAC1 via the region including the SRA domain. The PHD finger binds to methylated K9 of H3 and the Ring finger functions as an E3 ubiquitin ligase. (B) A model for the maintenance of DNA methylation by the UHRF1-DNMT1 complex during DNA replication. UHRF1 binds to hemi-methylated DNA at the replication foci and recruits DNMT1 to maintain the DNA methylation status. UHRF1 is also likely to ensure the heritability of histone modification by recruiting the G9a-containing complex.
как очень важный для доставки DNMT1 на полу-метилированную ДНК, чтобы гарантировать, что ДНК окажется посторно метилированной после репликции (Fig. 5). Кроме того, покольку UHRF1 комплекс содержит G9a histone methyltransferase и PHD finger из UHRF1 соединяется с метилированным K9 из H3 (Sharif et al., 2007, Karagianni et al., 2008), UHRF1 может быть важен для поддержания также гистоновых меток. Более того, кристаллическая структура SRA домена из UHRF1, связанного с полу-метилированной ДНК, показывает, что SRA домен распознает метилированную ДНК по зеркальному отражению (flipping) methyl-cytosine из спирали ДНК (Arita et al., 2008; Avvakumov et al., 2008; Hashimoto et al., 2008), это совершенно отлично от распознавания симметрично метилированной ДНК с помощью домена MBD (Ho et al., 2008). Это исследование отвечает на важный вопрос, почему DNMT1 обладает врожденной способностью распознавать полу-метилированную ДНК (Jeltsch, 2006). Однако остается неясным, действительно ли UHRF1 необходим для поддержания метилирования ДНК по всему геному, или это касается лишь некоторых специфических регионов. Играет ли родственный белок UHRF2 сходную роль?
Во всяком случае, ситуация с UHRF1 напоминает MBD1, который ассоциирует с p150 субъединицей CAF-1 и PCNA во время S-фазы, и поддерживает H3-K9 метилирование посредством рекрутирования histone methyltransferase SETDB1, чтобы метилировать ДНК (Sarraf and Stancheva, 2004). Бвло бы интерсно посмотреть, действует ли MBD1 комплекс одновременно с SRA белками или они функционируют независимо. Др. неизвестные факторы также могут участвовать в поддержании метилирования ДНК. Напр., SWI/SNF хроматин ремоделирующий фактор Lsh и CGBP, белок, который связывает неметилированные CpG, как известно, необходимы для глобального метилирования генома (Dennis et al., 2001, Carlone et al., 2005). Эти находки указывают на то, что инициация, распознавание и поддержание метилирования ДНК является сложным и что дополнительные игроки ещё могут быть обнаружены.
Roles of methyl-CpG binding proteins in invertebrates and in plants
MBD гены существуют не только у позвоночных, но и у беспозвоночных и у растений, а MBD2/MBD3, как полагают, является родоначальником гена MBD (Hendrich and Tweedie, 2003).
Drosophila содержит только один MBD белок (dMBD2/3) и одну DNA methyltransferase (dDnmt2) и её геном метилируется по CpT/A последовательностям, которые распознаются с помощью dMBD2/3 (Kunert et al., 2003, Marhold et al., 2004). Эти два белка несущественны для развития: мухи, лишенные этих генов, жизнеспособны и фертильны. Caenorhabditis elegans обладает MBD-подобным геном, хотя весь её геном неметилирован. Интересно, что MBD-подобный белок у C. elegans играет важную роль в развитии, указывая тем самым, что CeMBD имеет функции иные, чем связывание метилирoванной ДНК (Gutierrez and Sommer, 2004). Сходным образом, MBD3 млекопитающих не связывает метилированную ДНК, но существенен для развития и играет важные роли в плюрипотентности ES клеток (Hendrich et al., 2001, Kaji et al., 2006). Геном Arabidopsis thaliana содержит 13 генов для MBD-содержащих белков (Zemach and Grafi, 2007), из которых, по крайней мере, 3 могут связывать метилированную ДНК. Некоторые, подобно AtMBD9 и AtMBD11, являются не функциональными в качестве methyl-CpG связывающих белков, но тем не менее важны для развития растений. Более того, геномы позвоночных и беспозвоночных содержат ряд MBD-подобных доменов, наз. TAM ( TIP5, ARBP, MBD), большинство из которых, как полагают, нефункциональны в отношении связывания methyl-CpG (Hendrich and Tweedie, 2003). очевидно, что эти MBD-подобные домены теряют спсобность связывать methyl, т.к. они приобрели новые функции в ходе эволюции.
Подобно MBD белкам белки SRA обнаруживаются в геномах разных беспозвоночных, включая те, что у общественных несекомых пчел (Apis mellifera), а также в геномах растений, это указывает на то. что они могут регулировать метилирование ДНК у этих видов (Table 1). По крайней мере, 14 SRA-содержащих белков нацжено у Arabidopsis и др. растения также содержать много SRA белков. Подобно SRA-содержащим белкам млекопитающих Arabidopsis SRA белки Vim1 и KRYPTONITE (KYP) связывают метилированную ДНК посредством SRA домена (Johnson et al., 2007, Woo et al., 2007). Наивысшее количество SRA белков у растений может быть результатом сложности метилирования ДНК у растений, у которых не только CpG, но и CpHpG (where H = A, T or C) и CpHpH последовательности могут быть метилированы. В самом деле, Vim1 может соединяться с метилированными CpHpG последовательностями, а также с метилированными CpG, тогда как KYP соединяется с метилированными CpG, CpHpG и CpHpH последовательностями. Ёще предстоит исследовать предпочтения в связывании полу-метилированной ДНК, растительные SRA белки могут приобретать способность соединяться с разными метилированными последовательностями. Напротив, возможно, что некоторые растительные SRA белки не являются methyl-CpG связывающими белками, а выполняют важные функции по модификации гистонов или др. типу регуляции хроматина. В самом деле, некоторые ратительные SRA белки имеют SET домен, который может функционировать как histone methyltransferase (Baumbusch et al., 2001).
Интересно, что пчелы содержат метилированную ДНК в контексте CpG поледовательностей, а также MBD белки, SRA белки и de novo methyltransferases (Wang et al., 2006). Это находтся в резком контрасте с Drosophila и C. elegans, которые лишены de novo и поддерживающих DNA methyltransferases и SRA белков и имеют низкие уровни CpT/A метилирования или не имеют метилированной ДНК, соотв. (Table 1). Эти находки указывают на то, что de novo/maintenance DNMTs и SRA белки ко-эволюционируют, чтобы обеспечить точное поддержание метилирования ДНК.
Are there additional methyl-CpG binding proteins?
Учитывая, что метилирование ДНК выполняет разнообразные роли в геномах млекопитающих, поэтому метилирование ДНК может быть интерпретировано не только этими тремя семействами белков. Цинковые пальчики являются довольно распорстарненными мотивами в геноме млекопитающих. Хотя Kaiso-подобный zinc finger мотив найден только в трех белках Kaiso, ZBTB4 и ZBTB38, вполне возможно, что дополнительные белки также могут быть способны связывать methyl-CpG посредством цинковых пальчиков. В самом деле, искусственный белок с цинковыми пальчиками обнаруживает связывание с метилированной ДНК (Choo, 1998). Хотя трудно идентифицировать такие белки, но белки, локализованные в тесной близи от метилированного перицентромерного гетерохроматинового региона, подобно MBD белкам или Kaiso-подобным белкам (Hendrich and Bird, 1998, Filion et al., 2006), могут быть возможными кандидатами. Вполне возможно, что будут открыты новые methyl-CpG связывающие белки (домены).
Concluding remarks
After the discovery that DNA methylation and transcriptional repression are correlated, numerous factors including MBPs, histone modification enzymes, chromatin remodeling factors, DNA methyltransferases and histone binding proteins have been identified and shown to link DNA methylation and transcriptional silencing. However, we are still far from a complete understanding of this complex system and there are many issues to be uncovered. How are these proteins targeted to specific regions? How is the DNA methylation mark erased and re-established during development? The recent advances in genome-wide analysis techniques, the availability of complete genome sequences, and of genetically engineered mice and cell lines will be helpful to overcome these issues. Given the involvement of DNA methylation in development, cancer and human diseases, a greater understanding of the molecular mechanisms of DNA methylation, and of the roles of MBPs, is of great importance for the development of future clinical applications.
Сайт создан в системе
uCoz 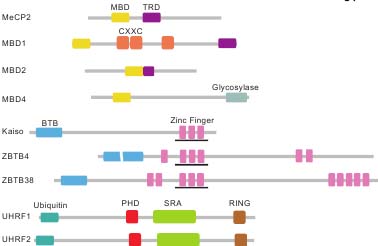 Fig. 1. The human proteins that bind methylated DNA. Three types of domains endow proteins with the ability to recognize methylated DNA: the MBD domain, certain zinc fingers, and the SRA domain. We have represented all the human proteins known to bind methylated DNA at this time. The MBD proteins contain the MBD as well as a trans-repression domain (TRD), CXXC zinc fingers or glycosylase domain. The zinc fingers are depicted by pink rectangles, and those that confer methyl-DNA binding are underlined. The zinc finger family proteins also contain a BTB domain and up to 7 additional zinc fingers. The BTB domain of ZBTB4 is disrupted by an insertion of serine rich sequences. UHRF1 and UHRF2 contain the SRA domain, a Ubiquitin-like domain, a PHD finger and a Ring finger.
Fig. 1. The human proteins that bind methylated DNA. Three types of domains endow proteins with the ability to recognize methylated DNA: the MBD domain, certain zinc fingers, and the SRA domain. We have represented all the human proteins known to bind methylated DNA at this time. The MBD proteins contain the MBD as well as a trans-repression domain (TRD), CXXC zinc fingers or glycosylase domain. The zinc fingers are depicted by pink rectangles, and those that confer methyl-DNA binding are underlined. The zinc finger family proteins also contain a BTB domain and up to 7 additional zinc fingers. The BTB domain of ZBTB4 is disrupted by an insertion of serine rich sequences. UHRF1 and UHRF2 contain the SRA domain, a Ubiquitin-like domain, a PHD finger and a Ring finger. 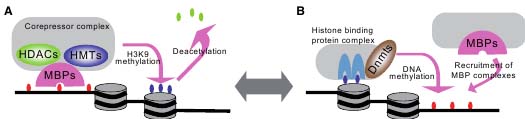 Fig. 2. Interplay between DNA methylation and histone modifications. (A) A model for histone modifications directed by DNA methylation. Methyl-CpG binding proteins recognize methylated DNA and then recruit corepressor complexes including histone deacetylases or methyltransferases to form heterochromatin, characterized by histone hypoacetylation and H3K9 methylation. (B) A model for histone modification-directed DNA methylation. The protein complex including the histone-binding proteins recruits DNA methyltransferases to methylate DNA, resulting in the binding of MBP complexes. These two mechanisms are interconnected and contribute to establish and maintain the transcriptionally silenced chromatin structure.
Fig. 2. Interplay between DNA methylation and histone modifications. (A) A model for histone modifications directed by DNA methylation. Methyl-CpG binding proteins recognize methylated DNA and then recruit corepressor complexes including histone deacetylases or methyltransferases to form heterochromatin, characterized by histone hypoacetylation and H3K9 methylation. (B) A model for histone modification-directed DNA methylation. The protein complex including the histone-binding proteins recruits DNA methyltransferases to methylate DNA, resulting in the binding of MBP complexes. These two mechanisms are interconnected and contribute to establish and maintain the transcriptionally silenced chromatin structure. 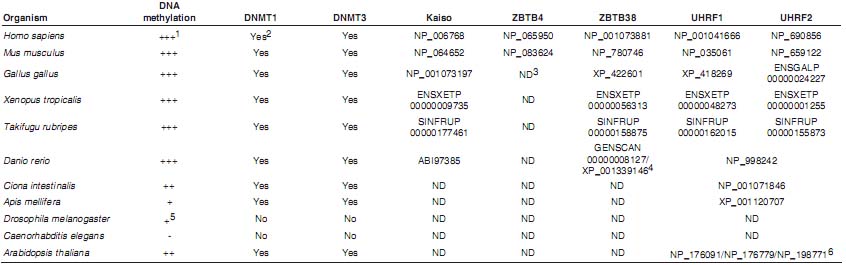

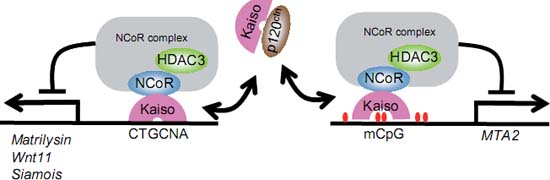 Fig. 3. Mechanisms of Kaiso-mediated transcriptional repression. Kaiso binds to the KBS of target promoters and represses their transcription by recruiting a corepressor complex including HDAC3 and NCoR (left). Kaiso also represses methylated promoters via recruitment of the NCoR complex (right). The binding of Kaiso to these sequences is inhibited by direct interaction of p120 catenin with the zinc finger region of Kaiso.
Fig. 3. Mechanisms of Kaiso-mediated transcriptional repression. Kaiso binds to the KBS of target promoters and represses their transcription by recruiting a corepressor complex including HDAC3 and NCoR (left). Kaiso also represses methylated promoters via recruitment of the NCoR complex (right). The binding of Kaiso to these sequences is inhibited by direct interaction of p120 catenin with the zinc finger region of Kaiso. 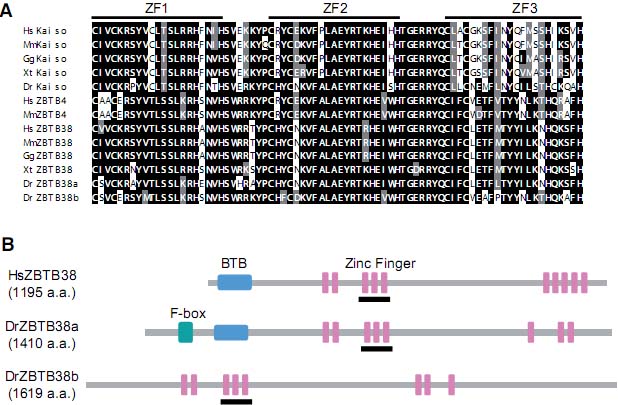 Fig. 4. Evolutionarily conserved methyl-CpG-binding zinc fingers. (A) Multiple alignments of methylCpG binding zinc fingers of Kaiso, ZBTB4 and ZBTB38 from human (Homo sapiens), mouse (Mus musculus) , chicken (Gallus gallus), frog (Xenopus tropicalis ) and zebrafish (Danio rerio) . We searched for proteins that contain three methyl-binding zinc finger motifs in the NCBI and Ensembl databases. Based on their structure and sequences, the proteins were classified as orthologs of Kaiso, ZBTB4 or ZBTB38. The alignment was performed using the Clustal W algorithm. (B) The domain structures of human (HsZBTB38) and two zebrafish ZBTB38 proteins (DrZBTB38a and DrZBTB38b). The methyl-binding zinc fingers are indicated by bold lines.
Fig. 4. Evolutionarily conserved methyl-CpG-binding zinc fingers. (A) Multiple alignments of methylCpG binding zinc fingers of Kaiso, ZBTB4 and ZBTB38 from human (Homo sapiens), mouse (Mus musculus) , chicken (Gallus gallus), frog (Xenopus tropicalis ) and zebrafish (Danio rerio) . We searched for proteins that contain three methyl-binding zinc finger motifs in the NCBI and Ensembl databases. Based on their structure and sequences, the proteins were classified as orthologs of Kaiso, ZBTB4 or ZBTB38. The alignment was performed using the Clustal W algorithm. (B) The domain structures of human (HsZBTB38) and two zebrafish ZBTB38 proteins (DrZBTB38a and DrZBTB38b). The methyl-binding zinc fingers are indicated by bold lines.
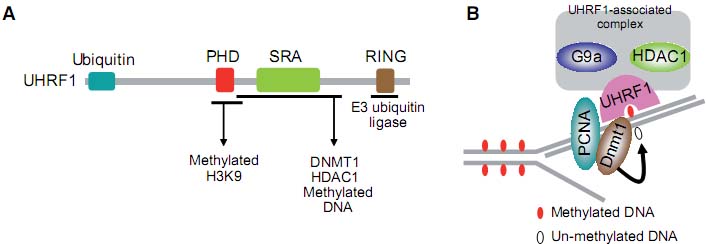 Fig. 5. Functions of UHRF1 during DNA replication. (A) Schematic representation of UHRF1. UHRF1 binds to methylated DNA as well as DNMT1 and HDAC1 via the region including the SRA domain. The PHD finger binds to methylated K9 of H3 and the Ring finger functions as an E3 ubiquitin ligase. (B) A model for the maintenance of DNA methylation by the UHRF1-DNMT1 complex during DNA replication. UHRF1 binds to hemi-methylated DNA at the replication foci and recruits DNMT1 to maintain the DNA methylation status. UHRF1 is also likely to ensure the heritability of histone modification by recruiting the G9a-containing complex.
Fig. 5. Functions of UHRF1 during DNA replication. (A) Schematic representation of UHRF1. UHRF1 binds to methylated DNA as well as DNMT1 and HDAC1 via the region including the SRA domain. The PHD finger binds to methylated K9 of H3 and the Ring finger functions as an E3 ubiquitin ligase. (B) A model for the maintenance of DNA methylation by the UHRF1-DNMT1 complex during DNA replication. UHRF1 binds to hemi-methylated DNA at the replication foci and recruits DNMT1 to maintain the DNA methylation status. UHRF1 is also likely to ensure the heritability of histone modification by recruiting the G9a-containing complex.