Introduction: Wnt family, functions and the signaling pathway
Исследование, проведенное Nusse & Varmus (1982) привело к открытию локуса, названного int-1 (integration site), который активировался в ответ на инсерцию провируса mouse mammary tumor virus (MMTV). Последующие исследовани идентифицировали ген int-1 как прото-онкоген при канцерогенезе молочных желез (Ooyen & Nusse 1984). В 1987, три группы идентифицировали у Drosophila ген сегментной полярности wingless (Wg), гомолог Drosophila гена int-1 (Baker 1987; Cabrera et al.. 1987; Rijsewijk et al.. 1987). Затем были идентифицированы многие гены этого семейства. Было высказано предложение, что int-1 и родственные гены д. называться Wnt (the Wg-type MMTV integration site) семейством генов (Nusse et al.. 1991). Сегодня открыто более 20 Wnt генов у разных видов, включая Xenopus, Drosophila, Caenorhabditis elegans, рыбок данио, мышей и человека.
Каждый Wnt ген кодирует белок, который, по-видимому, предназначен для секреции и для воздействия на 1 или более сайтов N-сцепленного гликозилирования (Bradley & Brown 1990; Papkoff & Schryver 1990; Vincent & Lawrence 1994). Недавно группа Nusse очистила активную Wnt молекулу и установила, что белок является липид-модифицируемым (Willert et al.. 2003). Члены семейства генов Wnt играют важные роли в регуляции ряда основных онтогенетических процессов, таких как сегментация у Drosophila (Rijsewijk et al.. 1987; Sanson 2001), нейральное развитие у мышей (McMahon 1992; Ligon et al.. 2003), формирование оси и миогенез у Xenopus (Christian et al.. 1991; Sokol et al.. 1991; Cui et al.. 1996; Tian et al.. 1999), и туморогенез молочных желез у млекопитающих (Nusse & Varmus 1992; Polakte 2000; Kikuchi 2003).
Хотя каждый индивидуальный Wnt ген обладает самостоятельным паттерном экспрессии и функциональным перекрыванием (redundancy) (Ikeya & Takada 1998), предполагается, что многие члены могут активировать общий внутриклеточный путь передачи сигналов. Согласуется с этой возможность то, что несколько независимых подходов идентифицировали две функционально отличающиеся категории Wnts. При одном наборе подходов члены класса Wnt1 (включая Wnt1, Wnt3a, Wnt8 and Wnt8b) индуцируют полные дупликации эмбриональной ост, если эктопически экспрессируются в вентральной маргинальной зоне дробящихся эмбрионов лягушек. Члены класса Wnt5a (включая Wnt5a, Wnt4 and Wnt11) не обладают способностью удваивать ось, но вместо этого вызывают дефекты клеточного движения во время гаструляции, если инъецируются в эмбрионы Xenopus и в конечном итоге приводят к укорочению оси тела (Du et al.. 1995; Torres et al.. 1996; Moon etaL 1997). В др. подходе, Wnt1 класс, но не Wnt5a класс, как было установлено, способен трансформировать C57mg эпителиальные клетки молочных желез мышей (Wong et al 1994). В обзоре будет рассмотрена регуляция в основном Wnt1 класса.
Первый путь передачи сигналов Wnt, который был открыт и хошрошо изучен, то канонический Wnt путь, который активирует функцию β-catenin. Много работ проделано и по изучению не-канонических путей, которые не используют β-catenin (Strutt 2003; Veeman et al.. 2003; Bejsovec 2005). Простая схема современной модели Wnt/β-catenin показана на Figure 1(B) и (C). В отсутствие Wnt лиганда, цитоплазматический деструктивный комплекс (который состоит из AXN, APC, GSK3 и β-catenin) направляет β-catenin на деградацию с помощью убиквитин-протеосомного пути. После этого Wnt соединяется с трансмембранным рецепторным комплексом Frizzled/LRP, это ведет к гиперфосфорилированию Dishevelled (Dsh). Dsh является фосфопротеином, если активирован, то становится более высоко фосфорилированным по сериновым и треониновым остаткам и ре-локализуется на плазматическую мембрану. Dsh приносит вместе с собой AXN, APC и GSK3 на плазматическую мембрану, и тем самым отделяет деструктивный комплекс для β-catenin. β-catenin поэтому накапливается, транслоцируется в ядро и взаимодействует с транскрипционными факторами TCF/LEF, чтобы активировать гены мишени (rev. Moon et al.. 2002; Nelson & Nusse 2004; Tolwinski & Wieschaus 2004).
Множество прекрасных обзоров опубликовано в последнее время (Korswagen & Clevers 1999; Moon et al.. 2002; Karim et al.. 2004; Logan & Nusse 2004; Nelson & Nusse 2004; Tolwinski & Wieschaus 2004). Т.к. большинство из них сфокусировано на передаче сигналов Wnt ниже рецепторов, то данный обзор посвящен регуляции самого Wnt на нескольких уровнях (Figure 1A). Эта множественная, точная и тонкая регуляция гарантирует корректное функционирование Wnts во времени и пространстве.
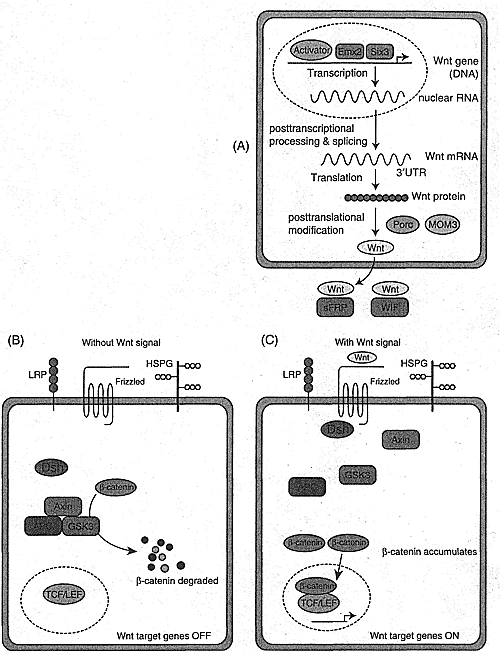 Fig. 1. Wnt producing and Wnt/ β-catenin signaling pathway. (A) In and around Wnt-producing cell. After going through transcriptional, post-transcriptional, translational, and post-translational processing and tight regulation, Wnt proteins are produced and secreted. At transcriptional level, Emx2 and Six3 are known as repressors of Wnt1 gene expression, while activators of wnt gene have not been identified. At post-transcriptional level, 3'-untranslated region (3'-UTR) of wnt mRNA can regulate RNA stability and its translation. At post-translational level, Wnt proteins need further modification. Porcupine (Pore) is an endoplasmic reticulum (ER) protein, which may attach a palmitate to Wnt. In Caenorhabditis elegans, the MOM3 may help in the production and secretion of Wnt. After Wnts are secreted, a number of secreted antagonists of Wnt signaling appear to function in the extracellular space to prevent Wnts from binding to and activating their cognate receptors. The extracellular antagonists include soluble/secreted Frizzled-related protein (sFRP), Wnt inhibitory factor (WIF), Cerberus and Dickkopf (Some are not shown in this figure). Heparan sulfate proteoglycans (HSPG> are also involved in Wnt reception or transport. (B) and (C) In and around Wnt-receiving cell. (B) In the absence of the Wnt ligand, the cytoplasmic destruction complex (which is composed of AXN, APC, GSK3, and β-catenin) targets B-catenin for degradation by the ubiquitin-proteasome pathway. (C) After Wnt binds to the trans-membrane Frizzled/LRP receptor complex, it leads to the hyperphosphorylation of Dishevelled (Dsh). Dsh is then relocated to the plasma membrane and brings AXN, APC, and GSK3 along with it to the plasma membrane, thus dissociating the destruction complex for β-catenin. β-catenin now accumulates, translocates to nucleus and interacts with transcription factors TCF/LEF to activate target genes. Negative regulators are drawn as rectangles. Positive components are in other shapes.
Fig. 1. Wnt producing and Wnt/ β-catenin signaling pathway. (A) In and around Wnt-producing cell. After going through transcriptional, post-transcriptional, translational, and post-translational processing and tight regulation, Wnt proteins are produced and secreted. At transcriptional level, Emx2 and Six3 are known as repressors of Wnt1 gene expression, while activators of wnt gene have not been identified. At post-transcriptional level, 3'-untranslated region (3'-UTR) of wnt mRNA can regulate RNA stability and its translation. At post-translational level, Wnt proteins need further modification. Porcupine (Pore) is an endoplasmic reticulum (ER) protein, which may attach a palmitate to Wnt. In Caenorhabditis elegans, the MOM3 may help in the production and secretion of Wnt. After Wnts are secreted, a number of secreted antagonists of Wnt signaling appear to function in the extracellular space to prevent Wnts from binding to and activating their cognate receptors. The extracellular antagonists include soluble/secreted Frizzled-related protein (sFRP), Wnt inhibitory factor (WIF), Cerberus and Dickkopf (Some are not shown in this figure). Heparan sulfate proteoglycans (HSPG> are also involved in Wnt reception or transport. (B) and (C) In and around Wnt-receiving cell. (B) In the absence of the Wnt ligand, the cytoplasmic destruction complex (which is composed of AXN, APC, GSK3, and β-catenin) targets B-catenin for degradation by the ubiquitin-proteasome pathway. (C) After Wnt binds to the trans-membrane Frizzled/LRP receptor complex, it leads to the hyperphosphorylation of Dishevelled (Dsh). Dsh is then relocated to the plasma membrane and brings AXN, APC, and GSK3 along with it to the plasma membrane, thus dissociating the destruction complex for β-catenin. β-catenin now accumulates, translocates to nucleus and interacts with transcription factors TCF/LEF to activate target genes. Negative regulators are drawn as rectangles. Positive components are in other shapes.
Regulation at the transcriptional level
Хотя генетические доказательства показывают, что Wg вовлечен в процесс сегментации у Drosophila и дает нам ясное представление о наличии вышестоящих регуляторных факторах (Rijsewijk et al.. 1987; Sanson 2001), но идентифицировать факторы, ответственные за контроль транскрипции генов Wnt, трудная задача. Мы будем использовать регуляцию экспрессии Wnt1 в среднем мозге мышей в качестве примера, т.к. большинство исследований транскрипции Wnt осуществлено на мышах.
Во-первых, cis-действующие регуляторные последовательности, которые управляют экспрессией Wnt1, были найдены и выделены. Экспрессия Wnt1 является одним из самых ранних сигналов, ассоциированных с формированием паттерна ЦНС. Экспрессия Wnt1 начинается в виде небольшого участка в презумптивном среднем мозге и распространяется каудально по большей части дорсальной срединной лини и ЦНС (Wilkinson et al.. 1987; Thomas & Capecchi 1990). Отсутствие экспрессии Wnt1 ведет к потере этой области в головном мозге (Thomas & Capecchi 1990; McMahon & Bradley 1990), указывая тем самым на важную роль Wnt1 в формировании паттерна головного мозга. Echelard et al. (1994) идентифицировали в 5.5 kilobase (kb) энхансер 3' кодирующей области Wnt1, который был способен управлять lacZ репортерным геном в виде корректного пространственно-временного паттерна. Эта область в 5.5 kb была делетирована из локуса Wnt1 с помощью генного таргетинга, чтобы оценить его функцию in vivo и было установлено, что 5.5 kb регуляторный элемент необходим для ранней активации экспрессии Wnt1 (Danielian et al. 1997). Более того, идентифицированы эволюционно законсервированные 110 base pair (bp), являющиеся минимальной регуляторной областью внутри этого энхансера, которые содержит homeo-domain binding sites (HBS1 and HBS2). Эта минимальная регуляторная область достаточна для активации lacZ репортера в виде Wnt1 паттерна на ст. нервной пластинки. Экспрессия трансгена Wnt1 под контролем минимального регуляторного элемента способна частично нормализовать фенотип среднего-заднего мозга (midbrain-hindbrain (MHB)) нулевых Wntl мутантов, это показало, что он обладает биологически функциональным сайтом связывания транскрипционного фактора (Her et al. 1995; Rowitch etaL 1998).
Во-вторых, было предпринято множество усилий, чтобы установить, какие транскрипционные факторы соединяются с cis-действующим элементом и активируют экспрессию Wnt. Возможным кандидатом является Pax-2, транскрипционный фактор, содержащий paired домен. Генетические доказательства в исследованиях на Drosophila и рыбках данио открыли возможность, что pax гены необходимы для активации Wnt1 в MHB соединении. У Drosophila paired ген кооперирует с wingless, hedgehog и engrailed в сигнальном пути, контролирующем образование границы заднего компартмента (Bejsovec & Martinez Arias 1991; Ingham & Hidalgo 1993). У рыбок данио анализ потери функции Pax-2 гомолога показал неспособность активации Wnt1 и тяжелый фенотип с делецией структур среднего мозга и мозжечка (Brand et al.. 1996). У мышей, хотя Pax-2 соединяется с 110 bp цис-регуляторным элементом in vitro и паттерн его экспрессии подтверждает возможную регуляторную роль в активации Wnt1, локализация сайта связывания не была в точности установлена, а мутации двух предполагаемых сайтов с низким сродством не устраняют активации Wnt1 репортерного трансгена in vivo (Rowitch et al.. 1997; Rowitch et al.. 1998). Эти результаты не подтверждают, хотя и не исключают гипотезу, что Pax белки регулируют Wnt1 путем непосредственных взаимодействий с этой cis-действующей регуляторной областью.
Др. кандидатом является Cubitus interruptus (Ci) в сигнальном пути hedgehog (hh). Генетические доказательства на Drosophila показали, что поддержание экспрессии Wg зависит от активности гена hh. В конце стадии 9 у нормальных эмбрионов wg транскрипт присутствует в клетках 15 полосок, маркирующих задние границы каждого из парасегментов. У hh мутантных эмбрионов wg транскрипты исчезают изо всех, кроме наиболее задних парсегментных полосок (Ingham & Hidalgo 1993). Wg у Drosophila и др. Wnt гены у позвоночных являются потенциальными мишенями hh в нескольких онтогенетических системах (Hammerschmidt et al.. 1997; Von Ohlen etat. 1997; Liu et al.. 2000; Cohen 2003).
Ci является би-функциональным регулятором транскрипции. В отсутствие активного Hedgehog лиганда генерируется укороченный транскрипционный репрессор и он соединяется с генами мишенями, блокируя их транскрипцию. В присутствии активного Hedgehog лиганда генерируется полной длины транскрипционный активатор и он соединяется с генами мишенями и активирует их транскрипцию (Methot & Basler 1999).
Ci-родственные гены у позвоночных, Gli1, Gli2 и Gli3, кодируют белки с 5 тандемными мотивами цинковые-пальчики, которые могут соединяться с ДНК сиквенс-специфическим способом (Pavletich & pabo 1993). Исследования с использованием генного таргетинга на модельных мышах показали, что Gli белки участвуют в пути передачи сигналов hh pathway (Park & Bai 2000; Bai et al. 2004). Но молекулярные взаимоотношения между Gli белком и Wnt геном у позвоночных не выявлены. Shh экспрессируется в трех ключевых сигнальных центрах у эмбрионов позвоночных: хорде, донной пластинке и в zone of polarizing activity (ZPA), но не в MHB области, где наблюдаются Wnt1/Engrailed взаимодействия (Ingham & McMahon 2001).
Др. кандидаты включают Otx-2 и Wif-1 (Acampora et al. 1997; Rowitch et al 1998). И снова молекулярные взаимоотношения между этими белками и геном Wnt у позвоночных не установлены.
Наконец, идентифицированы репрессоры (но не активаторы) экспрессии гена Wnt1 в головном мозге. Экспрессия Wnt1 начинается в виде небольшого участка в презумптивном среднем мозге и распространяется каудально вдоль большей часть дорсальной срединной линии ЦНС, но не обнаруживается в telencephalon и кортикальной кромке (hem) (Wilkinson et al. 1987; Thomas & Capecchi 1990). В самом деле пространственное ограничение экспрессии wg имеет критическое значение для формирования паттерна головного мозга, так имеется несколько транскрипционных репрессоров, чтобы контролировать и поддерживать этот паттерн.
Одним из репрессоров является Emx2, гомеодоменовый транскрипционный фактор. Гены Emx1 и Emx2 являются мышиными родственниками Drosophila head gap гена, empty spiracles, a паттерн их экспрессии подтверждает их участие в формировании регионального паттерна переднего мозга (Yoshida et at. 1997). Ранние исследования таргетинга генов Emx показали, что Emx участвуют в развитии переднего мозга и дорсальной части telencephalon (Pellegrini et al.. 1996; Yoshida et al. 1997). Более поздние исследования показали, что потеря функции Emx2 или функции Emx7/2 связаны с некоторыми дефектами, включая уменьшение или отсутствие, соотв., клеток Cajal-Retzius и subplate в областях кортекса, дефектами тангенциальной миграции нейронов и нахождения путей аксонами из вентральной части переднего мозга в кортекс (Mallamaci et al. 2000; Shinozaki et al. 2002; Bishop et al. 2003). Несмотря на их важные роли в развитии головного мозга нижестоящие транскипционные мишени Emx2 были не известны вплоть до недавнего времени, когда точки между Emx2 и Wnt1 были соединены.
Ligon et al.. (2003) проделали интересную работу, чтобы соединить эти точки. Они сообщили, что leptomeningeal glione-uronal heterotopias (LGH), фокальный тип кортикальной дисплазии, возникает у Emx2-/- мышей, которая эквивалентна таковой у людей. Они также расширили наблюдения Yoshida et al. (1997), что эктопическая экспрессия Wnt1 в эмбриональной области организатора верхней пластинки и дорсальной части telencephalon у Emx2-/- мышей, тогда как у нормальных мышей экспрессия Wnt1 исключается из этих областей (Ligon et al. 2003). Вместе с более ранними доказательствами, что EMX2 соединяется с высоко консервативным HBS1-связывающим сайтом в Wnt1 энхансере и что мутация или делеция HBS1 вызывает эктопическую экспрессию репортерного трансгена в дорсо-медиальной части telencephalon (Her et al. 1995; Rowitch et al. 1998), эти находки подтверждают, что активность EMX2 необходима для репрессии экспрессии Wnt1 в telencephalon во время образования preplate и её производных. Интересно, что анализ избыточности функций показал, что строгая эктопическая экспрессия Wnt1 в telencephalon, управляемая с помощью фрагмента энхансера с делецией HBS1 и окружающих последовательностей, дает LGH, идентичный таковому у Emx2-/- мышей (Ligon et al.. 2003). Всё это указывает на то, что EMX2 является прямым репрессором экспрессии Wnt1 в развивающемся telencephalon млекопитающих.
Однако, существует не один репрессор. Второй репрессор был идентифицирован в то же время (Lagutin et al.. 2003). Six3, a член Six семейства гомеобоксных генов, экспрессируется в наиболее передней части развивающейся нервной пластинки (Oliver et al.. 1995). Типичный consensus стержневой ATTA мотив идентичен с Six3 ДНК-связывающим мотивом (Zhu et al.. 2002), который располагается в минимальной регуляторной области энхансера Wnt1. И in vivo и in vitro ДНК-связывающие подходы показали, что Six3 соединяется с энхансером Wnt1. Когда мышиный Six3 локус инактивирован, то prosencephalon сильно укорочен, а экспрессия Wnt1 увеличивается рострально (Lagutin et al.. 2003). Всё это демонстрирует, что Six3 является прямым негативным регулятором экспрессии Wntl.
заключение, множественные репрессоры участвуют в регуляции экспрессии Wnt1. Было бы интересно посмотреть, соединяются ли эти множественные репрессоры с одним и тем же сайтом конкурентно. Вполне возможно, что существуют и др. белки, которые соединяются с этим или др. cis-элементами, чтобы скоординировать регуляторное действие. Кажется вполне возможным, что активатор(ы) экспрессии Wnt будут идентифицированы в ближайшем будущем. Wnt является таким мощным морфогеном, так что его экспрессия д. контролироваться тонкои точно.
RNA splicing
Таблица 1. Differencially spliced transcripts of Wnts in selected species
 Genes were annotated by using either a GeneWise model or from Genscan exons supported by protein, cDNA and EST evidence. In parenthesis are the different names describing the same protein, dumber of novel transcripts predicted by the model used (http://www.ensembl.org/).
Genes were annotated by using either a GeneWise model or from Genscan exons supported by protein, cDNA and EST evidence. In parenthesis are the different names describing the same protein, dumber of novel transcripts predicted by the model used (http://www.ensembl.org/).
Альтернативный сплайсинг РНК может создавать семейства белков, чьи члены могут выполнять разнве функции, регулируя развитие. Обстоятельные поиски баз данных отобранных видов (Table 1) показали, что некоторые члены этого семейства употребляют этот механизм. Помимо тех, что представлены в Table 1, немногие члены Wnt РНК у др. видов также описаны, как имеющие разнообразные сплайс-транскрипты, включая Wnt8 у рыбок данио (Lekven et al.. 2001) и Wnt8b у Xenopus laevis(Cui et al.. 1995). Существенно отличающиеся формы Wnt8b и Wnt2b транскриптов обнаруживают самостоятельные паттерны экспрессии (Cui et al.. 1995; Katob et al.. 2000). Это подтверждает, что wnt мРНК может транскрибироваться с использованием разных промоторов.
Более того, локус wnt8 у рыбок данио представлен двумя open reading frames (ORF), ORF1 и ORF2, которые ко-транскрибируются в одиночную из двух цистронов мРНК. Каждая ORF кодирует белок Wnt8 полной длины (Lekven et al.. 2001). Кроме того было показано, что транскрипты, специфичные для каждой ORF и ORF1/ORF2 слияния дают альтернативные сплайс-продукты и экспрессируются у эмбрионов. Функциональные подходы выявили, что обе ORF необходимы, чтобы нормализовать фенотип wnt8-дефицитных эмбрионов (Lekven et al.. 2001). Учитывая, что, по крайней мере, три транскрипта продуцируются с локуса wnt8 у рыбок данио, точная регуляция каждого транскрипта может оказаться существенной, чтобы модулировать передачу сигналов wnt8 во время эмбриогенеза.
Т.к. пока мало внимания привлечено к выяснению точного значения различных сплайс-форм Wnt РНК, то имеется прецедент, где экспрессия определенной формы РНК повышена при некоторых заболеваниях и тканях опухолей (Goldstein & Chen 2000). В др. случаях альтернативно сплайсированные варианты мРНК обнаруживаются транслируемыми на полисомах разных размеров (Foyt et al.. 1991; Mariottini et al.. 1999). Это указывает на то, что Wnt белки, производные разных сплайс-вариантов мРНК могут на самом деле вносить разные вклады в онтогенетические контролирующие программы.
Regulation at the post-transcriptional level
Члены семейства генов Wnt играют важные роли в ряде основных онтогенетических процессов. Исследования на Xenopus показали, что Wnts участвуют в регуляции эмбриональной индукции, формировании оси и спецификации судьбы клеток, такой как миогенная дифференцировка (Christian et al.. 1991; Smith & Hariand 1991; Sokol et al.. 1991; Christian & Moon 1993; Cui et al.. 1996; Hoppler et al.. 1996; Gilbert 1997, 2003; Tian et al.. 1999; Ordahl et al.. 2001).
Xenopus Wnt8 (Xwnt8) член суб-класса Wnt1 и соотв. может индуцировать образование вторичной дорсальной оси, если неправильно экспрессируется у ранних эмбрионов Xenopus (Christian et al.. 1991; Smith & Hariand 1991; Sokol et al.. 1991). Эндогенный Xwnt8 не присутствует в соотв. время или месте, чтобы участвовать в формировании раннего паттерна, но временно экспрессируется в вентральной и латеральной мезодерме во время гаструляции. На ранней ст. нейрулы транскрипты Xwnt8 больше не обнаруживаются в клетках латеральной мезодермы, но персистируют в вентральных клетках, по крайней мере, вплоть стадии хвостовой почки (Christian & Moon 1993).
Исследование избыточной и потери функции показали, что Xwnt8 играет важную роль в спецификации вентральной и латеральной судьбы во вновь индуцированной мезодерме. Эктопическая экспрессия Xwnt8 в крайних частях дорсальной мезодермы (проспективная хорда) во время гаструляции заставляет эти клетки адаптировать более вентральную судьбу, так что они дифференцируются как мышечные, а также вызывают вторичную потерю передних структур (Christian & Moon 1993). Напротив, блокирование функции Xwnt8 ведет к увеличению головы и к избыточной детерминации в дорсальную (хордальную) судьбу за счет латеральной мезодермальной (мышечной) судьбы (Hoppler et al.. 1996; Hoppler & Moon 1998). С одной стороны, как указывалось выше, Xwnt8 функция необходима во время гаструляции для развития мышц. С др. стороны, подавление Xwnt8 в ходе гаструляции также может быть важным, т.к. эктопическая экспрессия Wnts в сомитах вызывает экспансию дермомиотомов и репрессирует образование склеротомов (Capdevila et al.. 1998).
Драматические дефекты формирования паттерна, вызываемые нарушением функции Xwnt8 демонстрирует, что собственно временной и пространственный контроль его активности является критическим для нормального эмбрионального развития. Наши исследования показали, что экспрессия Xwnt8 негативно регулируется in vivo на уровне стабильности и трансляции РНК и что эта негативная регуляция обеспечивается за счёт 3'-untranslated region (3'-UTR) Xwnt8 (Tian et al.. 1999). Анализ серии делеций Xwnt8 3'-UTR выявил регуляторный элемент в 40 нуклеотидов. который негативно регулирует аденилирование, репрессирует трансляцию и ведет к стадио-специфической деградации транскриптов.
Более того, мы осуществили функциональный анализ Xwnt8 3'-UTR-обеспеичаемой негативной регуляции. После инъекции антисмысловой РНК, соответствующей регуляторной области Xwnt8 3'-UTR в 4-клеточные эмбрионы, Xwnt8 3'-UTR-обусловленная негативная регуляция исчезала. Это вызывает продолжительную экспрессию Xwnt8 в соматической мезодерме после гаструляции, что затем вызывает избыточную детерминацию (overcommitment) этих клеток в миогенную судьбу за счет образования склеротома (Tian et al.. 1999). Т.о., подавление экспрессии Xwnt8 м. гарантировать, что не все клетки сомита будут формировать мышцы. В заключение, хотя Xwnt8 и необходим пресомитным мезодермальным клеткам во время гаструляции, но он д. быстро исчезать из этих же самых клеток после этого периода. Множественные регуляторные механизмы, необходимы не только при подавлении на транскрипционном уровне, но и также на пост-транскрипционном и трансляционном уровне для выполнения этой цели.
Wnt proteins are secreted cysteine-rich glycoproteins that undergo post-translational modifications.
N-гликозилирование является одной из пост-трансляционных ступеней, которая регулирует процессинг и секрецию Wnt, а значит пределы передачи сигналов (Christiansen et al.. 1996; Tanaka et al.. 2000; Tanaka et al.. 2002). Имеется свыше 4-5 потенциальных сайтов N-гликозилирования у разных Wnt белков. Известно, что Wnt белки присутствуют как множественные промежуточные образования процессинга и в основном остаются в endoplasmic reticulum (ER) (Mason et al.. 1992; Tanaka et al.. 2000; Tanaka et al.. 2002). Хотя Wnt белки секретируются клетками, но секреция обычно неэффективна (Papkoff & Schryver 1990; Van Leeuwen et al.. 1994; Bradley & Brown 1995). Они никогда не были очищены в активной форме, чтобы осуществить их биохимическую характеристику до недавних пор, когда группе Nusse удалось изолировать активную Wnt3a и др. изоформы из кондиционной среды, где культивируемые клетки стабильно были трансфицированы соотв. кДНК (Willert et al.. 2003). Они показали, что белки palmitoylated по консервативным цистеиновым остаткам, которые законсервированы у всех членов семейства. Т.о., липидные модификации скорее всего имеют место во всех Wnt белках (Willert et al.. 2003). Эта находка явилась сюрпризом, т.к. секретируемые молекулы обычно гликозилируются, а не ацетилируются. Ферментативное удаление palmitate половинки или сайт-направленные/естественные мутации, модифицирующие остатки цистеина, приводили к потере активности, это подчеркивает существенную роль прикрепления этого липида (Couso & Arias 1994; Willert et al.. 2003).
Были предприняты множественные исследования, чтобы найти, что же отвечает за ацетилирование Wnt белков. Один из генов сегментной полярности у Drosophila, Porcupine (pore), был идентифицирован в 1996. Он кодирует ER многопроходной трансмембранный белок, которые необходим для нормального распределения и процессинга Wg белка у эмбрионов (Kadowaki et al.. 1996). Гомологи pore у C. eiegans, Xenopus, мышей и людей также были идентифицированы и оказались эволюционно хорошо законсервированными (Rocheleau et al.. 1997; Thorpe et al.. 1997; Tanaka et al.. 2000). Несколько линий доказательств подтверждает теорию, что Pore ответственен за ацетилирование Wnt белков. Во-первых, Pore м. соединяться с доменом Wg, который соответствует месту ацетилирования (Tanaka et al. 2002). Во-вторых, Pore принадлежит к семейству membrane-bound O-acyltransferases (MBOAT), которые присутствуют в ER мембране и которые ацетилируют разнообразные субстраты (Hofmann 2000). In vivo анализ ацетилирования Wnt у pore мутантов необходим для подтверждения этой теории. Согласно современной модели Wnt белки ко-трансляционно формируют внутримолекулярные дисульфидные связи in vivo и как результат ингибируется N-гликозилирование. Pore соединяется и ацетилирует Wnt белок по первому остатку цистеина, блокируя формирования дисульфидных мостиков между первым и др. цистеинами. В результате Wnt белок укладывается корректно, гликозилируется и секретируется (Tanaka ef al 2002; Nusse 2003).
Примечательно, что процессинг Wnt белков очень сложен. Он нуждается в др. белках (напр., у C. eiegans в Mom-3) помимо гомологов Pore (Thorpe et al.. 1997; Muller et al.. 1999). Кроме того, границы передачи сигналов и формирование градиента морфогене Wnt регулируются компонентами внеклеточного матрикса, такими как
heparan sulfate proteoglycans (HSPG) (Nybakken & Perrimon 2002; Takei et al.. 2004).
Epilogue
This review will end here without discussing other regulatory mechanisms that act after Wnts are secreted. For example, a number of secreted antagonists of Wnt signaling, including soluble/secreted Frizzled-related protein (sFRP), Wnt inhibitory factor (WIF), Cerberus and Dickkopf, have been identified that appear to function in the extracellular space to prevent Wnts from binding to and activating their cognate receptors (reviewed in Brown & Moon 1998; Wodarz & Nusse 1998; Kawano & Kypta 2003). Further, each component in Wnt signaling pathway is tightly controlled (Korswagen & Clevers 1999; Moon et al.. 2002; Karim et al.. 2004; Nelson & Nusse 2004; Toiwinski & Wieschaus 2004). These multiple checkpoints on Wnt activity presumably operate to ensure that individual Wnts are active only when and where they should be, thereby preventing inappropriate tissue patterning or celt type specification.
Сайт создан в системе
uCoz 
