Любой белок, который необходим для транскрипции, необходим для поддержания активного состояния. В самом деле, некоторые trxG белки играют довольно общие роли в транскрипции и не посвящены исключительно поддержанию детерминированного состояния. Др. trxG белки, однако, могут играть специализированные роли в этом процессе, или путем непосредственного противодействия PcG репрессии или путем поддержания наследуемых состояний генной активности в ходе репликации ДНК и митозов. Последний класс trxG белков особенно интересен для биологи развития.
Генетические исследования, показавшие, что гены trxG играют ключевые роли в транскрипции и развитии, стимулировали работу по выяснению биохимической функции этих продуктов. Многие из этих экспериментов были использованы в качестве концептуальной базы гипотезы, согласно которой хроматин биологически д. быть относящимся к делу субстратом для trxG белков. Все гены упакованы в хроматине и такая упаковка может создавать компактное недоступное состояние или может оставлять открытое и доступное состояние. И доступное и недоступное состояния, как можно представить, являются наследуемыми. Эти рассуждения привели к простой гипотезе, что trxG белки могут модулировать структуру хроматина, чтобы влиять на регуляцию. Более того, когда trxG гены были клонированы и секвенированы, стало очевидным, что некоторые из их продуктов связаны с белками, участвующими в АТФ-зависимом ремоделировании хроматина или в ковалентных модификациях нуклеосомных гистонов у др. организмов, включая дрожжи Saccharomyces cerevisiae. Т.о., хотя дрожжи лишены Hox генов или PcG репрессоров, этот организм предоставил ценные сведения о потенциальной роли trxG белков в эукариотической транскрипции.
Одной из первых взаимосвязей между trxG и хроматином стало открытие, что ген trxG дрозофилы brm очень близок дрожжевому SWI2/SNF2 (Tamkun et al. 1992). Ген SWI2/SNF2 был идентифицирован при скрининге генов, участвующих в переключении типов спаривания (switch [swi] генов) и ферментации сахарозы (sucrose-nonfermenting [snf] гены). Затем была установлена их необходимость для активации многочисленных индуцибельных генов дрожжей (Holstege et al. 1998; Sudarsanam et al. 2000). Дефекты транскрипции, наблюдаемые у swi2/snf2 мутантов, супрессируются мутациями в нуклеосомной хронологии, раннее наблюдение, которое впервые позволило предположить, что SWI2/SNF2 активирует транскрипцию путем противодействия репрессии хроматина (Kruger et al. 1995). Биохимические исследования, проведенные в начале 1990s подтвердили эту гипотезу; SWI2/SNF2 и многие др. из белков, идентифицированных при скрининге swi/snf функции в качестве субъединиц крупного белкового комплекса (SWI/SNF), используют энергию АТФ гидролиза для увеличения способности белков связываться с нуклеосомной ДНК (Cote et al. 1994; Imbalzano et al. 1994; Kwon et al. 1994). SWI2/SNF2 действует как субъединица ATPase или как "двигатель" этой хроматин-ремоделирующей машины; др. субъединицы SWI/SNF комплекса обеспечивают взаимодействия с регуляторными белками или со своим хроматиновым субстратом (Phelan et al. 1999).
Др. связь между trxG и хроматином была предположена благодаря присутствию SET доменов в trxG белках Trithorax (TRX) и Absent, small or homeotic (ASH1). SET домен был первоначально установлен с помощью анализа участка аминокислот, который обнаруживал гомологию с Su(var)3-9, Enhancer of zeste (E(z)) и TRX, последние два белка были соответственно членами групп PcG и trxG. В конце 1990s, семейство SET белков, как оказалось, обладает HKMT активностью. Su(var)3-9 метилирует H3K9, тогда как (E(z)) метилирует H3K27 (Rea et al. 2000; Levine et al. 2004; Ringrose and Paro 2004). Метилирование H3K9 способствует сборке гетерохроматина, тогда как метилирование H3K27, по-видимому, необходимо для PcG репрессии (см Chapters 5 и 11, соотв.). Присутствие SET доменов в trxG белках подтверждает, что метилирование гистоновых хвостов может быть важным для поддержания активного состояния транскрипции.
Эти находки вместе с вё растущим понимание, что хроматин-ремоделирующие и хроматин-модифицирующие энзимы играют ключевую роль в активации транскрипции, это подтолкнуло биохимиков к идентификации белковых комплексов, которые содержат trxG белки и исследовать эффекты этих комплексов на структуру хроматина
in vitro. Др. эксперименты тестировали гипотезу, что trxG белки могут взаимодействовать непосредственно с транскрипционным аппаратом, с помощью др. хорошо известного метода, затрагивающего регуляцию. Эти исследования показали, что некоторые trxG белки влияют на регуляцию путем модификации структуры хроматина, тогда как др. действуют благодаря непосредственным взаимодействиям с компонентами транскрипционного аппарата.
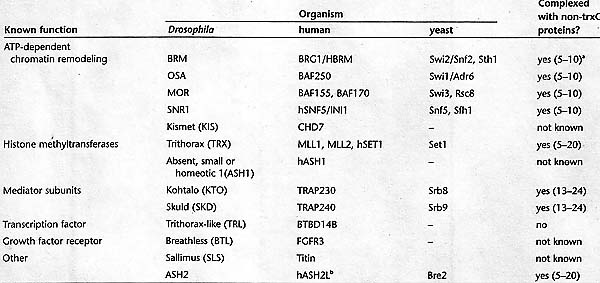
2.1 trxG Proteins Involved in ATP-dependent Chromatin Remodeling
Хроматин-ремоделирующие комплексы участвуют в широком круге разнообразных биологических процессов, включая репрессию и активацию транскрипции, сборку хроматина, регуляцию структуры хроматина высшего порядка и клеточную дифференцировку. Наиболее активно изученными trxG белками, участвующими в ремоделировании хроматина являются BRM и его гомолог у человека, BRG1 и HBRM. Как и предполагалось, эти белки функционируют как ATPase субъединицы комплексов, которые очень близки с дрожжевым SWI/SNF (Kwon et al. 1994; Wang et al. 1996). SWI/SNF комплексы содержат между 8 и 15 субъединицами и высоко законсервированы в ходе эволюции (Fig. 5). ATPase каждого из этих комплексов способна действовать как изолированная субъединица. Хотя это семейство белков исторически обозначается, как содержащее "helicase" мотив из-за сходства их ATPase домена с настоящими helicases, белками, родственными с BRM, но никогда не было показано, что оно обладает геликазной активностью, скорее оно использует др. механизмы, такие как транслокация вдоль ДНК, чтобы вызывать изменения в структуре хроматина (Whitehouse et al. 2003; Saha et al. 2005). Второй trxG ген, идентифицированный в этом скрининге, moira (mor), кодирует др. ключевой член этого АТФ-зависимого ремоделирующего комплекса у Drosophila, а гомологи BRM и MOR взаимодействуют непосредственно, чтобы сформировать функциональную сердцевину SWI/SNF у людей (Phelan et al. 1999).
SWI/SNF и др. хроматин-ремоделирующие комплексы используют энергию гидролиза АТФ, чтобы изменить структуру или позицию нуклеосом. Путем катализа АТФ-зависимых изменений в структуре хроматина, хроматин-ремоделирующие комплексы помогают транскрипционным факторам и др.регуляторным белкам получить доступ к ДНК последовательностям, которые обычно закрыты гистоновыми белками (Polach and Widom 1995; Logie and Peterson 1997). Модели для создания доступа к специфическим сайтам включают "скольжение" гистонов вдоль ДНК, чтобы переместить сайт в линкерную область, образовать петлю ДНК вдали от гистонового октамера или, более драматически, изгнать весь гистоновый октамер на др. место в ядре (Fig. 6). АТФ-зависимое ремоделирование может также приводить к изменениям в положении нуклеосом вдоль последовательности ДНК,
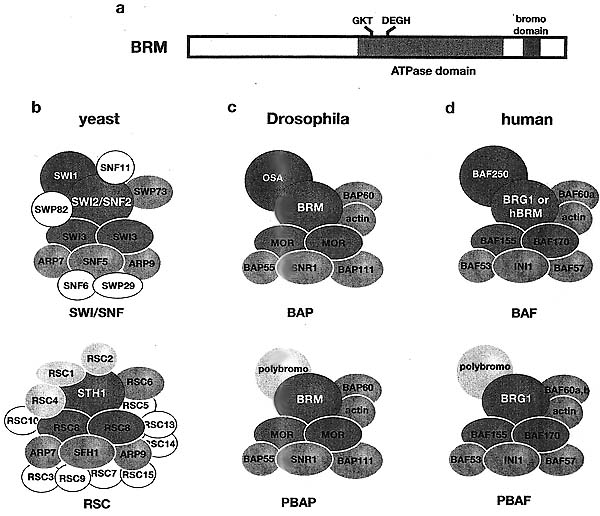 Figure 5. The SWI/SNF Family of Remodeling Complexes
Each complex contains a member of the SNF2/SWI2 family of ATPases and at least 8 other subunits. (a) Schematic diagram of the BRM protein, showing the location of the ATPase domain and carboxy-terminal bromodomain (which shows affinity to acetylated lysine residues in histone tails) that are conserved in all SNF2/SWI2 family members. SWI/SNF complexes in yeast (b), Drosophila (c), and human (d) are shown. Drosophila trxC proteins (BRM, MOR, and OSA) and their counterparts in other organisms are shown in color. Further information about these complexes and their subunits may be found in Mohrmann and Verrijzer (2005).
Figure 5. The SWI/SNF Family of Remodeling Complexes
Each complex contains a member of the SNF2/SWI2 family of ATPases and at least 8 other subunits. (a) Schematic diagram of the BRM protein, showing the location of the ATPase domain and carboxy-terminal bromodomain (which shows affinity to acetylated lysine residues in histone tails) that are conserved in all SNF2/SWI2 family members. SWI/SNF complexes in yeast (b), Drosophila (c), and human (d) are shown. Drosophila trxC proteins (BRM, MOR, and OSA) and their counterparts in other organisms are shown in color. Further information about these complexes and their subunits may be found in Mohrmann and Verrijzer (2005).
чтобы изменить пространственное положение нуклеосом и чтобы обмениваться гистонами в и из гистонового октамера, который является стержнем нуклеосомы. Разные ремоделирующие комплексы обладают разными тенденциями в отношении каждой из этих функций.
SWI/SNF комплексы многочисленны у высших эукариот, напр., каждое ядро млекопитающих содержит около 25,000 копий SWI/SNF-family комплексов. Биохимический анализ показал, что SWI/SNF комплексы способны создавать доступ к необычайно большому спектру сайтов внутри нуклеосом по сравнению с др. АТФ-зависимыми хроматин-ремоделирующими комплексами (Fan et al. 2003). Напр., SWI/SNF комплексы способны эффективно создавать доступ к местам в центре мононуклеосомы, что являются энергетически трудным, т.к. сайты в центре нуклеосомы имеют приблизительно 70 пар оснований от защемленной нуклеосомной ДНК на обеих сторонах. Обусловлено ли это необычайно мощной способностью использовать энергию гидролиза АТФ по сравнению с др. ремодельерами, или вместо этого существует самостоятельный механизм ремоделирования, является предметом будущих исследований (Kassabov et al. 2003). SWI/SNF комплексы не обладают измеримой способностью случайно распределять в пространстве нуклеосомы, характерная особенность др. хроматин-ремоделирующих комплексов. Они также не обладают той же самой степенью эффективности в "подкачке" H2A/H2B димеров, как это делают некоторые др. хроматин-ремоделирующие комплексы, хотя они способны делать это и изгонять октамеры, при тестировании
in vitro (Lorch et al. 1999). Какая из этих способностей связана с функцией этих комплексов при поддержании активного состояния, неясно. SWI/SNF комплексы участвуют в транскрипционной активации у каждого из исследованных видов. Это семейство комплексов может быть нацелено на гены путем взаимодействий с активаторами транскрипции, может ремоделировать нуклеосомы, чтобы помочь инициальному связыванию общих транскрипционных факторов и РНК полимеразы II, и может
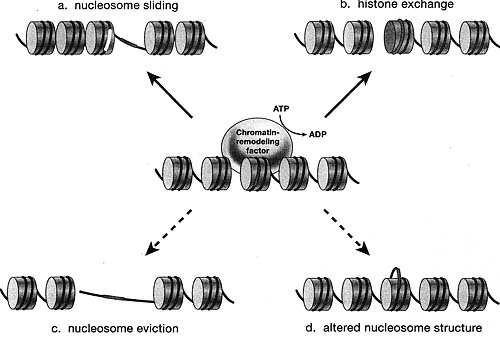 Figure 6. Mechanisms for ATP-dependent Remodeling
Models for chromatin remodeling are illustrated by showing the change in position or composition of nudeosomes relative to the DNA wrapped around it. The central panel indicates a starting chromatin region where linker DNA is indicated in yellow and nucleosomal DNA in red. (a) Movement of a nucleosome translationally along the DNA (sliding) to expose a region (marked in red) that was previously occluded; (Ј>) exchange of a variant histone for a standard histone to create a variant nucleosome; (c) eviction of nudeosomes to open a large region of DNA. This mechanism might depend on other proteins, such as histone chaperones or DNA-binding factors, in addition to remodeling proteins; (d) creating a loop on the surface of the nucleosome. Remodelers in the SWI/SNF family have been hypothesized to use alternative mechanisms, such as creating stable loops of DNA on the surface of the nucleosome, to make sites available that are central to the nucleosome.
Figure 6. Mechanisms for ATP-dependent Remodeling
Models for chromatin remodeling are illustrated by showing the change in position or composition of nudeosomes relative to the DNA wrapped around it. The central panel indicates a starting chromatin region where linker DNA is indicated in yellow and nucleosomal DNA in red. (a) Movement of a nucleosome translationally along the DNA (sliding) to expose a region (marked in red) that was previously occluded; (Ј>) exchange of a variant histone for a standard histone to create a variant nucleosome; (c) eviction of nudeosomes to open a large region of DNA. This mechanism might depend on other proteins, such as histone chaperones or DNA-binding factors, in addition to remodeling proteins; (d) creating a loop on the surface of the nucleosome. Remodelers in the SWI/SNF family have been hypothesized to use alternative mechanisms, such as creating stable loops of DNA on the surface of the nucleosome, to make sites available that are central to the nucleosome.
становиться вовлекаться позднее в процесс активации, чтобы помочь с транскрипционной элонгацией. Т.о., SWI/SNF комплексы, по-видимому, действуют на каждой ступени в процессе активации транскрипции, хотя, по-видимому, основной упор приходится на функцию на ранних ступенях, которые ведёт к загрузке РНК полимеразы II. Анализ микромассивов у дрожжей показал, что помимо этих эффектов, способствующих активации, SWI/SNF комплексы могут также способствовать репрессии некоторых генов (Sudarsanam et al. 2000).
Выдвинута простая гипотеза для объяснения этих широких функций in vivo , что эти ремоделирующие комплексы изменяют структуру нуклеосом способом, который облегчает связывание и функционирование широкого разнообразия регуляторных факторов и комплексов. Т.о., мощные ремоделирующие характеристики, наблюдаемые in vitro могут отражать способность существенного расширения доступа для регуляторных факторов in vivo. Возможно, что SWI/SNF комплексы уникальны, способны создавать широкий доступ, это может объяснить их важность для поддержания активного состояния.
Каждый изученный вид обладает, по крайней мере, двумя самостоятельными комплексами SWI/SNF, все они содержат BRM или очень близкую хроматин-ремоделирующую ATPase. Др. trxG белок, OSA, позволяет отличать эти комплексы, т.к. один класс комплексов содержит OSA, а др. эволюционно законсервированный комплекс содержит Polybromo-domain белок (Fig. 6) (Mohrmann and Verrijzer 2005). Биохимическая функция OSA неясна. Одной из привлекательных возможностей является то, что он может направлять SWI/SNF комплекс, в котором он находится, на специфический набор генов.
SWI/SNF является не только хроматин-ремоделирующим фактором, который присутствует в клетках эукариот. Идентифицированы десятки хроматин-ремоделирующих комплексов, включая NURF, NURD, ACF и CHRAC (Vignali et al. 2000). Эти комплексы могут быть подразделены на несколько основных групп, базируясь на характеристиках их ATPase субъединиц. SWI/SNF комплексы содержат ATPases родственные SWI2/SNF2; ISWI комплексы (напр., NURF, CHRAC и ACF) содержат ATPases, родственные Imitation-SWI (ISWI); a CHD комплексы (напр., NURD) содержат ATPases, родственные CHD1 и Mi2.
Недавно исследовали у Drosophila члена семейства CHD хроматин-ремоделирующих факторов - kismet (kis)- участвующего в поддержании активного состояния. Подобно brm, mor и 05a, kis был идентифицирован при скрининге внегенных супрессоров Pc, указывая тем самым. что он действует антагонистически белкам PcG, чтобы поддерживать активное состояние транскрипции Hox (Kennison and Tamkun 1988). Генетические исследования показали, что kis необходим как для сегментации, так и для поддержания транскрипции Hox во время развития Drosophila (Daubresse et al. 1999). Молекулярный анализ kis выявил, что он кодирует несколько крупных белков, включая приблизительно в 575-kD изоформу (KIS-L), которая содержит ATPase домен, характерный для хроматин-ремоделирующих факторов (Daubresse et al. 1999; Therrien et al. 2000). Законсервированные домены вне ATPase домена (включая bromodomains и chromodomains) вносят вклад в функциональную специфичность хроматин-ремоделирующих факторов путем обеспечения взаимодействий с нуклеосомами или др. белками. BRM и др. ATPase субъединицы SWI/SNF комплексов содержат по одиночному bromodomain (белковый мотив, ассоциированный со связыванием определенных ацетилированных гистонов), тогда как KIS-L содержит два chromodomains (белковых мотива, которые связывают определенные метилированные гистоны) и поэтому более сходен с Mi2 и др. членами CHD семейства хроматин-ремоделирующих факторов. Хотя крупный размер KIS-L (-575 kD) делает трудным его для анализа биохимически, его последовательности строго указывают на то, что он активирует транскрипцию путем ремоделирования хроматина.
KIS-L физически не ассоциирует с BRM и ведет себя хроматографически как если бы он является самостоятельным белковым комплексом (Srinivasan et al. 2005). Два белка перекрываются существенно др. с др. и с РНК полимеразой II на политенных хромосомах, однако, считается, что оба играют относительно глобальную роль в транскрипции (Fig. 7) (Armstrong et al. 2002; Srinivasan et al. 2005). Потеря функции BRM блокирует относительно раннюю ступень транскрипции (Armstrong et al. 2002), в то время как потеря функции KIS-L ведет к снижению уровня элонгации, но не инициации, форм РНК полимеразы II (Srinivasan et al. 2005). Эти находки подтверждают, что BRM и KIS-L облегчают разные ступени транскрипции с помощью РНК полимеразы II путем катализа АТФ-зависимых изменений в структуре нуклеосом или их пространственном расположении.
Важным вопросом будущих исследований является выяснение роли, как АТФ-зависимое ремоделирование участвует в поддержании активированного состояния. Интригует, что известны 4 члена trxG (BRM, KIS и OSA) или подозреваемые (KIS) члены крупных АТФ-зависимых хроматин-ремоделирующих комплексов, но ни один из этих многочисленных АТФ-зависимых хроматин-ремоделирующих комплексов не был идентифицирован при генетическом скрининге белков trxG у дрозофилы. Две предпочтительные гипотезы, не являющиеся взаимно исключительными, объясняют это тем, что BRM и KIS хроматин-ремоделирующие комплексы нацелены на гены, важные для хода развития или тем, что они обладают специальными ремоделирующими характеристиками, которые уникально необходимы для поддержания. Т.о., возможно, что характерное для определенного класса АТФ-зависимое хроматин-ремоделирование необходимо для всех активных состояний и что поддержание активного состояния онтогенетически важных генов происходит, чтобы обеспечить потребность в trxG членах, т.к. они нацелены на эти гены. Возможно также, что поддержание нуждается в специальных АТФ-зависимых функциях, которые могут осуществляться только комплексами, которые содержат членов trxG.
Интересно также подумать о механизмах, которые ремодельеры могут использовать, чтобы вносить вклад в эпигенетическую регуляцию активного состояния. По крайней мере, три класса механизмов можно представить. Во-первых, ремоделирующие функции могут быть необходимы каким-то косвенным образом, чтобы облегчить связывание (или повторное связывание после репликации) ген-специфических активирующих белков, которые необходимы для поддержания активной транскрипции. В таком случае ремодельеры не д. быть "мозгом" эпигенетического механизма, а вместо этого д. действовать как необходимый инструмент, который позволяет необходимым белкам функционировать эффективно. Во-вторых, ремодельеры д. действовать по одиночке или с гистоновыми хаперонами, чтобы изгонять нуклеосомы из области и такое отсутствие занятости нуклеосомами д. гипотетически давать область, остающуюся без нуклеосом после репликации. Как упоминалось выше способность replication/nucleosome deposition аппарата аккуратно воспроизводить модификации или локализацию нуклеосом является важным нерешенным вопросом эпигенетики. Наконец, аппараты ремоделирования д. устанавливать заново нуклеосомы, чтобы создать структуры, которые ответственны за активацию. Этот последний механизм имеет экспериментальное подтверждение в исследованиях с альбуминовым геном (Chaya et al. 2001; Cirillo et al. 2002). Некоторые ДНК связывающие факторы необходимы для поддержания активности этого ключевого гена в печени. Один из таких факторов, FoxA, соединяется с сайтом на нуклеосоме и специфическая нуклеосома-FoxA архитектура является ключевой для поддержания активного состояния гена альбумина. Хотя неясно, существует ли необходимая роль для АТФ-зависимго ремоделирования в позиции этой специфической нуклеосомы в печени, этот пример демонстрирует потенциал специфического позиционирования нуклеосомы, способного играть ключевую эпигенетическую роль.
2.2 trxC Proteins That Covalently Modify Nucleosomal Histones
Второй распространенный метод регуляции экспрессии генов связан с ковалентными модификациями N-терминальных хвостов стержневых гистонов, которые представляют белковый компонент нуклеосом. Эти хвосты, которые торчат с поверхности нуклеосом, могут обеспечивать взаимодействия др. нуклеосомами, а также с широким разнообразием структурных и регуляторных белков. Ковалентные модификации гистоновых хвостов с помощью ацетилирования, метилирования или фосфорилирования могут помочь нацелить регуляторные комплексы на хроматин и могут также непосредственно изменять способность нуклеосом компактизироваться в репрессивные структуры путем изменения зарядов на хвосте. Ковалентные модификации могут также обеспечивать метками, чтобы помочь поддержать специфическое регулируемое состояние, т.к. ковалентно модифицированные гистоны обладают потенциалом разделять две дочерние нити и тем самым передавать по наследству информацию, содержащуюся в ковалентной метке на материнскую и дочернюю клетки после репликации. Остаются ли гистоны ассоциированными с одной или обеими дочерними нитями после репликации является ключевым вопросом потенциальных механизмов эпигенетической регуляции, который остается противоречивым в основном из-за проблем с нахождением техники, которая позволила бы аккуратно отслеживать индивидуальные гистоны в живых клетках.
Некоторые trxG белки способны ковалентно модифицировать гистоновые хвосты и эти белки часто обнаруживаются в комплексах, которые способны осуществляют боле одного типа модификационных реакций. Напр., TRX дрозофилы и его аналоги у др. организмов метилирует гистон H3 по lysine 4 (H3K4): эта ковалентная метка прочно ассоциирует с активными генами у широкого круга организмов, включая дрожжей, мух и людей. Второй trxG белок, ASH1 (see below), также обладает H3K4 methyltransferase активностью (Beisel et al. 2002; Byrd and Shearn 2003). Метилирование H3K4 участвует в поддержании активной генной экспрессии у дрожжей одновременно с появлением и удалением активных генов (Santos-Rosa et al. 2002; Pokholok et al. 2005). Находка, что члены trxG обладают этой активностью модифицирования гистонов ещё больше связывает H3K4 метку с поддержанием активного состояния.
У дрожжей и у людей аналоги TRX обнаружены в комплексе, который также содержит третий trxG белок, Ash2, который не родственен своими последовательностями с Ashl. Дрожжевой гомолог trithorax, Setl, обнаружен в комплексе (COMPASS или SetlC), который приблизительно размером в 400 kD и содержит 5 др. белков помимо Setl и Ash2 (Miller et al. 2001; Roguev et al. 2001). Единственной известной биохимической активностью этого комплекса является метилирование H3K4; пока неясно, какова функция каждого из остальных белков, хотя один компонент может помогать наследованию метки метилирования.
У людей имеются три TRX гомолога, наз. MLL1, MLL2 и hSETl. Белок MLL1 привлек наибольшее внимание биохимиков, он был нацден в крупном комплексе (более 10 членов), который кроме того содержит человеческий гомолог ASH2 (Hughes et al. 2004; Yokoyama et al. 2004). Этот комплекс и дрожжевой комплекс. оба содержат белок с WD40 повторами, который назван WDR5 у людей (Dou et al. 2005; Wysocka et al. 2005). Недавно было показано, что белок WDR5 может соединяться с гистоном H3, который метилирован по лизину 4 (Wysocka et al. 2005). Т.о., связь этого белка с меткой, создаваемой с помощью MLL1 комплексе, в котором он находится, может указать на механизм для облегчения распространения метки. Это сходрно с предположениями, сделанными касательно репрессивных комплексов, которые метилируют H3K9, и которые содержат HP1, белок, который соединяется специфически с метилированным K9 (см. Chapters 5 and 6).
Имеются доказательства, полученные на дрозофле и человеке, что комплекс, содержащий TRX/MLL участвует также в ацетилировании. У людей MLL ассоциирован с MOF acetyltransferase, которая ацетилирует лизин 16 гистона H4, др. модификация обычно связана с активацией (Dou et al. 2005). У мух, TRX ассоциирует с dCBP, acetyltransferase с широкой специфичностью, которая участвует в активации (Petruk et al. 2001). Ацетилирование может работать синергично с метилированием H3K4, чтобы управлять активным состоянием, являющегося следствием функции этих trxG комплексов. Ацетилирование также, как известно, предупреждает метилирование остатков, таких как H3K9 и H3K27, которые управляют репрессией матрицы.
Белок ASH1, др. член trxG, также является гистоновой methyltransferase, которая метилирует H3K4 (Beisel et al. 2002; Byrd and Shearn 2003). Состав любого комплекса, содержащего ASH 1, не установлен и неясно как активности ASH1 и комплексов, содержащих TRX/MLL1/SET1, скоординированы. Однако, ASH1 как былдо установлено, ко-локализуется и ассоциирует с CBP семейством acetyltransferases (Bantig-nies et al. 2000), и снова предполагается, что метилирование и ацетилирование идут рука об руку.
Имеются многочисленные вызывающие интерес и еще вопросы без ответов, касающиеся того, как ковалентные модификации гистонов могут вносить вклад в функцию trxG. Какую функциональную роль выполняют метки? Ковалентные модификации могут вносить вклад в эпигенетическую регуляцию посредством широкого спектра механизмов. Метки метилирования и ацетилирования могут служить, чтобы непосредственно изменять компакцию хроматина (иногда наз. цис-эффекторы, как на Рис. 8 of Chapter 3). Способность хроматина вступать в компактное состояние, которое обычно полагается репрессивным для транскрипции, зависит от распределения зарядов на хвостах гистонов. Модификации, которые происходят на lysine (напр., acetylation) могут устранять позитивный заряд, обычно обнаруживаемый у этого остатка, и следовательно, могут непосредственно снижать способность нуклеосом формировать компактизованные структуры, увеличивая тем самым способность матрицы быть транскрибированной.
Ковалентные метки, как полагают, создают строгие сайты связывания для комплексов, которые управляют активацией транскрипции. Эти ковалентные модификации способны создавать специфические "бугры" на поверхности нуклеосом, которые соответствуют карманам на комплексах, которые способствуют активации, и тем самым увеличивается энергия связывания и функция этих комплексов. Напр., ацетилирование гистоновых хвостов, увеличивает связывание с помощью гомологов белка BRM, способствуя тем самым АТФ-зависимому ремоделированию ацетилированных матриц (Hassan et al. 2001). Этого типа механизм, часто обозначаемый как "histone code" или транс-эффекты ковалентных модификаций гистонов, обладает потенциалом быть центральной эпигенетической функцией. Необходимы дальнейшие исследования, чтобы определить, какие метки, создаваемые белками trxG, усиливают связывание и каких комплексов, чтобы определить степень, с которой энергия связывания с одиночным модифицированным остатком может влиять на функцию и targeting, и чтобы определить временную последовательность добавления меток и как они сохраняются во время митозов.
Обратная сторона этого механизма заключается в том, что метки могут ингибировать связывание с помощью репрессивных комплексов. Ковалентная метка на ключевом остатке, необходимая для оптимального связывания с помощью репрессивного комплекса, д. строго ингибировать связывание с помощью репрессивного комплекса. Напр., известно, что связывание с помощью репрессивных комплексов усиливается с помощью метилирования гистона H3 по K9 и K27 (Khorasanizadeh 2004). Ацетилирование этих остатков должно блокировать метилирование и создавать неправильной формы "knob" на гистоне, который участвует в связывании с помощью репрессивного комплекса. Т.о., способность модификаций влиять на функцию др. комплексов может быть пресечена в обоих направлениях, что увеличивает мощь этого потенциального способа эпигенетической регуляции.
Эти механизмы не только не являются взаимоисключающими, но и скорее всего работают совместно, чтобы помочь поддерживать активное состояние. Метки, которые химически увеличивают способность формировать компактное состояние (цис-эффект), могут также увеличивать способность комплексов соединяться (транс-эффект), и тем еще больше способствовать компактному состоянию. Напротив, метки, которые химически снижают компакцию, могут увеличивать связывание комплексов, что также decompact нуклеосомы. такое механически экономное использование ковалентных меток, чтобы изменять некоторые характеристики структцры хроматина и способность регуляторных комплексов соединяться, должны создавать мощное средство поддержания активного состояния.
3 Connections between trxG Proteins and the General Transcription Machinery
Тема, что trxG белки часто обнаруживаются в одних и тех же комплексах продолжается белками skuld (skd) и kohtalo (kto). Эти два белка являются гомологами белков, идентифицированных биохимически как TRAP240 (Skuld) и TRAP 230 (Kohtalo), которые являются членами комплекса "Mediator" (Janody et al. 2003). Комплекс mediator является крупным комплексом, который действует на инерфейсе между ген-специфическими активаторными белками и образованием пре-иниационного комплекса, который содержит РНК полимеразу II (Lewis and Reinberg 2003). Т.о., эти белки участвуют в процесса общей активации, большинство тем же самым способом, что и ремодельеры SWI/SNF-семейства и участвуют в общей активации. SKD и KTO могут обладать некоторыми специфическими функциями, участвующими в поддержании, т.к. др. компоненты комплекса не были идентифицированы при скрининге на гены trxG. Наблюдение, что SKD и KTO взаимодействуют др. с др. и что двойные мутанты имеют тот же самый фенотип, как и каждый из одиночных мутантов, это ведет к предположению, что эти два белка вместе формируют функциональную молекулу, которая каким-то образом меняет действие медиатора (Janody et al. 2003).
4 Biochemical Functions of Other trxG Proteins
Биохимическая активность большинства др. trxG белков остается довольно таинственной. Ring3, аналог у человека гена trxG дрозофилы
female-sterile homeotic (fsh), кодирует ядерную протеин киназу, с двумя bromodomains, которые участвуют в обеспечении хода клеточного цикла и в leukemogenesis, но субстраты для этой киназы неизвестны (Denis and Green 1996). trxG ген
Tonalli (Tna) кодирует белок, родственный белкам SP-RING пальчики, участвует в sumoylation, указывая тем самым. что он может также регулировать транскрипцию посредством ковалентных модификаций др., еще не установленных белков (Gutierrez et al. 2003). trxG ген
sallimus (sis) был идентифицирован при скрининге на вне генные супрессоры Pc (Kennison and Tamkun 1988) и впоследствии было установлено, что он кодирует у Drosophila Titin (Machado and Andrew 2000). Подобно своему аналогу у позвоночных дрозофилийный Titin помогает поддерживать целостность и эластичность саркомеров. Кроме того, Titin является хромосомным белком, который необходим для конденсации и сегрегации хромосом (Machado and Andrew 2000). Эти интригующие находки указывают на потенциальную роль trxG белков в регуляции структуры хроматина высшего порядка.
5 Functional Interactions between trxG Proteins
Сегодня, когда основные биохимические активности большинства членов групп trxG and PcG идентифицированы, внимание сдвинулось к путям, с помощью которых эти активности координируются, чтобы регулировать транскрипцию и поддерживать активное состояние. Не смотря на отсутствие in vitro систем для изучения поддержания детерминированного состояния, определенный прогресс был достигнут, одной из популярных гипотез является то, что члены trxG и PcG облегчают последовательность событий, необходимых для поддержания активного или репрессивного состояния. Подтверждение этой гипотезы получены недавно в исследованиях PcG комплексов PRC1 и PRC2; с помощью метилирования H3K27, E(z) histone methyl-transferase субъединицы PRC2, создается ковалентная метка, которя непосредственно распознается с помощью chromodomain Pc субъединицы из PRC1 (Jacobs and Khorasanizadeh 2002; Min et al. 2003). Т.о., один PcG комплекс, по-видимому, непосредственно способствует связыванию др. PcG комплекса с хроматином.
По аналогии возможно, что ковалентные модификации нуклеосом с помощью членов trxG с histone methyltransferase или acetyltransferase активностями (напр., TRX или ASH 1) непосредственно регулируют целенаправленную доставку или активности членов trxG, участвующих в АТФ-зависимом ремоделировании хроматина (напр., BRM [SWI/SNF], или KIS) (Fig. 8). В соответствии с этой возможностью, BRM и др. субъединицы SWI/SNF комплексов содержат bromodomains, которые могут непосредственно взаимодействовать с ацетилированными гистоновыми хвостами, а KIS содержит два chromodomains, которые могут непосредственно взаимодействовать с метилированными гистоновыми хвостами. Эта модель, которая подтверждается недавними исследованиями хроматин-ремоделирующих факторов на дрожжах и млекопитающих (Agalioti et al. 2000; Hassan et al. 2001), особенно привлекательна, т.к. она предоставляет механизм, с помощью которого наследуемые гистоновые модификации могут навсегда сохранять постоянно "открытую" конфигурацию хроматина, которая необходима для активной транскрипции.
6 trxG Proteins: Activators or Anti-repressors?
Др. важный вопрос связан с функциональным взаимоотношением между PcG репрессорами и trxG активаторами. Выполняют ли эти регуляторные белки независимые роли в активации репрессии, или они действуют в прямой оппозиции, чтобы поддерживать наследуемое состояние? недавние генетические исследования показали, что удаление PcG комплексов может реактивировать гены даже в отсутствие TRX и ASH1 (Klymenko and Muller 2004), указывая тем самым, что trxG белки с histone methyltransferase активностью могут функционировать как PcG анти-репрессоры, как противоположные активаторам (Fig. 8).
Как биохимический, так и генетический анализ предоставили доказательства, что возможны непосредственные взаимосвязи между trxG функцией и PcG функцией. Одним из интересных свойств PcG белков является то, что они способны репрессировать транскрипцию, ели прикреплены вблизи фактически любого гена, транскрибируемого с помощью РНК полимеразы II. Члены trxG, которые играют глобальные роли в транскрипции - включая BRM, KIS и др. членов trxG, участвующих в ремоделировании хроматина - являются таким образом прекрасными кандидатами на роль непосредственных мишеней для PcG репрессоров (Fig. 8). Один из крупных PcG комплексов, PRC1, блокирует функцию ремоделирующих комплексов семейства SWI/SNF, возможно путем блокирования доступа этого комплекса к матрице (Francis et al. 2001). Это согласуется с мнением, что один механизм PcG репрессии может предупреждать АТФ-зависимое ремоделирование с помощью членов trxG. Комплекс Brahma и PRC1 еще более оказываются взаимосвязанными благодаря тому факту, что оба непосредственно взаимодействуют с белком Zeste, который играет сложную роль в регуляции экспрессии генов у Drosophila, что может помогать прямому взаимодействию между этими комплексами.
Второй белок. который соединяет PcG белки и trxG блки, это GAGA фактор, который кодируется с помощью Trithorax-like гена и является таким образом членом trxG (Farkas et al. 1994). Этот белок может действовать как
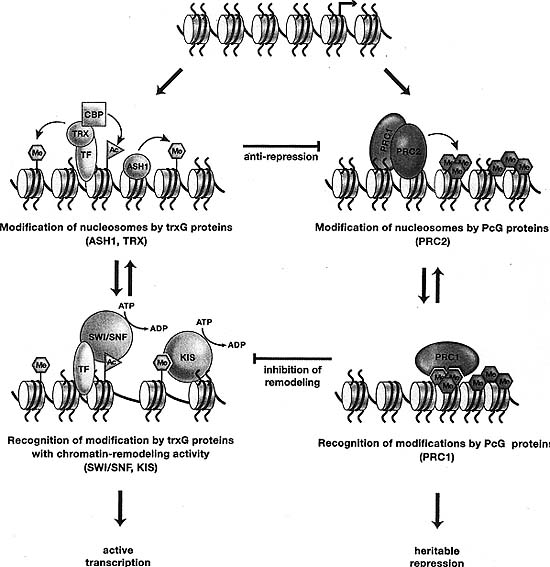 Figure 8. Trithorax Croup and Polycomb Group Functions and Interactions
Both trxG and PcG families include proteins that covalently modify histones and proteins that noncovalently modify chromatin. Covalent modifications on histones can increase binding by noncovalent modifying complexes such as SWI/SNF, KIS, or PRO. Binding by these latter complexes has the potential to lead to further covalent modification, thus leading to iterative cycles of covalent modification and recognition of the covalent marks.
Figure 8. Trithorax Croup and Polycomb Group Functions and Interactions
Both trxG and PcG families include proteins that covalently modify histones and proteins that noncovalently modify chromatin. Covalent modifications on histones can increase binding by noncovalent modifying complexes such as SWI/SNF, KIS, or PRO. Binding by these latter complexes has the potential to lead to further covalent modification, thus leading to iterative cycles of covalent modification and recognition of the covalent marks.
сиквенс-специфический белок активатор в некоторых промоторах, но также является выдающимся членом белков, которые соединяются с Polycomb Repressive Element (PRE, see Chapter 8). PRE последовательности управляют функцией PcG и, по крайней мере, один PRE может действовать как модуль памяти, если прикреплен к репортерной конструкции, подчеркивая важность этой последовательности. Последовательность, которая связывает GAGA фактор, играет важную роль в функции PRE, а прикрепление GAGA белка к ДНК, как полагают, усиливает связывание и функционирование PRC1 (Mahmoudi and Verrijzer 2001). Т.о., GAGA фактор может играть ключевую роль в поддержании активации (благодаря своим свойствам активирования транскрипции) и поддержании репрессии (благодаря взаимодействиям с PcG белками). Важным вопросом для будущих исследований является понимание, почему белки, такие как GAGA и Zeste, взаимодействуют с активирующими и репрессирующими аппаратами поддержания.
7 Conclusion and Outlook
Two of the major issues regarding function of trxG proteins remain largely a matter for conjecture. First, why does a relatively small subset of the proteins required for transcriptional activation score genetically as being important for maintenance of the active state? Is this because these proteins play global roles in transcription but are expressed in limiting quantities or happen, by evolutionary serendipity, to be especially important for developmentally important genes? Second, how can the active state be maintained across replication and mitosis? Replication will create two daughter strands that must both be regulated identically, and mitosis requires condensation and thereby inhibition of transcription of most genes in a cell. What mechanisms create the epigenetic mark(s) that ensures reactivation of a gene on both daughter strands following mitosis?
The majority of trxG proteins are part of complexes that are broadly used in gene expression, and most of these complexes also contain many other proteins not in the trxG (see Table 1). This raises the important question as to whether there are special functions that are used for maintenance of active gene expression. It is possible that SWI/SNF remodelers are able to perform a special remodeling function, that H3K4 methylation targets special complexes and/or chromatin conformations, and that Skuld/Kohtalo alter function of Mediator in a specific manner important for maintenance. Alternatively, it is possible that each of these proteins performs a reaction that is normally used in activation of all types of genes, and that these complexes are among those that have emerged as being important for maintenance for a relatively uninteresting reason (e.g., because even relatively subtle changes in the expression of Drosophila Hox genes cause homeotic transformations). To resolve these issues, considerably more information is needed about the precise mechanisms that each of these proteins uses in activation. For example, do the SWI/SNF complexes harness the energy of ATP hydrolysis in the same manner as other ATP-dependent remodeling complexes, or do they differ in an important way in how this energy is used to alter nucleosome structure? Structural techniques including crystallography, biophysical techniques such as single-molecule analysis and FRET (fluorescence resonance energy transfer), and detailed imaging in vivo might help to shed light on whether there are mechanisms specially designed for epigenetic maintenance of activation. The initial functional studies that have been done with trxG complexes on simple model templates are just the beginning of the process for answering these important questions.
The epigenetic mechanisms that might maintain an active state are even less well understood. Are covalent marks distributed to help create an active mark? Are nucleosome positions maintained following replication to create "open" stretches of chromatin, or specially positioned nucleosomes, that increase binding of activators? Does trxG function cause active genes to compartmentalize within the nucleus to regions that favor active transcription? These are all viable hypotheses; more hypotheses exist, and others have not yet even been envisioned. The incredible complexity of the machinery that transcribes DNA offers numerous possibilities for regulation, and for the development of mechanisms that allow an epigenetic maintenance of active transcription. This intersection of two fields rich in intellectual history, transcriptional activation and epigenetic mechanism, will provide fertile ground for experimentalists for many years.
Сайт создан в системе
uCoz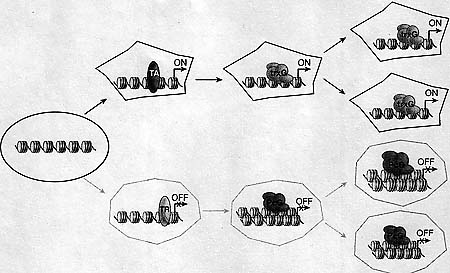 Figure 1. The Concept of Cellular Memory
Schematic illustration highlighting the role of trxG complexes in maintaining heritable states of active gene expression in contrast to heritable silencing by PcG complexes, as defined originally for the Drosophila Hox gene cluster.
Figure 1. The Concept of Cellular Memory
Schematic illustration highlighting the role of trxG complexes in maintaining heritable states of active gene expression in contrast to heritable silencing by PcG complexes, as defined originally for the Drosophila Hox gene cluster. 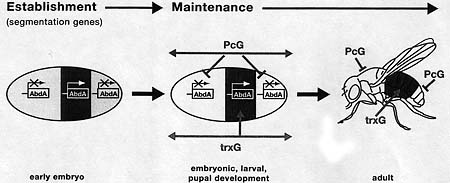 Figure 2. Regulation of Hox Transcription
The boundaries of abd-A transcription and other Hox genes are established by segmentation proteins. These include the products of gap and pair-rule genes, which subdivide the embryo into 14 identical segments. During subsequent development, the "OFF" or "ON" states of Hox transcription are maintained by the ubiquitously expressed members of the trxG of activators and the PcG of repressors via mechanisms that remain poorly understood.
Figure 2. Regulation of Hox Transcription
The boundaries of abd-A transcription and other Hox genes are established by segmentation proteins. These include the products of gap and pair-rule genes, which subdivide the embryo into 14 identical segments. During subsequent development, the "OFF" or "ON" states of Hox transcription are maintained by the ubiquitously expressed members of the trxG of activators and the PcG of repressors via mechanisms that remain poorly understood. 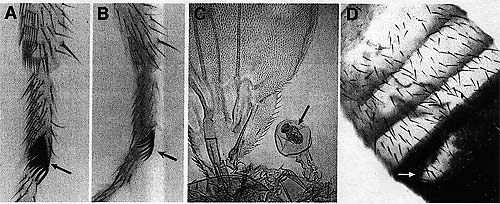 Figure 3. Examples of Developmental Cell Fate Transformations Associated with Mutations in Drosophila trxG Genes
(A) Wild-type first leg. The sex comb, unique to the first leg, is marked by an arrow. (B) A patch of kis mutant tissue (marked by an arrow) is partially transformed from the first leg to the second leg due to decreased Scr transcription, albeit incomplete, as evidenced by a reduction in the number of sex comb teeth. (Q A patch of mor mutant tissue (marked by an arrow) displays the partial transformation from balancer organ to wing, due to decreased Ubx expression. (D) A patch of kis mutant tissue (marked by an arrow) in the fifth abdominal segment is partially transformed to a more anterior identity due to decreased Abd B expression, as evidenced by the loss of the dark pigmentation characteristic of this segment. (A,B,D, Reprinted, with permission, from Daubresse et al. 1999.)
Figure 3. Examples of Developmental Cell Fate Transformations Associated with Mutations in Drosophila trxG Genes
(A) Wild-type first leg. The sex comb, unique to the first leg, is marked by an arrow. (B) A patch of kis mutant tissue (marked by an arrow) is partially transformed from the first leg to the second leg due to decreased Scr transcription, albeit incomplete, as evidenced by a reduction in the number of sex comb teeth. (Q A patch of mor mutant tissue (marked by an arrow) displays the partial transformation from balancer organ to wing, due to decreased Ubx expression. (D) A patch of kis mutant tissue (marked by an arrow) in the fifth abdominal segment is partially transformed to a more anterior identity due to decreased Abd B expression, as evidenced by the loss of the dark pigmentation characteristic of this segment. (A,B,D, Reprinted, with permission, from Daubresse et al. 1999.)