В геноме млекопитающих цитозины, за которыми следуют гуанины (CpG-динуклеотиды), служат основными мишенями для ферментов ДНК-метилтрансфераз (DNMT). Однако метилирование, не связанное с CpG, также происходит в определенных типах клеток, таких как ооциты, плюрипотентные эмбриональные стволовые клетки (ESCs), дифференцирующиеся клетки и зрелые нейроны [2-4]. Динуклеотиды CpG неравномерно распределены в геноме. Общегеномная плотность CpG примерно в десять раз ниже ожидаемой. Это является следствием частого перехода 5mC в T, который неэффективно восстанавливается из-за естественного присутствия тимина в ДНК. Геномная плотность динуклеотидов CpG почти равна или даже выше ожидаемой в островах CpG (CGI). CGI, часто расположенные в промоторах генов, часто не метилированы, в то время как подавляющее большинство остальных CpG метилированы, в результате чего в соматических клетках человека метилировано около 70 % всех CpG в геноме [5].
Метилирование ДНК представляет собой наиболее стабильную эпигенетическую метку. Однако в физиологических, патологических и некоторых экологических условиях уровень метилирования CpG может быстро меняться [6-8]. Наиболее известный пример - эмбриональное развитие. Вскоре после оплодотворения отцовский геном подвергается быстрому и обширному деметилированию, за которым следует более медленное деметилирование материнского генома [1, 5]. В результате до имплантации происходит значительная глобальная потеря геномного метилирования. Однако существуют видовые различия, и точные молекулярные механизмы все еще изучаются. Кроме того, до сих пор не выяснена роль потери метилирования ДНК в приобретении плюрипотентности. За этим ранним деметилированием следует волна реметилирования при имплантации и начало дифференцировки, когда тотипотентные клетки становятся плюрипотентными. Интересно, что если плюрипотентные клетки мезодермы имеют более высокий уровень метилирования, то клетки висцеральной эндодермы достигают лишь более низкого уровня метилирования [9]. Плюрипотентные клетки нейральной линии менее чувствительны к реметилированию, но подвергаются значительному увеличению метилирования после рождения [10, 11]. Линейно-специфические различия в метилировании особенно характерны для энхансеров. В ходе эмбриогенеза примордиальные зародышевые клетки (PGC) подвергаются еще более значительному деметилированию, чем первая волна в период преимплантации. За этим деметилированием вновь следует реметилирование во время полного созревания половых клеток.
Деметилирование может быть как репликационно-зависимым, так и независимым [12]. Независимое от репликации деметилирование представляет собой сложный многоступенчатый окислительный процесс, катализируемый белками ten-eleven translocation (TETTET) [13]. Это активное деметилирование, осуществляемое диоксигеназами TET1, 2 или 3, зависит от α-кетоглутарата, Fe2+ и ascorbate. Ферменты TET окисляют 5-метилцитозин до 5-гидроксиметилцитозина, затем до формил- и карбоксил-цитозина, что в конечном итоге приводит к замене метилированного цитозина на неметилированный цитозин путем эксцизионной репарации оснований [13-15]. Ферменты TET динамически контролируют экспрессию генов и уравновешивают репрессивные эффекты DNMT, что имеет решающее значение для поддержания клеточной идентичности и транскрипционной гибкости. Интересно, что физиологический эффект TETs одновременно антагонистичен и кооперативен с DNMTs. Действительно, для полноценной дифференцировки и созревания различных типов клеток (например, кроветворных) как метилирование, так и последовательное гидроксиметилирование, вызывающее осциллирующие циклические изменения метилирования ДНК, особенно в плюрипотентных стволовых клетках, имеет фундаментальное значение [16]. Мы получили представление об этих физиологических ролях, изучая консервативные семейства ферментов TET (описанные в других источниках, например, в [17, 18]) и ДНК-метилтрансфераз (DNMTs). В данном обзоре кратко описаны DNMTs и особое внимание уделено двум представителям этого семейства.
DNA methyltransferases (DNMTs)
После репликации ДНК метилирование сохраняется на исходной нити ДНК-шаблона, в то время как вновь синтезированная нить остается неметилированной [19-22]. Без активности ДНК-метилтрансфераз происходило бы репликационно-зависимое деметилирование. Поддерживающая метилтрансфераза DNMT1 накапливается на гемиметилированной двухцепочечной ДНК вблизи вилки репликации и восстанавливает исходный паттерн метилирования. В этом процессе UHRF1 играет критическую роль, сначала связываясь с гемиметилированными CpG-динуклеотидами, а затем образуя комплекс с DNMT1. Сотрудничество множества эпигенетических факторов и UHRF1 обеспечивает точную передачу замалчиваемых структур хроматина в ходе клеточного деления [23].
В отличие от других членов семейства DNMT, DNMT2 выделяется тем, что кодирует фермент, предназначенный для метилирования молекул тРНК [24].
Семейство DNMT дополняют белки, участвующие в основном в метилировании de novo. DNMT3A и DNMT3B устанавливают профили метилирования ДНК в дифференцирующихся стволовых клетках, примордиальных зародышевых клетках во время раннего эмбриогенеза и в меньшей степени в дифференцированных клетках на более поздних этапах жизни [25, 26]. Эти ферменты имеют сходную доменную организацию (ADD, PWWP и метилтрансфераза) с очень высокой идентичностью последовательностей (~85 %) в каталитическом домене метилтрансферазы.
Экспрессия Dnmt3a и Dnmt3b начинается еще до имплантации эмбриона [27]. Эти ферменты играют важную роль в замалчивании повторяющихся элементов в ESCs Экспрессия метилтрансфераз ДНК de novo возрастает в период имплантации, и они осуществляют очень быстрое реметилирование эмбриональных и вне-эмбриональных линий в постимплантационных эмбрионах. Эти ферменты экспрессируются в плюрипотентных стволовых клетках, что сохраняется до взрослого возраста. Хотя в различных тканях их экспрессия снижается по мере дифференцировки, точный паттерн экспрессии остается неясным. Аналогично соматическим клеткам Dnmt3a и Dnmt3b экспрессируются в PGCs где они отвечают за реметилирование клеток в процессе созревания.
Экспрессия
Dnmt3a контролируется альтернативными промоторами, которые продуцируют две различные изоформы: полноразмерную DNMT3A1 и короткий вариант DNMT3A2, в котором отсутствует N-концевой домен [28] (рис. 1). DNMT3A1 экспрессируется повсеместно на низком уровне и локализуется в гетерохроматине, в то время как DNMT3A2 экспрессируется на высоком уровне в эмбриональных стволовых клетках и ограничивается тканями, подвергающимися
de novo метилированию, такими как яички и яичник, где она локализуется в эухроматических областях [29]. Кроме того, было показано, что DNMT3A1, но не короткий DNMT3A2, необходим для постнатального развития мыши, связываясь с бивалентными нейроразвивающими генами в мозге и регулируя их [30].
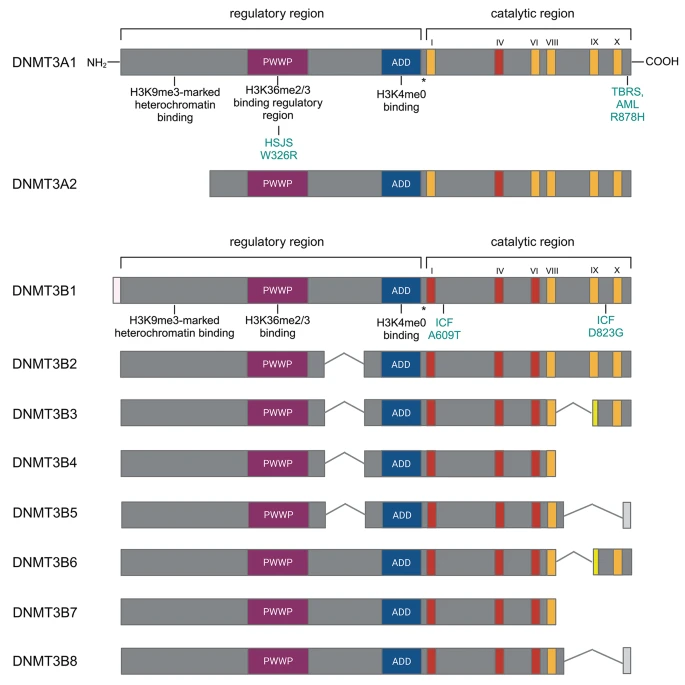
figure 1
DNMT3A and DNMT3B isoforms in mouse. Conserved regions are colored, and their respective functions are indicated below. The conserved domain IV in the catalytic region of Dnmt3a is flanked by the loxP sites is indicated in red. HSJS stands for Heyn-Sproul-Jackson syndrome, associated with mutations in the DNMT3A PWWP domain. The W326R mutation is homologous to the human W330R disease-causing mutation and recapitulates the disease phenotype (see under “Medical Relevance” chapter). TBRS represents Tattoon-Brown Rahman Syndrome, AML indicates acute myeloid leukemia. Both can develop due to the dominant R382H mutation in human. The corresponding mouse mutation R878H is indicated. DNMT3B isoforms are shown on the panel below. The conserved domains I - VI in the catalytic region of Dnmt3b flanked by the loxP sites are indicated in red. A609T and D823G mutations cause similar phenotype than the human ICF syndrome (immunodeciency-centromeric instability-facial dismorphism). Homologous A603T and D817G mutations were reported in ICF patients
DNMT3B изоформы показаны на панели внизу. Законсервированные домены I - VI в каталитической области Dnmt3b, фланкированные сайтами loxP, обозначены красным. Мутации A609T и D823G вызывают фенотип, сходный с человеческим синдромом ICF (immunodeciency-centromeric instability-facial dismorphism). Гомологичные мутации A603T и D817G были зарегистрированы у пациентов с ICF.
В отличие от Dnmt3a, существует более 30 сплайс-вариантов Dnmt3b, при этом лишь некоторые из них обнаруживаются на уровне белка и еще меньше являются каталитически активными [31] (рис. 1). Dnmt3b1 и Dnmt3b2 кодируют интактный С-концевой и ферментативно активный каталитический домен. Dnmt3b1 обычно рассматривается как типичный продукт гена Dnmt3b. Однако в мужских половых клетках был обнаружен Dnmt3b2 как основной транскрипт, способный осуществлять метилирование de novo [29]. Шесть других более распространенных изоформ (Dnmt3b3-8) имеют делеции в С-концевом каталитическом домене, что делает их более мелкими и каталитически неактивными белками. Однако паттерны их экспрессии высоко-консервативны между человеком и мышью, что позволяет предположить биологическую значимость этих изоформ. Действительно, они могут выступать в качестве вспомогательных белков, взаимодействующих с каталитически активными de novo метилтрансферазами и аллостерически активирующих DNMT3B1 [32, 33].
Как DNMT3A, так и DNMT3B нацелены на геномные регионы, не имеющие метилирования ни на одной из двух нитей. Они метили цитозины в динуклеотидах CpG и в сайтах, не относящихся к CpG (CpH, в основном CpA), хотя эффективность последних значительно ниже [2-4]. Ферменты проявляют некоторую, но довольно ограниченную специфичность к последовательности соседних нуклеотидов [34, 35]. Вместо этого модификации гистонов играют более важную роль в рекрутировании или ингибировании связывания de novo метилтрансфераз с определенными участками генома.
H3K4me3, характерная черта активных промоторов, и гетерохроматиновые домены, характеризующиеся моноубиквитилированием H3K27me3 или H2AK119, в целом ингибируют активность de novo метилатрансфераз. Напротив, модификации H3K9me3 (характерные для перицентромерного гетерохроматина) и H3K36me3 (присутствующие в активно транскрибируемых телах генов) активно привлекают DNMTs de novo, что приводит к интенсивному метилированию ДНК в этих геномных регионах. DNMT3A и DNMT3B узнают H3K36me2/3 через свой PWWP-мотив (Pro-Trp-Trp-Pro) и ограничивают инициацию транскрипции каноническими сайтами начала транскрипции (TSS), метилируя внутригенные промоторы [36]. Активность de novo DNMT усиливается ДНК-метилтрансферазой 3-like (DNMT3L), каталитически неактивным, но важным членом семейства DNMT. DNMT3L действует как партнер-мостик для de novo DNMT3, особенно в зародышевых клетках, между целевым регионом и ферментом [37-39]. DNMT3L избирательно связывается через свой домен ADD (ATRX, DNMT3 и DNMT3L) с не-модифицированным H3K4, в то время как связывание блокируется H3K4me3 [40]. В дополнение к этим членам семейства, DNMT3C завершает подсемейство de novo метилтрансфераз у Muridae, где он специфически экспрессируется в мужских половых клетках и метилирует транспозоны [41].
Критическая физиологическая роль DNMT3A и DNMT3B в нормальном развитии млекопитающих очевидна уже в раннем возрасте, о чем свидетельствует перинатальная летальность у нокаутных мышей Dnmt3a и эмбриональная летальность у нокаутных мышей Dnmt3b. Дисфункция этих ферментов была связана с различными заболеваниями человека, включая острый миелоидный лейкоз (AML), синдром ICF (иммунодефицит, нестабильность центромер и лицевые аномалии) и рак (см. главу «Медицинские аспекты»). Для выяснения детальной физиологической роли метилтрансфераз de novo были сконструированы тканеспецифические нокаутные мышиные модели. Эти модели выявили значительные фенотипические признаки, дающие ценное представление о функции этих ферментов, которые будут всесторонне рассмотрены в последующих разделах.
Tissue-specific de novo DNMT knockout mouse models
Dnmt1, Dnmt3a и Dnmt3b незаменимы в процессе развития, что затрудняет изучение их глобальных и тканеспецифических функций in vivo. Системы условного нокаута обеспечивают целенаправленный подход к преодолению этого ограничения, позволяя осуществлять пространственный и временной контроль над делецией генов. Эта стратегия позволяет раскрыть участие DNMT в спецификации линий, дифференцировке и поддержании клеточной идентичности.
Система рекомбинации Cre/loxP широко используется для создания условных нокаутов (cKO) у млекопитающих [42]. В этом методе рекомбиназа Cre вырезает сегменты ДНК, фланкированные сайтами loxP, а ее экспрессия направляется тканеспецифичными или индуцибельными промоторами для точной делеции генов. Альтернативные системы, такие как Flp/FRT, используются в некоторых контекстах, но менее распространены [43]. Другие методы, такие как Zn finger nuclease (ZFN) [44] и TALEN (transcription activator-like effector nuclease) - опосредованный нокаут [45], также иногда используются для геномной инженерии. Недавно CRISPR/Cas9 был адаптирован для условного редактирования генов, позволяя экспрессировать Cas9 или направляющие РНК в зависимости от ткани, что обеспечивает большую точность и гибкость [46]. Однако этот подход остается трудоемким.
Системы cKO сталкиваются с серьезными проблемами. Негерметичная экспрессия Cre может вызвать непреднамеренную рекомбинацию в не-целевых тканях или стадиях, что приведет к мозаицизму или неожиданным фенотипам. Неполная рекомбинация может привести к остаточной экспрессии целевого гена, что усложняет фенотипический анализ. Эффективность и специфичность рекомбиназы Cre в значительной степени зависят от выбранного промотора, что вносит вариабельность в делецию генов. Для индуцибельных систем, таких как Cre-ERT2, активируемая тамоксифеном, время индукции имеет решающее значение, но несоответствия в доставке или биодоступности лекарств могут повлиять на воспроизводимость.
Несмотря на эти ограничения, стратегии cKO произвели революцию в изучении метилирования ДНК, позволяя обойти эмбриональную летальность и целенаправленно нарушать работу генов.
Germ cells and early development
Для выяснения роли DNMT3A и B в процессе развития были проведены многочисленные исследования. Эти исследования показали, что одновременная делеция Dnmt3a и Dnmt3b в эмбриональных стволовых (ES) клетках приводит к потере способности к дифференцировке [26]. Кроме того, во время дифференцировки отдельных нокаутных ES-клеток Dnmt3a или Dnmt3b в эмбриональные фибробласты мыши (MEF) было выявлено значительно больше DNMT3B-, чем DNMT3A-зависимого метилирования цитозина [47]. Более того, были выявлены разные наборы генов, специфически метилируемых DNMT3A и DNMT3B, причем набор генов, зависящий от DNMT3A, был значительно обогащен генами Hox, связанными с развитием.
Хотя потребность в метилтрансферазах
de novo для дифференцировки хорошо известна, двойной нокаут не препятствует дедифференцировке и образованию индуцированных плюрипотентных стволовых клеток (iPSC) из MEF [48]. Более того, способность этих клеток к дифференцировке может быть восстановлена путем повторного введения
de novo Dnmts. Также было показано, что в клетках MEF DNMT3B проявляет некоторую поддерживающую метилтрансферазную активность, которая дополняет активность DNMT1 [49] (рис. 2). В этой нокаут-модели, где абляция Dnmt3b достигалась путем трансфекции аденовирусного вектора, кодирующего рекомбиназу cre, уровни метилирования ретровирусных и минорных сателлитных повторов снижались в отсутствие гена
Dnmt3b. В клетках MEF наблюдалась либо старение, либо иммортализация, а также хромосомные аномалии, тогда как нокаут
Dnmt3a не приводил к подобным эффектам.
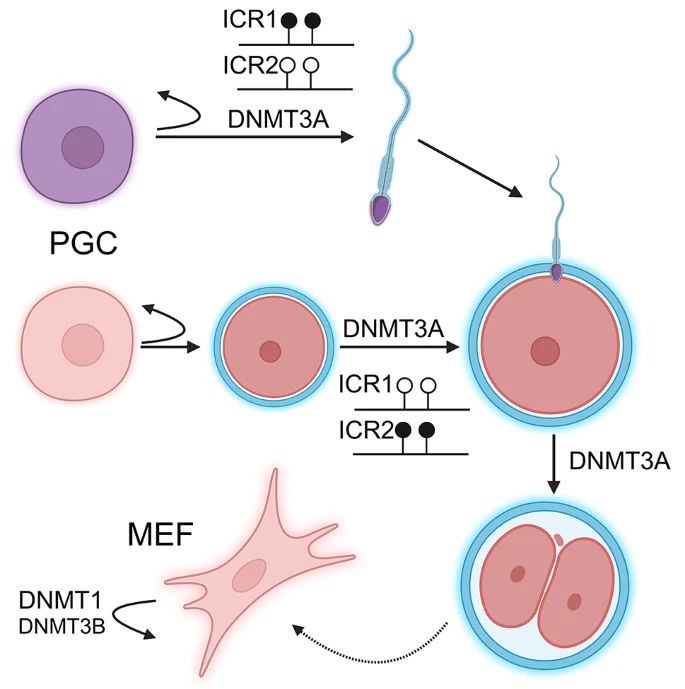
figure 2
DNMT3A plays pivotal role in germ cell maturation and during preimplantation. Dnmt3a knockout primordial germ cells (PGC) are unable to differentiate to mature germ cells and can not establish parental-specific methylation patterns required for genomic imprinting. The PGCs maintain their ability to replicate and remain PGCs. DNMT3B plays minor role in complementing of the maintainance methylation activity of DNMT1 in mouse embryonic fibroblasts (MEF). ICRs are imprinting control regions. Lollipops represent CpG sites. Black CpGs are methylated, white CpGs are unmethylated
Метилтрансферазы de novo также играют важнейшую роль в половых клетках и ранних эмбрионах [50] (рис. 2). В частности, специфический для сперматогониальных стволовых клеток нокаут Dnmt3a приводит к широкому геномному деметилированию, что подчеркивает регуляторную функцию этого фермента [51] (дополнительная табл. 1). В отсутствие DNMT3A клетки могут поддерживать состояние стволовости, но не способны к дифференцировке. Потеря DNMT3A в ооците приводит к снижению метилирования и нарушению накопления 5-гидроксиметилцитозинов в материнском геноме после оплодотворения [7]. Более того, аналогичный эффект материнской DNMT3A наблюдался и на отцовский геном в зиготе и 2-клеточном эмбрионе [7, 52].
Геномный импринтинг, характеризующийся специфической для родителей экспрессией нескольких десятков генов, регулируется различными эпигенетическими механизмами, включая метилирование ДНК. Отличительной чертой этих генов является регуляторная область, называемая областью контроля импринтинга (ICR), которая метилирована на замалчиваемом аллеле и лишена метилирования на транскрибируемом аллеле (рис. 2). Неудивительно, что DNMT играют определенную роль в этом процессе. Первые исследования с использованием TNAP-cre для инактивации Dnmt3a и Dnmt3b в половых клетках показали необходимость DNMT3A для метилирования как материнского, так и отцовского импринтированных локусов, в то время как DNMT3B не играет никакой роли в этом процессе [53]. Последующие исследования подтвердили, что DNMT3B не играет никакой роли в метилировании ICR. Кроме того, было показано, что после установления паттерна метилирования в ICR, DNMT3A не требуется для поддержания этой метки метилирования [54, 55]. Однако во время перепрограммирования плюрипотентных стволовых клеток DNMT3A привлекается для реметилирования некоторых ICRs [56].
Uterus and placenta
Хотя первоначально считалось, что DNMT3A играет лишь незначительную роль в матке [57], ее удаление из плацентарного сосудистого эндотелия привело к снижению васкуляризации, что привело к плацентарной недостаточности и задержке роста плода [58] (Дополнительная таблица 1). Аналогичным образом, истощение Dnmt3b в прогестероновый-рецептор-положительных стромальных и эпителиальных клетках матки с помощью Pgr-cre на первый взгляд не вызывало никаких серьезных изменений [59]. Однако при более детальном анализе стало очевидно, что у нокаутных мышей в матке происходит децидуализация эндометрия, что приводит к потере примерно половины имплантированных эмбрионов (рис. 3). Хотя это сопровождалось изменением картины экспрессии специфических для матки генов, глобальных изменений метилирования ДНК в ткани не наблюдалось. Однако данные по нескольким генам указывали на обратную корреляцию между экспрессией РНК и изменениями метилирования ДНК. Физиологическая значимость экспрессии
Dnmt3b в эндометрии была дополнительно подчеркнута при изучении поколения F1, поскольку потомство нокаутных женского пола особей характеризовалось изменениями гомеостаза липидов и глюкозы и гистологическими изменениями печени [60].
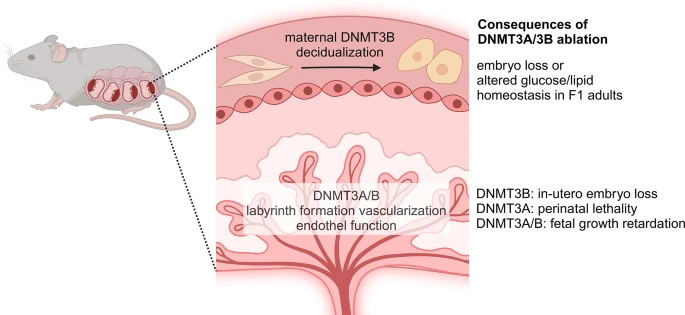
figure 3
DNMT3A and DNMT3B are involved in fetal development. DNMT3B is required for the decidualization of the endometrium and the absence of the gene from progesterone-sensitive cells disturbs this process and leads to embryonic loss. Both DNMT3A and DNMT3B are required for labyrinth formation. The maintenance of Dnmt3b expression in trophoblast cells is crucial for embryonic development and survival
Изучение плаценты, сложного органа, состоящего из тканей матери и плода, недавно пролило свет на роль DNMT3B во вне-эмбриональных тканях. Как уже упоминалось ранее, известна внутриутробная гибель всего организма от ДНМТ3b. Это согласуется с более значительным снижением метилирования, наблюдаемым при полном нокауте Dnmt3b по сравнению с нокаутом Dnmt3a. Во время эмбриогенеза наблюдается значительная потеря метилирования, особенно в экстра-эмбриональных тканях, а не в эпибласте, при двойном нокауте метилтрансфераз de novo (рис. 3). Интересно, что у эмбрионов с нокаутом Dnmt3b, опосредованным Sox2-cre, специфичным для эпибласта, где экспрессия гена в трофобласте сохраняется [61, 62], выживаемость почти нормальная. Однако эти мыши погибают вскоре после рождения [62]. В совокупности эти данные убедительно свидетельствуют о том, что внутриутробная летальность при нокауте Dnmt3b, скорее всего, связана с плацентарной недостаточностью.
Hematopoietic differentiation
Роль метилтрансфераз
de novo также была прослежена через терминальную дифференцировку с особым вниманием к кроветворным клеткам. Первоначально исследования показали, что гемопоэтические стволовые клетки (HSC), лишенные Dnmt3a [63, 64] и/или Dnmt3b, полученные путем трансплантации нокаутных HSC опосредованных Mx1-cre, теряли потенциал дифференцировки и демонстрировали повышенную способность к самообновлению [65] (рис. 4). Эти исследования выявили синергическую роль двух
de novo метилтрансфераз, причем DNMT3A играет важнейшую роль в кроветворении, а DNMT3B в основном дополняет ее функцию [66]. Неожиданно оказалось, что в отсутствие одного или обоих генов в разных геномных регионах наблюдалось гиперметилирование ДНК. Кроме того, более поздние исследования продемонстрировали независимую от метилирования регуляторную роль DNMT3A в сплайсинге как в ESCs так и в HSC [67].

figure 4
Hematopoietic stem cells (HSC) maintain their stemness or undergo differentiation after replication. Differentiation is primarily regulated by DNMT3A. DNMT3B has a complementary role in this process. Hematopoietic differentiation also requires TET2 demethylase activity. The methylome is characterized by kb long canyons with very low methylation levels enriched by methylation sensitive transcription factor (TF) binding sites involved in erythroid differentiation. The edges of the canyons are enriched in 5hmC (grey lollipops), regulating myeloid differentiation. TFs binding these regions are less sensitive to DNA methylation. Dnmt3a knockout mice have skewed erythroid, Tet2 knockout mice have skewed myeloid differentiation. CHIP: clonal hematopoiesis of indeterminate potential; MDS: myelodysplastic syndrome
Многочисленные исследования изучали роль метилтрансфераз de novo в дифференцировке различных подмножеств HSC с использованием различных линий cre [68-75] (дополнительная таблица 1). Однако истинная функция метилирования ДНК в кроветворении была выяснена только после сравнения роли DNMT3A и TET2 в HSC с одним или двумя нокаутами [76-78] (рис. 4). В отсутствие DNMT3A баланс эритроидной/миелоидной дифференцировки был смещен в сторону повышенной эритроидной дифференцировки [77]. И наоборот, отсутствие TET2 приводило к усилению миелоидной дифференцировки. Эти исследования также выявили крупные (длиной в несколько килобайт) неметилированные геномные регионы, названные «каньонами», которые характеризуются краями с высоким содержанием 5-гидроксиметилцитозина [76]. Центр и края каньонов обогащены несколькими сайтами связывания транскрипционных факторов и включают гены, вовлеченные в кроветворение. Мутации Dnmt3a у пациентов с гематологическими злокачественными опухолями были связаны с изменениями экспрессии генов каньона. Наконец, было обнаружено, что несколько транскрипционных факторов, ответственных за эритроидную дифференцировку (Tal1, Gata1 и Klf1), содержат больше CpG-динуклеотидов в своих сайтах связывания и, следовательно, более чувствительны к метилированию ДНК, чем миелоидные транскрипционные факторы [77]. Следовательно, эти элементы узнавания более метилированы в нокаутных клетках Tet2 и гипометилированы в нокаутных клетках Dnmt3a, что приводит к изменению баланса между неметилированным, метилированным и гидроксиметилированным состояниями по сравнению с клетками дикого типа. Это предполагает регулируемую кооперацию и конкуренцию между DNMT3A и TET2 [76, 78].
Musculoskeletal system
После выяснения роли метилтрансфераз
de novo в процессе дифференцировки HSC и в различных подмножествах гемопоэтических клеток постепенно раскрывается их значение в других тканях (рис. 5). Было показано, что, в отличие от дифференцировки кроветворных клеток, потеря Dnmt3a оказывает лишь незначительное влияние на оссификацию, тогда как DNMT3B играет решающую роль в этом процессе [79]. Отсутствие Dnmt3b в хондроцитах индуцирует остеоартрит [79, 80] (Дополнительная таблица 1). Более того, дефицит Dnmt3b в эмбриональной линии хондроцитов задерживает созревание хондроцитов и минерализацию матрикса [81]. Нокаут
Dnmt3b приводит и к другим изменениям, в основном из-за отсутствия фермента в мезенхимных клетках предшественниках [82-84]. Также наблюдалось нарушение эндохондрального окостенения, снижение репарации переломов и механической прочности новообразованной кости. Молекулярный механизм пока не до конца понятен, но, вероятно, в его основе лежит усиление Notch-сигнализации, которая в норме подавляется DNMT3B. С другой стороны, в клетках-предшественниках остеокластов, происходящих из макрофагов, основной метилтрансферазой
de novo является DNMT3A [85]. Нокаут
Dnmt3a в линии остеокластов с помощью трансгена Rank-cre приводит к тому, что клетки-предшественники остеокластов не дифференцируются в зрелые остеокласты, и у мышей наблюдается увеличение костной массы из-за недостаточной резорбции кости. Удивительно, но при определенных условиях некоторые мутанты
DNMT3A могут вызывать усиленный остеокластогенез и, как следствие, остеопороз (см. раздел «Медицинские аспекты»).

figure 5
De novo methyltransferases play primordial role in ossification. Mesenchymal progenitor cells (MPC) differentiate to chondroblasts (CB) then chondrocytes (CC) and osteoblasts (OB) then osteocytes (OC). DNMT3B is a key regulator of this process. In the absence of Dnmt3b delayed CC maturation, osteoarthritis, impaired fracture healing is observed. Osteoclasts (OCl), responsible for bone resorption and maintaining homeostasis of ossification are differentiating from MPC (macrophages) themselves originating from myeloblasts (MB). In the absence of Dnmt3a increased bone mass was reported. Skeletal muscle development also requires DNMT3A. In knockouts decreased body weight was reported. MPSC: myogenic progenitor stem cells; MB: myoblasts; MF: myofibrillul; MT: myotube
Наконец, роль DNMT3A в опорно-двигательном аппарате также изучалась на мышах-нокаутах [86]. Хотя были выявлены незначительные потери метилирования в масштабах генома и изменения экспрессии генов, серьезного эффекта от нокаута гена не отмечено. Однако другая модель тканеспецифического нокаута выявила функцию Dnmt3a и в скелетных мышцах [87]. Мыши, специфически нокаутированные Dnmt3a с помощью трансгена Pax3-cre в клетках-предшественниках мышечных сателлитов, демонстрируют снижение массы тела, мышечной массы и ухудшение способности к регенерации мышц. Молекулярный механизм этого может заключаться в том, что DNMT3A индуцирует пролиферацию, подавляя экспрессию ингибитора циклин-зависимой киназы (p57kip2), регулятора клеточного цикла, в клетках-сателлитах. Повышенная экспрессия p57kip2 в нокаутных клетках Dnmt3a приводила к ингибированию пролиферации и, в конечном итоге, к снижению мышечной массы [87].
Visceral organs
Роль Dnmt3a и Dnmt3b изучалась в ходе органогенеза и в ответ на стимулы окружающей среды. Незначительные эффекты ферментов были обнаружены в различных зародышевых слоях: тканях, связанных с эктодермой, таких как хрусталик [88] и эпидермис [89]; тканях, связанных с мезодермой, включая кардиомиоциты [90], почки [91] и матку (см. выше); и тканях, связанных с энтодермой, таких как печень [92] (дополнительная таблица 1). Однако более детальный анализ выявил их значительную функцию в конкретных висцеральных тканях и типах клеток.
Например, истощение Dnmt3b в кардиомиоцитах привело к изменению сплайсинга мРНК и накоплению альтернативно сплайсированных вариантов транскрипта саркомерного гена Myh7, что привело к нарушению систолической функции [93]. Исследования in vitro показали, что DNMT3B и DNMT3L подавляют экспрессию маркерных генов кардиомиоцитов в ESCs. Кроме того, было замечено, что в отсутствие Pten, ключевого регулятора дифференцировки сердца, экспрессия Dnmt3b увеличивается одновременно с метилированием CpG и не-CpG, что является характерным эффектом метилтрансфераз de novo. Это ингибирует экспрессию IGF2, нижележащего регулятора дифференцировки кардиомиоцитов [94]. Двойной нокаут Dnmt3b и Dnmt3l с помощью Crispr/Cas9 восстановил фенотип нокаутных клеток ESCs с Pten, что привело к увеличению числа кардиомиоцитов в культуре в условиях дифференцировки. Эти результаты были подтверждены в экспериментах in vivo.
В другом сценарии нокаута значимость роли DNMT3B была раскрыта только после того, как модель подверглась испытаниям. У мышей с нокаутом Dnmt3b, специфичным для бурого жира и скелетных мышц (полученным с помощью трансгена Myf5-cre), фенотип не проявлялся до 4-месячного возраста [95]. Однако самки мышей без функционального Dnmt3b были подвержены ожирению при кормлении высокожировой диетой (HFD), так как они набирали значительно больше веса, чем их контрольные сородичи. У этих самок с дефицитом Dnmt3b также развивалась инсулинорезистентность, несмотря на отсутствие увеличения потребления пищи. Примечательно, что были обнаружены лишь незначительные изменения метилирования ДНК и экспрессии метаболических генов. Удивительно, но самцы продемонстрировали устойчивость к HFD, которая не оказала никакого влияния на скелетные мышцы. Важно подчеркнуть, что выбор трансгенов, используемых для абляции Dnmt3b, имеет решающее значение. Та же исследовательская группа вскоре после этих результатов опубликовала еще одно исследование с использованием трансгена Ucp1-cre для устранения Dnmt3b в зрелых бурых адипоцитах. В этом исследовании у самок наблюдался тощий фенотип, и были зафиксированы контрастные эффекты на экспрессию большинства тех же нескольких генов, которые изучались в предыдущем исследовании [96]. Интересно, что в обоих исследованиях самцы были устойчивы к вызову HFD. Это позволяет предположить, что DNMT3B может оказывать обратное эпигенетическое влияние на экспрессию генов и фенотип на разных стадиях дифференцировки, или что различные подмножества пораженных клеток могут оказывать антагонистическое влияние на фенотип.
Другие исследования показали, что Dnmt3a также вносит вклад в адипогенез. У мышей Prx1-cre, у которых Dnmt3a был удален в клетках-предшественниках адипоцитов, у стареющих самцов наблюдалось увеличение числа клеток-предшественников и более значительное отложение жира, особенно в подкожных областях [97].
Анализ специфического для печени нокаута Dnmt3b выявил лишь незначительные фенотипические эффекты [92]. В частности, у взрослых нокаутных мышей наблюдалась незначительная потеря метилирования ДНК в масштабах всего генома, сопровождаемая измененной экспрессией генов окислительного фосфорилирования. Однако роль DNMT3B стала очевидной, когда были применены различные воздействия . В первичных гепатоцитах нокаутных животных обработка тиоацетамидом (ТАА) снижала общее потребление кислорода митохондриями и повышала уровень реактивных видов кислорода (ROS). В том же исследовании было показано, что DNMT3B играет защитную роль против печеночного воспаления, фиброза и канцерогенеза в модели фиброза печени, вызванного ТАА.
Как и в других органах, в кишечном эпителии мышей с условным тканеспецифическим нокаутом Dnmt3b, вызванным трансгеном Villin-creERT2, наблюдалось явное отсутствие фенотипа [98]. Важность этого гена была выявлена при изучении его совместно с Dnmt1. Одиночный нокаут Dnmt1 не был летальным; тем не менее, он приводил к снижению массы тела и потере метилирования ДНК, но мыши в основном восстанавливались через две недели. Однако при двойном нокауте Dnmt3b и Dnmt1 фенотип был гораздо более тяжелым, что привело к 60 % летальности, при этом некоторые мыши выздоровели благодаря тому, что некоторые клетки избежали абляции Dnmt3b. Это позволяет предположить, что DNMT3B обладает важной комплементарной поддерживающей метилтрансферазной активностью. Удивительно, но роль DNMT3B в метилировании ДНК не была подробно проанализирована в этом исследовании, однако она не оказывала влияния на локусы LINE-1 и H19. В целом, эти данные позволяют предположить, что, как обсуждалось ранее для клеток MEF и как мы увидим позже, DNMT3B и DNMT1 имеют некоторую перекрывающуюся, возможно, поддерживающую функцию. В модели Villin-creERT2 Dnmt3a, по-видимому, не играет никакой важной роли, поскольку ни одиночная, ни двойная абляция Dnmt1 не повлияла на фенотип мышей [98]. Однако в другой очень похожей модели (Villin-cre) было обнаружено, что DNMT3A участвует в поддержании целостности эпителия толстой кишки [99]. У этих мышей эпителиальные клетки имеют укороченные апикальные функциональные комплексы, а толстая кишка обладает повышенной проницаемостью, что может объяснить, почему эти мыши более восприимчивы к колиту.
Роль DNMTs de novo в почках изучалась на двух сходных моделях, в обеих из которых использовался двойной нокаут Dnmt3a и Dnmt3b [91]. Нокаут осуществлялся либо с помощью трансгена Six2-cre, экспрессируемого в клетках-предшественниках нефрона, либо с помощью трансгена Ksp-cre, экспрессируемого как в развивающейся, так и во взрослой почке. Хотя мыши не проявляли никакого видимого фенотипа, у них наблюдались изменения метилирования ДНК в масштабах всего генома, преимущественно гипометилирование. Эти гипометилированные участки были преимущественно расположены в энхансерах, большинство из которых были фетально-специфичными. Их гипометилирование сопровождалось изменениями экспрессии генов, включая повышенную экспрессию генов развития. Интересно, что значительная часть этих гипометилированных областей перекрывалась с энхансерами, сохранившимися у человека и демонстрирующими фетальный тип метилирования при диабетической нефропатии. Это позволяет предположить, что метилтрансферазы de novo играют определенную роль в сохранении правильного паттерна метилирования этих регионов у человека для предотвращения развития заболеваний. Это подчеркивает потенциальную специфическую роль DNMT3B, которая также функционирует как метилтрансфераза комплементарного поддержания.
Роль DNMT3A была также исследована в эндокринной поджелудочной железе. Зрелые бета-клетки поджелудочной железы характеризуются глюкозо-стимулированной секрецией инсулина (GSIS). Для приобретения этого фенотипа клетки постнатально подвергаются метаболическому сдвигу [100]. Было показано, что в бета-клетках единственной экспрессируемой de novo метилтрансферазой является Dnmt3a в течение первых 3 недель жизни. Чтобы изучить роль DNMT3A в этом метаболическом переходе, была проведена клеточно-специфическая абляция гена RIP-cre (промотор инсулина крысы) или PDX-cre ert2, специфичного для бета-клеток [100]. Бета-клетки, лишенные Dnmt3a, демонстрировали изменения метилирования ключевых гликолитических генов, оставались незрелыми и не могли развить GSIS.
Nervous system
Хотя до сих пор сообщалось лишь о минимальном эффекте абляции Dnmt3a или Dnmt3b в глиальных клетках [101, 102] (Дополнительная таблица 1), в нескольких исследованиях подчеркивалась значительная роль метилтрансфераз de novo в нейронах. Индуцируемая делеция Dnmt3a и Dnmt3b во взрослых стволовых и клетках предшественниках нейронов гиппокампа (NSPCs), ответственных за генерацию новых нейронов на протяжении всей жизни, показала, что метилтрансферазы ДНК de novo участвуют в морфологическом и функциональном созревании новых нейронов, включая рост дендритов [103]. Более того, обогащение окружающей среды, которое, как известно, вызывает изменения метилирования ДНК, привело к уменьшению количества активированных нейронов у нокаутных животных NSPC по сравнению с диким типом. Напротив, у нокаутных животных был обнаружен более высокий процент активированных интернейронов. Эти изменения привели к ухудшению обучения и памяти в поведенческих тестах у мышей Nestin-cre ert2. Эти данные подчеркивают роль метилтрансфераз de novo в условиях стресса. Кроме того, подчеркивается важнейшая роль Dnmt3a в развитии мозга, поскольку целенаправленная делеция Dnmt3a в мозге приводит к уменьшению числа двигательных нейронов, накоплению фрагментированных концевых пластинок в нервно-мышечных соединениях и преждевременной смерти с двигательными дефектами [104, 105].
Однако абляция Dnmt3a с середины беременности исключительно в возбуждающих нейронах неокортекса и гиппокампа [106] привела к более мягкому фенотипу с измененным поведением, включая нарушения рабочей памяти и социального интереса, а также неэффективное созревание синапсов и пластичность. Наряду с этими поведенческими изменениями в модели Nex-cre наблюдались и другие эпигенетические изменения на молекулярном уровне. В частности, неметилированные регионы подвергались вторжению сигнала H3K27me3 и polycomb репрессии.
Значение метилирования в постмитотических нейронах было впервые продемонстрировано с помощью двойного нокаута Dnmt1 и Dnmt3a, специфичного для переднего мозга, который выявил дефицит обучения, памяти и синаптической пластичности [107]. Аналогично, двойная делеция Dnmt1 и Dnmt3a с помощью AAV2/8-cre в первичной культуре гиппокампальных нейронов уменьшала образование возбуждающих синапсов, подавляла синаптическую передачу и снижала активность нейронов [108]. Однако ферменты DNMT1 и DNMT3A не могут функционально компенсировать друг друга в постнатальных нейронах, о чем свидетельствуют взрослые мыши с одиночным нокаутом, специфичным для переднего мозга. Отсутствие Dnmt3a приводило к нарушению обучения, памяти и синаптической пластичности, в то время как экспрессия Dnmt3b оставалась неизменной [109]. Тем не менее, DNMT3B также вносит свой вклад в формирование памяти, поскольку его отсутствие в дорсальных нейронах гиппокампа приводит к дефициту памяти на распознавание объектов, что подтверждается AAV-syn-cre опосредованным нокаутом [110].
Кроме того, еще одно интригующее наблюдение, касающееся событий de novo метилирования в мозге, заключается в том, что условный нокаут Dnmt3a в преоптической области новорожденных самок мышей приводит к последующему половому поведению самцов. Это наблюдение позволяет предположить, что феминизация является активным и постоянным подавлением маскулинизации в мозге [111]. Кроме того, была показана роль Dnmt3a в центральной нервной системе в регуляции энергетического и метаболического гомеостаза. Это было выявлено путем делеции гена в различных нейронах гипоталамуса. Его отсутствие в нейронах, экспрессирующих agouti-related protein (AgRP), приводит к увеличению жировой массы, что связано со снижением склонности к добровольным физическим нагрузкам [112], а его дефицит в других нейронах гипоталамуса (нейроны Sim1 в паравентрикулярном ядре) проявляется в ожирении, гиперфагии и непереносимости глюкозы [113].
В заключение следует отметить, что эти исследования подчеркивают важнейшую роль de novo метилтрансфераз, Dnmt3a и Dnmt3b, в эмбриогенезе, дифференцировке стволовых клеток и клеточных реакциях на экологический стресс. Эти ферменты проявляют частично перекрывающиеся, но различные физиологические регуляторные функции, специфичные для каждого типа клеток, которые постепенно выясняются. Кроме того, оба гена были связаны с различными патологиями человека. В заключительном разделе данного обзора обобщены наши современные представления о заболеваниях, возникающих в результате мутаций зародышевой линии или соматических мутаций Dnmt3a или Dnmt3b.
Medical relevance
Заболевания, связанные с мутациями метилтрансфераз de novo, можно разделить на две группы: наследственные синдромы и заболевания, обусловленные соматическими мутациями или изменениями экспрессии. Исследования на мышах показали, что полный нокаут Dnmt3a или Dnmt3b несовместим с жизнью. Поэтому неудивительно, что три документально подтвержденных синдрома семейного происхождения встречаются очень редко. Хотя эти синдромы характеризуются частично сохраненной активностью фермента, мутации приводят к симптомам, поражающим множество органов.
Синдром Tatton-Brown – Rahman [114, 115] - это синдром избыточного роста, характеризующийся увеличением роста и окружности головы, часто сопровождающийся умеренной умственной отсталостью или расстройством аутистического спектра (ASD). Это аутосомно-доминантное заболевание вызывается loss-of-function мутациями гена DNMT3A de novo(рис. 1). Последние исследования показывают, что фенотип нейроразвития может быть частично обусловлен сниженным метилированием нейронов, не связанных с CpG (CpA), опосредованным DNMT3A. Метилированные CpA-сайты распознаются MeCP2, и отсутствие этой эпигенетической метки может приводить к вариантам Ретт-синдрома, сходным с классическим Ретт-синдромом, вызванным мутациями MeCP2 [116, 117].
Heyn – Sproul – Jackson , в отличие от синдрома - Tatton-Brown – Rahman, возникает в результате избыточности функции мутаций гена DNMT3A [118]. Мутации, затрагивающие домен PWWP, нарушают его взаимодействие с областями H3K36me2/me3, что приводит к распространению метилирования на области, декорированные H3K27me3 (рис. 1). У людей с этим синдромом наблюдается микроцефалическая карликовость, сопровождающаяся умственной отсталостью. Недавние открытия также связывают зародышевые мутации избыточности функции домена DNMT3A PWWP с параганглиомами головы и шеи или папиллярной карциномой щитовидной железы [11-121]. Однако причина, по которой у некоторых пациентов вместо карликовости развиваются опухоли, остается неясной.
Гипоморфные рецессивные мутации Dnmt3b с потерей функции приводят к развитию синдрома иммунодефицита - центромерной нестабильности - лицевого (ICF) дисморфизма [122] (рис. 1). У людей с этим синдромом наблюдаются рецидивирующие респираторные инфекции, умственная отсталость и хромосомные аномалии, как правило, слияние хромосом 1, 9 и 16 в лимфоцитах. Следует отметить, что не все пациенты имеют мутации DNMT3B, и даже среди тех, у кого они есть, наблюдаемая потеря метилирования ДНК обычно незначительна.
Некоторые полиморфизмы в регуляторной области Dnmt3b были связаны с аутоиммунными заболеваниями, в частности с болезнью Graves’ и Hashimoto thyroiditis [123]. Однако молекулярный патомеханизм, лежащий в основе этой ассоциации, остается неясным. Несмотря на то, что наблюдаются сильные корреляции между изменениями метилирования ДНК и широким спектром хронических воспалительных и нейродегенеративных заболеваний, патологическая роль DNMT3A и/или DNMT3B в этих состояниях окончательно не доказана.
Также было показано, что DNMT3B имеет решающее значение для поддержания физиологии легочной артерии. У пациентов с легочной гипертензией, состоянием с опасными для жизни последствиями, экспрессия DNMT3B повышена в сосудистых гладкомышечных клетках. Интригующе, но исследования на крысиной модели показывают, что эта повышенная экспрессия может служить компенсаторным механизмом обратной связи. Действительно, у нокаутных крыс Dnmt3b наблюдалось ускоренное развитие легочной гипертензии - фенотип, который можно было предотвратить путем сверхэкспрессии гена [124].
Заболевания, связанные с соматическими мутациями или изменением экспрессии генов DNMT3A или DNMT3B, часто затрагивают кости, хондроциты и суставы. При остеоартрите наблюдается повышение экспрессии Dnmt3a и Dnmt1. Однако значительное снижение экспрессии Dnmt3b имеет большее значение в патогенезе заболевания, поскольку влияет на цикл ТСА и митохондриальное дыхание [79, 125] (рис. 5). Такое нарушение гомеостаза суставных хондроцитов вносит существенный вклад в развитие остеоартроза. Патогенная роль DNMT3B была подтверждена в модели мышей со специфическим нокаутом хондроцитов, у которых также развился остеоартрит [79].
Остеопороз и другие сопутствующие заболевания, характеризующиеся повышенной резорбцией кости вследствие изменения костного гомеостаза, часто наблюдаются у пациентов с клональным гемопоэзом неопределенного потенциала (CHIP), ассоциированным с повышенным остеокластогенезом [126] (рис. 1 и 4, а также 5). Доминантно-отрицательные мутации Dnmt3a в горячей точке R882 часто встречаются у этих пациентов. В мышиных моделях гемопоэтического специфического нокаута Dnmt3a [127] также развивается остеопороз, что служит дополнительным доказательством участия DNMT3A в патогенезе этого заболевания.
CHIP также связан с сердечно-сосудистыми заболеваниями [128, 129]. Например, у пациентов с CHIP часто наблюдается усиление воспаления из-за мутаций Dnmt3a в моноцитах и макрофагах, что приводит к повышению уровня воспалительных цитокинов, связанных с атеросклерозом, стенозом аорты и сердечной недостаточностью. Аналогичным образом была предложена роль DNMT3A в аллергических заболеваниях, опосредованных тучными клетками, таких как астма, хотя окончательных доказательств до сих пор нет [130].
Последняя большая группа патологий, на которые влияют метилтрансферазы de novo, включает злокачественные новообразования кроветворной системы [131] и солидные опухоли. DNMT3A обладают сходным действием в качестве опухолевого супрессора в кроветворных клетках [132], поэтому в 20-30 % различных гематологических заболеваний мутации Dnmt3a, по-видимому, играют причинную роль в их развитии. Помимо CHIP, который незначительно повышает риск развития лейкозов, часто встречаются миелодиспластический синдром (MDS) [133, 134], острый миелоидный лейкоз (AML) [135, 136], острый лимфоидный лейкоз (ALL, T-cell ALL) [71, 135] и хронический лимфоидный лейкоз (CLL) [137]. Различные мутации DNMT3A могут вызывать эти заболевания, но наиболее частой является доминантно-негативная мутация аргинин-гистидин (R882H) (рис. 1).
Также было показано, что действие двух de novo ДНК-метилтрансфераз является синергичным [66]. DNMT3B также обладает сходным с опухолевым супрессором действием в кроветворных клетках. Так, было показано, что при лейкозе смешанной линии (MLL-AF9) ген Dnmt3b понижен, а его делеция у мышей вызывает аналогичный фенотип лейкоза [66]. Роль DNMT3B была дополнительно подчеркнута при развитии Т-клеточной лимфомы [138] в мышиной модели, повторяющей человеческое заболевание. В этой модели потеря Dnmt3b в Т-клетках приводила к прогрессирующей потере метилирования ДНК в определенных геномных регионах (например, в гене Ment), что указывает на участие DNMT3B в поддерживающем метилировании. Это согласуется с описанной ранее вторичной функцией фермента.
Наконец, соматические мутации или изменения экспрессии метилтрансфераз de novo также наблюдаются в различных солидных опухолях. Интересно, что если геномные изменения метилирования в большинстве типов опухолей изучены достаточно широко, то механическая роль метилтрансфераз de novo описана в относительно небольшом количестве сообщений. Кроме того, эти ферменты считаются опухолевыми супрессорами в одних тканях и онкогенами в других, в то время как DNMT3A и DNMT3B иногда оказывают противоположные эффекты.
По данным портала NCI GDC Data (https://portal.gdc.cancer.gov [139] соматические мутации Dnmt3a и Dnmt3b присутствуют примерно в 3-5% опухолей, возникающих в широком спектре тканей, таких как кожа, легкие, ЖКТ, матка, молочная железа, простата и поджелудочная железа. Частота встречаемости мутаций Dnmt3a обычно несколько выше, чем мутаций Dnmt3b. Однако в большинстве солидных опухолей значительные изменения экспрессии DNMT3A и/или DNMT3B ассоциированы с заболеванием.
Опухолеподавляющий эффект DNMT3A был продемонстрирован на модели плоскоклеточной карциномы мыши, которая становилась еще более агрессивной при одновременном отсутствии Dnmt3b [89]. Также давно известно, что делеция DNMT3A способствует росту и прогрессии рака легкого [140]. Напротив, при колоректальном раке отмечается повышенная экспрессия DNMT3B [141], а делеция Dnmt3a ингибирует развитие колоректального рака [142]. Функциональная DNMT3B, однако, необходима только для формирования макроаденомы в кишечнике [143]. Как при раке эндометрия [144], так и при гепатоцеллюлярной карциноме [92] отмечается повышенная экспрессия DNMT3B. В других исследованиях сообщалось об изменении экспрессии DNMT3A и/или DNMT3B при раке яичников [145], простаты [146-148], желудка [149, 150], молочной железы [151, 152] и др.
Future directions
В будущих исследованиях необходимо изучить различные направления. В представленных здесь исследованиях использовались модели тканеспецифического нокаута с применением системы cre-lox. Они показали эффект полной абляции DNMT3A или DNMT3B либо во всем организме, либо в различных тканях. Однако с появлением технологии редактирования оснований CRISPR стало возможным вводить точечные мутации и другие вариации последовательности, что было продемонстрировано на примере остатка R882, мутационного очага DNMT3A, связанного с гематологическими злокачественными опухолями. Изучение мутационного ландшафта DNMT3A или DNMT3B может дать более глубокое понимание точной роли метилтрансфераз de novo. Такой подход может также пролить свет на функции их различных доменов и даже позволит провести более точную дискриминацию между различными ролями, связанными или не связанными с метилтрансферазной активностью, как это было сделано в работе [71].
Аналогичным образом, необходимо провести дальнейшие механистические исследования, чтобы лучше понять функциональную роль многочисленных сплайс-вариантов DNMT3A и особенно DNMT3B. Сообщалось о множестве изоформ DNMT3B, и исследования с использованием мышей, нокаутированных по изоформам, углубили бы наше понимание их физиологической и потенциальной патологической роли. Недавние исследования подчеркнули важность этой области, продемонстрировав, что постнатальный нокаут специфических сплайс-вариантов DNMT3A у мышей приводит к летальности, в то время как абляция других сплайс-вариантов не приводит к явным фенотипическим изменениям [30].
Еще один аспект будущих исследований должен быть посвящен роли DNMTs в приобретении плюрипотентного состояния. Почему ранние эмбрионы должны подвергаться глобальному деметилированию? Почему они подвергаются глобальному реметилированию?
И наконец, следует продолжить изучение роли DNMT3A и 3B в развитии заболеваний. Существуют ли другие наследственные синдромы, связанные с мутациями этих генов? Являются ли изменения метилирования ДНК при распространенных заболеваниях и раке причинами или следствиями развивающихся клинических фенотипов?
 figure 1
DNMT3A and DNMT3B isoforms in mouse. Conserved regions are colored, and their respective functions are indicated below. The conserved domain IV in the catalytic region of Dnmt3a is flanked by the loxP sites is indicated in red. HSJS stands for Heyn-Sproul-Jackson syndrome, associated with mutations in the DNMT3A PWWP domain. The W326R mutation is homologous to the human W330R disease-causing mutation and recapitulates the disease phenotype (see under “Medical Relevance” chapter). TBRS represents Tattoon-Brown Rahman Syndrome, AML indicates acute myeloid leukemia. Both can develop due to the dominant R382H mutation in human. The corresponding mouse mutation R878H is indicated. DNMT3B isoforms are shown on the panel below. The conserved domains I - VI in the catalytic region of Dnmt3b flanked by the loxP sites are indicated in red. A609T and D823G mutations cause similar phenotype than the human ICF syndrome (immunodeciency-centromeric instability-facial dismorphism). Homologous A603T and D817G mutations were reported in ICF patients
figure 1
DNMT3A and DNMT3B isoforms in mouse. Conserved regions are colored, and their respective functions are indicated below. The conserved domain IV in the catalytic region of Dnmt3a is flanked by the loxP sites is indicated in red. HSJS stands for Heyn-Sproul-Jackson syndrome, associated with mutations in the DNMT3A PWWP domain. The W326R mutation is homologous to the human W330R disease-causing mutation and recapitulates the disease phenotype (see under “Medical Relevance” chapter). TBRS represents Tattoon-Brown Rahman Syndrome, AML indicates acute myeloid leukemia. Both can develop due to the dominant R382H mutation in human. The corresponding mouse mutation R878H is indicated. DNMT3B isoforms are shown on the panel below. The conserved domains I - VI in the catalytic region of Dnmt3b flanked by the loxP sites are indicated in red. A609T and D823G mutations cause similar phenotype than the human ICF syndrome (immunodeciency-centromeric instability-facial dismorphism). Homologous A603T and D817G mutations were reported in ICF patients
 figure 2
DNMT3A plays pivotal role in germ cell maturation and during preimplantation. Dnmt3a knockout primordial germ cells (PGC) are unable to differentiate to mature germ cells and can not establish parental-specific methylation patterns required for genomic imprinting. The PGCs maintain their ability to replicate and remain PGCs. DNMT3B plays minor role in complementing of the maintainance methylation activity of DNMT1 in mouse embryonic fibroblasts (MEF). ICRs are imprinting control regions. Lollipops represent CpG sites. Black CpGs are methylated, white CpGs are unmethylated
figure 2
DNMT3A plays pivotal role in germ cell maturation and during preimplantation. Dnmt3a knockout primordial germ cells (PGC) are unable to differentiate to mature germ cells and can not establish parental-specific methylation patterns required for genomic imprinting. The PGCs maintain their ability to replicate and remain PGCs. DNMT3B plays minor role in complementing of the maintainance methylation activity of DNMT1 in mouse embryonic fibroblasts (MEF). ICRs are imprinting control regions. Lollipops represent CpG sites. Black CpGs are methylated, white CpGs are unmethylated
 figure 3
DNMT3A and DNMT3B are involved in fetal development. DNMT3B is required for the decidualization of the endometrium and the absence of the gene from progesterone-sensitive cells disturbs this process and leads to embryonic loss. Both DNMT3A and DNMT3B are required for labyrinth formation. The maintenance of Dnmt3b expression in trophoblast cells is crucial for embryonic development and survival
figure 3
DNMT3A and DNMT3B are involved in fetal development. DNMT3B is required for the decidualization of the endometrium and the absence of the gene from progesterone-sensitive cells disturbs this process and leads to embryonic loss. Both DNMT3A and DNMT3B are required for labyrinth formation. The maintenance of Dnmt3b expression in trophoblast cells is crucial for embryonic development and survival