Пользователи: 
POLYCOMB ГРУППЫ
Белки, регулирующие развитие
Research advances of polycomb group proteins in regulating mammalian development Yan Li,Yanxiang Mo, Chen Chen et al.
 Front. Cell Dev. Biol., 05 March 2024
Sec. Epigenomics and Epigenetics
Volume 12 - 2024 | https://doi.org/10.3389/fcell.2024.1383200
|
Polycomb group (PcG) proteins are a subset of epigenetic factors that are highly conserved throughout evolution. In mammals, PcG proteins can be classified into two muti-proteins complexes: Polycomb repressive complex 1 (PRC1) and PRC2. Increasing evidence has demonstrated that PcG complexes play critical roles in the regulation of gene expression, genomic imprinting, chromosome X-inactivation, and chromatin structure. Accordingly, the dysfunction of PcG proteins is tightly orchestrated with abnormal developmental processes. Here, we summarized and discussed the current knowledge of the biochemical and molecular functions of PcG complexes, especially the PRC1 and PRC2 in mammalian development including embryonic development and tissue development, which will shed further light on the deep understanding of the basic knowledge of PcGs and their functions for reproductive health and developmental disorders.
|
Гены группы Polycomb (PcG) были первоначально обнаружены у Drosophila melanogaster (Struhl, 1981; Negre et al., 2006). Так называемый "Polycomb" относится к вне-половому фенотипу, наблюдаемому у мух-самцов, а первый ген, в котором доминантная мутация проявляется в виде этого фенотипа, назван Polycomb (Pc) (Kassis et al., 2017). В ходе последующих исследований было обнаружено все большее число генов, похожих на Polycomb, и эти гены были названы PcG-генами (Kim and Kingston, 2022). Хорошо известно, что гены группы Polycomb (PcG) и их белковые продукты широко сохраняются у многих видов животных, от мух до человека (Kim and Kingston, 2022). Благодаря биохимическим технологиям определение гена PcG также переключается с конкретного фенотипа мутации на формирование комплексов PcG (Piunti and Shilatifard, 2021). В настоящее время механизм PcG состоит из двух основных комплексов: Polycomb repressive complex 1 (PRC1) и PRC2. Эти два комплекса могут быть далее разделены на множество вариантов в соответствии с их различными биохимическими составами.
Функционально комплексы PcG обычно связаны с транскрипционной репрессией (Morgan and Shilatifard, 2020). Изначально было замечено, что комплексы PcG участвуют в сегментарном детерминировании, подавляя экспрессию гомеотических генов (Hox) (Lewis, 1978). Кроме того, было обнаружено, что комплексы PcG, являясь консервативными модификаторами хроматина, участвуют в транскрипционной репрессии более масштабных генов, которые вовлечены в регуляцию клеточной пролиферации, плюрипотентности стволовых клеток и онкогенеза (de Potter et al., 2023). Функция генного сайленсинга комплексов PcG связана с их гистон-модифицирующей активностью (Morgan and Shilatifard, 2020). Примечательно, что PRC1 в основном катализирует убиквитилирование гистона H2A по лизину 119, в то время как PRC2 способствует метилированию гистона H3 по лизину 27 (Millan-Zambrano et al., 2022). Действительно, комплексы PcG могут также препятствовать экспрессии генов, опосредуя уплотнение хроматина (Piunti and Shilatifard, 2021). Помимо их роли в репрессии транскрипции, важно отметить, что комплексы PcG также напрямую регулируют активацию генов в зависимости от типа клеток (Parreno et al., 2022).
Важно отметить, что комплексы PcG необходимы для развития эмбриона у млекопитающих. Опосредованные PcG-комплексами репрессивные модификации гистонов играют важную роль в глушении транскрипции неактивных генов-регуляторов развития в ранних эмбрионах, что имеет решающее значение для прохождения эмбрионом стадии гаструляции (Owen and Davidovich, 2022). Кроме того, PRC2-медиатор H3K27me3 контролирует установление независимого от метилирования ДНК импринтинга, который необходим для нормального развития экстра-эмбриональных тканей мыши (Chen et al., 2019). Опираясь на эту функцию регуляции импринтинга, белки PcG вовлечены в специфический процесс, названный X-chromosome inactivation (XCI). Нарушение XCI в женских эмбрионах может привести к остановке развития и гибели эмбриона (Yang et al., 2016; Kobayashi, 2018). Кроме того, комплексы PcG участвуют в самообновлении и раннем распределении по линиям стволовых клеток различных тканей во время развития (Takano et al., 2022). Глубокое понимание функций белков polycomb крайне важно для изучения молекулярных механизмов, лежащих в основе многочисленных процессов развития и болезней развития.
2 The composition of PcG complexes
2.1 The composition of PRC1
Каталитическое ядро PRC1 представляет собой димер, состоящий из действительно интересных новых генов 1A или B (RING1A/B), которые функционируют как убиквитиновые E3-лигазы, и одного из шести ортологов 6 polycomb группы RING finger (PCGF), который регулирует ферментативную активность PRC1 (Dobrinic et al., 2021). PRC1.1-1.6, шесть основных групп комплекса PRC1, определяются различными ассоциированными с ортологиями PCGF (Gao et al., 2012). RING1A/B и все белки PCGF содержат два консервативных белковых домена: Ring finger domain и WD40-ассоциированный убиквитин-подобный (RAWUL) домен (Geng and Gao, 2020; de Potter et al., 2023). Аналогичный RING-домен опосредует димеризацию RING1 и PCGF, в результате чего образуется каталитическое ядро PRC1. Этот димер RING-домена облегчает связывание фермента E2-конъюгата с PRC1. Примечательно, что PCGF2 и PCGF4 содержат пролин-серин-богатые (PS) домены. А белки PCGF могут взаимодействовать с различными вспомогательными субъединицами через свои домены RAWUL (Geng and Gao, 2020; de Potter et al., 2023). В зависимости от субъединицы, связанной с RING-PCGF-ядром, PRC1 можно разделить на канонический PRC1 (cPRC1) и неканонический PRC1 (ncPRC1).
Комплексы cPRC1 мешают RING1A/B, PCGF2/4 и одному из пяти хромобоксных белков (CBX) (CBX2, CBX4, CBX6, CBX7 или CBX8) (Gao et al., 2012). Белки CBX содержат N-концевые хромодомены, которые отвечают за рекрутирование и стабилизацию cPRC1 в определенных областях хроматина, особенно в регионах, богатых H3K27me3. А AT-крючок белков CBX облегчает их связывание с AT-богатыми основными сателлитами ДНК (Bernstein et al., 2006; Gao et al., 2012). Кроме того, cPRC1 содержит один из полигомеотических белков (PHC1, PHC2 или PHC3) и гомолог полового гребня на средней ножке 1 или 2 (SCMH1/2), которые способствуют полимеризации комплексов PRC1 через домен стерильного альфа-мотива (SAM) (Di Croce and Helin, 2013; Wani et al., 2016; Geng and Gao, 2020). Кроме того, белки PHC могут связываться с RAWUL-доменами PCGF2/4, но не PCGF1/3 (Kim and Kingston, 2022).
В отличие от cPRC1, комплексы ncPRC1 состоят из любого из шести белков PCGF (PCGF1-6), RING1/B и YY1-связывающего белка (RYBP) или его гомолога YY1-ассоциированного фактора 2 (YAF2) (Chan et al., 2018). RYBP и YAF2 могут конкурентно связываться с RING1B и стимулировать ферментативную активность RING1B по модели положительной обратной связи (Gao et al., 2012; Chagraoui et al., 2018; Liu et al., 2023). Кроме того, недавние исследования показали, что RYBP/YAF может связываться с H2AK119ub1, способствуя дальнейшему распространению H2AK119ub1 на соседние нуклеосомы (Zhao et al., 2020).
Интересно, что некоторые субъединицы, как выяснилось, специально существуют в одном из комплексов ncPRC1-6. Например, CXXC-домен лизин-деметилазы 2B (KDM2B), входящей в состав ncPRC1.1, может распознавать CpG-островки и способствовать набору ncPRC1.1 на гипометилированные CpG-богатые промоторы (Farcas et al., 2012; Sugishita et al., 2021). Субъединицы BCL6 corepressor (BCOR) и BCL6 corepressor like 1 (BCORL1) необходимы для стабильности PCGF1 и важны для соединения KDM2B с ферментативным ядром ncPRC1.1 (Wong et al., 2016; Schaefer et al., 2022). Фиброзин (FBRS) и кандидат на восприимчивость к аутизму 2 (AUTS2) - два белка-паралога ncPRC1.3 и ncPRC1.5 (Collier et al., 2022). AUTS2 может рекрутировать гистоновую ацетилтрансферазу EP300 в комплексы PRC1 (Castanza et al., 2021; Pauli et al., 2021). В то время как роль FBRS в ncPRC1.3/5 остается неустановленной. Несколько белков, связанных с PCGF6, таких как L3MBTL гистон-метил-лизин связывающий белок 2 (L3MBTL2), E2F транскрипционный фактор 6 (E2F6) и MAX ген-ассоциированный белок (MGA), являются общими субъединицами ncPRC1.6. Как правило, эти белки действуют совместно, чтобы облегчить загрузку ncPRC1.6 на целевые сайты (Huang et al., 2018; 2022; Dahlet et al., 2021).
2.2 The composition of PRC2
Каталитическое ядро PRC2 состоит из четырех субъединиц: энхансера гомолога Zeste 1/2 (EZH1/2), белка развития эмбриональной эктодермы (EED), супрессора Zeste 12 (SUZ12) и RB-связывающего белка 4 или 7 (RBBP4/7) (Vijayanathan et al., 2022). Белки EZH содержат домен SET, наделяющий PRC2 гистоновой лизин-метилтрансферазной активностью (Shen et al., 2008; Lee et al., 2018, 2). EED стабилизирует EZH1/2 в PRC2 и стимулирует активность метилирования EZH1/2 (Margueron et al., 2009; Hsu et al., 2020). Повторяющийся домен WD40 (WDR) EED отвечает за локализацию H3K27me3 на PRC2 (Oksuz et al., 2018). SUZ12 функционирует как структурированная платформа, взаимодействующая с тремя другими core-белками, что способствует стабильности комплекса (Kasinath et al., 2018). WDR-содержащие белки RBBP4/7 являются еще одним компонентом ядра PRC2 и модулируют рекрутирование PRC2 в хроматин (Schapira et al., 2017; Huang et al., 2021).
Ядро PRC2, собираясь со вспомогательными белками, образует два разных гомокомплекса - PRC2.1 и PRC2.2 (Petracovici and Bonasio, 2021; de Potter et al., 2023). Эти вспомогательные субъединицы, включая белок цинковых пальчиков, связывающий белок АЕ 2 (AEBP2), гомологи Polycomb-подобных (PCL), PRC2-ассоциированная LCOR изоформа 1 или 2 (PALI1/2), Polycomb repressive complex 2-associated protein (EPOP) и Jumonji and ATrich interaction domain containing 2 (JARID2), содержат ДНК-связывающие домены, которые способны рекрутировать PRC2 в определенные геномные локусы и позволяют адаптировать PRC2 к измененному клеточному состоянию (Conway et al. , 2018; Huang et al., 2023). PRC2.1 определяется наличием одного из трех PCL (PCL1/2 PCL3) и либо EPOP, либо PALI1/2. С-концевой хромоподобный участок PCL может напрямую взаимодействовать с основной субъединицей PRC2.1 SUZ12. N-концевой домен PCL направлен на связывание PRC2.1 с определенными областями хроматина (Guo et al., 2021). Интересно, что белки PCL могут связываться с не метилированной ДНК. Связывание 2.2 The composition of PRC2 домена PCL1 с ДНК способствует увеличению времени пребывания PCL1-PRC2 на хроматине и тем самым облегчает метилирование H3K27 (Choi et al., 2017). А Tudorе домены PCL1-3 обладают высоким сродством к участкам хроматина, модифицированным H3K36me3, и дают начало ДНК-управляемому рекрутингу PRC2.1 к новым генам-мишеням (Ballare et al., 2012; Musselman et al., 2012). PCL2 может распознавать и связывать регионы с высокой плотностью не метилированных CpG в относительно развернутой спирали, что необходимо для точного нацеливания и связывания PCL2-PRC2 с генами развития (Perino et al., 2018). Более того, метилированный PALI1 может связываться с субъединицей EED ядра PRC2.1, аллостерически активируя PRC2.1, а также облегчая его связывание с ДНК (Zhang et al., 2021). Важно отметить, что для стабильных взаимодействий между EPOP и PRC2.1 необходимо связывание С-концевого домена EPOP с ZnB-Zn доменом SUZ12 (Guo et al., 2021).
Примечательно, что PRC2.2 содержит две субъединицы, содержащие цинковые пальцы, AEBP2 и JARID2 (Hauri et al., 2016; Kasinath et al., 2021). И AEBP2, и JARID2 могут напрямую связываться с ZnB-Zn доменом SUZ12, стабилизируя взаимодействие PRC2.2 с геномными мишенями (Chen et al., 2018). AEBP2, но не JARID2, который конкурирует с PCL3 за связывание с доменом C2 SUZ12 (Chen et al., 2018). JARID и EPOP имеют общий домен связывания SUZ12 (Chen et al., 2018). Более того, эти модули связывания вносят вклад в структурную организацию различных классов голокомплексов PRC2 (Chen et al., 2018). Подобно PALI1, метилированный JARID2 также может аллостерически активировать PRC2.2, напрямую взаимодействуя с белком EED (Sanulli et al., 2015). JARID2 регулирует рекрутирование и активацию PRC2 путем распознавания и связывания нуклеосом, содержащих H2AK119ub1. Интересно, что результаты крио-электронной микроскопии (крио-ЭМ) показали, что JARID2 и AEBP2 совместно локализуются в CpG-богатых промоторных областях с активными маркерами транскрипции (H3K4me3 и H3K36me3) (Kasinath et al., 2021). JARID2 дополнительно содержит РНК-связывающий регион, а связывание JARID2 с не-кодирующими РНК (ncRNAs) облегчает взаимодействие JARID-PRC2, что способствует рекрутированию PRC2 на хроматин (Kaneko et al., 2014) (рис. 1).
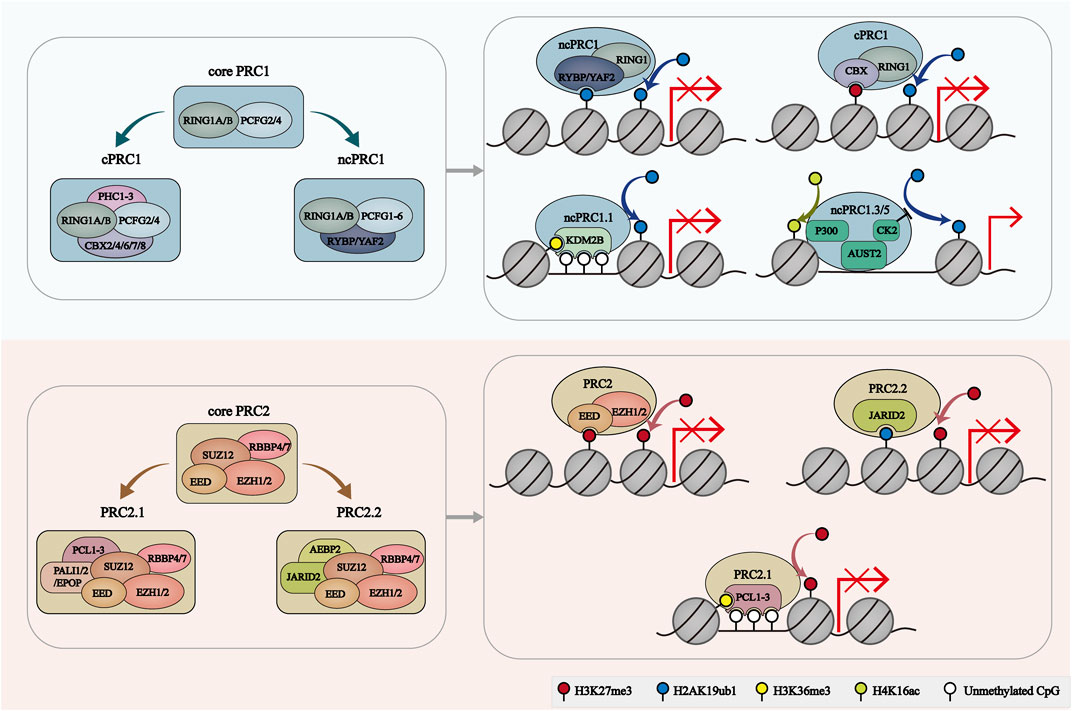
FIGURE 1. The composition and recruitment of PcG complexes. The catalytic core of PRC1 contains RING1A/B and one of six PCGF orthologs, which play a role in H2AK119ub1 deposition. PRC1 can further be divide into 2 groups: cPRC1 with RING1A/B, PCGF2/4, CBX2/4/6/7/8 and PHC1/2/3, and ncPRC1 with RING1A/B, PCGF1-6, RYBP/YAF2. RYBP/YAF2 can recognize H2AK119ub1 and facilitate the binding of ncPRC1 with chromatin. CBX proteins facilitate the cPRC1 binding to H3K27me3-deposit regions. KDM2B mediates the location of ncPRC1.1 to unmethylated CGIs. AUTS2-PRC1 is involved in transcriptional activation. PRC2 core comprises four subunits: EZH1/2, EED, SUZ12 and RBBP4/7. PRC2.1 is characterized by PCL1/2/3 and PALI1/2 or EPOP subunits. PRC2.2 was characterized by JARID2 and AEBP2 subunits. EZH2 catalyzes H3K27me3. EED, JARID2 and PCL target PRC2 to H3K27me3-enriched regions, H2AK119ub1-enriched regions and unmethylated CGIs, respectively.
3 The functions of PcG complexes
Ферментативная активность комплексов PcG необходима для их функционирования. У млекопитающих PRC1 регулирует депонирование моноубиквитилирования H2A на K119 (H2AK119ub1), а PRC2 катализирует моно-, ди- и триметилирование H3K27 (H3K27me2/3) (Campagne et al., 2019). Эти PcG-опосредованные модификации гистонов широко рассматривались как связанные с транскрипционной репрессией. Кроме того, PcG могут контролировать замалчивание генов, регулируя 3D-архитектуру генома. В то же время некоторые исследования показали, что некоторые комплексы PcG могут локализоваться на активных генах и способствовать их экспрессии (Campagne et al., 2019) (Рисунок 1).
3.1 PcG complexes and transcriptional repression
Белки PcG в основном присутствуют в репрессированных генах, что указывает на их роль в сайленсинге генов. KDM2B-PRC1.1 и PCL-PRC2.1 могут связываться с CGIs промоторов замалчиваемых генов и способствовать формированию хроматиновых доменов Polycomb, которые характеризуются заселением H3K27me3, H2AK119ub1, а также белками polycomb. Взаимодействие между PRC1 и PRC2 необходимо для формирования доменов polycomb (Dobrinic et al., 2021). Более подробно, H2AK119ub1, катализируемый PRC1, может быть распознан JARID2, который рекрутирует PRC2.2 и способствует отложению H3K27me3. Аналогично, CBX-PRC1 может связываться с H3K27me3 и стимулировать ферментативную активность PRC1. RYBP/YAF-PRC1 и EED-PRC2 могут распознавать и связываться с H2AK119ub1 и H3K27me3 соответственно, что способствует дальнейшему распространению доменов Polycomb. Кроме того, установлено, что заселение PRC2 доменами polycomb в первую очередь зависит от PRC1/H2AK119ub1 в эмбриональных стволовых клетках мыши (Dobrinic et al., 2021). Механически заселение H2AK119ub1 и H3K27me3 препятствует рекрутированию и активности РНК-полимеразы II (RNA Pol II), поэтому в значительной степени предотвращает элонгацию транскрипции с помощью RNA Pol II. Для бивалентных генов, содержащих как H3K27me3, так и H3K4me3, белки PcG могут удерживать РНК Pol II над стартовым сайтом транскрипции (Flora et al., 2021). Кроме того, комплексы PcG могут создавать уплотненную структуру хроматина, что в основном не зависит от их каталитической активности. Компактное состояние хроматина препятствует связыванию комплексов ремоделирования хроматина, таких как комплекс SWI/SNF, и, следовательно, приводит к транскрипционному сайленсингу. Полимеризация PRC1, которая опирается на SAM-домены белков PHC, необходима для polycomb-опосредованной организации структуры хроматина (Flora et al., 2021).
3.2 PcG complexes and transcriptional activation
Комплексы PRC1 также вносят свой вклад в активацию генов. Например, субъединицы ncPRC1.1, такие как PCGF1 и KDM2B, ко-локализуются на активно транскрибируемых генах (van den Boom et al., 2016). Данные ChIP-seq показали наличие определенного уровня H2AK119ub1 и отсутствие H3K27me3 в ncPRC1.1-связанных активных локусах. Эти наблюдения позволили предположить, что транскрипционно активная роль PRC1 не зависит от PRC2. Более того, в некоторых типах клеток вокруг этих локусов не было обнаружено H2AK119ub1. В клетках нейронов AUTS2 может напрямую взаимодействовать с гистоновой ацетилтрансферазой EP300 через свой домен HX-повтора, наделяя таким образом ncPRC1.3/5 способностью к транскрипционной активации (Gao et al., 2014a; Castanza et al., 2021; Pauli et al., 2021). Тем временем AUTS2 рекрутирует казеиновую киназу 2 (CK2) для фосфорилирования и инактивации RING1B. Как следствие, убиквитинирующая активность H2A PRC1 блокируется (Barbour et al., 2020). Недавнее исследование также показало, что ядерный дыхательный фактор 1 (NRF1) необходим для AUTS2-ncPRC1-опосредованной активации генов, направляя его связывание с определенным локусом (Liu et al., 2021). Должны существовать и другие факторы, подобные NRF1, которые способствуют PRC1-зависимой активации генов. Поэтому вопрос о том, как PRC1 участвует в активации генов, нуждается в дальнейшем изучении.
3.3 PcG complexes and X-chromosome inactivation (XCI)
XCI - это процесс развития, при котором одна из двух X-хромосом становится неактивной в женских клетках, чтобы выровнять дисбаланс доз генов, сцепленных с X-хромосомой, между XY-мужчинами и XX-женщинами. Механически инициация XCI зависит от связывания будущей неактивной Х-хромосомы (Xi) с X-inactive specific transcript (Xist), который представляет собой длинную не-кодирующую РНК, экспрессируемую на этой хромосоме в женских клетках (Borsani et al., 1991; Brockdorff et al., 1991; Loda et al., 2017). Покрытие Xist на Xi может рекрутировать различные комплексы и позволять им связываться и распространяться по хромосоме напрямую или опосредованно (Markaki et al., 2021). Тем временем структура хроматина Xi изменяется до уплотненного состояния с накоплением метилирования ДНК, потерей активных гистоновых маркеров (таких как метилирование H3K4 и пан-ацилирование) и отложением репрессивных гистоновых маркеров (таких как метилирование H3K9) (Keniry et al., 2016; Li et al., 2022). Кроме того, в ходе этого процесса происходит накопление PRC1-ассоциированного H2AK119Ub и PRC2-ассоциированного H3K27me3 (Brockdorff, 2017). Используя женские эмбриональные стволовые клетки мыши, Zylicz et al. (2019) обнаружили, что обогащение H2AK119Ub происходит раньше, чем H3K27me3, и их маркированные области в значительной степени перекрываются на Х-хромосоме. Интересно, что оба они сначала депонируются в межгенных областях вокруг сайтов входа в РНК Xist, которые помечаются PcGs до начала регуляции Xist. По-видимому, исходный хроматиновый ландшафт Х-хромосомы обуславливает изменение структуры хроматина, что приводит к специфическому паттерну распространения Xist и транскрипционному сайленсингу (Zylicz et al., 2019). Впоследствии PcG распространяются в генные тела после деацетилирования и возникновения сайленсинга генов, это указывает на то, что распространение PcG-зависимых маркеров может не быть триггером для репрессии генов в процессе XCI (Zylicz et al., 2019). В то же время роль комплекса PcG в координации XCI во время эмбрионального развития in vivo остается практически неизученной.
3.4 PcG complexes and genomic imprinting
У мышей подмножество импринтированных генов контролируется PRC2-опосредованным H3K27me3, что получило название неканонического импринтинга (Inoue, 2023). Причем H3K27me3-зависимый неканонический импринтинг наследуется от ооцитов. Действительно, H3K27me3-опосредованный импринтинг регулирует репрессию экспрессии материнского Xist, который отвечает за защиту материнской X (Xm) от сайленсинга в импринтированных XCI (Chen and Zhang, 2020). В аутосомах материнский H3K27me3 также способствует материнско-специфическому молчанию импринтированных генов. После имплантации метилирование ДНК компенсирует H3K27me3 для поддержания состояния импринтинга этих генов в эмбриональной линии. Однако H3K27me3-опосредованный импринтинг может поддерживаться в некоторых генах, важных для развития плаценты, во вне-эмбриональных линиях (Chen and Zhang, 2020). Хотя такой материнский H3K27me3-зависимый неканонический импринтинг не сохраняется у человека (Chen and Zhang, 2020).
4 H2AK119ub1 and H3K27me3 dynamics during embryonic development
H2AK119ub1 и H3K27me3, два основных белковых продукта комплексов PcGs, в значительной степени перепрограммируются после оплодотворения. В ооцитах мыши H2AK119ub1 и H3K27me3 перекрываются и неканонически обогащены как в промоторных, так и в дистальных областях (Chen et al., 2021). После оплодотворения H3K27me3 промотора в значительной степени стирается, в то время как неканонический материнский H3K27me3 дистальных областей наследуется зиготами (Liu et al., 2016). Более того, неканонический материнский H3K27me3 сохраняется и контролирует независимый от метилирования ДНК импринтинг во время преимплантационного развития (Chen et al., 2021; Mei et al., 2021). Однако H2AK119ub1 в основном располагается на промоторных областях и генных телах генов, связанных с развитием, и играет важную роль в регуляции транскрипции этих генов в ранних эмбрионах мыши (Chen et al., 2021; Mei et al., 2021). После имплантации распределение H3K27me3 и H2AK119ub1 сцеплено и ограничено промоторными областями генов, связанных с развитием (Chen et al., 2021; Mei et al., 2021). В то время как материнский H3K27me3 удаляется в районе активации зиготического генома (ZGA) у эмбрионов человека, что указывает на то, что он вряд ли может функционировать как маркер импринтинга (Xia et al., 2019; Wilkinson et al., 2023).
5 The role of PcG complexes in mammalian embryonic development
Развитие эмбриона - сложный процесс, который регулируется целым рядом регуляторов с различными механизмами. Белки PcG отвечают за эмбриональное развитие млекопитающих, в основном регулируя транскрипционную репрессию генов, связанных с развитием. Потеря белков PcG обычно приводит к эмбриональной летальности после имплантации.
5.1 The role of PRC1 in embryo development
5.1.1 RING1B-PRC1 is responsible for embryo development
Во время эмбрионального развития мыши RING1A и RING1B не являются функционально избыточными. Мыши с нулевым номером Ring1a были жизнеспособны и развивались почти нормально, за исключением дефектов осевого скелета (del Mar Lorente et al., 2000). В то время как RING1B был необходим для правильной гаструляции. Эмбрионы мышей с нокаутом Ring1b демонстрировали аномальную морфологию на эмбриональный день 6.5 (E6.5), демонстрируя неудачное расширение эпибласта и миграцию мезодермы. Наконец, все Ring1b-нулевые эмбрионы погибали до E10.5 (Voncken et al., 2003). Нарушение репрессии локуса Cdkn2a способствовало ранней остановке развития Ring1b-нулевых эмбрионов (Voncken et al., 2003). Стоит отметить, что абляция каталитической активности RING1B у мышей и последующая потеря H2AK119ub не повлияли на гаструляцию, и эти мыши доживали до E15.5 (Illingworth et al., 2015). Таким образом, некаталитическая функция RING1B, по-видимому, играет первостепенную роль в раннем эмбриональном развитии. Интересно, что эмбрионы с дефицитом RING1A и RING1B задерживались на двухклеточной стадии, что сопровождалось серьезным нарушением ZGA (Posfai et al., 2012). Материнский нокаут этих двух генов также приводил к аресту на двухклеточной стадии, что говорит о том, что материнский RING1B играет важную роль в материнско-зиготическом переходе (Posfai et al., 2012). Хотя ооциты с дефицитом RING1A/B завершили мейоз, дисрегуляция транскриптов и белков в цитоплазме и аберрантное состояние хроматина нарушили их способность к развитию (Posfai et al., 2012). Удаление Ring1a/b на ст. E5.5 приводило к эмбриональной летальности обоих полов в E8.5. При этом у эмбрионов женского пола наблюдались более серьезные аномалии, чем у эмбрионов мужского пола, что может быть связано с нарушением XCI во вне-эмбриональных тканях у PRC1-нулевых эмбрионов женского пола (Masui et al., 2023).
5.1.2 Distinct functions of PCGF proteins
Белки PCGF2/4 являются компонентами как cPRC1, так и ncPRC1, в то время как белки PCGF1/3/5/6 существуют только в ncPRC1 (Loh and Veenstra, 2022). Мыши, у которых отсутствовали PCGF2 или PCGF4, были жизнеспособны, но погибали после отъема о т груди, это позволяет предположить, что эти два белка могут компенсировать друг друга во время раннего развития эмбриона (van der Lugt et al., 1994; Akasaka et al., 1996). И некоторые сходные фенотипы, наблюдаемые у Pcgf2-нулевых и Pcgf4-нулевых мышей, такие как задержка роста, тяжелый иммунодефицит и задняя трансформация осевого скелета, дополнительно подтвердили эту гипотезу (van der Lugt et al., 1994; Akasaka et al., 1996). Скелетные аномалии, вероятно, связаны с эктопической экспрессией генов Hox (Akasaka et al., 1996). Кроме того, сообщалось, что PCGF2/4 необходим для поддержания, но не для инициации экспрессии генов Hox (Akasaka et al., 2001). Кроме того, мутация Pcgf2 приводит к неврологическим аномалиям, характеризующимся атаксической походкой и спорадическими судорогами (Akasaka et al., 1996). Мутация Pcgf4 коррелировала с кишечной непроходимостью из-за гипертрофии гладкой мускулатуры кишечника (van der Lugt et al., 1994). Эти уникальные характеристики, наблюдаемые у соответствующих нуль-мутантных мышей, выявили различия в функциях PCGF2 и PCGF4 на следующих стадиях развития (Akasaka et al., 2001).
Примечательно, что Pcgf1-нулевые мыши не могут развиваться дальше E12.5 (Dickinson et al., 2016). Нокаут Pcgf6 приводил к эмбриональной сублетальности, а выжившие Pcgf6-нулевые мыши были фертильными (Endoh et al., 2017). Подмножество Pcgf6-нулевых эмбрионов задерживалось уже на стадии бластоцисты. Нокаут Pcgf6 также вызывал переднюю трансформацию оси и значительное уменьшение размера плаценты. Эти результаты свидетельствуют о том, что PCGF6 необходим как для пре-, так и для пост-имплантационного развития (Endoh et al., 2017). Более выраженный фенотип развития у нокаутных эмбрионов Ring1a/b, чем у нокаутных эмбрионов с одним Pcgf, указывает на необходимость всех белков PRC1-6 для эмбрионального развития. Стоит отметить, что PCGF1 и PCGF6 функционально избыточны в ранних эмбрионах (Mei et al., 2021). Материнский нокаут Pcgf1/6 значительно задерживает эмбриональное развитие после 2-клеточной стадии, нарушает имплантацию и уменьшает размер помета (Mei et al., 2021). Кроме того, в нокаутных ооцитах Pcg1/6 наблюдалось снижение уровня H2AK119ub1 и H3K27me3, а также дерепрессия генов, и это аномальное эпигенетическое состояние наследовалось зиготами после оплодотворения. Неисправленные ландшафты H3K27me3 и H2AK119ub1 предположительно могут быть причиной остановки развития эмбриона. Более того, увеличенная плацента наблюдалась и у мышей с материнским дефицитом PCGF1/6, что было вызвано потерей неканонического импринтинга во вне-эмбриональных клетках (Mei et al., 2021).
Интересно, что одиночный нокаут Pcgf3 или Pcgf5 оказывал ограниченное влияние на раннее эмбриональное развитие (Dickinson et al., 2016; Almeida et al., 2017). Интересно, что двойной нокаут Pcgf3 и Pcgf5 приводил к эмбриональной летальности и плацентарным дефектам, характерным для женского пола, из-за нарушения Xist-опосредованного сайленсинга (Almeida et al., 2017). Поэтому могут потребоваться дальнейшие исследования для выяснения того, как PCGF3/5-ncPRC1 взаимодействует с Xist.
5.1.3 CBX and PHC proteins are indispensable for completing development
Удаление отдельных белков CBX не повлияло на развитие эмбриона, но привело к различным фенотипам после рождения. Нокаут Cbx2 у мышей приводил к высокой постнатальной летальности до отъема (Core et al., 1997). Выжившие мыши сильно отставали в росте, демонстрировали скелетные пороки и смену пола с мужского на женский, что было связано с не-корректированной экспрессией генов Hox и Sry соответственно (Core et al., 1997; Katoh-Fukui et al., 1998; Baumann and De La Fuente, 2011). Кроме того, почти у 30 % плодов CBX2-нулевых мышей-самцов наблюдается гипопластическое яичко и контралатеральный маленький яичник. Это изменение пола с мужского на женский может быть восстановлено принудительной экспрессией Sry и Sox9 (Katoh-Fukui et al., 2012). Аналогичная реверсия пола наблюдалась у человека с кариотипом XY и мутацией CBX2 (Biason-Lauber et al., 2009). Кроме того, Tardat и др. (2015) обнаружили, что CBX2 регулирует рекрутирование PRC1 на отцовский перицентрический гетерохроматин (pat-PCH) через свой хромодомен и AT-крючок. Локализация PRC1 на pat-PCH способствует осаждению H2AK119ub, что вносит вклад в транскрипционную репрессию основных сателлитных повторов. Аналогично, нокаут Cbx4 также приводил к аномальному размеру эмбриона и предродовой летальности у мышей (Piunti and Shilatifard, 2021). В то время как Cbx6-, Cbx7- или Cbx8-нокаутные мыши могут развиваться до взрослого состояния. Механизм, лежащий в основе этого различия, заключается в том, что у CBX6-нулевых или CBX7-нулевых мышей обнаруживаются дефекты нескольких органов, но нет очевидных дефектов у CBX-8-нулевых мышей (Piunti and Shilatifard, 2021).
Белки PHC также необходимы для нормального развития эмбриона мышей. Phc1-нулевые мыши погибают в перинатальном периоде. В то время как Phc2-нулевые мыши могут дожить до рождения (Isono et al., 2005). И Phc1-null, и Phc2-null участвуют в развитии осевого скелета, вероятно, через прямое связывание с локусом Hoxb8 и подавление его транскрипционной активности (Isono et al., 2005). Более того, двойной нокаут Phc1 и Phc2 приводил к серьезной задержке роста и ранней эмбриональной летальности до середины беременности (Isono et al., 2005). Кроме того, Phc3-нулевые животные выживали при рождении, но характеризовались увеличенным сердцем (Piunti and Shilatifard, 2021).
5.1.4 KDM2B is crucial for targeting ncPRC1.1 to CpG islands
ДНК-связывающий домен ZF-CxxC KDM2B может особым образом распознавать и связываться с неметилированными островками CpG (CGI) (Blackledge et al., 2014). Благодаря этой способности KDM2B может нацеливать ncPRC1.1 на CGIs неактивных генов развития, чтобы поддерживать их состояние транскрипционного сайленсинга после имплантации (Blackledge et al., 2014). Нокаут Kdm2b у мышей приводил к эмбриональной летальности на средней стадии беременности (Boulard et al., 2015). Как комплексы PcG связываются с островами CpG и способствуют их депонированию, остается неясным. Действительно, KDM2B имеет две изоформы, длинную изоформу KDM2BLF и короткую изоформу KDM2BSF. Было установлено, что экспрессия KDM2BLF инициируется в периимплантационный период и снижается после E7.5, совпадая с процессом выхода из нативной плюрипотентности (Huo et al., 2022). С одной стороны, связывание KDM2BF истощало H3K36me2 и способствовало осаждению H3K27me3 и H2AK119ub1 на CGI в периимплантационных эмбрионах мыши. С другой стороны, KDM2BLF может способствовать рекрутированию BRG1/BRM-ассоциированного фактора (BAF) и основного компонента хроматинового ремоделлера SWI/SNF в не метилированные CGI, что приводит к повышению доступности хроматина в этих регионах. Инактивация KDM2BLF частично нарушала локализацию PcGs в CGIs, задерживала выход из нативной плюрипотентности и вызывала задержку роста уже в возрасте E6.5.
5.1.5 Other components of PRC1
Мыши, у которых отсутствовал компонент E2F6 ncPRC1.6, были жизнеспособны, но имели задние гомеотические трансформации осевого скелета (Storre et al., 2002). Это явление гораздо мягче, чем то, которое вызывает делеция PCGF6, что отражает избыточную роль E2F6 в ncPRC1.6 во время развития эмбриона. Однако E2F6 незаменим для репрессии генов зародышевой линии в преимплантационных эмбриональных клетках (Dahlet et al., 2021). Более того, нокаут E2f6 приводил к снижению уровня метилирования ДНК в промоторах нескольких генов зародышевой линии после имплантации, что говорит об ответственности E2F6 за долгосрочную эпигенетическую репрессию генов зародышевой линии. E2F6 функционирует как через PRC1-зависимые, так и PRC1-независимые механизмы, что подтверждается ограниченной репрессией генов-мишеней E2F6 в Pcgf6-нокаутных и Ring1a/b-нокаутных ESCs (Dahlet et al., 2021).
RYBP незаменим для развития вне-эмбриональных тканей, и его отсутствие приводит к нарушению децидуализации и эмбриональной летальности в возрасте от E5,5 до E6,0. Снижение способности к пролиферации может способствовать остановке развития эмбриона на этой стадии (Pirity et al., 2005). В то время как роль YAF2, гомолога RYBP, в развитии эмбриона до сих пор остается практически неизвестной и требует дальнейшего глубокого изучения. Однако AUTS2-нулевые мыши погибали до отъема on груди, с задержкой роста и дефектами нервной и сердечной систем (Hori et al., 2015; Dickinson et al., 2016) (табл. 1).
TABLE 1. The roles of PRC1 subunits in mouse development.
5.2 The role of PRC2 in embryo development
5.2.1 Maternal EED and EZH are essential for embryo development
Eed необходим для осаждения H3K27me3 во время оогенеза у мышей. Делеция материнского EED привела к потере импринтинга H3K27me3 и биаллельной экспрессии H3K27me3-опосредованных импринтированных генов в преимплантационных эмбрионах мыши. При этом отсутствие H3K27me3-зависимого импринтинга не влияло на формирование бластоциста (Inoue et al., 2018; Prokopuk et al., 2018). Любопытно, что отсутствие импринтинга H3K27me3 приводило к гибели около половины материнских Eed-нокаутных эмбрионов после имплантации. Эти эмбрионы демонстрировали летальность, ориентированную на мужчин, которая проявлялась уже к E6.5. У живого потомства делеция материнского Eed приводила к значительному увеличению постнатального веса, которое сохранялось до взрослой жизни (Prokopuk et al., 2018).
Устранение Ezh2 приводила к нарушению процесса образования H3K27me3 и эмбриональному аресту на стадии гаструляции (Zhao et al., 2022). Сходный ранний летальный фенотип, наблюдаемый у эмбрионов Ring1b-null, Eed-null и Ezh2-null, указывает на наличие механической связи между PRC1 и PRC2 во время гаструляции. В отличие от постанального переростка, полученного из ооцитов, лишенных EED, материнский нокаут Ezh2 или Ezh1/2 приводил к значительному снижению веса потомства при рождении (Erhardt et al., 2003; Zhao et al., 2022). А материнский нокаут Ezh1/2 нарушал решение о второй клеточной линии и размножение эпибласта на стадии позднего бластоциста, что может быть связано с ослаблением H3K27me3 (Erhardt et al., 2003; Zhao et al., 2022). Примечательно, что у нокаутных по материнской линии Ezh1/2 эмбрионов в возрасте E17,5 наблюдалось увеличение плаценты с чрезмерным ростом спонгиотрофобласта и увеличением веса. Причина несоответствия влияния материнского EED и EZH остается неясной. А более подробная информация о долгосрочном влиянии материнского PRC2 на потомство требует дальнейшего изучения.
5.2.2 Other core subunits of PRC2
RBBP4/7 может взаимодействовать с SUZ12 для направления PRC2 к целевым локусам, облегчая связывание PRC2 с хромосомами (Glancy et al., 2021; Mu et al., 2022). Было обнаружено, что нокаут RBBP4 приводит к преимплантационной летальности эмбрионов мыши (Miao et al., 2020). В то время как обнаружимый H3K27me3 наблюдался в женских бластоцистах. Вопрос о том, нарушаются ли опосредованные PRC2 функции у эмбрионов с дефицитом RBBP4 и способствуют ли они эмбриональной летальности, требует дальнейшего изучения (Miao et al., 2020). Кроме того, потеря Suz12 блокировала развитие эмбриона на ранней постимплантационной стадии и вызывала поразительное отсутствие H3K27me3 в эмбрионах (Pasini et al., 2004). Значительное уменьшение количества EZH в нокаутных эмбрионах SUZ12 может свидетельствовать о том, что SUZ12 необходим для стабильности белка EZH2 (Pasini et al., 2004) (Таблица 2).
TABLE 2. The roles of PRC2 subunits in mouse development.
6 The role of PcG complexes in establishment and maintenance of XCI
6.1 EED-PRC2 is required for the establishment of XCI in preimplantation embryos
Xist - материнский импринтированный ген у мышей. Было установлено, что H3K27me3, но не метилирование ДНК, аллель-специфично депонируется в материнском локусе Xist и способствует состоянию его импринтинга в ооцитах и ранних эмбрионах (Kobayashi et al., 2012; Zheng et al., 2016; Inoue et al., 2017a; 2017b). H3K27me3-зависимый импринтинг материнского Xist отвечает за защиту материнской Х-хромосомы от XCI (Inoue et al., 2017b). Как и в случае эмбрионов, которым вводили Kdm6b на зиготической стадии, потеря домена H3K27me3 в локусе Xist приводила к реактивации материнского Xist и материнского XCI в материнских нокаутных эмбрионах морулы Eed (Inoue et al., 2017b). Аберрантный XCI может быть в значительной степени восстановлен к E4.0 как у женских, так и у мужских эмбрионов с материнским нокаутом Eed, что согласуется с результатами, согласно которым некоторые эмбрионы выживают до рождения. В частности, у женских эмбрионов XCI происходит случайным образом в экстраэмбриональных клетках, с переменной родительской предрасположенностью к экспрессии сцепленных с Х генов (Inoue et al., 2018; Harris et al., 2019). Необходимы дальнейшие исследования для выяснения механизма, лежащего в основе преобразования Xi/Xi в Xa/Xi в экземплярах с материнским нокаутом Eed (Inoue et al., 2018; Harris et al., 2019). И еще предстоит выяснить, играет ли потеря импринтинга Xist или аутосомного H3K27me3 основную роль в летальности эмбрионов с материнским дефицитом EED, ориентированной на мужчин. Транскрипцию зиготического Eed проводили на 4-клеточной стадии у эмбрионов мыши. В отличие от материнского EED, отсутствие зиготического EED оказывало ограниченное влияние на инициацию и становление импринтированной Х-инактивации, но приводило к снижению регуляции подмножества Х-сцепленных генов (Harris et al., 2019).
6.2 PcG proteins are crucial for maintenance of XCI in extraembryonic lineages
У мышей XCI происходит двумя волнами. Первая волна XCI возникает вскоре после оплодотворения с родительским смещением, систематической инактивацией отцовской Х-хромосомы, которая называется импринтированной XCI (Mak et al., 2004; Okamoto et al., 2004; Ravid Lustig et al., 2023). А материнский H3K27me3, унаследованный из ооцитов, необходим для геномного импринтинга Xist во время XCI (Inoue et al., 2017b). На стадии поздней бластоцисты эта форма инактивации Х-хромосомы обращается вспять в клетках внутренней клеточной массы (ВКМ) - процесс, известный как реактивация Х-хромосомы (XCR) (Patrat et al., 2009; Min et al., 2017). В то время как установленная XCI в экстра-эмбриональной линии сохраняется на последующих стадиях развития. Случайная XCI (rXCI) вновь инициируется в клетках эмбриональной линии примерно в момент имплантации. И как только это происходит, статус Х-инактивации наследуется всеми клетками-потомками (Pacini et al., 2021).
Недавно Masui et al. (2023) вызвали делецию PRCs после создания импринтированных XCI (делеция Ring1a/b в E5.5 или делеция Eed в E3.5) и особенно сосредоточились на роли PRC1 и PRC2 в поддержании XCI (Borensztein et al., 2017). Нарушенное подавление Xist-связанных генов наблюдалось в экстра-эмбриональной линии на ст. E7.5, это продемонстрировало, что PRC1/2 оказывает существенное влияние на поддержание импринтированных XCI в экстра-эмбриональных линиях. Примечательно, что PRC1 и PRC2, по-видимому, функционируют независимо, поскольку потеря PRC1 или PRC2 не влияет на накопление H3K27me3 или H2AK119ub как в экстра-эмбриональных линиях, так и в эмбрионе на этой стадии (Masui et al., 2023). В то время как в предыдущем исследовании сообщалось, что нокаут гена Pcgf3/5 нарушает осаждение как H2AK119ub1, так и H3K27me3 на Xi в эмбриональных стволовых клетках мыши (Almeida et al., 2017). Одна из возможных причин такого несоответствия заключается в том, что PRC1 может больше не требоваться для распространения PRC2 на Xi во всех линиях на этапе поддержания XCI (Almeida et al., 2017). Кроме того, H3K27me3, накопленный на Xi на стадии инициации XCI, может в достаточной степени способствовать последующему рекрутированию и распространению PRC2 на стадии поддержания.
Аллель-специфическое РНК-секвенирование выявило частичное перекрытие PRC1- и PRC2-зависимых X-сцепленных генов, что подтверждает наличие синергизма между PRC1 и PRC2. К истощению PRC1 было чувствительно больше генов, чем к истощению PRC2, что предполагает, что PRC1 является основным игроком в поддержании XCI (Masui et al., 2023). Кроме того, эти гены, чувствительные к PRC1, имеют CGI в промоторных областях (Masui et al., 2023). В соответствии с этой идеей Andergassen и др. сгенерировали зиготы, обедненные PRC1 или PRC2, и обнаружили, что PRC2, а не PRC1, доминирует при XCI экстра-эмбриональных тканей (Andergassen et al., 2021). Преобладающее влияние PRC2 на инициацию XCI может внести свой вклад в эту дискуссию. Необходимы дальнейшие исследования для изучения механизмов, лежащих в основе участия PcGs в инициации и поддержании XCI у эмбрионов млекопитающих.
Интересно, что, в отличие от того, что наблюдалось во вне-эмбриональных тканях, транскрипционный сайленсинг сцепленных с X генов все еще наблюдается в PRC1-нулевых или PRC2-нулевых эмбриональных линиях в E7.5 (Masui et al., 2023). Эти результаты указывают на то, что PRC являются избыточными для случайного XCI в эмбриональных линиях и должны существовать другие доминирующие механизмы XCI в эмбрионе, но не во внеэмбриональных тканях, такие как метилирование ДНК или H3K9me3.
7 The role of polycomb proteins in tissue stem cells
Комплексы PcG также имеют решающее значение для самообновления и детерминации клонов стволовых клеток. Анемия и неврологические аномалии - два характерных симптома у выживших плодов с дефицитом белков PcG.
7.1 PcG complexes are required for hematopoiesis
PCGF1-PRC1 необходим для сбалансированного выхода гемопоэтических стволовых и прогениторных клеток (HSPCs). Делеция Pcgf1 приводит к миелоидной дифференцировке HSPC, в основном за счет депрессии C/EBPα и генов семейства Hox (Takano et al., 2022; Nakajima-Takagi et al., 2023). В клетках с дефицитом Pcgf1 подавлялась лимфоидная дифференцировка. В результате делеция Pcgf1 в гемопоэтических клетках приводила к легкой анемии и лейкопении у мышей (Takano et al., 2022; Nakajima-Takagi et al., 2023). У мышей с функциональной недостаточностью BCOR, не взаимодействующей с PCGF1, также наблюдается миелоидная дифференцировка (Tara et al., 2018). В гемопоэтических клетках с недостаточностью BCOR также наблюдалось повышение регуляции генов Cebp и Hox (Tara et al., 2018). KDM2B также регулирует способность ГСК к самообновлению. Дефицит KDM2B приводил к значительному уменьшению количества HSCs и нарушению лимфоидной спецификации (Andricovich et al., 2016). Эти результаты указывают на то, что ncPRC1.1 необходим для дефинитивного кроветворения и приверженности линии HSPC. Однако PCGF4 необходим для способности к самообновлению и мультипотентности HSCs за счет репрессии экспрессии регулятора клеточного цикла INK4A/ARFPAX5 и регулятора развития линии В клеток EBF1 и PAX5 (van der Lugt et al., 1994; Oguro et al., 2010).
PRC2 также играет ключевую роль в развитии кроветворной системы. EED необходим для нормального кроветворения в постнатальном периоде. Условный нокаут Eed в гемопоэтических клетках мыши с помощью VavCre не оказывал видимого влияния на детенышей при рождении, но приводил к тяжелой лейкопении, анемии и ранней летальности вскоре после рождения. Нарушенная дифференцировка кроветворных клеток неонатального костного мозга (BM) может объяснять снижение количества зрелых клеток крови (Xie et al., 2014). Для взрослых ГСК BM потеря Eed приводила к истощению HSCS, что указывает на то, что EED необходим для поддержания HSCS BM взрослых (Xie et al., 2014). Что касается эмбрионального кроветворения, то потеря EED через VavCre не повлияла на развитие гемопоэтических стволовых клеток (HSCS) печени плода (FL) (Xie et al., 2014). С другой стороны, делеция EED привела к нарушению гомеостаза HSCS и постимплантационной летальности в середине беременности у эмбрионов с Tie2Cre (EEDCKO) (Yu et al., 2017). Более раннее начало делеции Tie2Cre в гемангиобластах может частично объяснять эти разные результаты (Yu et al., 2017).
В отличие от EED, EZH2 незаменим для поддержания HSCS как FL, так и BM (VavCre-опосредованное удаление Ezh2) (Xie et al., 2014). И наоборот, TieCre-опосредованная делеция EZH2 приводила к значительному снижению количества HSCS FL и эмбриональной летальности на стадии середины беременности, что указывает на незаменимую роль EZH2 в эмбриональном кроветворении (Mochizuki-Kashio et al., 2011). По-видимому, EZH1 частично компенсирует дефицит EZH2 в кроветворении BM, но не в печени плода (Mochizuki-Kashio et al., 2011; Xie et al., 2014). Кроме того, нарушение целостности сосудов, наблюдаемое у эмбрионов EZH2CKO, отсутствовало у эмбрионов EEDCKO. EZH2 может играть важную роль в развитии сосудов через независимые от EED неканонические функции PRC2. Сообщалось, что помимо кроветворения, EZH2 необходим для постнатального гомеостаза сердца (Delgado-Olguin et al., 2012). Удаление Ezh2 в сердечных предшественниках нарушает постнатальную дифференцировку и пролиферацию кардиомиоцитов и в конечном итоге приводит к гипертрофии и фиброзу миокарда после рождения (Delgado-Olguin et al., 2012).
SUZ12 также необходим как для фетального кроветворения, так и для поддержания взрослых HSCS. Мыши SUZ12CKO, полученные с помощью VavCre, погибали до отъема детей от груди. По-видимому, SUZ12 может регулировать эмбриональное кроветворение посредством PRC2-независимых действий. В пользу этой гипотезы говорит существование неканонического субкомплекса, содержащего EZH1 и SUZ12, но не имеющего EED (Xu et al., 2015). Более того, у мышей с лимфоид-специфической делецией Suz12 развитие лимфоидной ткани было в значительной степени нарушено, наблюдалась лимфопения и значительно сниженное количество клеток селезенки и тимуса (Lee et al., 2015).
В отличие от основных единиц PRC2, обильно экспрессирующихся во всех тканях, вспомогательные белки экспрессируются только в определенных тканях (Rothberg et al., 2018). Оказалось, что неосновные единицы PRC2.1-PCL2 также играют важную роль в развитии дефинитивных эритроидов. Эмбрионы, лишенные PCL2, погибали к ст. E15.5, демонстрируя дефекты роста и анемию (Rothberg et al., 2018). Нокаут Pcl2 привел к значительному снижению уровня основных белков PRC2 и глобальной потере промоторного H3K27me3. Механически, потеря PCL2-опосредованного H3K27me3 аномально активировала сигнальный путь Wnt/β-катенин, что привело к нарушению созревания и дифференцировки эритроидов (Rothberg et al., 2018) (Таблица 2).
7.2 PcG complexes are required for neuronal development
PcGs также играют важную роль в регуляции развития нейронов млекопитающих (Desai and Pethe, 2020). Например, нокаут Pcgf4 у мышей вызывал такие неврологические аномалии, как атаксическая походка и спорадические судороги (van der Lugt et al., 1994). Аналогично, нокаут Auts2 вызывал аномалии в нервной системе (Hori et al., 2015). А делеция Auts2, особенно в центральной нервной системе мыши, вызывала фенотип, сходный с синдромом AUTS2, описанным у человека (Gao et al., 2014b). В отличие от типичной роли PRC1 в репрессии генов, AUTS2-PRC1 действует как транскрипционный активатор в клетках нейронов, благодаря рекрутированию CK2 и взаимодействию с EP300 (Gao et al., 2014b). Примечательно, что NRF1 был необходим для рекрутирования AUTS2-PRC1 в сайты-мишени (Liu et al., 2021).
Некоторые субъединицы PRC2 также участвуют в дифференцировке и пролиферации нейронов. Сообщалось, что EZH2 играет важную роль в переходе судьбы как кортикальных клеток предшественников в коре головного мозга, так и GABA-ергических нейронов в мозжечке (Pereira et al., 2010; Feng et al., 2016). Потеря EZH2 значительно изменяет сроки развития коры головного мозга. Из-за удаления H3K27me3, вызванного делецией EZH2, баланс между самообновлением и дифференцировкой клеток-предшественников коры головного мозга был нарушен и перешел в дифференцировку (Pereira et al., 2010). Специфическая для мозжечка делеция EZH2 привела к увеличению количества интернейронов мозжечка и уменьшению количества клеток Пуркинье и клеток-предшественников гранул в эмбриональном мозжечке, что в конечном итоге привело к гипоплазии мозжечка (Feng et al., 2016). Кроме того, субъединица PRC1 Pcgf4 также необходима для развития мозжечка и способствует экспансии клеток-предшественников гранул (Leung et al., 2004). EED регулирует дифференцировку нейронов и пролиферацию нейральных стволовых и клеток предшественников. Условный нокаут Eed в мозге приводит к постнатальной летальности, нарушению дифференцировки и пролиферации нейронов и пороку развития зубчатой извилины (Liu et al., 2019). Сверхэкспрессия SOX11, последующей мишени EED, может устранить дефект дифференцировки нейронов, вызванный EED-аблацией. Было показано, что для транскрипционной активации Sox11 необходимо осаждение H3K27me1 под действием EED/PRC2 (Liu et al., 2019). Важно отметить, что мутация EED у человека была связана с возникновением синдрома Weaver, который характеризуется умственной отсталостью (Cooney et al., 2017). Кроме того, пороки развития мозга наблюдались у мышей с гетерозиготной мутацией гена Suz12 (Miro et al., 2009).
8 Conclusion and outlook
Развитие млекопитающих - это непрерывный процесс, который регулируется множеством генов и белков. Среди них важнейшее значение для регуляции правильного развития имеют комплексы PcG, которые принимают активное участие во множестве биологических процессов, включая активацию и репрессию генов, геномный импринтинг, XCI и создание 3D-структуры хроматина. Для точной регуляции мишеней требования к отдельным белкам PcG отличаются на разных стадиях развития. В этом обзоре мы представили состав и биологические функции комплексов PcG у млекопитающих и всесторонне обобщили роль белков PcG в эмбрионах млекопитающих и стволовых клетках тканей. Тем не менее, остается ряд вопросов, на которые еще предстоит получить исчерпывающие ответы.
PcGs и катализируемые ими продукты особым образом локализуются в генах развития и контролируют их экспрессию, что важно для развития млекопитающих. Однако до сих пор остается малоизученным, как белки polycomb рекрутируются в гены-мишени и поддерживают состояние транскрипционной репрессии. В эмбриональных стволовых клетках мыши PRC1/H2AK119ub1 определяет заселенность PRC2 в хроматиновых доменах Polycomb (Dobrinic et al., 2021). Напротив, в ранних эмбрионах мыши осаждение H2AK119ub1 предшествует H3K27me3 в промоторных областях генов, связанных с развитием (Chen et al., 2021; Mei et al., 2021). Модель рекрутирования комплексов PcG требует дальнейшего глубокого изучения. Помимо хорошо известной функции репрессии экспрессии генов, PcG также участвуют в транскрипционной активации некоторых генов в нейрональных клетках (Liu et al., 2021). Вопрос о том, действуют ли PcGs в качестве активатора в других типах клеток или в ранних эмбрионах, все еще нуждается в дальнейшем изучении.
Хотя белки CpG хорошо сохранились, их специализированные роли, продемонстрированные в контроле эмбрионального развития, могут различаться у разных видов. Например, потеря материнского EED/PRC2 приводит к эмбриональной летальности у мышей из-за отсутствия неканонического импринтинга и нарушенного XCI. В то время как экспрессия основных генов PRC2, включая EED, практически не обнаруживается (Harris et al., 2019; Lu et al., 2021). Различный polycomb ландшафт наблюдался у эмбрионов человека и мыши. Специфичный для ооцитов H3K27me3 в основном сохраняется до стадии бластоцисты у мышей, в то время как у человека и свиньи он отсутствует после стадии 4 клеток (Wilkinson et al., 2023). Эти результаты показали, что H3K27me3-опосредованный импринтинг, по-видимому, присутствует и необходим только у грызунов (Lu et al., 2021). Влияние CpG-белков на развитие человеческого эмбриона во многом остается неясным. Достижения в области технологий секвенирования и низкопроизводительных технологий эпигеномного профилирования помогут расшифровать роль комплексов PcG в развитии человеческого эмбриона.
Недавнее исследование показало, что H3K27me3 может функционировать как трансгенерационный эпигенетический переносчик у C. elegans. Состояние H3K27me3 может передаваться по наследству менделевским способом, влияя на экспрессию генов в двух поколениях половых клеток (Kaneshiro et al., 2022). Этот вывод указывает на то, что изменение состояния H3K27me3 может наследоваться в разных поколениях и оказывать долгосрочное влияние на здоровье потомства. У мышей было обнаружено, что H3K27me3 вносит вклад в межпоколенную наследственность, контролируя установление неканонического импринтинга (Inoue, 2023). В значительной степени неизвестно, вносит ли H3K27me3 или H2AK119ub1 вклад в трансгенерационное эпигенетическое наследование у млекопитающих. Действительно, избыточная экспрессия KDM1A может вызывать снижение уровня H3K4me3 в сперме мыши и изменение относительной экспрессии генов в разных поколениях (Lismer et al., 2020). Поэтому необходимы дальнейшие усилия для выяснения функции комплексов PcG в трансгенерационном наследовании.
Сходная структура белков компонентов PcG может определять их функциональную избыточность, что иллюстрируется последующим сходным фенотипом при дефиците одного компонента PcG (Owen and Davidovich, 2022). Кроме того, комплексы PcG влияют друг на друга, поэтому отсутствие одного компонента неизбежно скажется на других комплексах PcG. Из-за этих особенностей комплексов PcG сложно четко определить их точные эффекты в нормальном состоянии in vivo. Для оценки динамических функций белков CpG на разных стадиях развития in vivo будет полезна технология отслеживания в живую одиночных молекул.
|
 FIGURE 1. The composition and recruitment of PcG complexes. The catalytic core of PRC1 contains RING1A/B and one of six PCGF orthologs, which play a role in H2AK119ub1 deposition. PRC1 can further be divide into 2 groups: cPRC1 with RING1A/B, PCGF2/4, CBX2/4/6/7/8 and PHC1/2/3, and ncPRC1 with RING1A/B, PCGF1-6, RYBP/YAF2. RYBP/YAF2 can recognize H2AK119ub1 and facilitate the binding of ncPRC1 with chromatin. CBX proteins facilitate the cPRC1 binding to H3K27me3-deposit regions. KDM2B mediates the location of ncPRC1.1 to unmethylated CGIs. AUTS2-PRC1 is involved in transcriptional activation. PRC2 core comprises four subunits: EZH1/2, EED, SUZ12 and RBBP4/7. PRC2.1 is characterized by PCL1/2/3 and PALI1/2 or EPOP subunits. PRC2.2 was characterized by JARID2 and AEBP2 subunits. EZH2 catalyzes H3K27me3. EED, JARID2 and PCL target PRC2 to H3K27me3-enriched regions, H2AK119ub1-enriched regions and unmethylated CGIs, respectively.
FIGURE 1. The composition and recruitment of PcG complexes. The catalytic core of PRC1 contains RING1A/B and one of six PCGF orthologs, which play a role in H2AK119ub1 deposition. PRC1 can further be divide into 2 groups: cPRC1 with RING1A/B, PCGF2/4, CBX2/4/6/7/8 and PHC1/2/3, and ncPRC1 with RING1A/B, PCGF1-6, RYBP/YAF2. RYBP/YAF2 can recognize H2AK119ub1 and facilitate the binding of ncPRC1 with chromatin. CBX proteins facilitate the cPRC1 binding to H3K27me3-deposit regions. KDM2B mediates the location of ncPRC1.1 to unmethylated CGIs. AUTS2-PRC1 is involved in transcriptional activation. PRC2 core comprises four subunits: EZH1/2, EED, SUZ12 and RBBP4/7. PRC2.1 is characterized by PCL1/2/3 and PALI1/2 or EPOP subunits. PRC2.2 was characterized by JARID2 and AEBP2 subunits. EZH2 catalyzes H3K27me3. EED, JARID2 and PCL target PRC2 to H3K27me3-enriched regions, H2AK119ub1-enriched regions and unmethylated CGIs, respectively.