Генетика развития вестибулярной системы
Федеральное государственное бюджетное учреждение «Медико-генетический научный центр» Российской академии медицинских наук
Россия, 115478, Москва, ул. Москворечье, д. 1. E-mail: mglinetz@med-gen.ru
Рассматриваются развитие, структура и функция вестибулярного аппарата и их генетический контроль. Как известно, ве-
стибулярный аппарат развивается из общего со слуховым аппаратом отического зачатка. Их разделение контролируется ге-
нетически. Общим для обеих систем является наличие сенсорных волосковых клеток. Различают пять специфических участ-
ков волосковых клеток вестибулярного аппарата, являющихся местом восприятия линейных ускорений, угловых ускорений, а
также гравитации и вибрационных колебаний. Отличительные особенности развивающегося вестибулярного аппарата — со-
хранение киноцилий, выполняющих ведущую роль в образовании стереоцилий волосковыми клетками, а также образование
отоконий.
Ключевые слова: вестибулярная систма, генетика развития
|
Структура вестибулярного аппарата У взрослых индивидов мембранозный, или перепонча- Полукружные каналы в месте соединения их с эллипти- | Генетика развития вестибулярного аппарата Ретиноевая кислота Установлено, что ретиноевая кислота действует в ка- Ретиноевая кислота впоследствии принимает учас- Регионализация Помимо действия морфогенетического градиента ре- 3 |
|
сё это приводит, в свою очередь, к дифференциальной Подобным же образом осуществляется подразделе- Процесс регионализации, всё более разграничивающий |
Для развития вестибулярных структур важным явля- Морфогенез вестибулярных структур Сначала из дорсомедиальной области отического пу- Далее начинается формирование полукружных кана- В формировании полукружных каналов принимает |
|
на сенсорные гребешки ампул переднего и латерального Дифференциальная экспрессия регуляторных генов Происходит формирование специфических сенсор- | Спецификация волосковых клеток После выделения индивидуальных сенсорных участ- Предложена [36] следующая последовательность ге- Последний этап развития волосковых клеток харак- 6 |
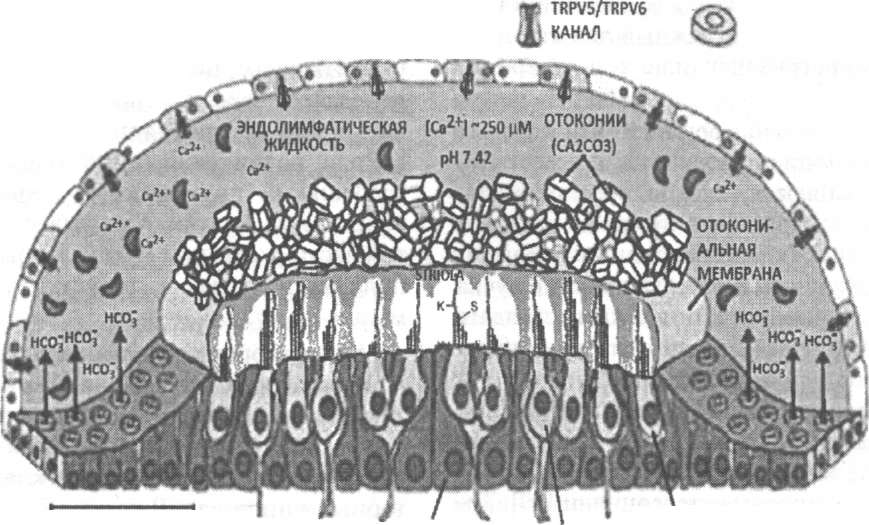
Схематическое изображение эллиптического мешочка вестибулярного аппарата.
Стереоцилии (S) расположены на верхушке кутикулярной пластинки, расположенной на апикальной части волосковых клеток, тогда киноцилия
(К) происходит из базального тельца в промежутке, лишённом кутикулы. Верхний конец киноцилия закреплён в желатинозном слое, нижняя
часть которого представлена сетчатой структурой, доходящей до апикальных частей поддерживающих клеток. Волосковые клетки расположе-
ны зеркально симметрично по отношению к разделяющей макулу на две части стриоле (striola). В эллиптическом мешочке киноцилии всех во-
лосковых клеток обращены к области striola, тогда как в сферическом мешочке они обращены противоположным образом. Каждый мешочек
регистрирует колебания желатинозного слоя и вперёд, и назад, возбуждая одну группу стереоцилий и одновременно тормозя другую. Пучки
стереоцилий сильно различаются по длине, увеличиваясь в зависимости от расстояния от срединной линии в каждой половине макулы. Для
формирования отоконий отокониальные белки, такие, как отоконин 90, секретируются в эндолимфу ещё до начала и во время зарождения и со-
зревания отоконий, где они связывают ионы кальция, образуя биоминерал кальцит. Активность пендриновых каналов в группе переходных кле-
ток эллиптического мешочка обеспечивает секрецию анионов НС03~ для поддержания нормального уровня кислотности (рН 7.42) эндолимфа-
тической жидкости. Этот уровень кислотности позволяет осуществлять реабсорбцию кальция с помощью чувствительных к рН кальциевых ка-
налов, TRPV5 и TRPV6, регулируя тем самым уровни кальция в эпителии полукружных каналов и в вестибулярных тёмных клетках.
|
дистальной части киноцилии отсутствует центральная В своём основании стереоцилии закреплены в кути- Принимая во внимание, что в органе Корти в зрелых Механотрансдукция Вестибулярные волосковые клетки способны вос- |
При смещении стереоцилий в сторону киноцилии Как и в органе Корти, в вестибулярной системе от- 8 |
|
Формирование костного лабиринта Костный лабиринт внутреннего уха формируется в Образование желатинозных мембран и отокониев Как отмечалось выше, к неклеточным структурам Для образования отокониев (отолитов) важны осмо- | Функционируя во внутреннем ухе в качестве транспор- Формирование ушных камней, отокониев, происхо- Зачатки отокониев у мыши обнаруживаются на эмб- 10 |
|
24. Cohen-Salmon М., El-Amraoui A., Leibovici М., Petit С. 25. Cole L.K., Le Roux I., Nunes F. et al. Sensory organ genera- - Vol. 424. - P. 509-520. 26. Dabdoub A., Puligilla C., Jones J.M. et al. Sox2 signaling in 27. Deans M.R., Antic D., Suyama K. et al. Asymmetric distri- - Vol. 27. - P. 3139-3147. 28. Denman-Johnson K., Forge A. Establishment of hair bundle 29. Dror A.A., Politi Y., Shahin H. et al. Calcium Oxalate Stone 30. Elkan-Miller Т., Ulitsky I., Hertzano R. et al. Integration of 31. Farinas I., Jones K.R., Tessarollo L. et al. Spatial shaping of 32. Fekete D.M., Homburger S.A., Waring M.T. et al. Involve- 33. Fekete D.M., Wu D.K. Revisiting cell fate specification in 34. Fritzsch В., Signore M., Simeone A. Otxl null mutant mice 35. Fritzsch В., Tessarollo L., Coppola E., Reichardt L.F. Neu- 36. Gao W.-Q. Hair cell development in higher vertebrates // 37. Gap C„ Wang G., Amack J.D., Mitchell D.R. Odal6/Wdr69 38. Gerlach L.M., Hutson M.R., Germiller J.A. et al. Addition 39. Goodyear R.J., Kwan Т., Oh S.H. et al. The cell adhesion 40. Goodyear R.J., Forge A., Legan P.K., Richardson G.P. - 2010. - Vol. 518(21). - P. 4288-4297. 41. Grati M., Kachar B. Myosin Vila and sans localization at - P. 11476-11481. 42. Hammond K.L., Loynes H.E., Folarin A.A. et al. Hedgehog |
43. Hashino E., Dolnick R.Y., Cohan C.S. Developing vestibu- 44. Haugas M., Lillevali K., Hakanen J., Salminen M. Gata2 Is 45. Herbrand H., Guthrie S., Hadrys T. et al. Two regulatory ge- 46. Hertzano R., Dror A.A., Montcouquiol M. et al. Lhx3, a 47. Hidalgo-Sanchez M., Alvarado-Mallart R., Alvarez I.S. 48. Hughes I., Thalmann I., Thalmann R., Ornitz D.M. Mixing 49. Hughes I., Binkley J., Hurle B.B. Identification of the Oto- 50. Hwang C.H., Simeone A., Lai E., Wu D.K. Foxgl is requi- 51. Karis A., Pata I., Van Doorninck J.H. et al. Transcription 52. Kawakami Y., Capdevila J., Buscher D. et al. WNT signals 53. Kiernan A.E., Steel K.P., Fekete D.M. Development of the 54. Kiernan A.E., Pelling A.L., Leung K.K. et al. Sox2 Is Requi- 55. Kim W.Y., Fritzsch В., Serls A. et al. NeuroD-null mice are 56. Lang H., Fekete D.M. Lineage analysis in the chicken inner 57. Leibovici M., Verpya E., Goodyear R.J. et al. Initial charac- 58. Li S„ Price S.M., Cahill H., Ryugo D.K. et al. Hearing loss 59. Lin Z., Cantos R., Patente M., Wu D.K. Gbx2 is required for 12 |
|
99. Zheng J., Gao W.Q. Overexpression of Mathl induces robust 100. Zheng J., Shou J., Guillemot F. Hesl is a negative regulator 101. Zine A., Aubert A., Qiu J. et al. Hesl and Hes5 activities are 102. Zou D., Silvius D., Rodrigo-Blomqvist S. et al. Eyal regu- |
103. Zou D., Erickson C., Kim E.-H. et al. Eyel gene dosage 104. Zwaenepoel I., Mustapha M., Leibovici M. et al. Otoanco- |
Research Centre for Medical Genetics,
115478, Moscow, ul. Moskvorechye, 1, Russia, E-mail: mglinetz@med-gen.ru
Examines the development, structure and function of the vestibular apparatus and its genetic control. The vestibular apparatus
develops from a general with a hearing aid otic anlage. Their separation is controlled genetically. Common to both systems is the sen-
sory hair cells. Five specific areas of hair cells vestibular system are the site of perception of linear acceleration and angular accelera-
tion, gravity and space perception and vibratory oscillations. Distinctive features of the vestibular system are the conservation of
kinocilia on hair cells, and formation otoconia.
Key words: vestibular system, genetic control
14