Васкулярные (сосудистые) структуры формируются в результате процесса васкулогенеза, для которого характерным является дифференцировка эндотелиальных клеток из морфологически недифференцированных мезенхимных клеток.
В последующем развитии васкулатура нуждается в ангиогенезе(Flamme et al., 1997), процессе распределения и ветвления (sprouts) уже существующих сосудов как результат роста уже имеющегося эндотелия. Однако в некоторых органах, таких как легкие и скелетные мышцы. выявлен non-sprouting механизм роста кровеносных сосудов (intussusceptive growth). Кровеносные сосуды делется и расщепляются в результате врастания окружающей ткани. В некоторых органах, таких как желточный мешок встречаются оба механизма.
Генетический контроль
Два подсемейства тирозин киназных рецепторов характеризуются своей выской специфической экспрессией в эндотелии. Одно семейство включает Flt-1/VEGFR1, Flk-1/KDR/VEGFR2 и Flt-4/VEGFR3, все члены семейства vascular endothelial growth factor (VEGF). Другое семейство включает TIE1/TIE и TIE2/TEK. Эти рецепторы подобно VEGFRs играют критическую роль в формировании эмбриональных сосудов.
Первой ступенью ангиогенеза взрослых сосудов является диссоциация периэндотелиальных клеток (перицитов), тесно слипшихсся с эндотелиальными клетками. Сила их адгезии зависит от ангиопоэтинов, лигандов для TIE2. Ультраструктурный анализ показывает, что тесная адгезия между эндотелиальными клетками и перицитами ингибируется при отсутствии TIE2 или Ang1. Естественный антогонист Ang1, обозначаемый как Ang2, блокирует способность Ang1 активировать TIE2. Так как Ang1 экспрессируется в мезенхиме, окружающей крупные сосуды эмбриона и широко экспрессируется у взрослых, то Ang2 экспрессируется только в местах ремоделирования сосудов. Следовательно, Ang2 блокирует другие конституитивные стабилизирующие сигналы с помощью Ang1 и способствует локальной дестабилизации сосуда, необходимой или для регрессии (VEGF-) или для отщепления (sprouting) нового сосуда (VEGF+).
Установлено, что Ang1 стимулирует интегрин-зависимую адгезию клеток, экспрессирующих TIE2, c фибронектином и коллагеном. Это согласуется с тем, что Ang1 способствует адгезии эндотелиальных клеток и перицитов. Ang1 способствует также ветвлению сосудов, действуя как аттрактант. Ветвление начинается с диссоциации перицитов от эндотелиальных клеток, постепенно эндотелиальные клетки ответвляются в направлении Ang1 продуцирующей ткани. Рекрутация перицитов сопровождается миграцией эндотелальных клеток.
Показано, что фактор роста сосудистого эндотелия (VEGF) и фактор роста фибробластов (bFGF) контролируют миграцию эндотелиальных клеток и образование ими сосудистых трубок. Предполагается, что эти факторы участвуют в формировании коронарных сосудов в развивающемся сердце (Ratajska et al., 1995).
Экспрессия in vivo VEGF коррелирует с процессом сосудообразования во время эмбриогенеза и опухолевым ростом. Специфичность VEGF для эндотелиальных клеток зависит от огрниченной экспрессии эндотелием VEGF рецепторов, flt-1 и KDR/flk-1. Недавно было показано, что bHLH PAS доменовый транкрипционный фактор, hypoxia inducible factor 1 α(HIF1α), который управляет экспрессией VEGF в ответ на гипоксию. VEGF регулирует экспрессию своего собственного рецептора flk-1. Недавно у дрозофилы выявлен ген, регулирующий тубогенез в трахейной системе Trachealess (trl). Поиск его гомолога у позвоночных показал, что HIF-1α обладает значительным скходством последовательностей c trl. Идентифицирован и родственый ему фактор HRF, который экспрессируется преимущественно в эндотелиальных клетках капиляров головного мозга , а также в других кросеносных сосудах и эпителии бронхов у эмбрионов и взрослых.
Экспрессия дивергентного гомеобоксного гена Нех в мезодерме впервые обнаруживается в будущих VYS кровяных островках, где начинают формироваться примитивные эритроциты и кровеносные сосуды. В собственно эмбрионе, где локализация эндотелиальных клеток-предшественников определена менее четко, Нех транскрипты на стадии нервной пластинки ассоциированы с проксимо-дистальной мезодермой, где возникают ангиобласты. Позднее Нех экспрессируется в областях, где образуются дефинитивные сосуды , так же как это делают сливающиеся эндотелиальные предшественники ( напр., в дорсальной аорте) или при ответвлении новых сосудов ( напр., межсомитные сосуды). В этой связи, очевидно, что Нех участвует в инициальных фазах как ангиогенеза,так и васкулогенеза, подтверждая предположение об общем молекулярном механизме , лежащем в основе этих процесов. Экспрессия Нех строго соответствует экспрессии flk-1, который является самым ранним из известных маркеров эндотелиальных клеток-предшественников и который существенен для дифференцировки эндотелиальных клеток клеточно автономным способом. Сходство в экспрессии Нех и flk-1 указывает на участие Нех в инициальной стадии отбора и/или дифференцировки эндотелиальных клеток и делает его наиболее вероятным кандидатом, экспрессирующемся в предполагаемых гемангиобластных стволовых клетках. В отличие от flk-1 транскрипты Нех не сохраняются в дифференцированных эндотелиальных клетках. Это быстрое затухание экспрессии Нех по мере дифференцировки напоминает подавление в диффренцированном потомстве гематопоэтических предшественников и клеточных линиях.
Эндотелиальные клетки из пупочной вены человека (human umbilical vein endothelial cells, HUVEC) способны in vitro формировать трубочко-подобные структуры, в их клетках существенно снижалась экспрессия винкулина, α2 субъединицы интегрина, таллина, альфа-актинина и актина, тогда как количество FVIII-сходного антигена не менялось. Эти изменения связаны с распадом адгезивных бляшек, необходимых мигрирующим эндотелиальным клеткам. Внутриклеточные домены интегринов через сеть взаимодействующих белков, таких как винкулин, талин и паксилин осуществляют физическую связь с F-актиновыми и альфа-актининовыми микрофиламентами цитосеклета клеток. Эта система и образует фокальные адгезивные бляшки, участвующие в присоединении клеток к внеклеточному матриксу и распластывании. Они оперируют как механотрансдукторы . За связь бляшек с ВКМ в основном отвечает субъединица α2 интегрина, входящая в состав α2β1 интегрина, наиболее эффектиного рецептора коллагена I на поверхности HUVEC.
Образование просветов
Было установлено(Meyer et al., 1997)., что 3 различные популяции эндотелиальных клеток участвуют в формировании сосудистых трубок. Эндотелиальные клетки с фагоцитарным фенотипом (1) прокладывают путь для образования сосудов путем деградации коллагенового матрикса, они проделывают туннель в глубину геля (образование капилярного ответвления (capilary sprout)) (Рис.1)
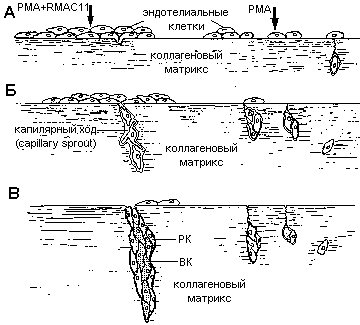
Схематическое изображение морфологических событий, ведущих к образованию просветов в тяжах клеток после обработки эндотелиальных клеток phorbol myristate acetate (PMA) и антиинтегриновыми антителами RMAC11 А - Действие RMAC11 усиливает агрегацию клеток во время первых 2 ч. Б - спустя 6 ч эндотелиальные клетки образуют короткие отростки и проникают в коллагеновый гель. В - спустя 12 ч образуются большие капилярные ответвления, состоящие из эндотелиальных клеток содержащих лизосом-подобные структуры и вакуоли (вакуолизированные клетки, ВК) , которые частично окружены мигрирующими поверх рекрутируемыми клетками (РК).
Морфология этих клеток указывает на то, что они обладают высокой фагоцитарной активностью, они накапливают липофусцин(компонент вторичных лизосом) с своей цитоплазме. В большинстве клеток гранулы липофусцина сливаются с плазмалеммой и освобождают свое содержимое во внеклеточное пространство. Предполагается наличие связи между накоплением липофусцина и ишемией, которая возникает по мере миграции эндотелиальных клеток (1) в коллагеновый гель, прочь от культуральной среды и кислорода. Процесс начинается с продукции неорганических супероксидных свободных радикалов. Эти клетки обладают способностью деградировать гиалуроновую кислоту и коллаген, компоненты базальных мембран. Это усиливает их инвазивную способность.
Клетки второй популяции (2) мигрируют поверх фагоцитарных (1) по канальцам, проделанным в коллагеновом матриксе, при этом они они покрывают последние. В результате они обрекают фагоцитарные клетки на "голодание" или индуцируют в них апоптоз, так как до этого их связь с с матриксом благодаря интегриновым лигандам ингибировала апоптоз. Основным признаком второй мигрирующей популяции клеток является присутствие в них большого числа внутриклеточных вакуолей. Эти вакуоли соединяются и сливаются с плазменными мембранами, обращенными во межклеточный компартмент. Следовательно, полярность этих клеток уже предопределена в результате межклеточных контактов и они образуют межклеточное пространство, которое предопределяет положение примитивного просвета(Рис.2)
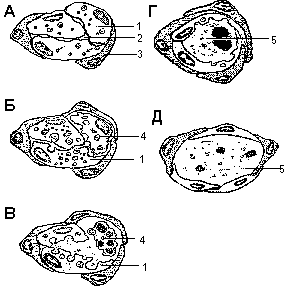
Схематическое изображение морфологических событий, ведущих к образованию просветов в тяжах клеток после обработки эндотелиальных клеток phorbol myristate acetate (PMA) и антиинтегриновыми антителами RMAC11.Поперечные срезы через ответвляющиеся тяжи эндотелиальных клеток А - между 2-6 ч небольшие темно окрашенные лизосомы ( стрелки)и вакуоли накапливаются в вакуолизированных клетках (1). В это время большая часть этих клеток контактирует с матриксом. Образуются межклеточное пространство (2), из которого в дальнейшем возникнет просвет. Поверх вакуолизированных клеток (1) мигрируют так наз. рекрутируемые клетки (3).Б - спустя 12 ч вакуоли, содержащие клеточный дебрис, соединяются, некоторые клетки, лишенные контакта с матриксом, обнаруживают первые признаки клеточной гибели (4). В - спустя 12-24 ч вакуоли открываются в межклеточное пространство . Г - весь объем содержимого вакуолей переносится в межклеточный компартмент. Погибающие клетки дегенерируют и обусловливают тем самым расширение межклеточного компартмента (5). Появляются добавочные клетки. Д - образование просвета (5)
Внутриклеточные вакуоли по морфологическим признакам являются аутофагичными,т.е. результатом лизосомной деградации экстенсивных плазменных мембран, ранее использованных для миграции. Аутофагичные вакуоли (цитолизосомы) содержат набор органелл на разных стадиях разложения. Вакуоли соединяются друг с другом и плазменными мембранами. Их содержимое путем экзоцитоза высвобождается в межклеточный просвет. Это вместе в запрограммированой гибелью клеток (2)ведет к расширению внутриклеточного компартмента в зрелый функциональный просвет
Затем размер капилярных трубок расширяется в результате экспансии новых клеток, которые инкорпорируются в трубочные структуры(3). Эти клетки отличаются морфологически от других, они менее электрон-проницаемы, содержат мало органелл и имеют сквамозную форму. Эти клетки появляются поверх предсуществующих трубчатых структур и проникают между отдельными эндотелиальными клетками.
Модуляция ангиогенеза гипоксией
Формирование кровеносных сосудов запускается снижением поступления кислорода и питательных веществ, которое наступает если расстояние между капилярами превышает 100µм (толщина 3-7 клеток). Гипоксия важный регулятор экспрессии VEGF, его же экспрессия регулируется гипоксия-индуцибельными транскрипционными фактороами (HIF), вклчая и HIF-1β (aryl hydrocarbon-receptor nuclear translocator, ARNT), HIF-1α, HIF-2α . Они обеспечивают реакцию на гипоксию, гипогликемию, инсулин и IGF-I путем связывания с отвечающим на гипоксию промоторным элементом в пределах физиологических концентраций кислорода (0.5-20%). Факторы, индуцирующие гипоксию и элементы, реагирующие на гипоксию, использутся для генной терапии ишемических состояний.